Главная тема: АПТЕЧНОЕ ИЗГОТОВЛЕНИЕ: ЗА ДАЧИ, ПРОБЛЕМЫ, ПУТИ РЕШЕНИЯ
Вопросы возрождения производственных аптек активно обсуждаются как в медицинском и фармацевтическом сообществах, так и на разных уровнях государственного управления. Своим мнением делится руководитель рабочей группы по возрождению производственных аптек при Комитете по охране здоровья Государственной Думы РФ, депутат Государственной Думы Федерального Собрания Российской Федерации VIII созыва, член Комитета Госдумы по бюджету и налогам, вице-президент Союза медицинского сообщества «Национальная медицинская палата», доктор медицинских наук, доцент, заслуженный врач Республики Татарстан Айрат Закиевич Фаррахов.
ВВЕДЕНИЕ. Организация надлежащего изготовления лекарственных препаратов в аптечных организациях в настоящее время рассматривается как одна из приоритетных задач отечественного здравоохранения. Применяемые пациентами экстемпоральные лекарственные препараты (ЭЛП) должны быть качественными, эффективными и безопасными. Установление единых научно-обоснованных фармакопейных требований к качеству лекарственных средств, в том числе изготавливаемых в аптечных организациях, является актуальным вопросом стандартизации.
ЦЕЛЬ. На основании анализа международного опыта определить направления совершенствования подходов Государственной фармакопеи Российской Федерации к стандартизации качества лекарственных препаратов аптечного изготовления.
ОБСУЖДЕНИЕ. Рассмотрены общие и отличительные признаки экстемпоральных (не подлежащих регистрации) и готовых лекарственных препаратов. Проведен анализ требований и рекомендаций регуляторных и фармакопейных органов России, Республики Беларусь, стран Европейского союза, Великобритании, США, Канады к аптечному изготовлению лекарственных препаратов и обеспечению их качества. Отмечено, что в Фармакопею США включены около 150 частных монографий на нестерильные ЭЛП конкретного состава и более 20 частных монографий на стерильные ЭЛП. Согласно Европейской фармакопее, изготовление ЭЛП должно быть организовано в рамках системы обеспечения качества аптечной организации после соответствующей оценки уровня риска. В Республике Беларусь изготовление ЭЛП осуществляется в соответствии с правилами Надлежащей аптечной практики и фармакопейными требованиями, включающими описание методов экспресс-анализа ЭЛП.
ВЫВОДЫ. Перспективными направлениями развития требований к качеству лекарственных препаратов аптечного изготовления являются: определение подходов к экспресс-анализу препаратов; разработка фармакопейных статей на фармацевтические субстанции для изготовления ЭЛП с дополнительным подразделом в разделе «Идентификация», содержащим доступные для аптечных организаций методики; разработка фармакопейных статей на часто встречающиеся прописи ЭЛП.
ВВЕДЕНИЕ. Изготовление лекарственных препаратов (ЛП) аптечными организациями Российской Федерации является одним из приоритетных направлений лекарственной помощи населению, в том числе при выявлении дефицита или отсутствия лекарственного препарата в обращении. В связи с развитием индивидуального подхода при лечении пациентов, расширением практики изготовления орфанных препаратов и задачами импортозамещения актуальным остается изучение возможности совершенствования деятельности производственных аптек в Российской Федерации.
ЦЕЛЬ. Выявление факторов развития деятельности производственных аптек в современных условиях.
МАТЕРИАЛЫ И МЕТОДЫ. Объектами исследования являлась российская нормативная база регулирования аптечного изготовления, а также номенклатура лекарственных форм и путей введения лекарственных препаратов, изготовленных и расфасованных производственными аптеками г. Иркутска в 2021–2023 гг.
РЕЗУЛЬТАТЫ. Отмечена востребованность лекарственных препаратов аптечного изготовления у врачей и пациентов, в том числе традиционного ассортимента, включая мануальные прописи; лекарственные препараты для применения в педиатрии и гериатрии; лекарственные препараты, изготовленные в виде внутриаптечной заготовки и фасовки. Ежегодный объем изготовления лекарственных препаратов в аптечных организациях г. Иркутска в 2021–2023 гг. составил в среднем ~500 тыс. единиц продукции в различных дозах и лекарственных формах, ~100 наименований фармацевтических субстанций и более 20 зарегистрированных лекарственных препаратов. Показаны эволюционные изменения российского законодательства, касающегося деятельности по аптечному изготовлению лекарственных препаратов: разработана система качества ЛП; увеличены сроки годности на некоторые лекарственные формы; разрешено использование в аптечном изготовлении лекарственных препаратов, зарегистрированных на территории стран Евразийского экономического союза. Основными факторами роста деятельности производственных аптек являются текущее изменение нормативной правовой базы и переход от стандартизированной к персонализированной медицине. К факторам, тормозящим развитие производственных аптек, можно отнести отсутствие мер поддержки производственных аптек со стороны государства; запрет на изготовление ЛП по номенклатуре промышленности; недостаточный кадровый потенциал; низкий уровень оснащенности аптек оборудованием, в первую очередь технологическим; проблемы с доступностью малых фасовок фармацевтических субстанций и вспомогательных веществ; сложности при проведении государственного контроля и надзора за качеством изготавливаемых ЛП.
ВЫВОДЫ. Для интенсификации развития деятельности производственных аптек целесообразно продолжение изучения деятельности производственных аптек в различных регионах для разработки правовых мер поддержки аптечного производства на федеральном и региональном уровнях, создания современной материально-технической базы и подготовки квалифицированных специалистов для производственных аптек.
ВВЕДЕНИЕ. Ассортимент жидких поливитаминных средств промышленного изготовления для детей младшего возраста, разрешенных для применения на территории Российской Федерации, представлен всего двумя сиропами иностранного производства. Аптечное изготовление сиропа с витаминами позволит обеспечить потребность фармацевтического рынка в поливитаминных средствах в оптимальной лекарственной форме. Необходимым этапом введения в медицинскую практику таких препаратов является разработка и валидация методик оценки качества такого лекарственного средства.
ЦЕЛЬ. Подбор и адаптация аналитических методик для оценки качества экстемпорального поливитаминного средства для детей.
МАТЕРИАЛЫ И МЕТОДЫ. Объект исследования: сироп аптечного изготовления с витаминами С, РР, В1, В2, В6 (дозировки компонентов сиропа соответствуют нормам потребления для детей от года до трех лет) на сорбитоле. Для оценки подлинности проводили качественные реакции и спектрофотометрию. Для количественного определения компонентов использовали следующие методы: для определения аскорбиновой кислоты – прямая йодометрия без индикатора, для никотиновой кислоты – алкалиметрия с индикатором бромтимоловым синим, для тиамина гидрохлорида и пиридоксина гидрохлорида в сумме – прямая аргентометрия по Фаянсу в уксуснокислой среде с индикатором бромфеноловым синим, для рибофлавина – спектрофотометрия в видимой области при длине волны 445 нм и спектрофлуориметрия. Определение содержания сорбитола проводили рефрактометрически, при расчете учитывали содержание других компонентов сиропа. Методика спектрофлуориметрического определения рибофлавина была валидирована по требованиям Государственной фармакопеи Российской Федерации.
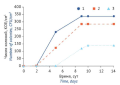
РЕЗУЛЬТАТЫ. Подобраны методики оценки качества поливитаминного сиропа, содержащего пять водорастворимых витаминов (С, РР, В1, В2, В6) и сорбитол. Адаптированы методики анализа ингредиентов с учетом совместного присутствия рибофлавина, аскорбиновой и никотиновой кислот, тиамина гидрохлорида и пиридоксина гидрохлорида. Разработаны методики для определения рибофлавина методом спектрофлуориметрии и спектрофотометрии, и селективного определения тиамина гидрохлорида методом фотометрии после осаждения солью Рейнеке. Выполнена валидация методики спектрофлуориметрического определения рибофлавина по следующим характеристикам: специфичность, правильность, линейность, прецизионность (повторяемость и внутрилабораторная прецизионность), аналитическая область.
ВЫВОДЫ. Предложены методики оценки подлинности поливитаминного сиропа. Методика спектрофлуориметрического количественного определения рибофлавина валидирована и может быть использована в аналитических лабораториях для количественного анализа рибофлавина в поливитаминных смесях, а также для оценки стабильности сиропа.
ВВЕДЕНИЕ. Возрождению экстемпорального изготовления лекарственных препаратов в Российской Федерации в настоящий момент уделяется много внимания на всех уровнях медицинского и фармацевтического сообщества. Обладая значительным потенциалом роста в Российской Федерации, рынок аптечных лекарственных препаратов нуждается в высококвалифицированных кадрах, которые смогут обеспечить работу системы производственных аптечных учреждений и надлежащее качество экстемпоральных препаратов. Эффективность подготовки таких специалистов может быть повышена путем использования элементов опыта учебных заведений стран с развитой системой аптечного изготовления.
ЦЕЛЬ. Определение основных направлений и анализ специфики подготовки специалистов в экстемпоральном изготовлении лекарственных препаратов в ведущих зарубежных образовательных организациях.
МАТЕРИАЛЫ И МЕТОДЫ. В исследовании были использованы методы логического, сравнительного, структурного и контент-анализа. Проанализированы 106 образовательных программ топ-25 высших учебных заведений, в соответствии с рейтингом QS World University Rankings по направлению «Фармация и фармакология». Анализ учебных программ осуществлялся посредством анализа открытых данных, размещенных в сети интернет, в том числе на официальных веб-сайтах образовательных организаций.
РЕЗУЛЬТАТЫ. Показаны особенности подготовки специалистов разного уровня образования в области экстемпорального изготовления лекарственных препаратов, включая: требования, предъявляемые к абитуриентам; сроки обучения; стандарты компетенций; структуру экзаменов; порядок допуска к профессиональной деятельности с учетом национальных особенностей. Определены основные тренды обучения фармацевтических работников экстемпоральному изготовлению лекарственных препаратов, среди которых: снижение сроков подготовки специалистов среднего звена; углубленное изучение клинических дисциплин, обусловленное расширением полномочий фармацевтических работников; специализация по направлениям экстемпорального изготовления лекарственных препаратов: детских, стоматологических, стерильных, ветеринарных, радиофармацевтических, предназначенных для лечения орфанных заболеваний; использование технологий симуляционного и онлайн-обучения, развитие системы дополнительного профессионального образования.
ВЫВОДЫ. В программы фармацевтического образования ведущих зарубежных образовательных организаций включено освоение дисциплин, связанных с направлением экстемпорального изготовления. Современные международные тренды, касающиеся получения специализации фармацевтическими работниками в области изготовления лекарственных препаратов; интеграции в образовательный процесс технологий симуляционного и онлайн-обучения; развития системы дополнительного профессионального образования, коррелируют с направлениями развития фармацевтического образования в Российской Федерации. При этом формирование дополнительных профессиональных компетенций в сфере аптечного изготовления детских, стерильных, химиотерапевтических, радиофармацевтических, ветеринарных, стоматологических лекарственных препаратов, которое за рубежом осуществляется за счет получения фармацевтическими специалистами специализации посредством освоения программ дополнительного профессионального образования, в Российской Федерации может быть реализовано на уровне дополнительных образовательных программ повышения квалификации и обучения в ординатуре.
ВВЕДЕНИЕ. При изготовлении лекарственных препаратов в производственных аптеках существуют определенные риски, которые сопряжены непосредственно с процессом изготовления и действиями его участников. Роль действий санитарок-мойщиц, которые также могут повлиять на качество изготавливаемых лекарственных препаратов, при этом ранее не рассматривалась.
ЦЕЛЬ. Анализ рисков, обусловленных производственной деятельностью санитарки-мойщицы при аптечном изготовлении нестерильных лекарственных форм, для качества экстемпоральных лекарственных препаратов.
МАТЕРИАЛЫ И МЕТОДЫ. Исследование проводилось с помощью FMEA-анализа согласно государственному стандарту и метода «мозгового штурма» в форме открытой дискуссии. Объектом исследования являлась трудовая деятельность санитарки-мойщицы при изготовлении нестерильных лекарственных форм. Результаты оценивали путем статистической обработки данных и отнесения каждого из возможных видов отказа к определенным категориям.
РЕЗУЛЬТАТЫ. Проведенный анализ рисков показал, что из 45 возможных видов отказа в производственной деятельности санитарки-мойщицы 12 видов отказа относятся к критическому уровню риска, что составляет 26,7% от общего количества, 14 видов отказа относятся к среднему уровню риска (31,1% от общего количества), и 19 видов отказа представляют собой незначительный уровень риска (42,2% от общего количества). Установлено, что не для всех вероятных видов отказа имеется действующая нормативная документация, позволяющая оценить риски и разработать меры по предупреждению отказов.
ВЫВОДЫ. Проведенный анализ деятельности санитарки-мойщицы позволил выявить риски, которые могут влиять на качество изготавливаемых лекарственных препаратов в производственных аптеках. Выявлено отсутствие актуальной регламентированной нормативной документации. Результаты анализа предлагается использовать для внесения изменений в нормативную документацию, стандартные операционные процедуры, регламентирующие производственную деятельность санитарки-мойщицы, для разработки иллюстративных материалов и проведения внутрипроизводственного обучения.
ДОКЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
ВВЕДЕНИЕ. Определение маркеров нефротоксичности является целесообразным и необходимым этапом детекции почечного поражения в экспериментах на животных, позволяющим точно определить локализацию повреждения органа. В связи с разнообразием существующих повреждающих агентов и установленных механизмов нефротоксичности, а также с учетом видового разнообразия лабораторных животных на сегодня не существует общепризнанного маркера почечного повреждения, который соответствовал бы всем предъявляемым требованиям.
ЦЕЛЬ. Систематизация данных литературы о маркерах нефротоксичности, анализ их прогностической значимости, формирование общих рекомендаций для оценки функционального состояния мочевыделительной системы в доклинических исследованиях.
ОБСУЖДЕНИЕ. Проведен сравнительный анализ маркеров нефротоксичности, рекомендованных регуляторными органами для мониторинга лекарственно-индуцированного повреждения почек. Отмечено, что наиболее часто используемыми и прогностически значимыми маркерами острого повреждения почек в доклинических исследованиях являются цистатин С, альбумин, общий белок, молекула повреждения почек-1 (KIM-1), липокалин-2 (NGAL) и кластерин. Маркерами хронического повреждения почек являются как вышеперечисленные маркеры, так и скорость клубочковой фильтрации, креатинин, мочевина и остеопонтин. Определение содержания электролитов может быть использовано для дифференциальной диагностики преренальной азотемии и острого повреждения почек. Возможными ограничениями при использовании маркеров в рутинной практике исследований являются высокая стоимость их количественного анализа и недостаток информации о применимости данных на разных видах лабораторных животных.
ВЫВОДЫ. На основании сравнительной оценки прогностической значимости используемых биомаркеров предложены общие рекомендации для комплексной оценки функционального состояния мочевыделительной системы в доклинических исследованиях, включающей проведение лабораторных, инструментальных, а также гистопатологических исследований. Дизайн исследования следует выбирать в зависимости от целей работы, вида или видов лабораторных животных, их количества, специфики тестируемого объекта.
КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
ВВЕДЕНИЕ. Синдром раздраженного кишечника (СРК) представляет собой хроническое функциональное заболевание, которому подвержены не менее 13% населения. При достаточно широком распространении СРК в настоящее время отмечается дефицит должным образом изученных и зарегистрированных препаратов для его лечения, что обусловлено как невысокой активностью в области разработки таких лекарственных средств, так и отсутствием обоснованных подходов к проведению их экспертизы. Актуальность подготовки рекомендаций по планированию и проведению клинических исследований лекарственных препаратов для лечения СРК связана с активизацией работ по созданию новых препаратов для повышения эффективности и безопасности лекарственной терапии СРК в условиях развития единых фармацевтических рынков стран Евразийского экономического союза.
ЦЕЛЬ. Оценка возможности использования методологических подходов зарубежных руководящих документов к подготовке руководства (рекомендаций) по организации и проведению клинических исследований препаратов для лечения СРК в Российской Федерации.
ОБСУЖДЕНИЕ. Выполнен анализ основных положений Руководства по клиническим исследованиям препаратов для терапии СРК Европейского агентства по лекарственным средствам (European Medicines Agency, EMA). Определен методический инструментарий, содержание работ, этапы проведения клинических исследований и критерии оценки эффективности препаратов на каждом из этапов. Проведена оценка особенностей диагностики СРК при определении эффективности терапии. Показана необходимость гармонизации отечественных и зарубежных методических подходов к оценке результатов клинических исследований, обеспечивающая повышение обоснованности результатов экспертизы клинических исследований, выполняемых в разных странах. Определены особенности планирования поисковых и подтверждающих клинических исследований (выбор конечных точек, дизайна, длительности клинических исследований в популяциях взрослых и детей), а также отличия, связанные с полом субъектов исследования.
ВЫВОДЫ. Положения руководства ЕМА могут послужить основой для разработки программы клинического изучения новых препаратов для лечения СРК и быть использованы в практической деятельности экспертами, оценивающими результаты клинических исследования, и разработчиками новых лекарственных препаратов.
КОНТРОЛЬ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ
ВВЕДЕНИЕ. Метрологическая оценка методик позволяет определить выбор способа проведения испытаний с целью получения достоверных и корректных результатов. Это особенно актуально в тех случаях, когда оценку качества лекарственного средства по конкретному показателю, например, содержание воды в лекарственной форме «Лиофилизаты» в соответствии с фармакопейными требованиями допускается определять разными способами: титрованием по К. Фишеру полумикрометодом (волюметрическое титрование), микроопределением (кулонометрическое титрование) и определением потери в массе при высушивании.
ЦЕЛЬ. Оценка взаимосвязи между выбором метода и полученным результатом определения содержания воды в лекарственной форме «Лиофилизаты» при помощи дисперсионного анализа ANOVA, а также оценка неопределенности результатов измерений при определении данного показателя титрованием по К. Фишеру.
МАТЕРИАЛЫ И МЕТОДЫ. Показатель «Вода» определяли в образце лиофилизата «Микафунгин» с использованием методов, регламентированных Фармакопеей Евразийского экономического союза 2.5.1.14 «Лиофилизаты»: титрование по К. Фишеру полумикрометодом, микроопределением и дополнительно проводили определение потери в массе при высушивании. Оценку влияния метода на результаты анализа проводили дисперсионным анализом ANOVA с использованием программы Microsoft Excel. Статистическая обработка результатов эксперимента включала: сравнение воспроизводимости с использованием критерия Фишера, сравнение средних результатов, полученных двумя разными методами, с использованием критерия Стьюдента. Для оценки неопределенности измерений рассчитывали граничные значения доверительных интервалов с уровнем доверительной вероятности 0,95 и 0,99.
РЕЗУЛЬТАТЫ. Дисперсионным анализом ANOVA было показано, что способ определения содержания воды в лиофилизатах оказывает влияние на полученный результат. Установлено, что методы титрования по К. Фишеру, полумикрометод и микроопределение позволяют получить воспроизводимые результаты, так как для четырех серий лиофилизата вычисленный критерий Фишера (F1=2,3440; F2=1,0762; F3=3,5302; F4=1,0989) меньше критического значения Fкр(0,95;2;2)=19,000. Полученные разными методами средние результаты не равны, так как вычисленный критерий Стьюдента (t1=9,2391; t2=11,4847; t3=11,0041; t4=33,6502) больше критического значения tкр (0,95;2) = 4,3027. Для оценки степени неопределенности полученных результатов рассчитаны граничные значения доверительных интервалов по критерию Стьюдента с доверительной вероятностью 0,95 и 0,99 для двустороннего интервала. Неопределенность измерений при определении воды полумикрометодом меньше неопределенности, полученной при микроопределении данного показателя.
ВЫВОДЫ. Результат определения содержания воды в лиофилизате «Микафунгин» зависит от выбранного метода определения. Потеря в массе при высушивании не применяется для оценки содержания воды в изучаемых лекарственных средствах. Способы определения воды полумикрометодом и микроопределением для лиофилизатов «Микафунгин» не являются альтернативными. Необходимо дополнительное исследование для оценки смещения и его учета в суммарной неопределенности измерений.
МИКРОБИОЛОГИЧЕСКИЙ АНАЛИЗ
ВВЕДЕНИЕ. Программы микробиологического мониторинга состояния помещений для фармацевтического производства, включенные в нормативные документы разного уровня, различаются. В частности, это касается условий проведения эксперимента: используемых питательных сред, температуры и времени инкубации. Для унификации процедур контроля качества необходимо разработать единую стратегию обработки проб микробиологического анализа.
ЦЕЛЬ. Определение оптимальных условий инкубации посевов при микробиологическом мониторинге «чистых» помещений.
МАТЕРИАЛЫ И МЕТОДЫ. Проведено сравнение условий культивирования тест-штаммов Bacillus subtilis ATCC 6633, Staphylococcus aureus ATCC 6538, Pseudomonas aeruginosa ATCC 9027, Candida albicans ATCC 10231, Aspergillus brasiliensis ATCC 16404, Aspergillus fumigatus ВКПМ F-62, Aspergillus terreus ВКПМ F-1269, Penicillium chrysogenum ВКПМ F-3, а также изолятов из окружающей среды Staphylococcus epidermidis, Kocuria rosea, Micrococcus luteus, Bacillus spp., Sphingomonas paucimobilis. Питательные среды: триптиказо-соевый агар (TSA), агар Сабуро с декстрозой и хлорамфениколом (SDCA), агар Ризонера (R2A). Режимы инкубации: 2 сут при 30–35 ºС, затем 3 сут при 20–25 ºС; 3 сут при 20–25 ºС, затем 2 сут при 30–35 ºС; 48–72 ч при 30–35 ºС (культивирование аэробных бактерий); 5–7 сут при 20–25 ºС (культивирование дрожжевых и плесневых грибов).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ. При культивации бактерий в среде TSA и R2A статистически значимых различий результатов, полученных при разных температурных условиях, выявлено не было. Коэффициент прорастания изолятов из окружающей среды был существенно ниже (на 19–37%) в случае их выращивания на TSA при двухтемпературной схеме инкубации (первоначальное выдерживание посевов при более низкой температуре). Выявлены группы микроорганизмов (бактерии с угнетенными физиологическими функциями и замедленным ростом, а также плесневые грибы), требующие при микробиологическом мониторинге подбора условий культивирования.
ВЫВОДЫ. Установлена необходимость стандартизации выполнения микробиологического анализа при мониторинге и его регламентация в установленном порядке в виде общей фармакопейной статьи. Показана возможность использования при микробиологическом мониторинге в качестве питательной среды как триптиказо-соевого агара, так и агара Ризонера. Применение двухтемпературной схемы инкубации с использованием одной неселективной питательной среды требует валидации в каждом конкретном случае. При культивировании тест-штаммов последовательность изменения температуры не оказывает влияния на коэффициент их прорастания, однако в случае бактерий, выделенных из окружающей среды, предпочтительным следует считать режим инкубации с более высокой температурой (30–35 ºС) на начальном этапе инкубации.
ISSN 3034-3453 (Online)