«Регуляторные исследования и экспертиза лекарственных средств» – научно-практический рецензируемый журнал открытого доступа, выпускаемый в печатной и онлайн-версиях. Основан в 1999 году.
Цель журнала: содействие развитию фармацевтической и медицинской науки и практики посредством опубликования и распространения информации о передовых достижениях в регуляторной деятельности и сфере обращения лекарственных средств.
Целевая аудитория. Предназначен для широкого круга специалистов, как российских, так и зарубежных, работающих в сфере обращения лекарственных средств:
- разработчиков и производителей лекарственных препаратов;
- представителей экспертных организаций, государственных регуляторных органов;
- работников контрольно-разрешительной системы и государственного надзора в сфере обращения лекарственных средств;
- сотрудников научно-исследовательских институтов, преподавателей, аспирантов и студентов медицинских, фармацевтических вузов, врачей и провизоров.
Более подробная информация – в разделе Цели и задачи.
Учредитель: ФГБУ «Научный центр экспертизы средств медицинского применения» Министерства здравоохранения Российской Федерации.
Периодичность: 6 раз в год.
Импакт-фактор: двухлетний импакт-фактор РИНЦ (2024) – 0,533.
Редколлегия. Географическое представительство:
- 5 стран
- 9 городов
Рецензирование:
- Двойное слепое
- Минимум 2 рецензента на рукопись
Основные метрики журнала:
14 дней в среднем от подачи до первого решения
88 дней в среднем от подачи до публикации в Интернете
15% приглашенных авторов
79% доля принятия рукописей
64 тыс. загрузок PDF в 2025 г.
Плата за публикацию: бесплатно.
Индексация. Индексируется в российских и международных реферативных и полнотекстовых базах, включен в наукометрические базы данных РИНЦ, RSCI, входит в "Белый список" научных изданий и Перечень ВАК (категория К1).
Информация об индексации в других российских и международных базах доступна в разделе Индексирование.
Регистрация. Свидетельство о регистрации средства массовой информации ПИ № ФС77-82931 от 14 марта 2022 г.
Подписка. Подписной индекс в каталоге Пресса России – 57942, Урал-Пресс – 57942.
Текущий выпуск
ГЛАВНАЯ ТЕМА: РЕГУЛИРОВАНИЕ ОБРАЩЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ В ЕАЭС: РЕГИСТРАЦИЯ И КОНТРОЛЬ КАЧЕСТВА
ЦИФРОВЫЕ ТЕХНОЛОГИИ В ФАРМАЦИИ
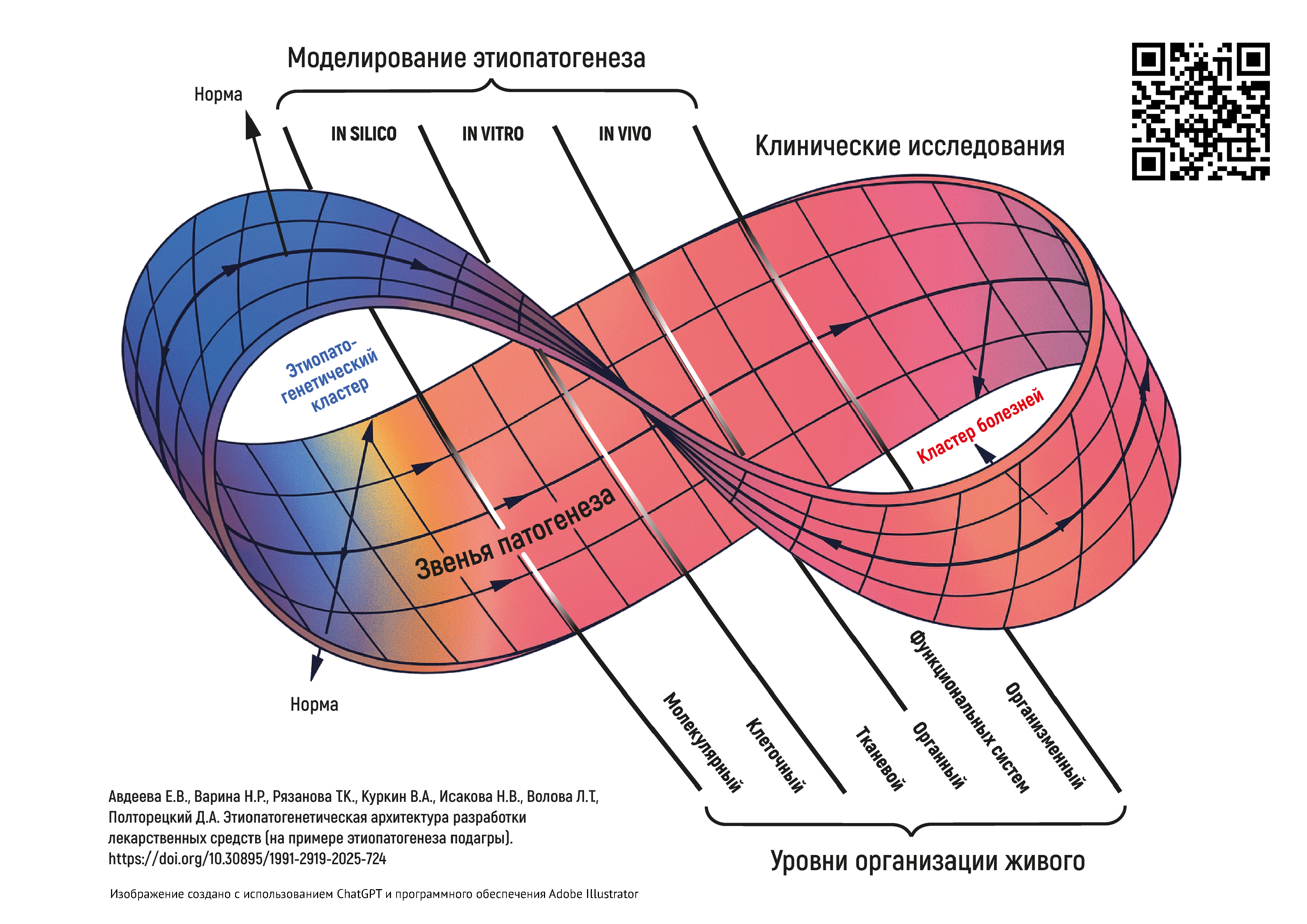
РАЗРАБОТКА ЛЕКАРСТВЕННЫХ СРЕДСТВ
КОНТРОЛЬ КАЧЕСТВА
ЛЕКАРСТВЕННЫЕ СРЕДСТВА РАСТИТЕЛЬНОГО ПРОИСХОЖДЕНИЯ
АПТЕЧНОЕ ИЗГОТОВЛЕНИЕ
Объявления
2025-06-03
Поздравляем с избранием в академики РАН!
Редколлегия и редакция журнала «Регуляторные исследования и экспертиза лекарственных» поздравляют члена редколлегии – Андрея Дмитриевича Дурнева, избранного в действительные члены Российской академии наук.
| Еще объявления... |