Перейти к:
Классификация продуктов клеточной терапии по степени манипулирования клеток и выполняемым функциям: анализ международных регуляторных подходов
https://doi.org/10.30895/1991-2919-2024-14-5-533-546
Резюме
ВВЕДЕНИЕ. Степень обработки (манипулирования) клеток, входящих в состав клеточных препаратов, и выполняемые ими функции после введения (гомологичное/ негомологичное применение) определяют их отнесение к классу трансплантатов или высокотехнологичных лекарственных препаратов и, соответственно, особенности регулирования их обращения. В законодательстве Евразийского экономического союза (ЕАЭС) и Российской Федерации в настоящее время недостаточно полно разъяснены термины «минимальные манипуляции» и «гомологичное/негомологичное применение», что может служить причиной применения у человека клеточных препаратов с недоказанной безопасностью и эффективностью.
ЦЕЛЬ. Сравнение международных и российских подходов к интерпретации терминов «минимальные манипуляции», «гомологичное/негомологичное применение» на примере препаратов стромально-васкулярной фракции (СВФ) с целью классификации препарата и определения пути его регулирования.
ОБСУЖДЕНИЕ. Рассмотрены и обобщены регуляторные подходы Российской Федерации, ЕАЭС, США и ЕС в зависимости от классификации клеточных препаратов по степени манипулирования входящих в их состав клеток и выполняемых ими функций после применения. Проведены анализ и сравнение нормативно-правовых актов и подходов рассмотренных стран на примере препаратов на основе СВФ. Показаны общие аспекты толкования терминов «минимальные манипуляции» и «гомологичное/негомологичное применение», продемонстрировано различие в регуляторных подходах разных стран, заключающееся в отнесении ферментативной обработки и селективного отбора клеток к существенным или минимальным манипуляциям.
ВЫВОДЫ. Механизм регулирования обращения клеточных препаратов зависит от степени обработки клеток в их составе (минимальное или существенное манипулирование) и от предполагаемого применения (гомологичного или негомологичного). Общим принципом отнесения манипуляций к минимальным, принятым регуляторными организациями США, ЕС, ЕАЭС, Российской Федерации, является сохранение биологических характеристик и физиологической функции продуктов после их проведения; признаком гомологичного применения клеток или тканей является их использование для выполнения присущих им функций в организме. В России перечень манипуляций, отнесенных к минимальным, определен в нормативных актах как для высокотехнологичных лекарственных препаратов, так и для объектов трансплантации. Препараты на основе минимально манипулированных клеток стромально-васкулярной фракции, согласно международным нормам, при негомологичном применении классифицируются как высокотехнологичные лекарственные препараты. Термины «минимальные манипуляции» и «гомологичное/негомологичное применение» недостаточно полно и четко определены в законодательстве ЕАЭС и Российской Федерации, поэтому актуальной является разработка рекомендаций по их разъяснению на конкретных примерах.
Ключевые слова
Для цитирования:
Водякова М.А., Покровский Н.С., Семенова И.С., Меркулов В.A., Мельникова Е.В. Классификация продуктов клеточной терапии по степени манипулирования клеток и выполняемым функциям: анализ международных регуляторных подходов. Регуляторные исследования и экспертиза лекарственных средств. 2024;14(5):533-546. https://doi.org/10.30895/1991-2919-2024-14-5-533-546
For citation:
Vodyakova M.A., Pokrovsky N.S., Semenova I.S., Merkulov V.A., Melnikova E.V. Classification of Cell Therapy Products by Cell Manipulation Degree and Functions Performed: Analysis of International Regulatory Approaches. Regulatory Research and Medicine Evaluation. 2024;14(5):533-546. (In Russ.) https://doi.org/10.30895/1991-2919-2024-14-5-533-546
ВВЕДЕНИЕ
Регуляторные подходы к оценке безопасности и эффективности клеточных препаратов зависят от предполагаемого клинического использования клеток в составе препарата и специфики их обработки [1]. Термины «минимальные манипуляции» (ММ) и «гомологичное/негомологичное применение» (ГП/НГП) являются ключевыми для выбора стратегии применения в медицинской практике препаратов на основе жизнеспособных клеток. В зависимости от степени манипулирования препараты можно отнести к объектам трансплантации или к препаратам генной и клеточной терапии.
Разница заключается в том, что для трансплантатов не требуется полный цикл разработки, проведение доклинических и клинических исследований, а также государственная регистрация; для препаратов генной и клеточной терапии требуется полный цикл разработки и, соответственно, государственная регистрация1. Это означает, что безопасность и эффективность:
- объектов трансплантации предсказуемы, исходя из принятых мер предосторожности по предотвращению передачи инфекционных заболеваний на основе обследования донора и валидации процессов заготовки, хранения, транспортировки;
- препаратов генной и клеточной терапии неизвестны и должны быть подтверждены данными доклинических и клинических исследований [2].
Во многих странах существует отдельное регулирование ММ для клеток и тканей. Общим аспектом в толковании ММ регулирующими органами в мире является принцип сохранения биологических характеристик и физиологической функции продуктов после проведения манипуляции [3]. Если этот принцип не соблюдается, манипуляция считается существенной.
Необходимо отметить, что в настоящее время существует недостаточно четкая интерпретация терминов «гомологичное/негомологичное применение» в нормативно-правовых актах разных стран, что вызывает вопросы даже в тех странах мира, где развито применение и регулирование клеточных препаратов2. Одним из спорных примеров является клиническое использование стромально-васкулярной фракции (СВФ), представляющей собой гетерогенную суспензию, выделенную из жировой ткани (липоаспирата) путем фракционирования ее стромального компонента. Основное применение в клинической практике липоаспирата (и, соответственно, всех клеток в его составе) — это реконструкция мягких тканей после мастэктомии [4]. В последнее время появилось много публикаций по поводу использования клеток СВФ, выделенных из липоаспирата, в регенеративной медицине для лечения остеоартроза, инсульта, дегенеративных заболеваний [5–7]. Кроме того, СВФ проявляет иммуномодулирующие свойства и может применяться для лечения воспалительных и аутоиммунных заболеваний [8]. Следует отметить, что в ряде исследований применения СВФ были выявлены нежелательные реакции [9][10].
Регенеративная способность СВФ объясняется наличием мезенхимальных стволовых клеток (МСК), способных дифференцироваться в различные типы клеток и участвовать в восстановлении поврежденных тканей. СВФ в своем составе помимо МСК содержит эндотелиальные клетки, перициты, фибробласты и иммунные клетки. Содержание МСК в СВФ по литературным данным варьирует от 2 до 30% [5][11].
СВФ получают с помощью ММ, однако в случаях использования СВФ, отличных от восполнения дефектов мягких тканей, основной механизм терапевтических эффектов этой фракции связывают, главным образом, с фармакологическим действием различных факторов и медиаторов, секретируемых МСК. В этом случае их следует отнести к классу соматотерапевтических лекарственных препаратов (СТЛП), относящихся к высокотехнологичным лекарственным препаратам (ВТЛП)3, а не к объектам трансплантации. При негомологичном применении ведущие мировые регуляторы (Европейское медицинское агентство (European Medicines Agency, ЕМА) и Управление по контролю качества пищевых продуктов и лекарственных препаратов (Food and Drug Administration, FDA)) требуют проведения полного комплекса исследований при разработке и введении в обращение препарата на основе СВФ4. Тем не менее на территориях, не попадающих под действие норм ЕМА и FDA, остается вопрос неконтролируемого использования недостаточно изученных клеточных препаратов5 (в рамках «медицинского туризма»).
В законодательстве Евразийского экономического союза (ЕАЭС) и Российской Федерации термины ММ и ГП/НГП в настоящее время недостаточно полно разъяснены.
Цель работы — сравнение международных и российских подходов к интерпретации терминов «минимальные манипуляции», «гомологичное/негомологичное применение» на примере стромально-васкулярной фракции с целью классификации препарата и определения пути регулирования.
Особенности регулирования обращения клеточных продуктов в зависимости от степени манипулирования и способа применения
В таблице 1 представлено описание регуляторных подходов в различных правовых системах в зависимости от степени манипулирования и способа применения препаратов на основе СВФ. Во всех странах ММ препараты в случае ГП отнесены к объектам трансплантации. Следует отметить, что в документах FDA представлено более подробное, чем в странах ЕС и ЕАЭС, толкование отнесения к ММ, основанное на определении структурной и неструктурной ткани и изменений в них в результате манипуляций, а также приведены конкретные примеры областей применения таких препаратов6:
- структурная ткань служит барьером или выполняет функцию физической поддержки, соединения, покрытия или амортизации (кожа, кости, жировая ткань, хрящи и другие);
- неструктурные ткани или клетки (гематопоэтические стволовые клетки / клетки-предшественники (например, пуповинная кровь), ткани поджелудочной железы, периферического нерва и другие) выполняют метаболические или другие (кроветворные, иммунные и эндокринные) биохимические функции в организме (рис. 1, опубликован на сайте журнала на английском языке7).
Таблица 1. Сравнение регуляторных подходов Российской Федерации, США и Европейского союза в зависимости от классификации клеточных продуктов по степени манипулирования и применения
Table 1. Comparison of regulatory approaches of the Russian Federation, the United States, and the European Union based on the classification of cell products by the degree of cell manipulation and their application
Характеристика Characteristics | Российская Федерация, Евразийский экономический союз Russia, EAEU | США USA | Европейский союз European Union | |||
Степень манипулирования / Manipulation degree | ||||||
Минимальная Minimal | Существенная Substantial | Минимальная Minimal | Существенная Substantial | Минимальная Minimal | Существенная Substantial | |
Гомологичное применение / Homologous use | ||||||
Государственная регистрация лекарственного препарата Marketing authorisation | Не требуется Not required | Требуется Required | Не требуется Not required | Требуется (кроме IND и IDE) Required (except INDs and IDEs) | Не требуется Not required | Требуется Required |
Нормативный акт Regulatory act | Приказ № 306н/3 Order 306n/3 | Решение Совета ЕЭК № 78 EEC Council Resolution 78 | Руководства FDA FDA guidelines | Руководства FDA FDA guidelines | Директива 2004/23/EC Directive 2004/23/EC | Директива 2001/83/EC Directive 2001/83/EC |
Класс продукта Product class | Объект трансплантации Transplant | Высокотехнологичный лекарственный препарат ATMP | 361 HCT/P | 351 HCT/P (лекарственный препарат, медицинское изделие, биопрепарат) / (medicinal products, medical devices, and/or biotherapeutics) | Клетки и ткани человека для применения на людях Human cells and tissues for human use | Препарат передовой терапии Клетки и ткани, подвергнутые инженерии АТМР Engineered cells and tissues |
Ферментативная обработка или селективный отбор клеток Enzymatic digestion and selective collection of cells | Относится к минимальной манипуляции Considered minimally manipulated | Относится к существенной манипуляции Considered substantially manipulated | Относится к минимальной манипуляции Considered minimally manipulated | |||
Негомологичное применение / Non-homologous use | ||||||
Государственная регистрация лекарственного препарата Marketing authorisation | Требуется Required | Требуется (кроме IND и IDE) Required (except INDs and IDEs) | Требуется Required | |||
Нормативный акт Regulatory act | Решение Совета ЕЭК № 78 EEC Council Resolution 78 | Руководства FDA FDA guidelines | Директива 2001/83/EC Directive 2001/83/EC | |||
Класс продукта Product class | Высокотехнологичный лекарственный препарат ATMP | 351 HCT/P (лекарственный препарат, медицинское изделие, биопрепарат) (medicinal products, medical devices, and/or biotherapeutics) | Препарат передовой терапии АТМР | |||
Ферментативная обработка или селективный отбор клеток Enzymatic digestion and selective collection of cells | Не применимо Not applicable | Не применимо Not applicable | Не применимо Not applicable | |||
Таблица составлена авторами / The table is prepared by the authors
Примечание. IND — investigational new drug (исследование применения нового препарата); IDE — investigational device exemption (исследование применения нового медицинского изделия); ЕЭК — Евразийская экономическая комиссия; HCT/P — клетки и ткани человека, а также препараты, основанные на клетках и тканях.
Note. АТМР, advanced therapy medicinal product; IND, investigational new drug; IDE, investigational device exemption; EAEU, Eurasian Economic Union; EEC, Eurasian Economic Commission; PHSA, Public Health Service Act; CFR, Code of Federal Regulations; FDA, Food and Drug Administration; EMA, European Medicines Agency; HCT/P, human cells, tissues, and cellular and tissue-based products.
Приказ № 306н/3 — Приказ Министерства здравоохранения Российской Федерации, Российской академии наук от 04.06.2015 № 306н/3 «Об утверждении перечня объектов трансплантации».
Order 306n of the Ministry of Health of Russia / Order 3 of the Russian Academy of Sciences of 4 June 2015 on approval of the list of objects transplantation.
Решение ЕАЭС № 78 — Решение Совета Евразийской экономической комиссии от 03.11.2016 № 78 «О Правилах регистрации и экспертизы лекарственных средств для медицинского применения».
Resolution 78 of the Eurasian Economic Commission Council of 3 November 2016 on the Rules of marketing authorisation and assessment of medicinal products for human use.
Руководства FDA — Code of Federal Regulations. Title 21. Section 1271.3. Human cells, tissues, and cellular and tissue-based products. Code of Federal Regulations. Title 21. Section 1271.10. Human cells, tissues, and cellular and tissue-based products. Regulatory considerations for human cells, tissues, and cellular and tissue-based products: minimal manipulation and homologous use. Guidance for industry and Food and Drug Administration staff. 2020. Section 351, 361 of the Public Health Service (PHS) Act (42 U.S.C. § 262).
Директива 2004/23/EC EMA — Directive 2004/23/EC of the European Parliament and of the Council of 31 March 2004 on setting standards of quality and safety for the donation, procurement, testing, processing, preservation, storage and distribution of human tissues and cells.
Директива 2001/83/EC — Directive 2001/83/EC of the European Parliament and of the Council of 6 November 2001 on the Community code relating to medicinal products for human use; Regulation (EC) No 726/2004 of the European Parliament and of the Council of 31 March 2004 laying down Community procedures for the authorisation and supervision of medicinal products for human and veterinary use and establishing a European Medicines Agency.
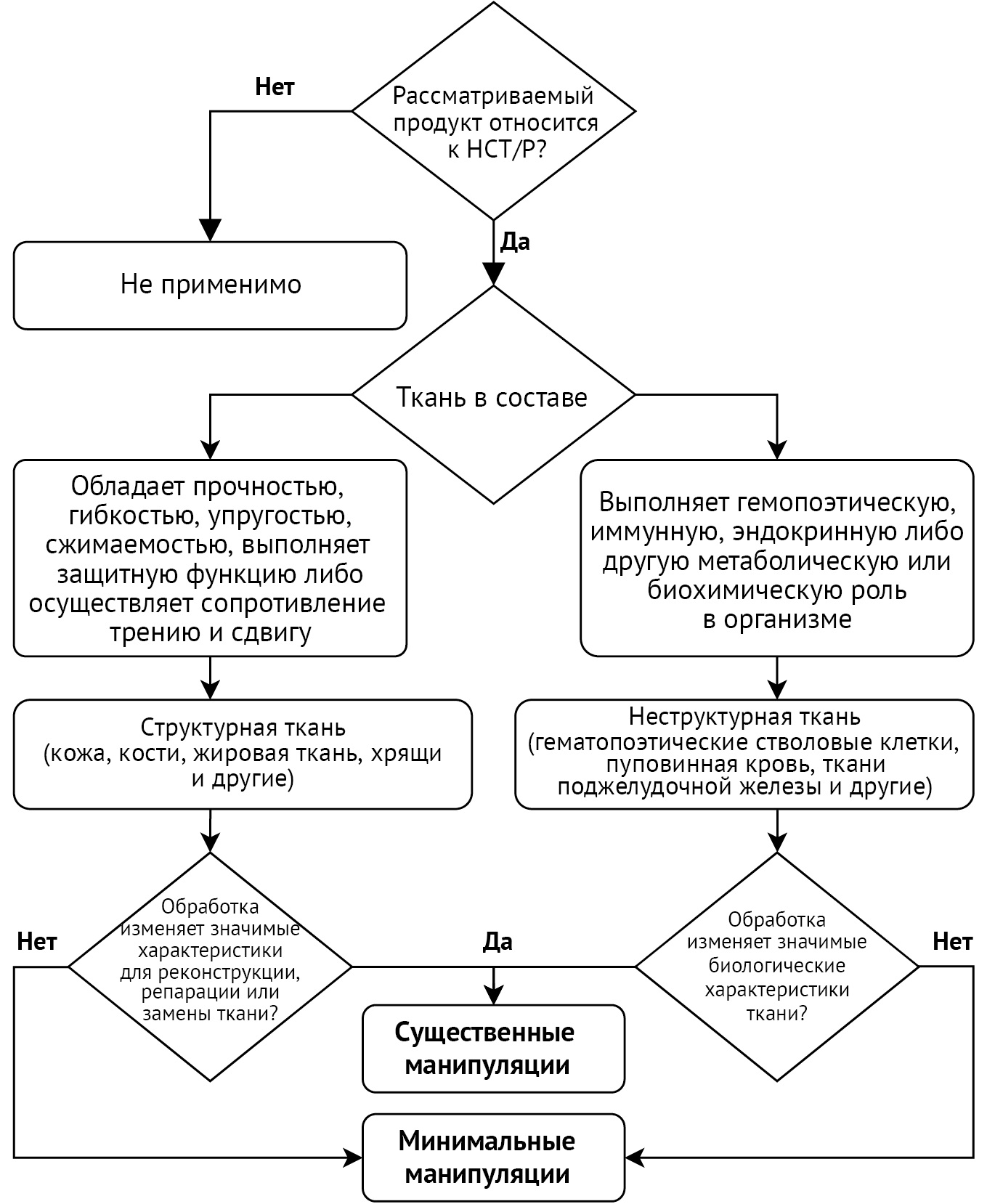
Рисунок подготовлен авторами по данным Regulatory Considerations for Human Cells, Tissues, and Cellular and Tissue-Based Products: Minimal Manipulation and Homologous Use. Guidance for Industry and Food and Drug Administration Staff. 2020 / The figure is prepared by the authors using data from Regulatory Considerations for Human Cells, Tissues, and Cellular and Tissue-Based Products: Minimal Manipulation and Homologous Use. Guidance for Industry and Food and Drug Administration Staff. 2020
Рис. 1. Алгоритм отнесения к минимальным и существенным манипуляциям согласно регуляторному подходу Управления по контролю качества пищевых продуктов и лекарственных препаратов. HCT/P — клетки и ткани человека, а также препараты, основанные на клетках и тканях
Fig. 1. Algorithm for the classification of manipulations as minimal or substantial according to the Food and Drug Administration regulatory approach. HCT/P, human cells, tissues, and cellular and tissue-based products
В законодательстве Российской Федерации (ЕАЭС) определение и перечень ММ, а также общие принципы регулирования обращения гармонизированы с регуляторным подходом ЕMA. В Правилах регистрации и экспертизы лекарственных средств для медицинского применения8 дано определение «соматотерапевтических лекарственных препаратов» без указания объема манипуляций c клетками; таким образом, препараты на основе ММ клеток и тканей для осуществления разных функций у реципиента и донора регулируются как соматотерапевтические лекарственные препараты или препараты тканевой инженерии.
В Российской Федерации перечень ММ препаратов, используемых при гомологичном применении, представлен в совместном приказе Министерства здравоохранения и Российской академии наук9, такие продукты относятся к объектам трансплантации и не требуют государственной регистрации.
Существенное различие в регуляторных подходах различных стран связано с применением ферментативной обработки и селективного выделения (отбора) клеток. Получение СВФ из жировой ткани, содержащей в том числе стволовые клетки, происходит путем ферментативного расщепления или механического разрушения. Согласно трактовке FDA продукт произведен с применением существенных манипуляций, если обработка разрушает и удаляет адипоциты и окружающие структурные компоненты, которые обеспечивают амортизацию и сохранение формы при гомологичном применении, тем самым изменяя первоначальные значимые биологические характеристики продукта, связанные с его пригодностью для реконструкции, репарации или замены10. В Российской Федерации ферментативную обработку или селективное выделение (отбор) клеток в процессе подготовки трансплантата относят к минимальным манипуляциям с клетками и тканями, входящими в перечень объектов трансплантации (ГП)11. Регуляторный подход Республики Беларусь отличается от общемирового тем, что накопление биомассы клеток человека в условиях in vitro (культивирование) относится к ММ, а вместо термина «биологические характеристики» применяется «идентификационные характеристики»12.
Для разработчиков указание возможности применения СВФ в клинической практике в качестве трансплантата является желательным фактором из-за меньшего объема необходимых исследований эффективности и безопасности таких препаратов. При использовании СВФ для терапии механизм действия в большинстве случаев объясняется действием МСК и их секретома, а ГП МСК обосновывается их общеизвестными функциями, как и в организме (противовоспалительной, иммуномодулирующей и другими), но не принимается во внимание гетерогенный состав СВФ с небольшим содержанием МСК [5][11].
Парадигма принятия общих постулатов известных функций в организме МСК за основу доказательной базы их эффективности и безопасности для лечения любых серьезных заболеваний обуславливает проблему массового медицинского туризма в страны с отсутствием нормативной базы регулирования обращения препаратов клеточной терапии13. Простота производства ММ препаратов и различия в правовом поле разных стран привели к значительному росту числа их непроверенного использования для лечения широкого спектра заболеваний, несмотря на отсутствие гарантий их эффективности и безопасности. Показания к применению данных препаратов не основываются на данных тщательно спланированных и проведенных рандомизированных контролируемых клинических исследований, и эти препараты не были одобрены национальными регулирующими органами [12]. Таким образом, доказательства их эффективности и безопасности отсутствуют.
Для предотвращения неконтролируемого клинического использования стволовых клеток Международное общество исследований стволовых клеток (International Society for Stem Cell Research, ISSCR) разработало рекомендации14, направленные на обеспечение контроля во всех областях исследования стволовых клеток. В частности, в них говорится, что прежде чем препараты, включающие стволовые клетки, а также клетки и ткани, подвергнувшиеся существенным манипуляциям или использующиеся негомологичным образом, будет включены в стандарты медицинской помощи или реализовываться на рынке, должна быть доказана их безопасность и эффективность при предполагаемом использовании.
В ЕС препарат для медицинского применения на основе СВФ по показанию «остеоартриты» классифицирован как препарат передовой терапии15. Согласно рекомендациям ЕМА, СВФ — это суспензия клеток, применяемая для облегчения симптомов остеоартрита, которая содержит клетки, не предназначенные для использования у реципиента, с сохранением тех же функций, что и у донора; такие клетки обладают фармакологическим и иммунологическим действием16.
Другими примерами препаратов передовой терапии, в частности, препаратами тканевой инженерии, содержащими МСК (включая СВФ), согласно классификации ЕМА, являются17:
- препарат на основе МСК жировой ткани для лечения стрессового недержания мочи у мужчин после радикальной простатэктомии (дата рекомендации по классификации препарата Комитетом по передовой терапии Европейского медицинского агентства (Committee for Advanced Therapies (CAT) EMA) (далее — дата рассмотрения) — май 2022 г.);
- препарат на основе аллогенных или аутологичных МСК жировой ткани для лечения утолщения стенки мочевого пузыря у пациентов с малой емкостью мочевого пузыря с высоким давлением (дата рассмотрения — март 2023 г.);
- препараты на основе СВФ для лечения гемофильной артропатии (дата рассмотрения — январь 2023 г.) и остеоартрита (дата рассмотрения — июнь 2024 г.).
Директор Центра оценки и исследований биологических препаратов (Center for Biologics Evaluation and Research, CBER) FDA P. Marks в 2020 г. отметил, что аутологичные продукты на основе СВФ представляют собой гетерогенную суспензию, безопасность и эффективность которой неочевидны [2]. В отличие от кожи, сухожилий, костной и некоторых других структурных препаратов на основе клеток и тканей человека, аутологичные препараты, содержащие СВФ, не проходили клинические исследования, и отсутствуют подтверждения их безопасности и эффективности при использовании в клинической практике. Эффективность использования аутологичной СВФ, вводимой одним из нескольких путей (внутрисуставной, внутримышечный, внутриглазной, внутривенный, интратекальный) не была продемонстрирована при таких показаниях, как ревматоидный артрит или остеоартрит [13], инсульт или болезнь Паркинсона [6], сердечная недостаточность [14]. Не было показано и клиническое преимущество лечения препаратами СВФ перед существующей терапией [2]. Немаловажным является и отсутствие в большинстве случаев полного цикла исследований по разработке препаратов на основе СВФ для получения доказательств их эффективности и безопасности, а также разрешения на проведение КИ. Проведение же научных клинических исследований, на которые не были получены разрешения от регуляторного органа, ставит под сомнение надлежащий контроль систематического и тщательного сбора данных о всех развившихся нежелательных явлениях [2].
Таким образом, по мнению эксперта FDA, аутологичные СВФ по всем критериям Международного сообщества по клеточной терапии (International Society for Cell & Gene Therapy, ISCT) являются препаратами клеточной терапии с недоказанной безопасностью и эффективностью [2][15].
Клинические данные о применении продуктов на основе стромально-васкулярной фракции
В последние годы исследования безопасности и эффективности применения СВФ были предметом клинических исследований (табл. 2), охватывающих различные медицинские области (эндокринные, нефрологические, неврологические, дерматологические, гинекологические, урологические и заболевания опорно-двигательного аппарата), что подчеркивает универсальность и потенциал терапевтического применения СВФ. Большинство клинических исследований находятся на ранних стадиях (фазы I и II) для доказательства безопасности, переносимости и начальной концепции эффективности.
Таблица 2. Клинические исследования препаратов, содержащих стромально-васкулярную фракцию
Table 2. Clinical trials of stromal vascular fraction products
Номер клинического исследования Clinical trial ID | Заболевание Disease | Цель исследования Study aim | Количество участников Number of participants | Фаза Phase | Статус Status | Годы проведения Years of study | Страна проведения Country |
NCT05925829 | Сахарный диабет 2 типа Diabetes mellitus, type 2 | Ретроспективное исследование лечения пациентов с диабетом 2 типа СВФ и аутологичной активированной обогащенной тромбоцитами плазмой Retrospective study on type 2 diabetes patients that were treated with autologous SVF and autologous activated platelet-rich plasma | 39 | Фаза 1 Phase 1 | Завершено Completed | 2017 | Индонезия Indonesia |
NCT05154591 | Хроническая почечная недостаточность неизвестной этиологии Сhronic kidney disease of unknown cause | Лечение пациентов, страдающих хронической почечной недостаточностью неизвестной этиологии при помощи трансплантации аутологичных клеток СВФ Treatment of 18 CKDu patients with transplanted autologous SVF cells [16–23] | 18 | Фаза 1 Фаза 2 Phase 1 Phase 2 | Завершено Completed | 2018–2021 | Никарагуа Nicaragua |
NCT06304623 | Легочный фиброз Pulmonary fibrosis | Оценка безопасности однократного внутривенного введения аутологичной СВФ, полученной из жировой ткани для лечения вторичного респираторного дистресс-синдрома, связанного с COVID-19 Evaluation of the safety of a single intravenous injection of autologous adipose-derived SVF for the treatment of secondary respiratory distress associated with COVID-19 [24–28] | 40 | Фаза 1 Phase 1 | Завершено Completed | 2020–2024 | Никарагуа Nicaragua |
NCT05699161 | Болезнь Паркинсона Parkinson’s disease | Лечение болезни Паркинсона трансплантацией клеток СВФ и жировой ткани. Оценка безопасности и поисковое исследование эффективности Treatment of Parkinson’s disease with transplantation of autologous adipose tissue-derived SVF cells (safety and exploratory efficacy study) [16][18][20][22][29–31] | 10 | Фаза 1 Фаза 2 Phase 1 Phase 2 | Завершено Completed | 2021–2022 | Никарагуа Nicaragua |
NCT06116162 | Умеренные и тяжелые рубцы от угревой сыпи Moderate to severe acne scars | Определение эффективности и безопасности геля, содержащего СВФ, для лечения рубцов и сравнение результатов с терапией с использованием фракционного СО2 лазера Determination of the efficacy and safety of SVF-gel filling for acne scars and comparison of the results with those of CO2 fractional laser treatment [32–35] | 18 | Не применимо Not applicable | Завершено Completed | 2021–2023 | Китай China |
NCT06373809 | Критически большие диабетические раны и диабетическая нейропатия Сritically sized diabetic wounds and diabetic neuropathy | Безопасность эскалации дозы и поисковое исследование эффективности для лечения диабетических ран и диабетической нейропатии Initial dose escalation safety and exploratory efficacy study for the treatment of diabetic wounds and diabetic neuropathy [11][36–41] | 20 | Начало фазы 1 Early Phase 1 | Завершено Completed | 2021–2024 | Никарагуа Nicaragua |
NCT05354544 | Рубцы голосовых складок Vocal fold scars | Оценка безопасности и возможности применения аутологичной СВФ у пациентов с рубцеванием голосовых складок Evaluation of the safety and feasibility of autologous SVF in subjects with vocal fold scars | 12 | Фаза 1 Phase 1 | Набор Recruiting | 2021–2025 | США USA |
NCT04753853 | Тендиноз Tendinopathy | Оценка клинических и радиологических результатов лечения тендиноза путем введения аутологичной СВФ внутрь и в область сухожилия Evaluation of the clinical and radiological results after the treatment of patellar tendinopathy through the injection of autologous ultrasound-guided, intra- and peri-tendon SVF | 30 | Не применимо Not applicable | Активно Active | 2021–2025 | Италия Italy |
NCT05232903 | Спонтанное внутримозговое кровоизлияние Spontaneous intracerebral haemorrhage | Оценка безопасности СВФ-терапии у пациентов со спонтанным внутримозговым кровоизлиянием Evaluation of the safety of SVF therapy in patients with SICH | 15 | Фаза 1 Phase 1 | Набор Recruiting | 2022–2024 | Китай China |
NCT04771442 | Заболевания полового члена Penile diseases | Исследование безопасности и возможности однократного применения аутологичной СВФ в или рядом с бляшкой Investigation of the safety and suitability of a single injection of autologous SVF into and around a Peyronie’s disease plaque | 22 | Фаза 1 Phase 1 | Завершено Completed | 2022–2024 | Дания Denmark |
NCT06171204 | Артроз коленного сустава Knee arthrosis | Изучение безопасности и эффективности СВФ для лечения артроза коленного сустава Investigation of the safety and efficacy of SVF for the treatment of knee arthrosis | 10 | Не применимо Not applicable | Набор Recruiting | 2022–2026 | Бельгия Belgium |
NCT06439459 | Истощение регенеративной способности кожи Exhaustion of dermal regenerative capacity | Исследование эффективности СВФ для лечения истощения регенеративной способности кожи при процедуре растяжения кожи Exploration of the efficacy of SVF transplantation in treating exhaustion of dermal regenerative capacity during skin expansion | 8 | Не применимо Not applicable | Завершено Completed | 2023–2024 | Китай China |
NCT05967325 | Травматическое повреждение спинного мозга Traumatic spinal cord injury | Оценка безопасности и возможности применения СВФ в комбинации с функциональными самособирающимися пептидами в нановолокнах в форме геля при лечении травм спинного мозга Evaluation of the safety and feasibility of SVF combined with functional SAP nanofiber hydrogels in the treatment of spinal cord injury | 15 | Не применимо Not applicable | Набор Recruiting | 2023–2025 | Китай China |
NCT06481969 | Синдром истощения яичников Premature ovarian insufficiency | Оценка эффективности и безопасности применения аутологичной СВФ для улучшения исходов беременности у бесплодных пациенток с синдромом истощения яичников Evaluation of the efficacy and safety of autologous SVF in improving the pregnancy outcome of infertile patients with POI | 260 | Не применимо Not applicable | Набор Recruiting | 2024–2026 | Китай China |
Таблица составлена авторами по данным ClinicalTrials.gov / The table is prepared by the authors using dara from ClinicalTrials.gov
Примечание. POI — premature ovarian insufficiency (синдром истощения яичников); SVF — stromal vascular fraction (стромально-васкулярная фракция); SAP — self-assembling peptide (самособирающиеся пептиды); CKDu — chronic kidney disease of unknown cause (хроническая почечная недостаточность неизвестной причины); SICH — spontaneous intracerebral hemorrhage (спонтанное внутримозговое кровоизлияние).
Note. POI, premature ovarian insufficiency; SVF, stromal vascular fraction; SAP, self-assembling peptide; CKDu, chronic kidney disease of unknown cause; SICH, spontaneous intracerebral haemorrhage.
Несмотря на то что некоторые из представленных клинических исследований уже завершены, их результаты не опубликованы, в том числе нет информации о нежелательных явлениях, сопутствующих применению препаратов СВФ в таких исследованиях. В научной литературе присутствуют данные как о случаях развития нежелательных реакций, так и безопасности применения СВФ при различных заболеваниях. В опубликованных ранее данных доклинических исследований были описаны, например, тяжелые воспалительные реакции у животных моделей (коз) при лечении травм межпозвоночных дисков [9], есть сообщения о потере зрения при лечении пациентов с возрастной макулярной дегенерацией [10]. Отсутствие развития серьезных нежелательных реакций на введение СВФ было показано при лечении опорно-двигательного аппарата и неврологических заболеваний [42], остеоартроза [5][43][44], ахиллотендинита [45], мышечно-скелетных заболеваний [13], дегенеративных и аутоиммунных заболеваний [8], системной склеродермии [46], дефектов кожи [47–49]. Необходимо отметить, что для доказательства статистически значимой эффективности применения СВФ в большинстве описанных разработок требуются дополнительные исследования [5–7][46].
С 2015 г. значительно увеличилось количество клинических исследований препаратов на основе СВФ, прошедших весь цикл разработки для получения достоверных сведений об их эффективности и безопасности, а также о нежелательных реакциях при применении СВФ у человека (табл. 2). Однако в настоящее время СВФ, с точки зрения регуляторных органов, остается непроверенным препаратом в связи с отсутствием убедительных и хорошо контролируемых данных в достаточном количестве, демонстрирующих эффективность и безопасность клинического применения таких препаратов.
ЗАКЛЮЧЕНИЕ
Общим принципом отнесения манипуляций к минимальным, принятым регуляторными организациями разных регионов мира, является сохранение биологических характеристик и физиологической функции продуктов после их проведения; признаком гомологического применения тканей или клеток является их использование для замещения (выполнения) присущих им функций в организме.
Существенным различием в регуляторных подходах разных стран к классификации клеточных препаратов, в том числе на основе СВФ, являются такие манипуляции, как ферментативная обработка и селективное выделение (отбор) клеток.
В России перечень ММ определен в нормативных актах как для высокотехнологичных лекарственных препаратов, в частности СТЛП, (Решение № 78 ЕАЭС), так и для объектов трансплантации (Приказ Минздрава России № 306н/3). Однако путь регулирования клеточных препаратов также зависит от их функции после применения (гомологичное/негомологичное). Согласно действующему законодательству ЕАЭС, существует четкое определение СТЛП, включающее, в том числе, норму НГП клеток или тканей без указания объема манипуляций. Таким образом, клетки и ткани, подвергнутые минимальным манипуляциям, используемые для осуществления разных функций у реципиента и донора, регулируются как СТЛП или препараты тканевой инженерии. В связи с этим при клиническом применении, отличном от восполнения дефектов мягких тканей (ГП), СВФ классифицируется как высокотехнологичный лекарственный препарат.
Термины ММ и ГП/НГП недостаточно полно и четко определены в законодательстве ЕАЭС и Российской Федерации, поэтому актуальной является разработка соответствующих рекомендаций по их разъяснению на конкретных примерах.
Дополнительная информация. На сайте журнала «Регуляторные исследования и экспертиза лекарственных средств» размещена англоязычная версия рисунка 1.
https://doi.org/10.30895/1991-2919-2024-14-5-533-546-fig1
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: М.А. Водякова — анализ данных литературы, написание текста рукописи и формулировка выводов; Н.С. Покровский — анализ нормативных документов, написание текста рукописи и формулировка выводов; И.С. Семенова — участие в формулировании выводов; В.А. Меркулов — утверждение окончательной версии рукописи для публикации; Е.В. Мельникова — концепция и дизайн исследования.
Additional information. Figure 1 in English is published on the website of Regulatory Research and Medicine Evaluation.
https://doi.org/10.30895/1991-2919-2024-14-5-533-546-fig1
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Marina A. Vodyakova analysed literature data, drafted the manuscript, and formulated the conclusions. Nikita S. Pokrovsky analysed regulatory documents, drafted the manuscript, and formulated the conclusions. Irina S. Semenova took part in formulating the conclusions. Vadim A. Merkulov approved the final version of the manuscript for publication. Ekaterina V. Melnikova conceptualised and designed the study.
1. Решение Совета Евразийской экономической комиссии от 03.11.2016 № 78 «О Правилах регистрации и экспертизы лекарственных средств для медицинского применения».
2. Executive summary of WHO implementation workshop on ‘WHO considerations in developing a regulatory framework for human cells and tissues and for advanced therapy medicinal products’. WHO. May 2024.
3. Решение Совета Евразийской экономической комиссии от 03.11.2016 № 78 «О Правилах регистрации и экспертизы лекарственных средств для медицинского применения».
4. Executive summary of WHO implementation workshop on ‘WHO considerations in developing a regulatory framework for human cells and tissues and for advanced therapy medicinal products’. WHO. May 2024.
Directive 2001/83/EC of the European Parliament and of the Council of 6 November 2001 on the Community code relating to medicinal products for human use.
Regulation (EC) No. 726/2004 of the European Parliament and of the Council of 31 March 2004 laying down Community procedures for the authorisation and supervision of medicinal products for human and veterinary use and establishing a European Medicines Agency.
Code of Federal Regulations — Title 21 — Part 1271.3 Human cells, tissues, and cellular and tissue-based products.
Code of Federal Regulations — Title 21 — Part 1271.10 Human cells, tissues, and cellular and tissue-based products.
Regulatory considerations for human cells, tissues, and cellular and tissue-based products: Minimal manipulation and homologous use. Guidance for industry and Food and Drug Administration staff. 2020.
Section 351 of the Public Health Service (PHS) Act (42 U.S.C. § 262).
5. Executive summary of WHO implementation workshop on ‘WHO considerations in developing a regulatory framework for human cells and tissues and for advanced therapy medicinal products’. WHO. May 2024.
6. Regulatory considerations for human cells, tissues, and cellular and tissue-based products: Minimal manipulation and homo¬logous use. Guidance for industry and Food and Drug Administration staff. 2020.
7. https://doi.org/10.30895/1991-2919-2024-14-5-533-546-fig1
8. Решение Совета Евразийской экономической комиссии от 03.11.2016 № 78 «О Правилах регистрации и экспертизы лекарственных средств для медицинского применения».
Directive 2001/83/EC of the European Parliament and of the Council of 6 November 2001 on the Community code relating to medicinal products for human use.
9. Приказ Министерства здравоохранения Российской Федерации, Российской академии наук от 04.06.2015 № 306н/3 «Об утверждении перечня объектов трансплантации».
10. Regulatory considerations for human cells, tissues, and cellular and tissue-based products: Minimal manipulation and homologous use. Guidance for industry and Food and Drug Administration staff. 2020.
11. Приказ Министерства здравоохранения Российской Федерации, Российской академии наук от 04.06.2015 № 306н/3 «Об утверждении перечня объектов трансплантации».
12. Постановление Министерства здравоохранения Республики Беларусь от 12.01.2024 № 7 «О перечне манипуляций с клетками человека, не относящихся к существенным».
13. Executive summary of WHO implementation workshop on ‘WHO considerations in developing a regulatory framework for human cells and tissues and for advanced therapy medicinal products’. WHO. May 2024.
14.. ISSCR. Guidelines for Stem Cell Research and Clinical Translation. 2021.
15. Scientific recommendation on classification of advanced therapy medicinal products. EMA/534818/2017.
16. Там же.
17. Там же.
Список литературы
1. Мельникова ЕВ, Горяев АА, Савкина МВ, Меркулова ОВ, Чапленко АА, Рачинская ОА и др. Международный опыт нормативно-правового регулирования препаратов, содержащих жизнеспособные клетки человека. БИОпрепараты. Профилактика, диагностика, лечение. 2018;18(3):150–60. https://doi.org/10.30895/2221-996X-2018-18-3-150-160
2. Marks PW. Clear evidence of safety and efficacy is needed for stromal vascular fraction products: Commentary on “Arguments for a different regulatory categorization and framework for stromal vascular fraction”. Stem Cells Dev. 2020;29(5):263–5. https://doi.org/10.1089/scd.2020.0011
3. Chisholm J, Von Tigerstrom B, Bedford P, Fradette J, Viswanathan S. Workshop to address gaps in regulation of minimally manipulated autologous cell therapies for homologous use in Canada. Cytotherapy. 2017;19(12):1400–11. https://doi.org/10.1016/j.jcyt.2017.08.015
4. Ejaz A, Yang KS, Venkatesh KP, Chinnapaka S, Kokai LE, Rubin JP. The impact of human lipoaspirate and adipose tissue-derived stem cells contact culture on breast cancer cells: implications in breast reconstruction. Int J Mol Sci. 2020;21(23):9171. https://doi.org/10.3390/ijms21239171
5. Dykstra JA, Facile T, Patrick RJ, Francis KR, Milanovich S, Weimer JM, et al. Concise review: fat and furious: harnessing the full potential of adipose-derived stromal vascular fraction. Stem Cells Transl Med. 2017;6(4):1096–108. https://doi.org/10.1002/sctm.16-0337
6. Zheng H, Zhang B, Chhatbar PY, Dong Y, Alawieh A, Lowe F, et al. Mesenchymal stem cell therapy in stroke: a systematic review of literature in pre-clinical and clinical research. Cell Transplant. 2018;27(12):1723–30. https://doi.org/10.1177/0963689718806846
7. Karina K, Rosliana I, Rosadi I, Schwartz R, Sobariah S, Afini I, et al. Safety of technique and procedure of stromal vascular fraction therapy: from liposuction to cell administration. Scientifica (Cairo). 2020;2020:2863624. https://doi.org/10.1155/2020/2863624
8. Bowles AC, Wise RM, Gerstein BY, Thomas RC, Ogelman R, Manayan RC, et al. Adipose stromal vascular fraction attenuates Th1 cell-mediated pathology in a model of multiple sclerosis. J Neuroinflammation. 2018;15(1):77. https://doi.org/10.1186/s12974-018-1099-3
9. Detiger SEL, Helder MN, Smit TH, Hoogendoorn RJW. Adverse effects of stromal vascular fraction during regenerative treatment of the intervertebral disc: observations in a goat model. Eur Spine J. 2015;24(9):1992–2000. https://doi.org/10.1007/s00586-015-3803-7
10. Kuriyan AE, Albini TA, Townsend JH, Rodriguez M, Pandya HK, Leonard RE, et al. Vision loss after intravitreal injection of autologous “stem cells” for AMD. N Engl J Med. 2017;376(11):1047–53. https://doi.org/10.1056/NEJMoa1609583
11. Bourin P, Bunnell BA, Casteilla L, Dominici M, Katz AJ, March KL, et al. Stromal cells from the adipose tissue-derived stromal vascular fraction and culture expanded adipose tissue-derived stromal/stem cells: a joint statement of the International Federation for Adipose Therapeutics and Science (IFATS) and the International Society for Cellular Therapy (ISCT). Cytotherapy. 2013;15(6):641–8. https://doi.org/10.1016/j.jcyt.2013.02.006
12. Turner LG. US clinics marketing unproven and unlicensed adipose-derived autologous stem cell interventions. Regen Med. 2015;10(4):397–402. https://doi.org/10.2217/rme.15.10
13. Law L, Hunt CL, Van Wijnen AJ, Nassr A, Larson AN, Eldrige JS, et al. Office-based mesenchymal stem cell therapy for the treatment of musculoskeletal disease: a systematic review of recent human studies. Pain Med. 2019;20(8):1570–83. https://doi.org/10.1093/pm/pny256
14. Lalu MM, Mazzarello S, Zlepnig J, Dong YY (Ryan), Montroy J, McIntyre L, et al. Safety and efficacy of adult stem cell therapy for acute myocardial infarction and ischemic heart failure (SafeCell Heart): a systematic review and meta-analysis. Stem Cells Transl Med. 2018;7(12):857–66. https://doi.org/10.1002/sctm.18-0120
15. Dominici M, Nichols K, Srivastava A, Weiss DJ, Eldridge P, Cuende N, et al. Positioning a scientific community on unproven cellular therapies: the 2015 international society for cellular therapy perspective. Cytotherapy. 2015;17(12):1663–6. https://doi.org/10.1016/j.jcyt.2015.10.007
16. Brown JC, Shang H, Li Y, Yang N, Patel N, Katz AJ. Isolation of adipose-derived stromal vascular fraction cells using a novel point-of-care device: cell characterization and review of the literature. Tissue Eng Part C Methods. 2017;23(3):125–35. https://doi.org/10.1089/ten.tec.2016.0377
17. Caplan AI, Correa D. The MSC: an injury drugstore. Cell Stem Cell. 2011;9(1):11–5. https://doi.org/10.1016/j.stem.2011.06.008
18. Carstens M, Haq I, Martinez-Cerrato J, Dos-Anjos S, Bertram K, Correa D. Sustained clinical improvement of Parkinson’s disease in two patients with facially-transplanted adipose-derived stromal vascular fraction cells. J Clin Neurosci. 2020;81:47–51. https://doi.org/10.1016/j.jocn.2020.09.001
19. Correa-Rotter R, García-Trabanino R. Mesoamerican nephropathy. Semin Nephrol. 2019;39(3):263–71. https://doi.org/10.1016/j.semnephrol.2019.02.004
20. Guo J, Nguyen A, Banyard DA, Fadavi D, Toranto JD, Wirth GA, et al. Stromal vascular fraction: a regenerative reality? Part 2: Mechanisms of regenerative action. J Plast Reconstr Aesthet Surg. 2016;69(2):180–8. https://doi.org/10.1016/j.bjps.2015.10.014
21. Johnson RJ, Wesseling C, Newman LS. Chronic kidney disease of unknown cause in agricultural communities. N Engl J Med. 2019;380(19):1843–52. https://doi.org/10.1056/NEJMra1813869
22. Nguyen A, Guo J, Banyard DA, Fadavi D, Toranto JD, Wirth GA, et al. Stromal vascular fraction: a regenerative reality? Part 1: Current concepts and review of the literature. J Plast Reconstr Aesthet Surg. 2016;69(2):170–9. https://doi.org/10.1016/j.bjps.2015.10.015
23. Wijkström J, González-Quiroz M, Hernandez M, Trujillo Z, Hultenby K, Ring A, et al. Renal morphology, clinical findings, and progression rate in Mesoamerican nephropathy. Am J Kidney Dis. 2017;69(5):626–36. https://doi.org/10.1053/j.ajkd.2016.10.036
24. Coronaviridae Study Group of the International Committee on Taxonomy of Viruses. The species Severe acute respiratory syndromerelated coronavirus: classifying 2019-nCoV and naming it SARS-CoV-2. Nat Microbiol. 2020;5(4):536–44. https://doi.org/10.1038/s41564-020-0695-z
25. Guan W, Ni Z, Hu Y, Liang W, Ou C, He J, et al. Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med. 2020;382(18):1708–20. https://doi.org/10.1056/NEJMoa2002032
26. Jiang S, Du L, Shi Z. An emerging coronavirus causing pneumonia outbreak in Wuhan, China: calling for developing therapeutic and prophylactic strategies. Emerg Microbes Infect. 2020;9(1):275–7. https://doi.org/10.1080/22221751.2020.1723441
27. Mehta P, McAuley DF, Brown M, Sanchez E, Tattersall RS, Manson JJ. COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet. 2020;395(10229):1033–4. https://doi.org/10.1016/S0140-6736(20)30628-0
28. Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;395(10223):497–506. https://doi.org/10.1016/S0140-6736(20)30183-5
29. Lindvall O. Treatment of Parkinson’s disease using cell transplantation. Phil Trans R Soc Lond B Biol Sci. 2015;370(1680):20140370. https://doi.org/10.1098/rstb.2014.0370
30. Shulman LM, Gruber-Baldini AL, Anderson KE, Fishman PS, Reich SG, Weiner WJ. The clinically important difference on the unified Parkinson’s disease rating scale. Arch Neurol. 2010;67(1):64–70. https://doi.org/10.1001/archneurol.2009.295
31. Horváth K, Aschermann Z, Kovács M, Makkos A, Harmat M, Janszky J, et al. Changes in quality of life in Parkinson’s disease: how large must they be to be relevant? Neuroepidemiology. 2017;48(1–2):1–8. https://doi.org/10.1159/000455863
32. Bhargava S, Cunha PR, Lee J, Kroumpouzos G. Acne scarring management: systematic review and evaluation of the evidence. Am J Clin Dermatol. 2018;19(4):459–77. https://doi.org/10.1007/s40257-018-0358-5
33. Connolly D, Vu HL, Mariwalla K, Saedi N. Acne scarring — pathogenesis, evaluation, and treatment options. J Clin Aesthet Dermatol. 2017;10(9):12–23. PMID: 29344322
34. Boen M, Jacob C. A review and update of treatment options using the acne scar classification system. Dermatol Surg. 2019;45(3):411–22. https://doi.org/10.1097/DSS.0000000000001765
35. Yao Y, Cai J, Zhang P, Liao Y, Yuan Y, Dong Z, et al. Adipose stromal vascular fraction gel grafting: a new method for tissue volumization and rejuvenation. Dermatol Surg. 2018;44(10):1278–86. https://doi.org/10.1097/DSS.0000000000001556
36. Amos PJ, Shang H, Bailey AM, Taylor A, Katz AJ, Peirce SM. IFATS collection: the role of human adipose-derived stromal cells in inflammatory microvascular remodeling and evidence of a perivascular phenotype. Stem Cells. 2008;26(10):2682–90. https://doi.org/10.1634/stemcells.2008-0030
37. Arnberg F, Lundberg J, Olsson A, Samén E, Jaff N, Jussing E, et al. Intra-arterial administration of placenta-derived decidual stromal cells to the superior mesenteric artery in the rabbit: distribution of cells, feasibility, and safety. Cell Transplant. 2016;25(2):401–10. https://doi.org/10.3727/096368915X688191
38. Berishvili E, Kaiser L, Cohen M, Berney T, Scholz H, Floisand Y, Mattsson J. Treatment of COVID-19 pneumonia: the case for placenta-derived cell therapy. Stem Cell Rev Rep. 2021;17(1):63–70. https://doi.org/10.1007/s12015-020-10004-x
39. Bishop PD, Feiten LE, Ouriel K, Nassoiy SP, Pavkov ML, Clair DG, et al. Arterial calcification increases in distal arteries in patients with peripheral arterial disease. Ann Vasc Surg. 2008;22(6):799–805. https://doi.org/10.1016/j.avsg.2008.04.008
40. Bura A, Planat-Benard V, Bourin P, Silvestre J-S, Gross F, Grolleau J-L, et al. Phase I trial: the use of autologous cultured adipose-derived stroma/stem cells to treat patients with non-revascularizable critical limb ischemia. Cytotherapy. 2014;16(2):245–57. https://doi.org/10.1016/j.jcyt.2013.11.011
41. Carstens MH, Correa D, Llull R, Gomez A, Turner E, Valladares LS. Subcutaneous reconstruction of hand dorsum and fingers for late sequelae of burn scars using adipose-derived stromal vascular fraction (SVF). CellR4. 2015;3(5):e1675.
42. Siennicka K, Zolocinska A, Stepien K, Lubina-Dabrowska N, Maciagowska M, Zolocinska E, et al. Adipose-derived cells (stromal vascular fraction) transplanted for orthopedical or neurological purposes: are they safe enough? Stem Cells Int. 2016;2016:5762916. https://doi.org/10.1155/2016/5762916
43. Lu J, Xu B, Hu J, Yu J, Kang J, Yu Y, et al. Autologous adipose-derived vascular stromal component injection offers a safe and effective method for treating knee osteoarthritis: a one-year double-blind, randomized controlled clinical trial. Preprint; 2023. https://doi.org/10.21203/rs.3.rs-3369095/v1
44. Goncharov EN, Koval OA, Bezuglov EN, Encarnacion Ramirez M, Engelgard M, Eremin II, et al. Stromal vascular fraction therapy for knee osteoarthritis: a systematic review. Medicina (Kaunas). 2023;59(12):2090. https://doi.org/10.3390/medicina59122090
45. Usuelli FG, Grassi M, Maccario C, Vigano M, Lanfranchi L, Alfieri Montrasio U, de Girolamo L. Intratendinous adipose-derived stromal vascular fraction (SVF) injection provides a safe, efficacious treatment for Achilles tendinopathy: results of a randomized controlled clinical trial at a 6-month follow-up. Knee Surg Sports Traumatol Arthrosc. 2018;26(7):2000–10. https://doi.org/10.1007/s00167-017-4479-9
46. Mazur S, Zołocińska A, Siennicka K, Janik-Kosacka K, Chrapusta A, Pojda Z. Safety of adipose-derived cell (stromal vascular fraction — SVF) augmentation for surgical breast reconstruction in cancer patients. Adv Clin Exp Med. 2018;27(8):1085–90. https://doi.org/10.17219/acem/70798
47. Pattayadeekul T, Pawcsuntorn T, Nararatwanchai T. The efficacy and safety of autologous stromal vascular fraction transplantation for infraorbital skin rejuvenation: a clinical prospective study. J Cosmet Dermatol. 2022;21(1):220–6. https://doi.org/10.1111/jocd.14069
48. Han X, Ji D, Liu Y, Hu S. Efficacy and safety of transplantation of autologous fat, platelet-rich plasma (PRP) and stromal vascular fraction (SVF) in the treatment of acne scar: systematic review and meta-analysis. Aesthetic Plast Surg. 2023;47(4):1623–32. https://doi.org/10.1007/s00266-023-03295-1
49. Roohaninasab M, Ahmadi M, Dehghani A, Zare S, Goodarzi A, Nouri M, et al. The investigation and comparison of the efficacy and safety of stromal vascular fraction (SVF), platelet rich plasma (PRP), and 1064-nm Q-switched Nd:YAG laser in reducing nanofat-treated infraorbital dark circles and wrinkles: a controlled blinded randomized clinical trial. Skin Res Technol. 2024;30(6):e13793. https://doi.org/10.1111/srt.13793
Об авторах
М. А. ВодяковаРоссия
Водякова Марина Андреевна - канд. фарм. наук.
Петровский б-р, д. 8, стр. 2, Москва, 127051
Н. С. Покровский
Россия
Покровский Никита Станиславович.
Петровский б-р, д. 8, стр. 2, Москва, 127051
И. С. Семенова
Россия
Семенова Ирина Семеновна - канд. биол. наук.
Петровский б-р, д. 8, стр. 2, Москва, 127051
В. A. Меркулов
Россия
Меркулов Вадим Анатольевич - д-р мед. наук, проф.
Петровский б-р, д. 8, стр. 2, Москва, 127051
Е. В. Мельникова
Россия
Мельникова Екатерина Валерьевна - канд. биол. наук.
Петровский б-р, д. 8, стр. 2, Москва, 127051
Дополнительные файлы

|
1. Fig. 1. Algorithm for the classification of manipulations as minimal or substantial according to the Food and Drug Administration regulatory approach. HCT/P, human cells, tissues, and cellular and tissue-based products | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(1MB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Водякова М.А., Покровский Н.С., Семенова И.С., Меркулов В.A., Мельникова Е.В. Классификация продуктов клеточной терапии по степени манипулирования клеток и выполняемым функциям: анализ международных регуляторных подходов. Регуляторные исследования и экспертиза лекарственных средств. 2024;14(5):533-546. https://doi.org/10.30895/1991-2919-2024-14-5-533-546
For citation:
Vodyakova M.A., Pokrovsky N.S., Semenova I.S., Merkulov V.A., Melnikova E.V. Classification of Cell Therapy Products by Cell Manipulation Degree and Functions Performed: Analysis of International Regulatory Approaches. Regulatory Research and Medicine Evaluation. 2024;14(5):533-546. (In Russ.) https://doi.org/10.30895/1991-2919-2024-14-5-533-546



































