Перейти к:
Вопросы валидации биоаналитических методик количественного определения биомаркеров: обзор нормативных документов
https://doi.org/10.30895/1991-2919-2025-766
Резюме
ВВЕДЕНИЕ. Биомаркеры используют при оценке нормальных физиологических процессов в организме; для диагностики и подбора терапии различных заболеваний; при разработке новых лекарственных препаратов. Расширение использования биомаркеров в качестве инструментов разработки лекарственных препаратов обусловливает необходимость совершенствования методов их количественного определения.
ЦЕЛЬ. Обобщение материалов по вопросам валидации биоаналитических методик количественного определения биомаркеров.
ОБСУЖДЕНИЕ. Использованы регуляторные документы Международного совета по гармонизации (International Council for Harmonisation, ICH), Управления по контролю за качеством продуктов питания и лекарственных средств (Food and Drug Administration, FDA), включая Рабочую группу по совместному обсуждению анализа биомаркеров (Biomarker Assay Collaborative Evidentiary Considerations Writing Group) и Институт критического пути (Critical Path Institute, C-Path) Европейского агентства по лекарственным средствам (European Medicines Agency, EMA), Евразийской экономической комиссии (ЕЭК) и научные публикации, находящиеся в открытом доступе (в том числе по данным библиографических баз и поисковых систем PubMed, Web of Science, РИНЦ (eLIBRARY.RU), Google Scholar), преимущественно опубликованные в период 2014–2024 гг. Рассмотрены процессы аналитической и клинической валидации биомаркеров, отмечены этапы их аналитической валидации, выделены ключевые показатели валидации биоаналитической методики в зависимости от задачи (анализ для исследований фармакокинетики, биоэквивалентности и токсикокинетики; анализ биомаркеров при разработке лекарственных препаратов и для диагностики в ходе доклинических и клинических исследований). Предложен алгоритм выбора уровня аналитической валидации биомаркеров в зависимости от особенностей метода (хроматография, лигандсвязывающие методы с использованием наборов реагентов различного назначения) и решаемых задач.
ВЫВОДЫ. Подтверждение пригодности методики анализа биомаркеров для применения согласно планируемым целям близко к общепринятой процедуре валидации биоаналитических методик. Необходимо широкое научное обсуждение деталей валидации анализа биомаркеров, поскольку выработка единого алгоритма этой сложной процедуры будет способствовать более надежному использованию биомаркеров, повышению качества сопутствующих этому процессу исследований и конечному результату — введению в обращение новых эффективных и безопасных лекарственных препаратов.
Ключевые слова
Для цитирования:
Косман В.М., Карлина М.В., Фаустова Н.М., Макарова М.Н., Макаров В.Г. Вопросы валидации биоаналитических методик количественного определения биомаркеров: обзор нормативных документов. Регуляторные исследования и экспертиза лекарственных средств. 2025;15(5):550-564. https://doi.org/10.30895/1991-2919-2025-766
For citation:
Kosman V.M., Karlina M.V., Faustova N.M., Makarova M.N., Makarov V.G. Validating Bioanalytical Methods for Biomarker Quantitation: A Regulatory Document Review. Regulatory Research and Medicine Evaluation. 2025;15(5):550-564. https://doi.org/10.30895/1991-2919-2025-766
ВВЕДЕНИЕ
Согласно определению, данному Рабочей группой по определениям биомаркеров (Biomarkers Definitions Working Group) Управления по контролю за качеством продуктов питания и лекарственных средств (Food and Drug Administration, FDA, США) и Национального института здоровья (National Institutes of Health, NIH), «биологические маркеры — это количественно определяемые биологические параметры, которые как индикаторы определяют норму, патологию и результат лекарственной коррекции заболевания»1 [1]. В интерпретации [2][3] сделан иной акцент: биомаркер — это «показатель, который можно объективно измерить и который может служить индикатором физиологического или патологического процесса или ответа на лекарственную терапию». Авторы источника [4] со ссылкой на источник [3] приводят такое определение: «биомаркер — объективно исследуемый параметр, измерение которого отличается высокой точностью, воспроизводимостью и надежностью, что позволяет отражать интенсивность физиологических процессов, состояние здоровья, степень риска или факт развития болезни, ее стадию и прогноз». Параметр может быть химическим, физическим или биологическим. Биомаркеры используют при оценке физиологических процессов в организме; выявлении заболевания и подборе лечения; прогнозировании течения, прогрессирования и исхода болезни; разработке новых лекарственных препаратов, установлении их лечебного эффекта и побочного действия, выявлении механизма действия [4].
Учитывая большое количество биомаркеров, имеющих разнообразную природу, разработать единую классификацию не удается. Биомаркеры классифицируют в зависимости от цели применения при диагностике и лечении, от исследуемой системы, от вида исследования, специфичности и др. [4]. Одна из классификаций [1]:
0 тип — маркер, указывающий на наличие заболевания и коррелирующий с его клиническими проявлениями;
I тип — маркер, связанный с терапевтическим эффектом и механизмом действия препарата;
II тип (предиктор клинического исхода, суррогатная конечная точка) — маркер, позволяющий предположить исход заболевания, оценить эффективность лечения.
В зависимости от задачи выделяют следующие группы биомаркеров [2]:
- диагностические, позволяющие установить факт наличия или отсутствия заболевания, степень его тяжести (например, количество гликированного гемоглобина — сахарный диабет);
- прогностические, позволяющие оценить риск развития заболевания или его осложнений (например, полиморфизм генов факторов свертывания крови);
- терапевтические, позволяющие оценить или дать прогноз эффективности лекарственной терапии (например, международное нормализованное отношение — оценка эффективности варфарина, являющаяся стандартизированным показателем, введенным Всемирной организацией здравоохранения для унификации результатов протромбинового теста в разных лабораториях [5]).
Признание того или иного параметра биомаркером чего-либо является многоступенчатым и длительным процессом, подразумевающим анализ результатов широкого спектра клинических, филогенетических и других исследований [6]. Так, авторы обзора [6] обсуждали возможность использования ряда параметров (связанных с генами, кодирующими ферменты комплекса цитохрома Р450, семейства уридин-дифосфат глюкуронозилтрансферазы, гликопротеин Р) в качестве фармакогенетических маркеров фармакокинетики противоэпилептических препаратов. Однако пришли к выводу, что из-за неоднозначных результатов исследований и недостатка соответствующих рандомизированных проспективных плацебо-контролируемых исследований достоверные данные по этому вопросу отсутствуют.
Важно отметить, что далеко не каждый лабораторный показатель можно назвать биомаркером. По мнению авторов [2], основной признак биомаркера — его статистически обоснованная взаимосвязь с заболеванием, осложнением, эффектом терапии. Авторы отмечали, что только в результатах 20% проанализированных ими исследований2 приведены чувствительность, специфичность, прогностическая ценность показателя. В большинстве работ показатель назван биомаркером на основании его статистически значимого повышения/понижения/появления при определенной патологии, что явно недостаточно для признания показателя биомаркером.
Учитывая возрастающую роль биомаркеров в диагностике, мониторинге терапии и разработке лекарственных средств, систематизация международных и национальных регуляторных требований, а также научных рекомендаций по определению и применению биомаркеров является актуальной.
Цель работы — обобщение материалов по вопросам валидации биоаналитических методик количественного определения биомаркеров.
При подготовке работы использованы регуляторные документы Международного совета по гармонизации (International Council for Harmonisation, ICH), Управления по контролю за качеством продуктов питания и лекарственных средств (Food and Drug Administration, FDA), включая Рабочую группу по совместному обсуждению анализа биомаркеров (Biomarker Assay Collaborative Evidentiary Considerations Writing Group) и Институт критического пути (Critical Path Institute, C-Path), Европейского агентства по лекарственным средствам (European Medicines Agency, EMA), Евразийской экономической комиссии (ЕЭК) и иные научные источники, находящиеся в открытом доступе (в том числе по данным электронных баз PubMed, Web of Science, РИНЦ (eLIBRARY.RU), Google Scholar), преимущественно опубликованные в период 2014–2024 гг. Ключевые слова, использованные в поисковых запросах: «биомаркеры» (biomarkers), «аналитические/биоаналитические методы» (analytical/bioanalytical methods), «количественное определение» (assay, quantification), «валидация» (validation).
ОСНОВНАЯ ЧАСТЬ
Клиническая и аналитическая валидация (квалификация) биомаркера. В работе [7] отмечено, что для успешного применения биомаркера его необходимо выбрать, изучить и валидировать. Под валидацией в данном случае понимают процесс подтверждения того, что выбранный биомаркер выполняет свое функциональное назначение (клиническое, диагностическое и др.), а его использование приводит к ожидаемым результатам (выявление заболевания, оценка влияния терапии на течение заболевания, идентификация мишеней лекарственных средств и др.). Документ «Вопросы для обсуждения: Научное и регуляторное обсуждение аналитической валидации анализов, используемых в квалификации биомаркеров в биологических матрицах»3 выделяет аналитическую валидацию (включает все факторы, которые являются частью процедуры анализа, зависят от приемлемости образцов, критических реагентов и рабочих характеристик оборудования или тестовой системы, включая отбор образцов, их обработку и хранение) и клиническую валидацию биомаркера (направлена на интерпретацию измерений биомаркера, оценку клинической чувствительности, клинической специфичности, клинической точности биомаркера при прогнозировании заявленного результата).
В литературе можно встретить также термин «квалификация биомаркера» [8], который, по-видимому, является синонимом термина «валидация биомаркера»; по нашему мнению, оба этих термина следует отнести к клинической валидации (или клинической квалификации) биомаркера. Также отметим, что во многих работах, посвященных валидации биомаркера, предметом обсуждения являются именно аспекты клинической валидации: прогностической ценности, отклика биомаркера в условиях различных экспериментов, популяций, патологий и др., как в рамках клинического применения, так и в доклинических исследованиях (ДКИ), а также правовые вопросы защиты биоинформации, использования биомедицинских технологий и биоматериалов [9–16]. По мнению авторов [14], по причине отсутствия широкомасштабных когортных исследований потенциальных биомаркеров, которые подтвердили бы их клиническую значимость, из открытых за прошедшие десятилетия тысяч биомаркеров клиническое применение в медицине нашли менее ста. Таким образом, внимание к клинической валидации биомаркеров безусловно оправдано. Можно также отметить, что чем более общепринятым, широко используемым в клинической практике является какой-либо показатель, тем больше данных (с применением устоявшейся методики его измерения) у значительного числа пациентов и популяций можно получить и проанализировать, тем больше вероятность выявления клинического значения такого показателя и его квалификации в качестве биомаркера.
Вместе с тем данные, положенные в основу клинической валидации (квалификации) биомаркера, должны базироваться на достоверных способах измерения параметра, являющегося потенциальным биомаркером, — биоаналитических методиках. Поскольку в определениях биомаркера звучат следующие словосочетания: «количественно определяемые», «объективно определяемые», «измерение с высокой точностью, воспроизводимостью и надежностью», становится очевидной необходимость разработки методики количественного определения выбранного биомаркера и ее последующей валидации.
Регуляторные аспекты валидации биоаналитических методик и методик анализа биомаркеров. Процедура и объем валидации биоаналитических методик регламентированы рядом документов4. Руководства направлены на описание процедуры валидации биоаналитических методик, используемых для определения концентраций химических и биологических препаратов и их метаболитов в биологических образцах (кровь, плазма, сыворотка, другие биологические жидкости или ткани), полученных в токсикокинетических (ТК), фармакокинетических (ФК) исследованиях и на всех этапах клинических исследований (КИ), включая сравнительные исследования биодоступности/биоэквивалентности (БЭ). Все документы отмечают отличия в процедуре в отношении хроматографических методов и методов связывания лиганда.
Действие Руководства5 распространяется в том числе на методики анализа биомаркеров; в других документах6 отмечено, что анализ биомаркеров и биоаналитические методы, используемые для оценки иммуногенности, не входят в сферу действия руководств. Такое разночтение по отношению к биомаркерам, по-видимому, связано с тем, что полный цикл валидационных испытаний является достаточно ресурсозатратной и трудоемкой процедурой, поэтому ее целесообразность на ранних стадиях изучения потенциального биомаркера дискуссионна. Е.С. Дон и соавт. [7] отмечают, что валидацию биомаркера необходимо начинать с валидации анализа его определения (биоаналитической методики), а часто и с разработки такой методики. Особенности изучения биомаркера — неизвестный диапазон возможных концентраций, их вариабельность, влияние условий отбора и хранения образцов, компонентов матрицы и используемых реагентов. Кроме того, отсутствие хорошо охарактеризованных стандартных образцов для анализа осложняет валидацию таких методик, обусловливает отсутствие единой стратегии и возможность валидации методики определения только для решения определенных задач, допуская непригодность для альтернативных, иных целей [7].
В англоязычной литературе в отношении аналитических методик определения биомаркеров в биологических матрицах закреплены термины context of use (COU) — контекст использования и fit-for-purpose (FFP) — соответствие назначению7, подразумевающие, что для поисковых исследований могут быть использованы предварительные результаты оценки потенциального (предполагаемого) биомаркера, в то время как принятие более важных решений должно быть основано на данных по валидированному (квалифицированному) биомаркеру [17]. Соответственно необходимо провести валидационные испытания в объеме, подтверждающем адекватность методики согласно предполагаемому ее применению на конкретном этапе исследований. По мнению A. Safavi8, важно постоянно возвращаться к контексту использования анализа. Ответы на вопросы: «для чего будут использованы данные»; «какие выводы будут сделаны на основе анализа»; «будут ли они качественными или количественными»; «будут ли данные о биомаркере использованы для подачи в регулирующие органы, или они нужны только для лучшего понимания механизма действия препарата» составляют основу концепции COU и FFP. Эта концепция, появившаяся в 2005–2006 гг. [17], претерпела ряд изменений и обсуждений как в специальных рабочих группах, так и в ходе широких научных дискуссий в рамках конференций, научных публикаций и др. [18–20] и нашла наиболее полное и подробное отражение в документах 2018–2021 гг.9 [21]. Правовой статус документа10, озаглавленного «Вопросы для обсуждения», не ясен — в некоторых работах он отмечен как «окончательный вариант документа» C-Path и FDA [22], но на момент подготовки публикации отсутствует на сайте FDA. По-видимому, он является предшественником руководства, наделенного регуляторным статусом, а его рекомендаций целесообразно придерживаться в практической работе. Отметим, что концепция и документ продолжают быть предметом дальнейшего совершенствования и выработки подходов с учетом различных мнений специалистов в данной области [22–24], а ключевые положения вошли в принятый FDA документ, посвященный применению биомаркеров в КИ новых лекарственных препаратов (ЛП) для животных11.
Этапы и ключевые элементы аналитической валидации биомаркера. Анализ биомаркера в свете концепции FFP — процесс, сопровождающий создание ЛП с использованием биомаркера (независимо от роли биомаркера в данном процессе) и включающий (по мнению [18]) четыре непрерывных этапа: разработку и предварительную валидацию методики, валидацию исследовательской методики, «полную» или обширную валидацию методики и валидацию методики в исследовании (рис. 1). Процедуры измерения значений биомаркера, которые далее используют для установления и подтверждения точек принятия решений при клинической валидации (квалификации) биомаркера, должны проходить достаточно обширную и строгую аналитическую валидацию, чтобы гарантировать соответствие эффективности анализа применению биомаркера12. В данной работе мы сфокусированы именно на аналитической части — методике/процедуре измерения параметра.
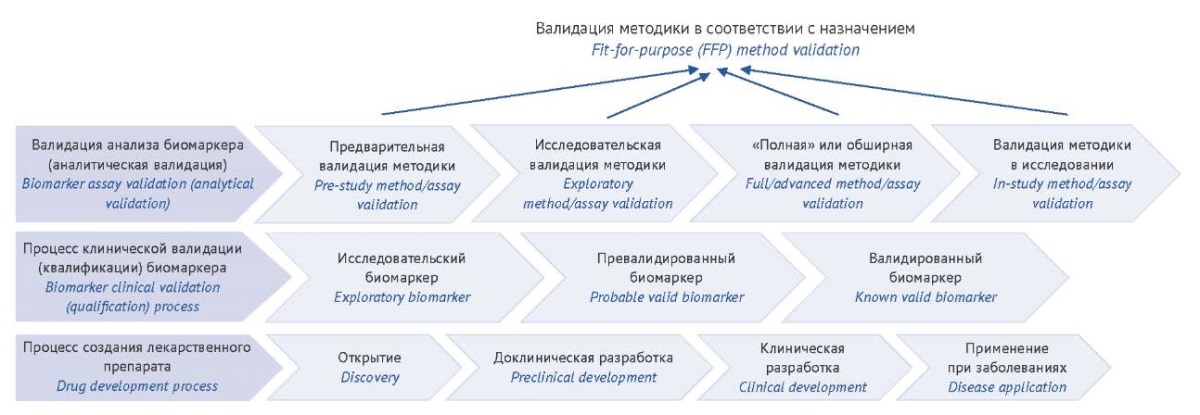
Рисунок подготовлен авторами / The figure is prepared by the authors
Рис. 1. Интеграция аналитической валидации анализа биомаркеров и процесса его клинической квалификации с разработкой лекарственных препаратов (по материалам [18] с изменениями)
Fig. 1. Integrating analytical validation of biomarker analysis and its clinical qualification with drug development (based on moderated material [18])
В большинстве работ выделяют два основных этапа или направления: анализ биомаркера в процессе разработки ЛП и для диагностики13 [7][17][18][22][23], которые определяют глубину/объем валидационных испытаний. Можно также встретить выделение предварительных (скрининговых) этапов [17], частичной валидации (translational/partial validation, отсутствует в более ранних работах [18][19], упомянута в ключевом документе14) и сопоставление с объемом валидационных испытаний методики для оценки БЭ, ФК, ТК исследуемых соединений15 [7][17]. Упомянутые рекомендации обобщены в таблице 1.
Таблица 1. Ключевые элементы валидации биоаналитической методики в зависимости от задачи
Table 1. Key elements of bioanalytical method validation depending on the objective
|
Параметры Parameters |
Анализ биомаркера при исследованиях биоэквивалентности, фармако- и токсикокинетики Biomarker analysis in bioequivalence, pharmaco- and toxicokinetics studies |
Анализ биомаркера в процессе разработки лекарственных препаратов Biomarker analysis during medicinal product development |
Анализ биомаркера для диагностики Biomarker analysis for diagnosis |
|
|
Стадия создания лекарственного препарата, характер принимаемого решения Stage of medicinal products development, nature of the decision |
Регуляторные ДКИ и КИ лекарственных веществ Regulatory pre-CS and CS of medicinal substances |
Разработка, скрининг, принятие решения о дальнейшем использовании биомаркера Development, screening, deciding on further use of the biomarker |
Трансляционные ДКИ и КИ, выбор биомаркера-кандидата, безопасность, механизм действия (фармакодинамика), выбор дозы, режима дозирования, подтверждение концепции применения биомаркера Translational pre-CS and CS, candidate biomarker selection, safety, mechanism of action (PD), dose selection, dosing regimen, biomarker proof of concept |
ДКИ и КИ, выявление заболеваний, патологических состояний, оценка безопасности определения биомаркера для субъекта исследования / пациента, подтверждение диагноза Pre-CS and CS, healthy identification of diseases, pathological conditions, assessment of the safety of biomarker determination for the subject/patient, confirmation of diagnosis |
|
Уровень валидации* Validation level* |
Полная валидация Full validation |
Исследовательская валидация Discovery exploratory validation |
Частичная валидация Translational partial validation |
Полная валидация Full advanced validation |
|
Тип результата Result type |
Количественный (абсолютный или относительный) Quantitative (absolute or relative) |
Качественный, полуколичественный, количественный (абсолютный или относительный) Qualitative, semi-quantitative, quantitative (absolute or relative) |
||
|
Аналит Analyte |
Экзогенный, эндогенный Exogenous, endogenous |
Эндогенный Endogenous |
||
|
Матрица Matrix |
Аутентичная или суррогатная; параллелизм/линейность отклика Authentic or surrogate; parallelism/linearity of response |
Аутентичная или суррогатная; параллелизм (при наличии проб) Authentic or surrogate, parallelism (if samples are available) |
Аутентичная или суррогатная; обсуждение статуса заболевания, несколько доноров (не менее 6 источников для хроматографических методов, не менее 10 — для методов связывания лиганда), параллелизм Authentic or surrogate; discussion of the disease status, several donors (at least 6 sources for chromatographic methods, at least 10 — for ligand binding methods), parallelism |
|
|
Стандартные образцы Standards |
Как правило, хорошо охарактеризованы Generally well characterised |
Могут быть недостаточно полно охарактеризованы, могут меняться от поставщика к поставщику, от серии к серии May be poorly characterised, may vary from supplier to supplier, batch to batch |
Реагенты и стандарты должны быть хорошо охарактеризованы, установлен контроль изменений от партии к партии, соблюдены требования GMP, обеспечена стабильность реагентов Reagents and standards should be well characterised, batch-to-batch change control established, GMP requirements met, stability of reagents ensured |
|
|
Калибровочные образцы, образцы для контроля качества (КК) Calibration samples, QC samples |
Модельные смеси с добавками аналита Model mixtures with analyte additives |
Модельные смеси с добавками аналита, как образцы КК могут быть использованы реальные пробы от животных/человека и (или) лиофилизированные образцы 2–3 уровней концентраций, входящие в наборы реагентов Model mixtures with analyte additives, as QC samples, real samples from animals/humans, and/or lyophilised samples of 2–3 concentration levels from reagent kit can be used |
||
|
Селективность/специфичность Selectivity/specificity |
Специфичность к аналиту, селективность в присутствии неродственных примесей в биологическом образце (не менее 6 источников холостых образцов хроматографических методов, не менее 10 — для методов связывания лиганда) Analyte specificity, selectivity in the presence of unrelated impurities in the biological sample (minimum 6 blank sources for chromatographic methods, at least 10 — for ligand binding methods) |
Специфичность к аналиту; можно использовать эталонный стандарт из набора реагентов Analyte specificity; reference standard from reagent kit can be used |
Селективность в присутствии других изоформ, ко-медиаторов и эндогенных лигандов; рекомендуется проверить эталонный стандарт из набора реагентов Selectivity in the presence of other isoforms, co-mediators, and endogenous ligands; it is recommended to check the reference standard from the reagent kit |
|
|
Калибровочная модель Calibration model |
Чаще линейная (хроматография), выбор математической модели (методы связывания лиганда) More often linear (chromatography), mathematic model selection (ligand binding methods) |
Выбор математической модели (методы связывания лиганда), реже линейная (хроматография) Mathematic model selection (ligand binding methods), less commonly linear moder (chromatography) |
||
|
Калибровочный (аналитический) диапазон Calibration (analytical) range |
Не менее 6 концентрационных уровней, 3 повторности для хроматографических методов, 6 — для методов связывания лиганда Not less than 6 concentration levels, 3 replicates for chromatographic methods, 6 — for ligand binding methods |
Не менее 6 концентрационных уровней, 3 повторности Not less than 6 concentration levels, 3 replicates |
Не менее 6 концентрационных уровней, 6 повторностей Not less than 6 concentration levels, 6 replicates |
|
|
Чувствительность Sensitivity |
НПКО определяют на основании критериев приемлемости (минимальный калибровочный стандарт, 3 повторности — для хроматографических методов, 6 — для методов связывания лиганда), возможно определение ПО (чаще используют для методов связывания лиганда, схема из инструкции к коммерческому набору реагентов и/или расчетным путем по соотношению среднего значения аналитического сигнала и стандартного отклонения, SD) Для хроматографии аналитический сигнал для уровня НПКО не менее чем в 5 раз больше, чем сигнал холостого образца LLOQ is determined using acceptance criteria (minimum calibration standard, 3 replicates for chromatographic methods, 6 — for ligand binding methods); LOD can be determined as well (more often used for ligand binding methods, the scheme from the instructions for the commercial reagent kit and/or calculated by the ratio of the average value of the analytical signal and standard deviation, SD) For chromatography, the analytical signal for the LLOQ level is at least 5 times greater than the signal of the blank sample |
|||
|
Валидация правильности (точности)** и прецизионности*** Validation of accuracy** and precision*** |
4 уровня КК, 3 повторности, не менее чем в 2 разных дня для хроматографических методов; 5 уровней КК, 6 повторностей, не менее чем в 2 разных дня — для методов связывания лиганда 4 QC levels, 3 replicates, not less than 2 different days for chromatographic methods; 5 QC levels, 6 replicates, not less than 2 different days for ligand binding methods |
Нет рекомендаций или без уточнения количества уровней, 3 повторности No recommendations or without specifying the number of levels, 3 replicates |
По разным источникам: 4–5 уровней КК, 2 повторности; 2–6 уровней, 3–6 повторностей или 4–6 уровней, 6 повторностей According to various sources: 4–5 QC levels, 2 replicates, 2–6 levels, 3–6 replicates or 4–6 levels, 6 replicates |
По разным источникам: 4 уровня КК, 3 повторности для хроматографических методов; 5 уровней КК, 6 повторностей для методов связывания лиганда; 4–6 уровней, 6 повторностей By various sources: 4 QC levels, 3 replicates for chromatographic methods, 5 QC levels, 6 replicates for ligand binding methods, 4–6 levels, 6 replicates |
|
Стабильность**** Stability**** |
Исходный и рабочие растворы аналита и ВС; заморозка/разморозка, краткосрочная и длительная стабильность, пробы с добавками в матрицу Stock and working solutions of analyte and IS freezing/thawing, short-term and long-term stability, matrix spiked samples |
Краткосрочная стабильность, в т.ч. при комнатной температуре, в холодильнике (до 4 ч), 1 цикл разморозка/заморозка Short-term stability, can include at room temperature, in the refrigerator (up to 4 hours), 1 defrosting/freezing cycle |
По разным источникам: стабильность реагентов; заморозка/разморозка (3 цикла), краткосрочная (комнатная температура, холодильник — до 24 ч) и длительная стабильность (–20 ºС и (или) –80 ºС, 1–2 года, пробы с добавками в матрицу и (или) анализируемые образцы) According to various sources: stability of reagents; freezing/thawing (3 cycles), short-term (room temperature, refrigerator — up to 24 hours) and long-term stability (–20ºС and/or –80ºС, 1–2 years, samples with additives to the matrix and/or analysed samples) |
|
|
Параллелизм, минимально необходимое разведение, линейность разведения Parallelism, minimum required dilution, dilution linearity |
Необходимы, преимущественно для методов связывания лиганда (линейность разведения актуальна и для хроматографических методов, рекомендовано не менее 5 определений на каждое разбавление, правильность и прецизионность в пределах ±15%) Necessary, mainly for ligand binding methods (linearity of dilution is also relevant for chromatographic methods, at least 5 determinations per dilution, accuracy and precision within ± 15% are recommended) |
|||
|
Критерии приемлемости Acceptance criteria |
Критерии приемлемости установлены регуляторными документами***** Acceptance criteria are established by regulatory documents***** |
Критерии приемлемости не требуются, устанавливают по результатам оценки Acceptance criteria are not required, established based on the assessment results |
Критерии приемлемости устанавливают по результатам оценки и технологически обоснованных аналитических соображений (в т.ч. ДИ, 2SD и др.), могут быть приближены и/или аналогичны принятым для БЭ Acceptance criteria are established based on the results of the assessment and technologically sound analytical considerations (including the CI, 2SD, etc.), can be approximated and/or similar to those adopted for BE |
|
|
Документация Documents |
План/отчет о валидации Validation plan/report |
Описание анализа и результатов, инструкция к коммерческим наборам реагентов Description of analysis and results, instructions for commercial reagent kits |
План/отчет о валидации Validation plan/report |
|
|
Регуляторные требования Regulatory requirements |
Соответствие принципам GLP Compliance with GLP principles |
Нет специфических рекомендаций, но соблюдение принципов GLP гарантирует прослеживаемость этапов и результатов No specific recommendations, but adherence to GLP principles ensures traceability of milestones and outcomes |
Методы одобрены FDA, формирование результатов соответствует рекомендациям для КИ (если применимо) FDA-approved methods, results are consistent with CT recommendations (if applicable) |
|
Таблица составлена авторами / The table is prepared by the authors
Сокращения. ВС — внутренний стандарт, ДИ — доверительный интервал, ДКИ — доклинические исследования, КИ — клинические исследования, КК — контроль качества, НПКО — нижний предел количественного определения, ПО — предел обнаружения, ФД — фармакодинамика, FDA — Управление по контролю за качеством продуктов питания и лекарственных средств (Food and Drug Administration), GLP — Надлежащая лабораторная практика (Good laboratory practice), GMP — Надлежащая производственная практика (Good manufacturing practice), SD — стандартное отклонение (standard deviation)
Abbreviations. IS, internal standard; pre-CS, pre-clinical study; CI, confidence interval; CS, clinical study; FDA, Food and Drug Administration; GLP, Good laboratory practice; GMP, Good manufacturing practice; LLOQ, lower limit of quantification; LOD, limit of detection; PD, pharmacodynamics; QC, quality control; SD, standard deviation
* критерии проверки в исследовании (in-study validation) определяют по итогам валидации и формулируют по аналогии с критериями приемлемости при анализе испытуемых образцов (Решение Совета ЕЭК от 03.11.2016 № 85 «Правила проведения исследований биоэквивалентности лекарственных препаратов в рамках Евразийского экономического союза»; Guidance for industry: Bioanalytical method for validation. Rockville, 2018);
** для гетерогенных (высокомолекулярных) биомаркеров калибраторы обычно получают с рекомбинантным эталонным материалом в суррогатной матрице. Анализ позволяет оценить только относительную точность. Этот термин подходит почти для всех биомаркеров, где калибровочный материал (стандартный образец и матрица) отличается от эндогенного биомаркера;
*** более подробные рекомендации по дизайну (объему) экспериментов по оценке прецизионности при валидации анализа биомаркера приведены в таблице 7 документа Piccoli SP, Sauer JM. Points to consider document: scientific and regulatory considerations for the analytical validation of assays used in the qualification of biomarkers in biological matrices. Biomarker Assay Collaborative Evidentiary Considerations Writing Group, Critical Path Institute (C-Path); 2019;
**** для гетерогенных (высокомолекулярных) биомаркеров в случае использования меченых эталонных стандартов анализ не может дать представление о стабильности эндогенных биомаркеров, только о стабильности рекомбинантной молекулы;
***** Решение Совета ЕЭК от 03.11.2016 № 85 «Правила проведения исследований биоэквивалентности лекарственных препаратов в рамках Евразийского экономического союза»; Guidance for industry: Bioanalytical method for validation. Rockville, 2018; Guideline on bioanalytical method validation. EMEA/CHMP/EWP192217/2009. London, 2011; ICH M10 on bioanalytical method validation — Scientific guideline. EMA/CHMP/ICH/172948/2019. Amsterdam, 2022.
* in-study validation criteria are based on validation results and formulated in the same way as the acceptance criteria for test sample analysis.
** for heterogeneous (high molecular weight) biomarkers, calibrators are usually prepared with recombinant reference material in a surrogate matrix. The analysis evaluates only relative accuracy. The term is appropriate for almost all biomarkers where the calibration material (reference standard and matrix) differs from the endogenous biomarker.
*** refer to Table 7 in Piccoli SP, Sauer JM. Points to consider document: scientific and regulatory considerations for the analytical validation of assays used in the qualification of biomarkers in biological matrices. Biomarker Assay Collaborative Evidentiary Considerations Writing Group, Critical Path Institute (C-Path); 2019. for more detailed recommendations on the design (scope) of experiments to evaluate the precision of biomarker assay validation.
**** for heterogeneous (high molecular weight) biomarkers, when using labelled reference standards, the analysis cannot provide endogenous biomarkers stability, but only recombinant molecule stability.
***** ECE Council Resolution No. 85 of 03.11.2016 “On Procedure of Bioequivalence Studies in the EAEU”; Guidance for industry: Bioanalytical method for validation. Rockville, 2018; Guideline on bioanalytical method validation. EMEA/CHMP/ICH/172948/2019. Amsterdam, 2022.
Таблица 1 составлена по материалам16 [7][17][18] с дополнениями и изменениями, однако при ее подготовке предпочтение в отношении классификации/этапов валидации отдано ключевому документу17, в котором не выделяется этап предварительной валидации методики. В аспекте рассмотрения преаналитических вопросов и разработки методики этот этап был затронут в работе [17] и включал такие элементы, как характеристика источников реагентов и стандартных образцов, оценка нижнего предела количественного определения (НПКО) и предварительного аналитического диапазона, правильности и прецизионности методики (без конкретных рекомендаций по количеству концентрационных уровней и повторностей), тип калибровочной зависимости, специфичность реагентов (по информации от поставщика или из литературы), матричный эффект, условия сбора, обработки, хранения реагентов и проб и др. Данный этап следует рассматривать как подготовительный, поисковый, не заканчивающийся анализом экспериментальных проб с получением значений, от которых зависит принятие решений в рамках исследования препаратов. Позднее авторами18 также была отмечена значимость преаналитических факторов (тип биоматериала, интерференция, процедура отбора, лабораторная посуда и инструменты для отбора биоматериала, время и условия отбора, первичная обработка образцов, хранение и дальнейшая логистика, заморозка/разморозка19), которым необходимо уделять внимание по мере разработки и валидации методики, стандартизовать их, определять границы применимости (приемлемости) вариаций.
На ранних этапах исследований биомаркеров (скрининг, выбор биомаркера, оценка его полезности) может быть достаточно простого и минимально подтвержденного анализа (табл. 1, исследовательская валидация). Однако при клинической квалификации биомаркера (оценка терапевтической эффективности создаваемого ЛП, диагностика и др. как в рамках ДКИ, так и КИ) потребуется аналитически подтвержденный результат. Вместе с тем необходимый объем испытаний, по мнению разных источников, варьируется, а критерии выбора, к какому этапу/задаче следует отнести валидируемую методику в случае анализа биомаркера, не сформулированы или неоднозначны, что, безусловно, затрудняет формирование единого алгоритма аналитической валидации биомаркеров.
Анализируя объединенные рекомендации (табл. 1), можно отметить, что ключевые показатели, предусмотренные при аналитической валидации биоаналитической методики, схожи независимо от задачи, для решения которой она предназначена. Аналитическая валидация биомаркера в целом должна включать оценку семи параметров: точность (правильность), диапазон аналитических измерений (включая НПКО и верхний предел количественного определения (ВПКО)), параллелизм (минимально необходимое разведение и линейность разбавления, если применимо), прецизионность (внутри и между циклами, операторами, днями, лотами реагентов, если применимо), селективность, специфичность и стабильность (в рабочих условиях и краткосрочная, долгосрочная, при заморозке/разморозке).
В некоторых случаях может потребоваться информация о дополнительных аналитических параметрах, включая устойчивость, оценку межлекарственных взаимодействий и др.20. Авторы [22] подчеркивали, что в документе21 сделан акцент на важность оценки параллелизма и представлена концепция допустимой общей аналитической ошибки (total analytical error, TAE). Отметим, что понятие общей аналитической ошибки, состоящей из суммы ошибки при определении правильности (относительной систематической погрешности, δ) и прецизионности (CV), которая не должна превышать 30% (для ВПКО и НПКО 40%), присутствует в отношении методов связывания лиганда в уже действующих документах22.
Валидационные параметры, процедуры и критерии приемлемости для анализа биомаркеров близки, хотя и могут быть не идентичны изложенным в отношении получения данных по БЭ, ФК, ТК23. Именно этот документ отмечает, что «валидация метода для анализа биомаркеров должна решать те же вопросы, что и валидация метода для анализа лекарственных препаратов. ... Подход, используемый для анализа лекарственных препаратов, должен быть отправной точкой для проверки анализа биомаркеров, хотя некоторые характеристики могут не применяться или могут потребоваться различные соображения»24.
Необходимо также осветить позицию A. Safavi25, в которой представлены отличия/сходства валидации и квалификации биомаркеров, по-видимому, с точки зрения только аналитических аспектов этих процессов (не затрагивая клиническую валидацию/квалификацию биомаркера). По его мнению, оба процесса направлены на доказательство того, что тест подходит для достижения предполагаемой цели, но различаются в отношении глубины и надежности оцениваемых параметров и количества повторов, выполненных для каждого параметра. Объем квалификационных процедур, рекомендованный автором, сопоставим с исследовательской и (или) частичной валидациями (табл. 1). Также отметим, что понятие «квалификация аналитической методики» практически не встречается в научной литературе и регуляторных документах.
Особенности аналитической валидации биомаркера, обусловленные используемыми аналитическими методами. Некоторые аспекты, которые следует учитывать при валидации методики анализа биомаркеров, обусловлены особенностями метода, лежащего в ее основе, зависящего от природы измеряемого биомаркера (белок, липид и др.), наличия уже разработанных методик, наборов реагентов, особенностей реализации измерений (малый объем проб, лабораторные или полевые условия, квалификация персонала и др.), требований к чувствительности и селективности, а также доступности метода26. Как правило, для анализа биомаркера могут быть рассмотрены планшетные методики и различные методы обнаружения, включая флуоресценцию, хемилюминесценцию, электрохемилюминесценцию, хромогенное обнаружение, масс-спектрометрию и относительно новые акустические системы обнаружения27. Согласно данным источника [23], большинство методик анализов биомаркеров основаны на одном из трех методов:
- хроматографические методики, которые должны быть разработаны de novo;
- лиганд-связывающие методики, которые должны быть разработаны de novo;
- лиганд-связывающие методики с использованием коммерческих наборов реагентов.
Коммерческие наборы реагентов [25] могут быть разрешены для диагностики in vitro, для клинических лабораторных испытаний или исключительно для использования в исследовательских целях. Коммерческие наборы реагентов должны быть проверены на каждом анализируемом объекте (матрице) [22]. Необходимость валидации и параметры валидации клинических лабораторных наборов могут варьировать в каждом конкретном случае в зависимости от предполагаемого использования или характеристик биомаркеров. По-видимому, в этой ситуации корректно говорить о верификации методики, направленной на подтверждение того, что требования, заложенные при ее валидации, проведенной ранее (например, производителем набора реагентов), выполнены в условиях конкретной лаборатории (с использованием набора определенной серии на оборудовании, имеющемся в распоряжении лаборатории). Эти аспекты аналогичны рассмотренным в работе [26] применительно к деятельности клинико-диагностических лабораторий, которые проводят в том числе биомедицинские анализы на биомаркеры. Минимальный перечень испытаний при верификации клинико-лабораторных исследований должен включать оценку промежуточной прецизионности, правильности, линейности и диапазона измерений калибровочной зависимости, верификацию калибровки, а также подтверждение возможности использования биологических референтных интервалов, указанных в инструкции производителя (если применимо) [26].
Полную валидацию исследовательских наборов (предназначенных исключительно для исследований) проводят независимо от наличия валидационной информации, сопровождающей набор [22]. Принимать решение об использовании такого набора целесообразно после полного рассмотрения вопроса о том, соответствует ли он предполагаемому использованию или характеристикам соответствующего биомаркера (таким как диапазон калибровки или специфичность). Эталонный стандарт, входящий в состав такого набора, рекомендовано оценивать с использованием других коммерчески доступных продуктов, уделяя внимание отличиям от эндогенного вещества, являющегося целевым аналитом. Когда партия набора меняется, рекомендовано подтвердить, что различия в концентрации аналита в одном и том же образце между партиями являются приемлемыми. Поскольку исследовательские наборы могут стать недоступными (прекращение выпуска, нарушение экономических связей, поставок), следует рассмотреть альтернативные подходы к анализу (например, использование реагентов, доступных по отдельности, не в составе набора, если применимо).
Выбор уровня аналитической валидации биомаркера в зависимости от метода и решаемых задач. В практике ДКИ, проводимых in vivo с участием различных видов лабораторных животных и in vitro с применением буферных сред, клеточных линий, изолированных органов и др., могут быть использованы клинические и исследовательские наборы как специфичные для измеряемого маркера, вида животных и типа биологической матрицы, так и имеющие иное исходное предназначение. Расширение диапазона применения набора по сравнению с рекомендациями производителя в случае оценки БЭ, ФК, ТК требует проведения полной валидации биоаналитической методики, в иных случаях (в том числе для оценки фармакодинамики) — в зависимости от характера решаемой задачи: на этапе подбора биомаркера, по-видимому, можно ограничиться исследовательским уровнем валидации, при переходе к отработке модели с применением выбранного биомаркера целесообразно повысить уровень валидации биоаналитической методики до частичного, который близок по объему к полной валидации методики анализа биомаркера, необходимой при решении задач ДКИ/КИ, предполагающих диагностику патологий, оценку влияния терапии на ее течение и др. (табл. 1). Схожая схема может быть рекомендована и в ряде других ситуаций (рис. 2).
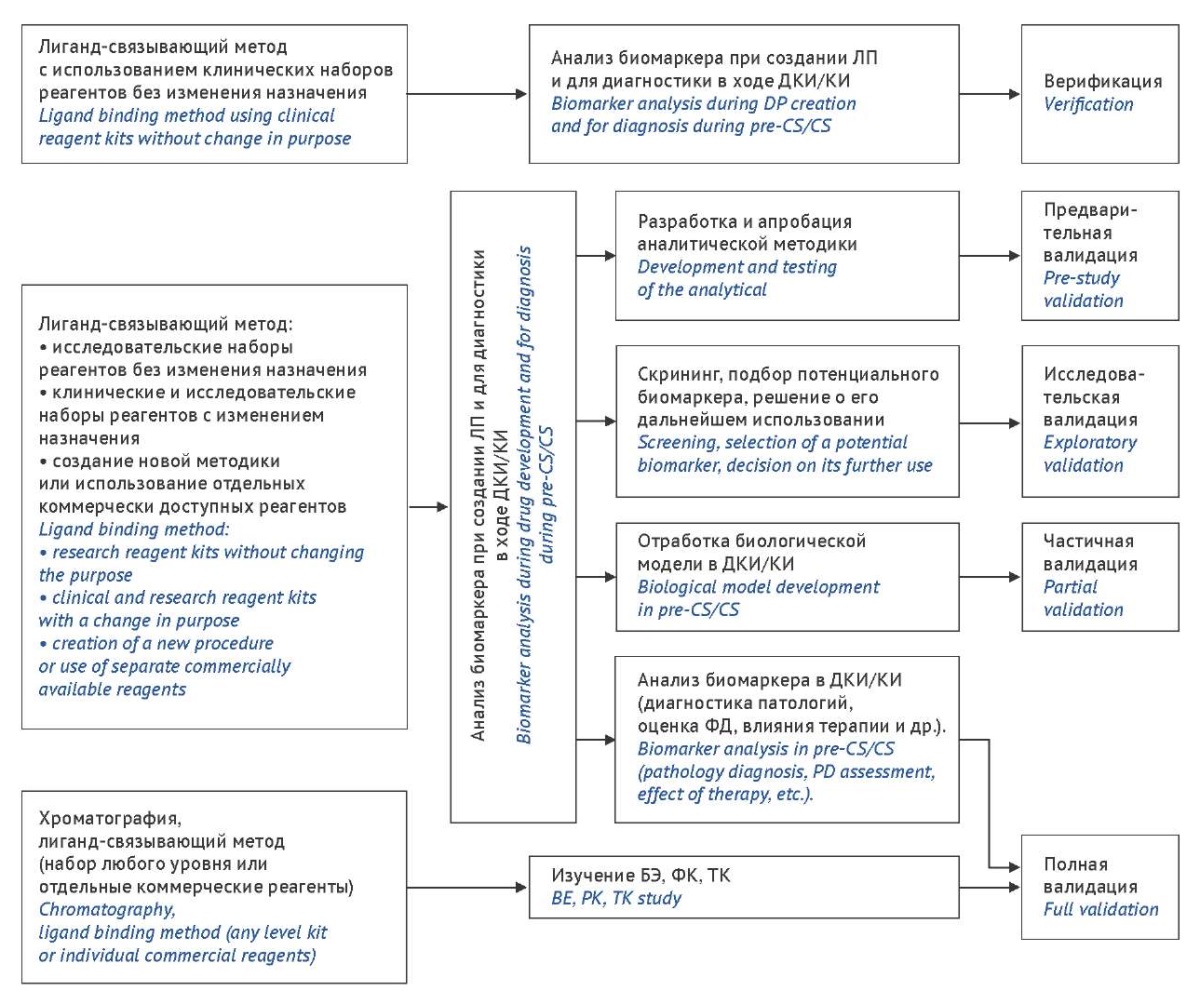
Рисунок подготовлен авторами / The figure is prepared by the authors
Рис. 2. Выбор уровня аналитической валидации биомаркера в зависимости от особенностей метода и решаемых задач; БЭ — биоэквивалентность, ДКИ — доклинические исследования, КИ — клинические исследования, ЛП — лекарственный препарат, ТК — токсикокинетика, ФД — фармакодинамика, ФК — фармакокинетика
Fig. 2. Choosing analytical validation level of a biomarker depending on the method characteristics and the objectives; BE, bioequivalence; pre-CS, pre-clinical study; CS, clinical study; D, medicinal product; TK, toxicokinetics; PD, pharmacodynamics; PK, pharmacokinetics
Таким образом, только вариант использования клинических наборов реагентов без изменения назначения позволяет минимизировать процедуры подтверждения пригодности методики, во всех остальных случаях потребуются сравнительно объемные валидационные испытания.
ЗАКЛЮЧЕНИЕ
Расширение использования биомаркеров в качестве инструментов разработки лекарственных препаратов обусловливает необходимость совершенствования методов их аналитического количественного определения. Очевидно, что использованию биомаркера должна предшествовать процедура подтверждения пригодности методики для применения согласно планируемым целям, близкая к общепринятой процедуре валидации биоаналитических методик. Сопоставлены ключевые элементы валидации биоаналитических методик анализа биомаркеров и рассмотрен выбор уровня их аналитической валидации в зависимости от особенностей метода и решаемых задач. Необходимо широкое научное обсуждение деталей валидации анализа биомаркеров, поскольку для этой сложной процедуры пока отсутствует единый алгоритм. Такое обсуждение будет способствовать более надежному использованию биомаркеров, повышению качества сопутствующих этому процессу исследований и конечному результату — введению в обращение новых эффективных и безопасных лекарственных препаратов.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: В.М. Косман — сбор, обработка и систематизация данных, написание текста рукописи; М.В. Карлина — идея публикации, обсуждение формы представления материала и иллюстраций; Н.М. Фаустова — обсуждение результатов и иллюстраций; В.Г. Макаров, М.Н. Макарова — критический пересмотр текста рукописи и иллюстративного материала.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Vera M. Kosman collected, processed and systematised data, and drafted the manuscript. Marina V. Karlina conceived the study, discussed material presentation and illustrations. Natalia M. Faustova discussed the results and illustrations. Valery G. Makarov and Marina N. Makarova critically revised the manuscript and illustrative material.
1. US FDA-NIH Biomarker Working Group. BEST (Biomarkers, EndpointS and other Tools) Resource.
2. Публикации eLIBRARY.RU за 2014–2024 гг., поиск проводили по ключевым словам «биомаркеры» (biomarkers), «аналитические/биоаналитические методы» (analytical/bioanalytical methods), «количественное определение» (assay, quantification), «валидация» (validation).
3. Piccoli SP, Sauer JM. Points to consider document: scientific and regulatory considerations for the analytical validation of assays used in the qualification of biomarkers in biological matrices. Biomarker Assay Collaborative Evidentiary Considerations Writing Group, Critical Path Institute (C-Path); 2019.
4. Решение Совета ЕЭК от 03.11.2016 № 85 «Правила проведения исследований биоэквивалентности лекарственных препаратов в рамках Евразийского экономического союза».
Guidance for industry: Bioanalytical method for validation. Rockville, 2018.
Guideline on bioanalytical method validation. EMEA/CHMP/EWP192217/2009. London, 2011.
ICH M10 on bioanalytical method validation. Scientific guideline. EMA/CHMP/ICH/172948/2019. Amsterdam, 2022.
5. Guidance for industry: Bioanalytical method for validation. Rockville, 2018.
6. Guideline on bioanalytical method validation. EMEA/CHMP/EWP192217/2009. London, 2011.
ICH M10 on bioanalytical method validation. Scientific guideline. EMA/CHMP/ICH/172948/2019. Amsterdam, 2022.
7. Piccoli SP, Sauer JM. Points to consider document: scientific and regulatory considerations for the analytical validation of assays used in the qualification of biomarkers in biological matrices. Biomarker Assay Collaborative Evidentiary Considerations Writing Group, Critical Path Institute (C-Path); 2019.
8. Safavi A. Exploratory biomarker testing: to qualify or validate the assay? 2018.
9. Piccoli SP, Sauer JM. Points to consider document: scientific and regulatory considerations for the analytical validation of assays used in the qualification of biomarkers in biological matrices. Biomarker Assay Collaborative Evidentiary Considerations Writing Group, Critical Path Institute (C-Path); 2019.
Guidance for industry. Biomarkers and surrogate endpoints in clinical studies to support effectiveness of new animal drugs. Rockville; 2021.
10. Piccoli SP, Sauer JM. Points to consider document: scientific and regulatory considerations for the analytical validation of assays used in the qualification of biomarkers in biological matrices. Biomarker Assay Collaborative Evidentiary Considerations Writing Group, Critical Path Institute (C-Path); 2019.
11. Guidance for industry. Biomarkers and surrogate endpoints in clinical studies to support effectiveness of new animal drugs. Rockville; 2021.
12. Piccoli SP, Sauer JM. Points to consider document: scientific and regulatory considerations for the analytical validation of assays used in the qualification of biomarkers in biological matrices. Biomarker Assay Collaborative Evidentiary Considerations Writing Group, Critical Path Institute (C-Path); 2019.
13. Там же.
14. Там же.
15. Там же.
16. Решение Совета ЕЭК от 03.11.2016 № 85 «Правила проведения исследований биоэквивалентности лекарственных препаратов в рамках Евразийского экономического союза».
Piccoli SP, Sauer JM. Points to consider document: scientific and regulatory considerations for the analytical validation of assays used in the qualification of biomarkers in biological matrices. Biomarker Assay Collaborative Evidentiary Considerations Writing Group, Critical Path Institute (C-Path); 2019.
Guidance for industry. Biomarkers and surrogate endpoints in clinical studies to support effectiveness of new animal drugs. Rockville; 2021.
Уварова НЕ. Твердые лекарственные формы для приема внутрь с немедленным высвобождением системного действия. Опыт экспертизы документов досье, касающихся исследований биоэквивалентности. Современные подходы к экспертизе и регистрации лекарственных средств (РегЛек-2022). Материалы научно-практической конференции. М.: ФГБУ «НЦЭСМП» Минздрава России, 2022.
17. Piccoli SP, Sauer JM. Points to consider document: scientific and regulatory considerations for the analytical validation of assays used in the qualification of biomarkers in biological matrices. Biomarker Assay Collaborative Evidentiary Considerations Writing Group, Critical Path Institute (C-Path); 2019.
18. Piccoli SP, Sauer JM. Points to consider document: scientific and regulatory considerations for the analytical validation of assays used in the qualification of biomarkers in biological matrices. Biomarker Assay Collaborative Evidentiary Considerations Writing Group, Critical Path Institute (C-Path); 2019.
19. Там же.
20. Там же.
21. Там же.
22. Решение Совета ЕЭК от 3.11.2016 № 85 «Правила проведения исследований биоэквивалентности лекарственных препаратов в рамках Евразийского экономического союза».
Guidance for industry: Bioanalytical method for validation. Rockville; 2018.
ICH M10 on bioanalytical method validation — Scientific guideline. EMA/CHMP/ICH/172948/2019. Amsterdam, 2022.
23. Guidance for industry: Bioanalytical method for validation. Rockville; 2018.
24. Piccoli SP, Sauer JM. Points to consider document: scientific and regulatory considerations for the analytical validation of assays used in the qualification of biomarkers in biological matrices. Biomarker Assay Collaborative Evidentiary Considerations Writing Group, Critical Path Institute (C-Path); 2019.
Guidance for industry: Bioanalytical method for validation. Rockville; 2018.
25. Safavi A. Exploratory biomarker testing: to qualify or validate the assay? 2018.
26. Piccoli SP, Sauer JM. Points to consider document: scientific and regulatory considerations for the analytical validation of assays used in the qualification of biomarkers in biological matrices. Biomarker Assay Collaborative Evidentiary Considerations Writing Group, Critical Path Institute (C-Path); 2019.
27. Там же.
Список литературы
1. Мирошниченко ИИ, Птицина СН. Биомаркеры в современной медико-биологической практике. Биомедицинская химия. 2009;5(4):425–40. EDN: KWROID
2. Кочетов АГ, Лянг ОВ, Жирова ИА, Ивойлов ОО. Лабораторные исследования в медицине. Терапевтический архив. 2020;92(4):4–8. https://doi.org/10.26442/00403660.2020.04.000501
3. Biomarkers Definitions Working Group Biomarkers and surrogate endpoints: preferred definitions and conceptual framework. Clin Pharmacol Ther. 2001;69(3):89–95. https://doi.org/10.1067/mcp.2001.113989
4. Осипова ТВ, Бухман ВМ. Биомаркеры трансляционной медицины. Российский биотерапевтический журнал. 2018;17(1):6–13. https://doi.org/10.17650/1726-9784-2018-17-1-6-13
5. Ansari D, Aronsson L, Sasor A, et al. The role of quantitative mass-spectrometry in the discovery of pancreatic cancer biomarkers for translational science. J Transl Med. 2014;12:87. https://doi.org/10.1186/1479-5876-12-87
6. Насырова РФ, Сивакова НА, Липатова ЛВ и др. Биологические маркеры эффективности и безопасности противоэпилептических препаратов: фармакогенетика и фармакокинетика. Сибирское медицинское обозрение. 2017;(1):17–25. https://doi.org/10.20333/2500136-2017-1-17-25
7. Дон ЕС, Тарасов АВ, Эпштейн ОИ, Тарасов СА. Биомаркеры в медицине: поиск, выбор, изучение и валидация. Клиническая лабораторная диагностика. 2017;62(1):52–9. EDN: YHEYHX
8. Bakker E, Hendrikse NM, Ehmann F, et al. Biomarker qualification at the European Medicines Agency: a review of biomarker qualification procedures from 2008 to 2020. Clin Pharmacol Ther. 2022;112(1):69–80. https://doi.org/10.1002/cpt.2554
9. Метельская ВА, Жаткина МВ, Гаврилова НЕ и др. Валидация комбинированных маркеров наличия и выраженности коронарного атеросклероза. Профилактическая медицина. 2020;23(6–2):65–71. https://doi.org/10.17116/profmed20202306265
10. Metelskaya VA, Gavrilova NE, Zhatkina MV, et al. A novel integrated biomarker for evaluation of risk and severity of coronary atherosclerosis, and its validation. J Pers Med. 2022;12(2):206. https://doi.org/10.3390/jpm12020206
11. Конради АО. Биомаркеры, их типы и основы применения в персонализированной медицине. Российский журнал персонализированной медицины. 2022;2(3):6–16. https://doi.org/10.18705/2782-3806-2022-2-3-6-16
12. Тихонова ГА, Котов ОВ, Маркин АА. Биомаркеры как инструмент медико-биологического мониторинга и контроля (Обзор литературы. Часть 1). Технологии живых систем. 2023;20(2):18–26. https://doi.org/10.18127/j20700997-202302-02
13. Тихонова ГА, Котов ОВ, Маркин АА. Биомаркеры как инструменты медико-биологического мониторинга и контроля (Обзор литературы. Часть 2). Технологии живых систем. 2023;20(4):5–18. EDN: WTPEOX
14. Калишьян МС. Биологические маркеры в современной ветеринарной практике. Ветеринарная патология. 2022;(4):40–8. https://doi.org/10.23947/1682-5616-2022-4-40-48
15. Вавилова ВА, Фаустова НМ, Пелешок АА и др. Белок S100b как биологический маркер повреждения нервной ткани у лабораторных животных в доклинических исследованиях. Трансляционная медицина. 2024;11(4):342–50. https://doi.org/10.18705/2311-4495-2024-11-4-342-350
16. Мирошников МВ, Султанова КТ, Макарова МН и др. Комплексная оценка функционального состояния мочевыделительной системы в доклинических исследованиях. Часть 2. Маркеры нефротоксичности (обзор). Регуляторные исследования и экспертиза лекарственных средств. 2024;14(4):448–62. https://doi.org/10.30895/1991-2919-2024-631
17. Lee JW, Devanarayan V, Barrett YC, et al. Fit-for-purpose method development and validation for successful biomarker measurement. Pharm Res. 2006;23(2):312–28. https://doi.org/10.1007/s11095-005-9045-3
18. Chau CH, Rixe O, McLeod H, Figg WD. Validation of analytic methods for biomarkers used in drug development. Clin Cancer Res. 2008;14(19):5967–76. https://doi.org/10.1158/1078-0432.CCR-07-4535
19. Hunter DJ, Losina E, Guermazi A, et al. A pathway and approach to biomarker validation and qualification for osteoarthritis clinical trials. Curr Drug Targets. 2010;11(5):536–45. https://doi.org/10.2174/138945010791011947
20. Lowes S, Ackermann BL. AAPS and US FDA Crystal City VI workshop on bioanalytical method validation for biomarkers. Bioanalysis. 2016;8(3):163–7. https://doi.org/10.4155/bio.15.251
21. Selby PJ, Banks RE, Gregory W, et al. Methods for the evaluation of biomarkers in patients with kidney and liver diseases: Multicentre research programme including ELUCIDATE RCT. Southampton (UK): NIHR Journals Library; 2018. https://doi.org/10.3310/pgfar06030
22. Ohtsu Y, Tanaka S, Igarashi H, et al. Analytical method validation for biomarkers as a drug development tool: points to consider. Bioanalysis. 2021;13(18):1379–89. https://doi.org/10.4155/bio-2021-0173
23. Ohtsu Y, Matsumaru T, Katashima M, et al. Biomarker assay validation for clinical trials: a questionnaire survey to pharmaceutical companies in Japan. Bioanalysis. 2019;11(2):55–60. https://doi.org/10.4155/bio-2018-0257
24. Mathews J, Amaravadi L, Eck S, et al. Best practices for the development and fit-for-purpose validation of biomarker methods: a conference report. AAPS Open. 2022;8:2. https://doi.org/10.1186/s41120-021-00050-1
25. Khan MU, Bowsher RR, Cameron M, et al. Recommendations for adaptation and validation of commercial kits for biomarker quantification in drug development. Bioanalysis. 2015;7(2):229–42. https://doi.org/10.4155/bio.14.274
26. Проценко ВН, Ивков АГ. Валидация и верификация количественных методик клинических лабораторных исследований. Лабораторная диагностика. Восточная Европа. 2019;8(2):171–9. EDN: AIPHJT
Об авторах
В. М. КосманРоссия
Косман Вера Михайловна, канд. фарм. наук
Заводская ул., д. 3, к. 245, г.п. Кузьмоловский, Всеволожский р-н, Ленинградская обл., 188663
М. В. Карлина
Россия
Карлина Марина Валерьевна, канд. биол. наук
Заводская ул., д. 3, к. 245, г.п. Кузьмоловский, Всеволожский р-н, Ленинградская обл., 188663
Н. М. Фаустова
Россия
Фаустова Наталья Михайловна, канд. хим. наук
Заводская ул., д. 3, к. 245, г.п. Кузьмоловский, Всеволожский р-н, Ленинградская обл., 188663
М. Н. Макарова
Россия
Макарова Марина Николаевна, д-р мед. наук
Заводская ул., д. 3, к. 245, г.п. Кузьмоловский, Всеволожский р-н, Ленинградская обл., 188663
В. Г. Макаров
Россия
Макаров Валерий Геннадьевич, д-р мед. наук
Заводская ул., д. 3, к. 245, г.п. Кузьмоловский, Всеволожский р-н, Ленинградская обл., 188663
Дополнительные файлы
Рецензия
Для цитирования:
Косман В.М., Карлина М.В., Фаустова Н.М., Макарова М.Н., Макаров В.Г. Вопросы валидации биоаналитических методик количественного определения биомаркеров: обзор нормативных документов. Регуляторные исследования и экспертиза лекарственных средств. 2025;15(5):550-564. https://doi.org/10.30895/1991-2919-2025-766
For citation:
Kosman V.M., Karlina M.V., Faustova N.M., Makarova M.N., Makarov V.G. Validating Bioanalytical Methods for Biomarker Quantitation: A Regulatory Document Review. Regulatory Research and Medicine Evaluation. 2025;15(5):550-564. https://doi.org/10.30895/1991-2919-2025-766
JATS XML