Перейти к:
Изучение экскреции 5-[5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида на крысах
https://doi.org/10.30895/1991-2919-2025-697
Резюме
ВВЕДЕНИЕ. Новый селективный ингибитор карбоангидразы II типа 5-[5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамид (TFISA) способен снижать внутриглазное давление при инстилляции в глаза. Данное соединение находится на стадии доклинического исследования. Процесс экскреции TFISA и его метаболитов ранее не изучен.
ЦЕЛЬ. Определение параметров экскреции 5-[5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида и его основных метаболитов у крыс.
МАТЕРИАЛЫ И МЕТОДЫ. Работа выполнена на 6 крысах линии Wistar (3 самца и 3 самки). Введение осуществляли путем инстилляции 1% глазной суспензии TFISA в каждый глаз из расчета 3,7 мг/кг. Пробы фекалий и мочи отбирали до введения препарата и многократно до 360 ч после введения. Отбор экскретов проводили с помощью метаболических клеток. Измерение концентрации TFISA, N-ацетил-5-[5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида (М2), N-гидрокси-5-[5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида (M1) и продукта его деградации 5-[5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфоновой кислоты (M3) в экскретах проводили методом высокоэффективной жидкостной хроматографии с тандемным масс-спектрометрическим детектированием.
РЕЗУЛЬТАТЫ. Биоаналитические методики определения TFISA и его метаболитов в экскретах крыс прошли полную валидацию. Аналитический диапазон определения TFISA, М2 и М3 в моче составил 10–10000 нг/мл, M1 — 1–1000 нг/мл. Аналитический диапазон определения концентрации TFISA в фекалиях составил 10–4000 нг/г, М2 и М3 — 5–2000 нг/г, М1 — 1–1000 нг/г. Установлено, что с мочой выводится 45,7±2,0% TFISA в неизменном виде, 38,7±2,7% в виде М1 и продукта его разложения М3, и 4,0±0,6% в виде М2 от общего количества элиминированных соединений. С калом выводится 8,2±1,0% TFISA в неизменном виде, 3,3±0,2% в виде продукта разложения N-гидроксиметаболита М3. Спустя 336 ч после введения TFISA дальнейшей элиминации не наблюдали.
ВЫВОД. С помощью разработанных и валидированных биоаналитических методик изучена экскреция TFISA и его метаболитов после аппликации глазной суспензии крысам в одной дозе. TFISA выводится преимущественно ренальным путем в неизменном виде, а также в виде N-гидроксиметаболита, который в процессе отбора образцов практически полностью разлагается до производного сульфокислоты. N-ацетилметаболит является минорным и выводится только с мочой.
Ключевые слова
Для цитирования:
Яичков И.И., Хохлов А.Л., Корсаков М.К., Вольхин Н.Н., Петухов С.С., Зайкова В.Е., Лазарянц О.Э. Изучение экскреции 5-[5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида на крысах. Регуляторные исследования и экспертиза лекарственных средств. 2025;15(5):508-520. https://doi.org/10.30895/1991-2919-2025-697
For citation:
Yaichkov I.I., Khokhlov A.L., Korsakov M.K., Volkhin N.N., Petukhov S.S., Zaykova V.E., Lazariants O.E. Excretion Study of 5-[5-(Trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonamide in Rats. Regulatory Research and Medicine Evaluation. 2025;15(5):508-520. (In Russ.) https://doi.org/10.30895/1991-2919-2025-697
ВВЕДЕНИЕ
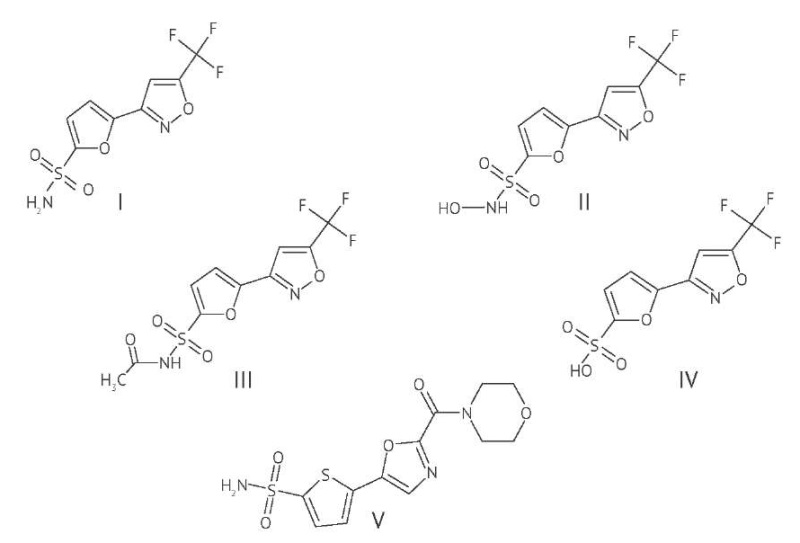
Селективные ингибиторы карбоангидразы II типа (ИКАII) широко используются для лечения открытоугольной глаукомы. Данные препараты уменьшают образование внутриглазной жидкости, снижая тем самым внутриглазное давление [1]. 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамид (TFISA) (I) является новым представителем ИКАII местного действия [2]. В настоящий момент субстанция TFISA и его глазная суспензия проходят доклиническое изучение эффективности, безопасности и фармакокинетики. Данное соединение, а также его основные метаболиты N-гидрокси-5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамид (M1) (II) и N-ацетил-5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамид (M2) (III) способны накапливаться в эритроцитах, что приводит к их длительному выведению (период полувыведения более 2 сут) [3–5]. Об этом свидетельствуют высокие по сравнению с плазмой концентрации этих аналитов в цельной крови.
Процесс экскреции TFISA и его метаболитов ранее не изучался. Для данного исследования необходима более длительная продолжительность эксперимента, чем при изучении системной экспозиции и относительной биодоступности, так как в крайней точке (216 ч после введения препарата) концентрации TFISA и М1 в крови были выше предела количественного определения методики [4]. Продление эксперимента до 2 недель предположительно позволит наблюдать полную элиминацию TFISA из организма крыс.
Биоаналитические методики, используемые для количественного определения лекарственных веществ и их метаболитов в экскретах, должны быть валидированы в том же объеме, что и методики определения веществ в плазме или цельной крови1. Такой подход применен при фармакокинетических исследованиях агаротриозы [6], иринотекана [7], DL0410 [8], а также при терапевтическом лекарственном мониторинге трамадола и прегабалина [9]. Калибровочные образцы и образцы контроля качества фекалий, как и тканей, в рамках валидации, как правило, готовят путем добавления рабочих растворов стандартного образца определяемого соединения к гомогенату холостого образца (интактного биоматериала) [10–12]. Данный способ является наиболее удобным при исследованиях распределения и экскреции. Модельные смеси мочи, как и других видов биологических жидкостей (цельной крови, плазмы и др.), получают путем смешивания раствора стандартного образца определяемого соединения с холостой пробой (интактным биоматериалом) [9–10].
Метаболит М1 в биологических жидкостях нестабилен и быстро разрушается с образованием 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфоновой кислоты (М3) (IV) [3–5]. Так, в пробах мочи без добавления стабилизатора в течение 1 ч разлагается более 50% от начального количества М1, а через 8 ч данное соединение полностью превращается в М3. Несмотря на то что в крови и плазме М3 не обнаружен [3], целесообразно его определение в экскретах (в дополнение к TFISA, М1 и М2, которые являлись целевыми аналитами при оценке плазмы и цельной крови), поскольку можно предполагать деградацию М1 во время нахождения мочи в мочевыводящих путях и кала в кишечнике крыс, а также в процессе отбора биоматериала. Поскольку экскреты обычно отбирают не в конкретные временные точки, а в интервалы продолжительностью примерно 2–24 ч [7][8], предотвратить такое разложение затруднительно. Пробы мочи крыс при этом необходимо стабилизировать с целью получения воспроизводимых и корректных результатов измерения концентрации М1 и М3 в рамках валидации и анализа испытуемых образцов2.
Цель работы — определение параметров экскреции 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида и его основных метаболитов у крыс.
МАТЕРИАЛЫ И МЕТОДЫ
Объекты исследования. Действующее вещество 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамид, лабораторная серия его глазной суспензии (1%) и образцы метаболитов произведены в ЦТФТ им. М.В. Дорогова ЯГПУ им. К.Д. Ушинского [4]. Соединения, применяемые в качестве стандартных образцов, были проанализированы и охарактеризованы с помощью методов спектроскопии ядерного магнитного резонанса, спектроскопии в инфракрасной области спектра, масс-спектрометрии, высокоэффективной жидкостной и газовой хроматографии. Массовая доля TFISA в используемой серии субстанции составила 99,1%, в соответствующих образцах метаболитов массовая доля составила: 98,2% для М1, 98,5% для М2, массовая доля М3 составила 98,7%, 98,3% для 5-[ 2-(морфолин-4-карбонил)-1,3-оксазол-5-ил]-тиофен-2-сульфонамида (THSA; внутренний стандарт, (V)). Основные растворы и рабочие растворы анализируемых веществ и внутреннего стандарта THSA готовили в диметилсульфоксиде (х.ч., АО «Ленреактив») (режим хранения — не выше 4 °С).
Определение концентрации TFISA и его метаболитов осуществляли с помощью высокоэффективного жидкостного хроматографа Agilent 1260 Infinity (Agilent Technologies), совмещенного с тандемным масс-спектрометрическим детектором AB Sciex QTRAP5500 (AB Sciex) (программное обеспечение «Analyst 1.6.2» — управление ВЭЖХ-МС/МС системой; «MultiQuant 3.0.5» — интегрирование хроматограмм).
Для хроматографического разделения применяли колонку Zorbax Eclipse Plus C18 (150×3,0 мм, 3,5 мкм) с предколонкой Zorbax Eclipse Plus C18 (12,5×2,1 мм, 5,0 мкм). Элюирование проводили в градиентном режиме при скорости потока 550 мкл/мин и температуре термостата 40 °С. Динамика изменения соотношения компонентов подвижной фазы: 0,1% водного раствора муравьиной кислоты (≥99%, Acros Organics) (А) и метанола (LiChrosolv hypergrade for LC-MS, Merck KGaA) (В) представлена в таблице 1.
Таблица 1. Параметры градиентного элюирования
Table 1. Gradient elution conditions
|
Время, мин Time, min |
Подвижная фаза А, 10 мМ водный р-р формиата аммония, % Mobile phase A, 10mM ammonium formate in water, % |
Подвижная фаза В, метанол, % Mobile phase B, methanol, % |
|
0,0 |
65 |
35 |
|
0,5 |
65 |
35 |
|
2,0 |
35 |
65 |
|
6,0 |
35 |
65 |
|
6,1 |
10 |
90 |
|
8,0 |
10 |
90 |
|
8,1 |
65 |
35 |
|
10,0 |
65 |
35 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Масс-спектрометрическое детектирование проводили в режиме ионизации электрораспылением, полярность отрицательная, напряжение — 4500 В; температура источника ионов — 700 °С. Использовали режим мониторинга множественных реакций (MRM) (табл. 2). Для расчетов концентрации М1 применяли MRM-переход THSA 342→110 m/z, для других аналитов — MRM-переход THSA 342→78 m/z.
Таблица 2. Параметры масс-спектрометрического детектирования в режиме мониторинга множественных реакций
Table 2. Parameters of mass spectrometric detection in the multiple reaction monitoring mode
|
MRM-переходы, m/z MRM transitions, m/z |
|||||||||
|
TFISA |
M1 |
M2 |
M3 |
THSA |
|||||
|
количественный quantitative |
контрольный сontrol |
количественный quantitative |
контрольный сontrol |
количественный quantitative |
контрольный сontrol |
количественный quantitative |
контрольный сontrol |
ВС для TFISA IS for TFISA |
ВС для M1, M2 IS for M1 and M2 |
|
281→136 |
281→66 |
297→136 |
297→66 |
323→136 |
323→66 |
282→136 |
282→66 |
342→78 |
342→110 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. MRM — мониторинг множественных реакций, TFISA — 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамид; M1 — N-гидрокси-5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамид; М2 — N-ацетил-5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамид; М3 — 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфоновая кислота; THSA — 5-[ 2-(морфолин-4-карбонил)-1,3-оксазол-5-ил]-тиофен-2-сульфонамид; ВС — внутренний стандарт.
Note. MRM, multiple reaction monitoring; TFISA, 5-[ 5-(trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonamide; M1, N-hydroxy-5-[ 5-(trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonamide; M2, N-acetyl-5-[ 5-(trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonamide; M3, 5-[ 5-(trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonic acid; THSA, 5-[ 2-(morpholine-4-carbonyl)-1,3-oxazole-5-yl]-thiophene-2-sulfonamide; IS, internal standard.
Исследуемые образцы. Образцы мочи крыс стабилизировали 5% раствором аскорбиновой кислоты из расчета 20 мкл раствора стабилизатора на 100 мкл мочи. Дальнейшую пробоподготовку осуществляли путем разведения раствором внутреннего стандарта: к 25 мкл образца добавляли 200 мкл раствора THSA 0,5 мкг/мл в метаноле, затем смесь перемешивали и центрифугировали (Heraeus Multifuge X3R, Thermo Fisher Scientific) 5 мин при скорости 10000 об./мин.
Фекалии взвешивали (с точностью до 0,1 мг), к ним добавляли метанол в соотношении 1:3 (масса, г : объем, мл) и проводили их гомогенизацию с использованием шарикового гомогенизатора Homogenizer Bioprep-6 (Allsheng). Затем гомогенат центрифугировали 5 мин при 3000 об./мин и к 50 мкл надосадочной жидкости добавляли 300 мкл метанольного раствора THSA. Смесь перемешивали на шейкере и центрифугировали 5 мин при 10000 об./мин.
Приготовление калибровочных и образцов контроля качества. Приготовление калибровочных (K1–K8) образцов, образцов контроля качества (нижнего предела количественного определения (НПКО), нижнего, среднего и верхнего уровней концентрации), образцов для теста разведения (Dil) выполняли путем добавления к биологическим объектам комбинированных рабочих растворов TFISA, М1, М2, М3 в диметилсульфоксиде, концентрация которых в 20 раз превосходила концентрацию аналитов в соответствующем образце мочи или кала (табл. 3). Для этого смешивали 190 мкл мочи или гомогената фекалий и 10 мкл рабочего раствора. В пробирку к пробам мочи предварительно вносили 40 мкл 5% раствора аскорбиновой кислоты. Холостые образцы экскретов для приготовления модельных смесей отбирали у 6 крыс линии Wistar (питомник ООО «СМК Стезар», г. Владимир) массой 230–270 г с помощью метаболических клеток.
Таблица 3. Концентрации 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида и его метаболитов в модельных образцах мочи и фекалий крыс
Table 3. Concentrations of 5-[ 5-(trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonamide and its metabolites in spiked samples of rat urine and faeces
|
Модельные образцы Spiked samples |
Концентрация аналитов Concentration |
||||
|
Моча, нг/мл Urine, ng/mL |
Фекалии, нг/г Faeces, ng/g |
||||
|
TFISA, M2, M3 |
M1 |
TFISA |
M1 |
M2 и М3 |
|
|
K1 (НПКО) (LLOQ) |
10 |
1 |
10 |
1 |
5 |
|
K2 |
50 |
5 |
50 |
5 |
25 |
|
K3 |
250 |
25 |
250 |
25 |
125 |
|
K4 |
1000 |
100 |
500 |
50 |
250 |
|
K5 |
2500 |
250 |
1000 |
100 |
500 |
|
K6 |
5000 |
500 |
2000 |
200 |
1000 |
|
K7 |
7500 |
750 |
3000 |
300 |
1500 |
|
K8 |
10000 |
1000 |
4000 |
400 |
2000 |
|
Нижний уровень концентрации LQC |
30 |
3 |
30 |
1 |
15 |
|
Средний уровень концентрации MQC |
3750 |
375 |
1500 |
150 |
750 |
|
Верхний уровень концентрации HQC |
8750 |
875 |
3500 |
350 |
1750 |
|
Dil |
15000 |
1500 |
7000 |
700 |
3500 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. TFISA — 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамид; M1 — N-гидрокси-5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамид; М2 — N-ацетил-5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамид; НПКО — нижний предел количественного определения; Dil — образцы для теста разведения.
Note. TFISA, 5-[ 5-(trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonamide; M1, N-hydroxy-5-[ 5-(trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonamide; M2, N-acetyl-5-[ 5-(trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonamide; LLOQ, lower limit of quantification; LQC, low concentration quality control sample; MQC, middle concentration quality control sample; HQC, high concentration quality control sample; Dil, samples for the dilution integrity test.
Валидацию биоаналитических методик проводили в полном объеме согласно требованиям Правил проведения исследований биоэквивалентности лекарственных препаратов3 к хроматографическим методикам анализа. Дополнительно изучали воспроизводимость при повторном введении аналитической серии согласно руководству ICH M104.
Лабораторные животные. Для фармакокинетической части исследования использованы крысы линии Wistar (питомник ООО «СМК Стезар», г. Владимир). Эксперимент проведен на 6 особях (3 самца и 3 самки) массой 250±6 г (М±SME) и возрастом 15 недель. Инстилляцию 1% глазной суспензии TFISA осуществляли в каждый глаз в одинаковом объеме. Доза составляла 3,7 мг/кг, как и в исследованиях фармакокинетики в крови и плазме [4][5]. За 4 ч до введения TFISA и 2 ч после введения TFISA доступ к комбикорму (АО «Гатчинский ККЗ») и воде был ограничен. В дальнейшем режим питания и питья был свободным. Цикл освещения: 12 ч — день, 12 ч — ночь. Для отбора проб экскретов и содержания животных применяли метаболические клетки.
Сбор образцов мочи и кала. Образцы собирали в следующие промежутки времени:
- моча (ч): до введения препарата (–4–0), после введения препарата: 0–4, 4–8, 8–12, 12–24, 24–48, 48–72, 72–96, 96–120, 120–144, 144–168, 168–192, 192–216, 216–240, 240–264, 264–288, 288–312, 312–336, 336–360;
- кал (ч): до введения препарата (–4–0), после введения 0–24, 24–48, 48–72, 72–96, 96–120, 120–144, 144–168, 168–192, 192–216, 216–240, 240–264, 264–288, 288–312, 312–336, 336–360.
После окончания периода отбора объем мочи измеряли с помощью мерного цилиндра на 25 мл (класс точности 1) и аликвоту 200 мкл стабилизировали смешением с 40 мкл 5% раствора аскорбиновой кислоты. Фекалии взвешивали и гомогенизировали в метаноле в объемном соотношении 1:3. Затем пробы стабилизированной мочи и гомогенатов кала замораживали и хранили при температуре не выше –70 °С до проведения анализов (морозильная камера MELING DV-HL218).
Исследование одобрено этическим комитетом ЯГПУ им. К.Д. Ушинского (протокол № 2 от 10.10.2023).
Для расчета показателей описательной статистики, таких как среднее арифметическое (M), относительное стандартное отклонение (RSD), стандартная ошибка среднего (SEM), применен программный пакет «Statsoft Statistica 10.0.1011». Для построения графиков использовали Microsoft Excel 2016.
Расчеты. Количество аналитов в пробе мочи или кала рассчитывали в нг (1):
m(A)=C(A)×V, (1)
где m(A) — количество аналита, экскретированного с мочой или калом в данный период отбора; C(A) — концентрация аналита в пробе мочи (нг/мл) или кала (нг/г); V — объем мочи (мл) или масса кала (г), экскретированные в данный период отбора.
Количество М3 во время всех фармакокинетических вычислений пересчитывали на массу М1 по формуле (2). Массы неизмененного М1 и М1 в виде М3 затем суммировали.
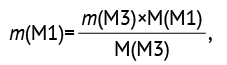 (2)
(2)
где m(M1) — количество М1 в пересчете с массы М3; m(М3) — количество М3, определенное в экскрете; M(M1) — молекулярная масса М1; М(М3) — молекулярная масса М3.
При построении графика кумулятивной экскреции (Me) и расчете доли экскретировавшихся аналитов в общем количестве элиминированных соединений массу М1 и М2 аналогичным образом пересчитывали на массу TFISA на основании отношения молекулярных масс.
Долю TFISA, M1 и М2 в общем количестве элиминированных соединений рассчитывали по формуле (3):
 (3)
(3)
где %(А) — доля TFISA, M1 или М2, экскретированных с мочой, или с калом, или суммарно с мочой и калом; m(АTFISA) — количество TFISA, М1 или М2 в пересчете на TFISA, экскретированных с мочой, или с калом, или суммарно с мочой и калом за 360 ч после инстилляции суспензии; m(TFISA)ur/fe — суммарное количество TFISA, экскретированного с мочой (ur) или калом (fe) за 360 ч после инстилляции суспензии; m(Mn)ur(fe) — суммарное количество M1 или M2, экскретированных с мочой (ur) или калом (fe), в пересчете на массу TFISA, за 360 ч после инстилляции суспензии.
Вычисление скорости экскреции проведено без пересчета массы М1 и М2 на массу TFISA по формуле (4):
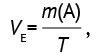 (4)
(4)
где VE — скорость экскреции, нг/ч; m(A) — количество аналита, обнаруженного в экскрете за период отбора, нг; T — продолжительность периода отбора, ч.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Методика хроматографического разделения, использованная при фармакокинетическом исследовании в крови и плазме [4][5], была изменена с целью достижения достаточного разрешения между хроматографическими пиками TFISA и продукта разложения N-гидроксиметаболита М3 (рис. 1). Так, эмпирическим путем вместо 0,1% водного раствора муравьиной кислоты был выбран 10 мМ водный раствор формиата аммония. Для предотвращения окисления остатков М1 в пробах мочи был применен 5% водный раствор аскорбиновой кислоты. Дополнительной стабилизации метанольных гомогенатов фекалий не требовалось.
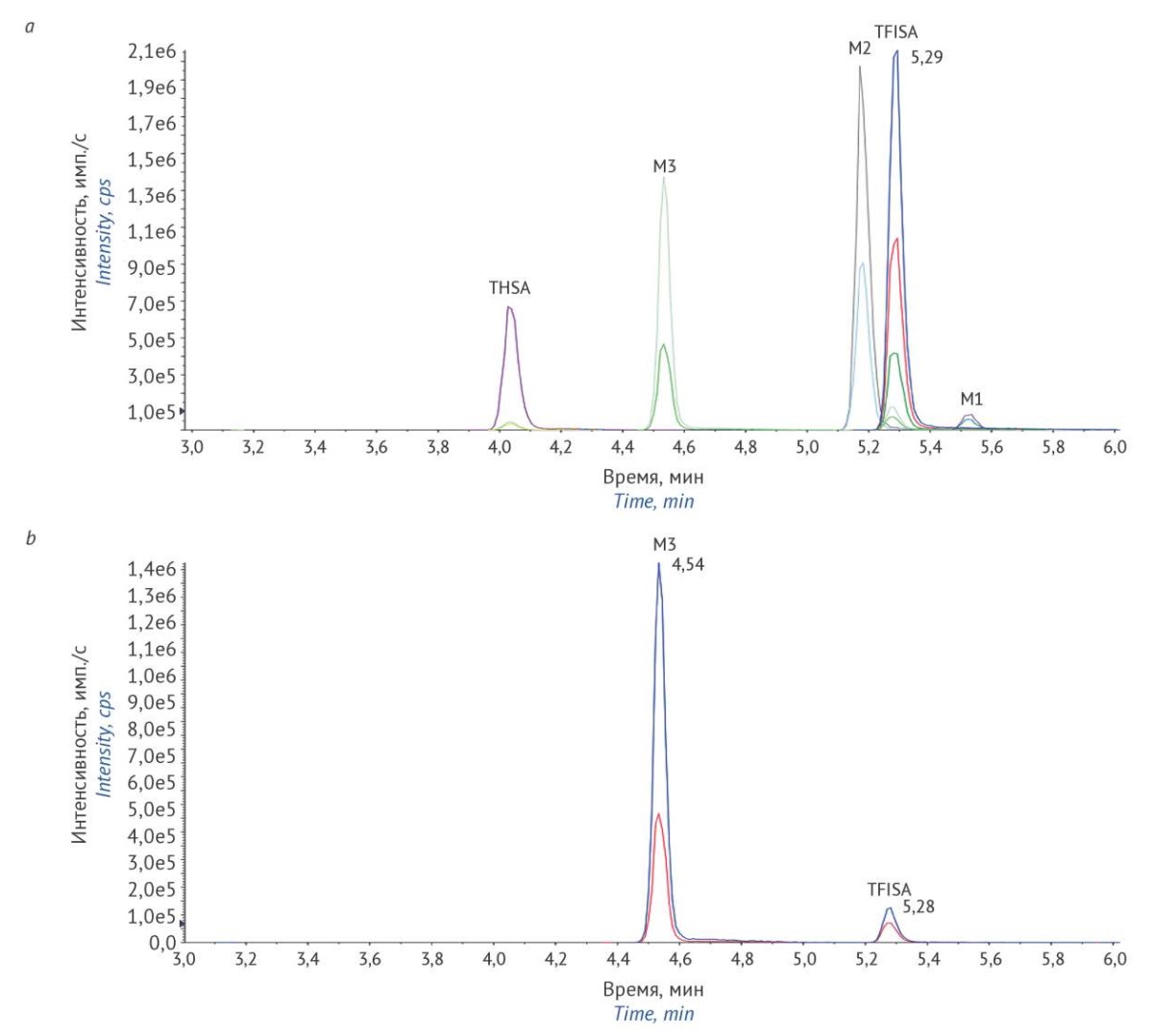
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 1. Пример хроматограммы калибровочного образца К6 мочи крысы: a — хроматограммы всех MRM-переходов; b — хроматограммы MRM-переходов М3 (282→136 m/z; 282→66 m/z), на которых присутствует хроматографический пик TFISA. TFISA — 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамид; M1 — N-гидрокси-5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамид; М2 — N-ацетил-5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамид; М3 — 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфоновая кислота; THSA — 5-[ 2-(морфолин-4-карбонил)-1,3-оксазол-5-ил]-тиофен-2-сульфонамид
Fig. 1. A chromatogram of the K6 calibration sample of rat urine (chromatograms of all the MRM transitions, a, and those of M3 (282→136 m/z; 282→66 m/z), b, that have a chromatographic peak TFISA. TFISA, 5-[ 5-(trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonamide; M1, N-hydroxy-5-[ 5-(trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonamide; M2, N-acetyl-5-[ 5-(trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonamide; M3, 5-[ 5-(trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonic acid; THSA, 5-[ 2-(morpholine-4-carbonyl)-1,3-oxazole-5-yl]-thiophene-2-sulfonamide
При оценке селективности методики установлено, что площадь пиков TFISA в холостых образцах мочи крыс составила 10,55% от площади пика TFISA в образцах НПКО, а в образцах фекалий крыс — 12,24%. Интерференция в области времени удерживания других аналитов и THSA отсутствовала. При испытаниях внутрисерийной и межсерийной правильности и прецизионности, эффекта разведения образцов величина относительной погрешности (δ) рассчитанных концентраций изучаемых соединений не превышала ±15% (20% — для образцов с концентрацией на уровне НПКО), а величина их относительного стандартного отклонения (RSD, %) не превышала 15% (20% — для образцов с концентрацией на уровне НПКО) для обеих методик (табл. 4, 5. «Результаты валидации методики определения 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида и его метаболитов в моче и кале крыс». Опубликованы на сайте журнала5). Это соответствует установленным требованиям6. Значение RSD нормализованного фактора матрицы (NMF) TFISA и его метаболитов после испытаний образцов мочи и кала, полученных от 6 разных животных, составило менее 15%.
Добавление 5% раствора аскорбиновой кислоты к образцам мочи и гомогенизация фекалий с метанолом позволили предотвратить разложение М1 после отбора проб, а также обеспечить сохранность действующего вещества и других метаболитов. Так, результаты испытания краткосрочной, долгосрочной стабильности, стабильности после заморозки/разморозки, стабильности приготовленных образцов в автодозаторе соответствовали критериям приемлемости для обоих изучаемых биологических матриц (табл. 6. «Результаты изучения стабильности 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида и его метаболитов в моче и гомогенатах фекалий крыс». Опубликована на сайте журнала7)8. Отклонение рассчитанной концентрации аналитов от номинальной не превышало 15%. Правильность и прецизионность при повторном введении аналитических серий с образцами мочи и фекалий спустя 48 ч сохранялись на требуемом уровне (табл. 4, 59)10.
После успешной валидации биоаналитических методик они были применены для анализа образцов экскретов крыс. Установлено, что 53,91±2,32% изучаемого соединения (М±SEM, от общего количества элиминированных соединений) выводится в неизменном виде: из них 45,74±2,06% — с мочой и 8,17±0,97% — с калом (табл. 7). Кумулятивная экскреция TFISA достигается спустя 336 ч после инстилляции суспензии (рис. 2). Наивысшую скорость ренальной экскреции действующего вещества наблюдали в первые 12 ч после введения (рис. 3a). С калом TFISA наиболее интенсивно выводится в период 48–72 ч (рис. 3b).
Таблица 7. Результаты изучения экскреции 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида и его метаболитов c мочой и калом
Table 7. Excretion study results for 5-[ 5-(trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonamide and its metabolites in urine and faeces
|
Способ экскреции Route of excretion |
Аналит, в виде которого выводится лекарственное средство Excreted analytes |
Доля от суммы экскретированных соединений Percentage of the total compounds excreted |
|
|
М±SME, % |
RSD, % |
||
|
Моча Urine |
TFISA |
45,74±2,06 |
11,02 |
|
M1* |
38,73±2,72 |
17,20 |
|
|
M2 |
4,02±0,58 |
35,22 |
|
|
Cуммарно (total) |
88,49±1,15 |
3,17 |
|
|
Кал Faeces |
TFISA |
8,17±0,97 |
29,06 |
|
M1* |
3,34±0,24 |
17,72 |
|
|
Cуммарно (total) |
11,51±1,15 |
24,37 |
|
|
Моча и кал (суммарно) Urine and faeces (total) |
TFISA |
53,91±2,32 |
10,56 |
|
M1* |
42,07±2,70 |
15,71 |
|
|
M2 |
4,02±0,58 |
35,22 |
|
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. TFISA — 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамид; M1 — N-гидрокси-5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамид; М2 — N-ацетил-5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамид.
* Расчет содержания М1 в экскретах проводился косвенно, по концентрации М3. M — среднее арифметическое, RSD — относительное стандартное отклонение, SEM — стандартная ошибка среднего.
Note. TFISA, 5-[ 5-(trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonamide; M1, N-hydroxy-5-[ 5-(trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonamide; M2, N-acetyl-5-[ 5-(trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonamide.
* The calculation of the M1 content in rat excreta was carried out indirectly, using the concentration of M3. M, arithmetic mean; RSD, relative standard deviation; SEM, standard error of the mean.
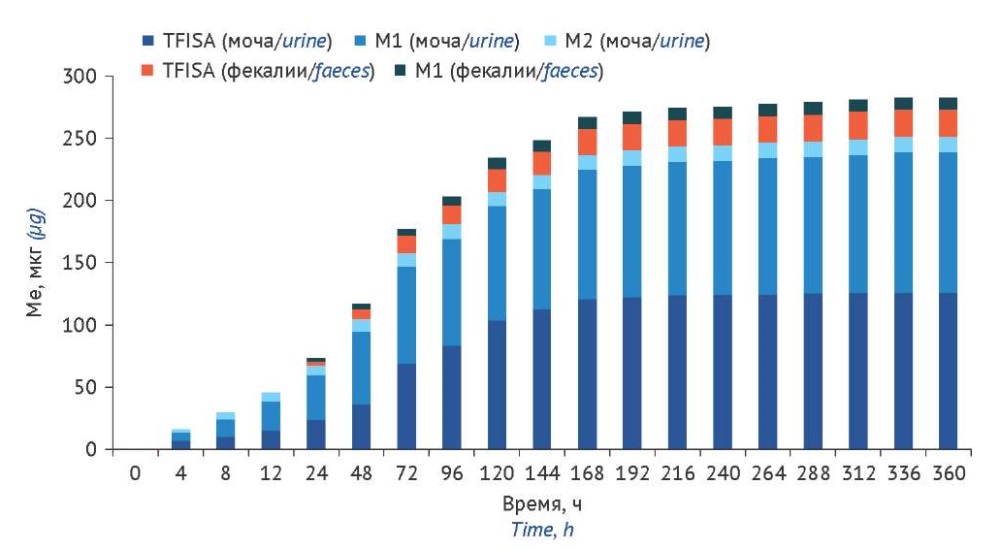
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 2. Кумулятивная экскреция 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида в неизменном виде и в виде метаболитов
TFISA — 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамид; M1 — N-гидрокси-5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамид; М2 — N-ацетил-5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамид; М3 — 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфоновая кислота; Ме — кумулятивная экскреция
Fig. 2. Cumulative excretion of unchanged 5-[ 5-(trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonamide and its metabolites
TFISA, 5-[ 5-(trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonamide; M1, N-hydroxy-5-[ 5-(trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonamide; M2, N-acetyl-5-[ 5-(trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonamide; M3, 5-[ 5-(trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonic acid; Ме , cumulative excretion
В форме М1 выводится 42,07±2,70% действующего вещества (М±SEM, от общего количества элиминированных соединений). При этом бóльшая часть N-гидроксиметаболита определялась косвенно по продукту разложения до М3. Так, М1 обнаружен только в образцах мочи, отобранных на начальном этапе после введения (в промежутки 0–4, 4–8, 8–12, 12–24 ч). За более длительные временные отрезки данное соединение полностью переходило в форму М3. Дифференциацию М3, образовавшегося в экскретах в процессе отбора проб, от М3, образовавшегося при формировании каловых масс и нахождения в мочевыводящих путях, не проводили, так как данный процесс не является физиологическим и не характеризует особенности метаболизма TFISA. М3 в организме крыс не обнаружен [13]. Содержание М1 и М3 в моче и кале ситуационно зависит от времени нахождения в кишечнике или мочевом пузыре. Так, при большем объеме питья или количестве съеденной пищи выведение М1 пройдет быстрее, и он деградирует в меньшем количестве, и наоборот. Поэтому даже при немедленной после испражнения стабилизации соотношение М1/М3 в изучаемых объектах будет нестабильным и не воспроизведется при повторном эксперименте даже у того же животного.
Установлено, что N-гидроксиметаболит выводится в основном через почки — 38,73±2,72% (М±SEM) от общего количества TFISA. Ме данного метаболита наступает спустя 336 ч эксперимента, как и для исходного изучаемого соединения. Наибольшая скорость ренальной экскреции M1 достигается в промежутке 8–12 ч после инстилляции глазной суспензии (рис. 3a), что соответствует периоду снижения его концентрации на фармакокинетических профилях в плазме и крови [3][4]. Динамика выведения М1 с калом (рис. 3b) была наиболее интенсивной в период 24–120 ч после начала эксперимента.
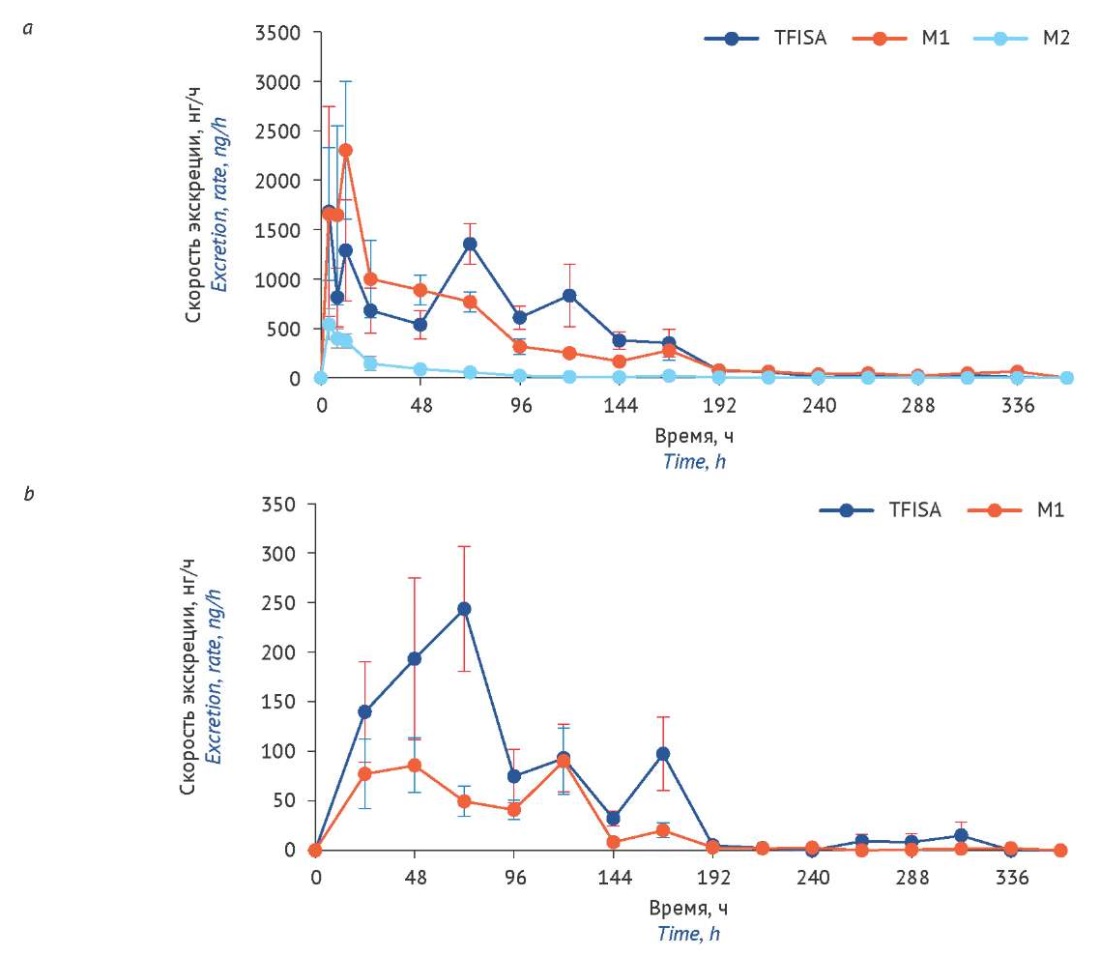
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 3. Скорость экскреции 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида и его метаболитов с мочой (a) и калом (b). TFISA — 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамид; M1 — N-гидрокси-5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамид; М2 — N-ацетил-5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамид; М3 — 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфоновая кислота
Fig. 3. Excretion rates of 5-[ 5-(trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonamide and its metabolites in urine (a) and faeces (b). TFISA, 5-[ 5-(trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonamide; M1, N-hydroxy-5-[ 5-(trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonamide; M2, N-acetyl-5-[ 5-(trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonamide; M3, 5-[ 5-(trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonic acid
N-ацетилметаболит элиминируется только с мочой. Его доля составляет 4,02±0,58% от суммарного количества экскретированных соединений. Максимальную Ve наблюдали в первые 4 ч после введения препарата (рис. 3). Бóльшая часть М2 выводится за первые 96 ч эксперимента, а спустя 312 ч концентрация М2 в пробах мочи ниже предела количественного определения методики.
Суммарная величина кумулятивной экскреции изучаемого соединения и его метаболитов с мочой и калом составила 278,0±40,8 мкг, что является 29,77±3,62% от введенной дозы (М±SEM) (рис. 2). Это может свидетельствовать о наличии либо других путей экскреции, либо низкой абсолютной биодоступности TFISA при инстилляции в глаза. Наличие дополнительного метаболита или метаболитов, на долю которых приходилось бы около 70% от Ме препарата, маловероятно ввиду высокой чувствительности скринингового ВЭЖХ-МС/МС-метода, примененного при исследовании биотрансформации [13]. Кроме того, в данной работе были учтены все возможные модификации молекулы TFISA. Поэтому целесообразно проведение дополнительного эксперимента с внутрибрюшинным введением суспензии крысам, при котором вся доза препарата гарантированно попадает в организм. В этом случае низкая доля выведенных соединений по отношению к введенной дозе будет свидетельствовать о наличии дополнительных путей экскреции, и потребуется более трудоемкое исследование по их изучению на крупных животных.
Таким образом, TFISA в неизменном виде и в виде метаболитов элиминируется преимущественно ренальным путем. Около 11% действующего вещества и М1 экскретируются с калом. Выведение изучаемого соединения из организма крыс с мочой и фекалиями заканчивается через 336 ч после инстилляции глазной суспензии. Такое длительное время элиминации связано с депонированием TFISA и его основных метаболитов в эритроцитах [3–5].
ЗАКЛЮЧЕНИЕ
Биоаналитические методики определения 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида, его метаболитов, а также продукта разложения его N-гидроксипроизводного в моче и кале крыс прошли полную валидацию и были успешно использованы для фармакокинетического исследования. Установлено, что более 53% изучаемого соединения выводится в неизменном виде, более 42% в виде N-гидрокси-5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида и более 4% в виде М2. Следует отметить, что содержание N-гидроксиметаболита в пробах определялось в основном косвенно по продукту его разложения — 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфоновой кислоте. Экскреция 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида, а также N-гидрокси-5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида и N-ацетил-5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида происходит преимущественно ренальным путем: на его долю приходится около 89% от суммарного количества элиминированных веществ. В кале обнаружены только действующее вещество и N-гидроксиметаболит. Выведение изучаемого соединения и его метаболитов с мочой и фекалиями из организма крыс заканчивается через 336 ч после введения препарата.
Дополнительная информация. На сайте журнала «Регуляторные исследования и экспертиза лекарственных средств» размещены таблицы 4–6.
https://doi.org/10.30895/1991-2919-2025-697-table4
https://doi.org/10.30895/1991-2919-2025-697-table5
https://doi.org/10.30895/1991-2919-2025-697-table6
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: И.И. Яичков — разработка и валидация биоаналитических методик, анализ образцов биоматериала животных, статистическая обработка данных, написание текста рукописи; А.Л. Хохлов — критическое обсуждение и утверждение окончательного варианта статьи для публикации; М.К. Корсаков — критическое обсуждение и редактирование текста рукописи; Н.Н. Вольхин, С.С. Петухов, В.Е. Зайкова, O.Э. Лазарянц — проведение работ с лабораторными животными.
Соответствие принципам этики. Проведение исследования было одобрено этическим комитетом ЯГПУ им. К.Д. Ушинского (протокол № 2 от 10.10.2023).
Additional information. Tables 4–6 are published on the website of Regulatory Research and Medicine Evaluation.
https://doi.org/10.30895/1991-2919-2025-697-table4
https://doi.org/10.30895/1991-2919-2025-697-table5
https://doi.org/10.30895/1991-2919-2025-697-table6
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Ilya I. Yaichkov developed and validated the bioanalytical procedures, analysed animal samples, conducted statistical processing of the data, and drafted the manuscript. Alexander L. Khokhlov participated in the critical discussion of the manuscript and approved the final version for publication. Mikhail K. Korsakov participated in the critical discussion and editing of the manuscript. Nikita N. Volkhin, Sergey S. Petukhov, Valeria E. Zaykova, and Olga E. Lazariants carried out the experiments in laboratory animals.
Ethics approval. This study was approved by the Ethics Committee at the Yaroslavl State Pedagogical University named after K.D. Ushinsky (Approval No. 2 of 10 October 2023).
1. Guideline M10 on bioanalytical method validation and study sample analysis. ICH; 2022.
Решение Совета ЕЭК от 03.11.2016 № 85 «Об утверждении Правил проведения исследований биоэквивалентности лекарственных препаратов в рамках Евразийского экономического союза».
2. Там же.
3. Решение Совета ЕЭК от 03.11.2016 № 85 «Об утверждении Правил проведения исследований биоэквивалентности лекарственных препаратов в рамках Евразийского экономического союза».
4. Guideline M10 on bioanalytical method validation and study sample analysis. ICH; 2022.
5. https://doi.org/10.30895/1991-2919-2025-697-table4
https://doi.org/10.30895/1991-2919-2025-697-table5
6. Решение Совета ЕЭК от 03.11.2016 № 85 «Об утверждении Правил проведения исследований биоэквивалентности лекарственных препаратов в рамках Евразийского экономического союза».
Guideline M10 on bioanalytical method validation and study sample analysis. ICH; 2022.
7. https://doi.org/10.30895/1991-2919-2025-697-table6
8. Решение Совета ЕЭК от 03.11.2016 № 85 «Об утверждении Правил проведения исследований биоэквивалентности лекарственных препаратов в рамках Евразийского экономического союза».
Guideline M10 on bioanalytical method validation and study sample analysis. ICH; 2022.
9. https://doi.org/10.30895/1991-2919-2025-697-table4
https://doi.org/10.30895/1991-2919-2025-697-table5
10. Решение Совета ЕЭК от 03.11.2016 № 85 «Об утверждении Правил проведения исследований биоэквивалентности лекарственных препаратов в рамках Евразийского экономического союза».
Guideline M10 on bioanalytical method validation and study sample analysis. ICH; 2022.
Список литературы
1. Popovic MM, Schlenker MB, Thiruchelvam D, Redelmeier DA. Serious adverse events of oral and topical carbonic anhydrase inhibitors. JAMA Ophthalmol. 2022;140(3):235–42. https://doi.org/10.1001/jamaophthalmol.2021.5977
2. Хохлов АЛ, Шетнев АА, Корсаков МК, Федоров ВН, Тюшина АН, Вольхин НН, Вдовиченко ВП. Фармакологические свойства производных сульфонамидов — новых ингибиторов карбоангидразы. Бюллетень экспериментальной биологии и медицины. 2023;175(2):166–70. https://doi.org/10.47056/0365-9615-2023-175-2-166-170
3. Khokhlov AL, Yaichkov II, Korsakov MK, Shetnev AA, Volkhin NN, Petukhov SS. Development of quantification methods of a new selective carbonic anhydrase II inhibitor in plasma and blood and study of the pharmacokinetics of its ophthalmic suspension in rats. Res Results Pharmacol. 2023;9(4):53–64. https://doi.org/10.18413/rrpharmacology.9.10056
4. Яичков ИИ, Хохлов АЛ, Корсаков МК, Шетнев АА, Вольхин НН, Петухов СС. Изучение фармакокинетики нового производного изоксазола на крысах с применением ВЭЖХ-МС/МС для анализа проб крови. Регуляторные исследования и экспертиза лекарственных средств. 2024;14(3):304–16. https://doi.org/10.30895/1991-2919-2024-14-3-304-316
5. Яичков ИИ, Корсаков МК, Шетнев АА, Вольхин НН, Петухов СС. Разработка и валидация методики количественного определения 5-[5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида и его метаболитов в плазме лабораторных животных. Разработка и регистрация лекарственных средств. 2024;13(3):219–30. https://doi.org/10.33380/2305-2066-2024-13-3-1771
6. Yue J, Cheng W, Wei S, Liu G, Zhou M, Lv Z, Yu M. Development and validation of UHPLC-MS/MS method for quantifying of agarotriose: an application for pharmacokinetic, tissue distribution, and excretion studies in rats. J Ocean Univ China. 2023;22:1683–91. https://doi.org/10.1007/s11802-023-5534-4
7. Basu S, Zeng M, Yin T, Gao S, Hu M. Development and validation of an UPLC-MS/MS method for the quantification of irinotecan, SN 38 and SN-38 glucuronide in plasma, urine, feces, liver and kidney: Application to a pharmacokinetic study of irinotecan in rats. J Chromatogr B Analyt Technol Biomed Life Sci. 2016;1015–1016:34–41. https://doi.org/10.1016/j.jchromb.2016.02.012
8. Pang X, Zhao Y, Song J, Kang D, Wu S, Wang L, et al. Pharmacokinetics, excretion and metabolites analysis of DL0410, a dual-acting cholinesterase inhibitor and histamine-3 receptor antagonist. Mol Med Rep. 2019;20(2):1103–12. https://doi.org/10.3892/mmr.2019.10306
9. Almalki AH, Ali NA, Elroby FA, El Ghobashy MR, Emam AA, Naguib IA. ESI–LC–MS/MS for therapeutic drug monitoring of binary mixture of pregabalin and tramadol: Human plasma and urine applications. Separations. 2021;8(2):21. https://doi.org/10.3390/separations8020021
10. Lu T, Wang X, Zhang Q, Liu K, Xu T, Wang Q, et al. Validated LC-MS/MS method for quantitation of solasodine in rat urine and feces: Blocking nonspecific adsorption. Acta Chromatogr. 2023;35(4):319–25. https://doi.org/10.1556/1326.2022.01079
11. Hu H, Xiao H, Bao H, Li M, Xue C, Li YT, et al. Tissue distribution comparison of six active ingredients from an Eucommiae cortex extract between normal and spontaneously hypertensive rats. Evid Based Complement Alternat Med. 2020;2020:2049059. https://doi.org/10.1155/2020/2049059
12. Kusuma Kumari G, Krishnamurthy PT, Ravi Kiran Ammu VVV, Vishwanath K, Narenderan ST, Babu B, Krishnaveni N. Development and validation of a sensitive LC-MS/MS method for pioglitazone: Application towards pharmacokinetic and tissue distribution study in rats. RSC Adv. 2021;11(19):11437–43. https://doi.org/10.1039/d1ra01126j
13. Khokhlov AL, Yaichkov II, Shetnev AА, Ivanovsky SA, Korsakov MK, Alexeev MA, et al. Identification and synthesis of metabolites of the new antiglaucoma drug. Res Results Pharmacol. 2024;10(1):53–66. https://doi.org/10.18413/rrpharmacology.10.431
Об авторах
И. И. ЯичковРоссия
Яичков Илья Игоревич, канд. фарм. наук
ул. Республиканская, д. 108/1, Ярославль, 150000;
ул. Революционная, д. 5, Ярославль, 150000
А. Л. Хохлов
Россия
Хохлов Александр Леонидович, д-р мед. наук, профессор, академик РАН
ул. Революционная, д. 5, Ярославль, 150000
М. К. Корсаков
Россия
Корсаков Михаил Константинович, д-р хим. наук, доцент
ул. Республиканская, д. 108/1, Ярославль, 150000
Н. Н. Вольхин
Россия
Вольхин Никита Николаевич
ул. Республиканская, д. 108/1, Ярославль, 150000;
ул. Революционная, д. 5, Ярославль, 150000
С. С. Петухов
Россия
Петухов Сергей Станиславович
ул. Республиканская, д. 108/1, Ярославль, 150000;
ул. Революционная, д. 5, Ярославль, 150000
В. Е. Зайкова
Россия
Зайкова Валерия Евгеньевна
ул. Республиканская, д. 108/1, Ярославль, 150000;
ул. Революционная, д. 5, Ярославль, 150000
О. Э. Лазарянц
Россия
Лазарянц Ольга Эммануиловна
ул. Республиканская, д. 108/1, Ярославль, 150000;
ул. Революционная, д. 5, Ярославль, 150000
Дополнительные файлы

|
1. Таблица 4. Результаты валидации методики определения 5-[5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида и его метаболитов в моче крыс | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(141KB)
|
Метаданные ▾ | |

|
2. Таблица 5. Результаты валидации методики определения 5-[5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида и его метаболитов в кале крыс | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(141KB)
|
Метаданные ▾ | |

|
3. Таблица 6. Результаты изучения стабильности 5-[5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида и его метаболитов в моче и гомогенатах фекалий крыс | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(121KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Яичков И.И., Хохлов А.Л., Корсаков М.К., Вольхин Н.Н., Петухов С.С., Зайкова В.Е., Лазарянц О.Э. Изучение экскреции 5-[5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида на крысах. Регуляторные исследования и экспертиза лекарственных средств. 2025;15(5):508-520. https://doi.org/10.30895/1991-2919-2025-697
For citation:
Yaichkov I.I., Khokhlov A.L., Korsakov M.K., Volkhin N.N., Petukhov S.S., Zaykova V.E., Lazariants O.E. Excretion Study of 5-[5-(Trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonamide in Rats. Regulatory Research and Medicine Evaluation. 2025;15(5):508-520. (In Russ.) https://doi.org/10.30895/1991-2919-2025-697



































