Перейти к:
Разработка и валидация методики количественного определения суммы флавоноидов в траве гречихи красностебельной (Fagopyrum rubricaulis) методом спектрофотометрии
https://doi.org/10.30895/1991-2919-2025-689
Резюме
ВВЕДЕНИЕ. Гречиха красностебельная (Fagopyrum rubricaulis, сем. Polygonаceae) отличается высоким содержанием флавоноидов, в первую очередь рутина, а в надземной части — кверцетина, изокверцетина, ориентина, витексина, изоориентина, изовитексина и других соединений. Известные фармакологические эффекты гречихи красностебельной — антиоксидантное, кардиопротекторное, гипогликемическое, антибактериальное действие — зависят от комплекса содержания флавоноидов в растительном сырье, поэтому траву гречихи целесообразно стандартизировать по сумме флавоноидов. Однако в отечественной литературе недостаточно информации по стандартизации сырья гречихи красностебельной, в связи с чем разработка методики количественного определения флавоноидов является актуальной.
ЦЕЛЬ. Разработка и валидация методики количественного определения флавоноидов в траве гречихи красностебельной с использованием спектрофотометрии.
МАТЕРИАЛЫ И МЕТОДЫ. Объектом исследования являлась трава гречихи красностебельной. В процессе извлечения были использованы различные экстрагенты (вода очищенная и спирт этиловый 40, 70 и 95%). Подтверждение наличия флавоноидов в сырье проводили методом тонкослойной хроматографии. Для количественного определения флавоноидов в траве гречихи красностебельной был использован спектрофотометрический метод, основанный на измерении оптической плотности раствора в присутствии алюминия хлорида. Валидацию методики проводили согласно Государственной фармакопее Российской Федерации XV издания.
РЕЗУЛЬТАТЫ. Согласно результатам идентификации методом тонкослойной хроматографии водно-спиртовые извлечения травы гречихи содержали флавоноиды. Способ количественного определения суммы флавоноидов в сырье гречихи красностебельной методом дифференциальной спектрофотометрии предполагает предварительное получение водно-спиртового извлечения путем однократной экстракции точной навески 1 г травы гречихи, измельченной до размера частиц не более 2 мм, спиртом этиловым 40% в соотношении сырье : экстрагент 1:25 при продолжительности экстракции 30 мин. Максимумы поглощения комплексов экстрактов с растворами алюминия хлорида наблюдались при длине волны 410 нм, что соответствовало максимуму поглощения раствора стандартного образца рутина. Количественное определение суммы флавоноидов проводили в пересчете на рутин. Получены результаты валидации методики по критериям: специфичность, линейность, повторяемость, внутрилабораторная воспроизводимость. С помощью разработанной методики были проанализированы четыре образца травы гречихи красностебельной производства ООО «Парафарм». Содержание суммы флавоноидов в пересчете на рутин варьировало от 9,15±0,20 до 9,55±0,11%.
ВЫВОДЫ. Разработана и валидирована спектрофотометрическая методика количественного определения суммы флавоноидов в пересчете на рутин в траве гречихи красностебельной. Данная методика может быть использована для стандартизации лекарственного сырья гречихи красностебельной.
Ключевые слова
Для цитирования:
Митишев А.В., Курдюков Е.Е., Макарцева М.Г., Немова Я.М., Елистратов Д.Г., Паксяев А.С. Разработка и валидация методики количественного определения суммы флавоноидов в траве гречихи красностебельной (Fagopyrum rubricaulis) методом спектрофотометрии. Регуляторные исследования и экспертиза лекарственных средств. 2025;15(5):565-573. https://doi.org/10.30895/1991-2919-2025-689
For citation:
Mitishev A.V., Kurdyukov E.E., Makartseva M.G., Nemova Ya.M., Elistratov D.G., Paksyaev A.S. Development and Validation of an Analytical Procedure for the Quantitative Determination of Total Flavonoids in Red-Stem Buckwheat Herb (Fagopyrum rubricaulis) by Spectrophotometry. Regulatory Research and Medicine Evaluation. 2025;15(5):565-573. (In Russ.) https://doi.org/10.30895/1991-2919-2025-689
ВВЕДЕНИЕ
В последние годы внимание исследователей сосредоточено на поиске растений, произрастающих на территории Российской Федерации, которые могут быть источниками для получения биологически активных соединений, в том числе полифенольных соединений. Гречиха красностебельная (Fagopyrum rubricaulis) — однолетнее растение, культивируемое на территории Российской Федерации в промышленных масштабах [1][2], в цветках и листьях которого содержится большое количество флавоноидов [3]. Основным флавоноидом травы гречихи красностебельной является рутин (витамин Р), содержание которого в надземной части растения варьирует от 5,39 до 11,2%, что значительно больше, чем в гречихе посевной (до 4,01%) [4]. В траве гречихи красностебельной также присутствуют кверцетин, изокверцетин, ориентин, витексин и другие флавоноиды [5]. Помимо флавоноидов в надземной части обнаружены фенилпропаноиды (хлорогеновая и кофейная кислоты) и фенолкарбоновые кислоты (протокатеховая, галловая) [6]. Плоды гречихи красностебельной характеризуются высоким содержанием белков, углеводов, жирных и органических кислот [7], витаминами группы В и каротиноидами [8]. Минеральный состав представлен солями кальция, меди, железа, фосфора.
Несмотря на широкий спектр фармакологических эффектов (сырье гречихи красностебельной обладает антимикробными, противовоспалительными, противоаллергическими, антиканцерогенными и антигипертензивными свойствами [9–11], гречиха красностебельная не является фармакопейным растением. Для разработки нормативной документации на растительное сырье «Гречихи красностебельной трава» необходимо определить нормируемые показатели и разработать методы количественного определения биологически активных соединений.
Фармакологическая активность экстрактов гречихи зависит от комплекса флавоноидов: рутин, кверцетин, ориентин, витексин. По данным источников литературы, в настоящее время используют следующие методики количественного определения флавоноидов: спектрофотометрия [12–14], высокоэффективная жидкостная хроматография с ультрафиолетовым и масс-спектрометрическим-детектированием [15–18], спектроскопия ядерного магнитного резонанса [19][20]. По данным [21], методики высокоэффективной жидкостной хроматографии с ультрафиолетовым детектированием используются для идентификации и количественного определения индивидуальных соединений в сырье и лекарственных растительных препаратах.
Для количественного определения суммы флавоноидов нами была выбрана методика дифференциальной спектрофотометрии как наиболее доступный, быстрый и недорогой метод количественного определения.
Цель работы — разработка и валидация методики количественного определения суммы флавоноидов в траве гречихи красностебельной с использованием дифференциальной спектрофотометрии.
МАТЕРИАЛЫ И МЕТОДЫ
Материалом для исследования служила гречихи красностебельной трава, собранная в фазу массового цветения и начала плодоношения на территории Пензенской обл. в Камешкирском р‑не в период с 25 июля по 10 августа 2024 г. Свежесобранную траву гречихи красностебельной сушили в сушильных шкафах (ШС-80-02 СПУ) при температуре не выше 40 °C, измельчение сырья проводили в лабораторных мельницах (ML-08B). Образцы взвешивали на лабораторных аналитических весах (AND GR-120). Определение влажности сырья проводили согласно ОФС.1.5.3.0007 «Определение влажности лекарственного растительного сырья и лекарственных средств растительного происхождения» Государственной фармакопеи Российской Федерации XV изд. Извлечение из травы гречихи красностебельной производили методом мацерации с использованием в качестве экстрагента спирта этилового 40, 70 и 95% при температуре 90 °C. Подтверждение наличия флавоноидов в водно-спиртовых экстрактах осуществляли методом тонкослойной хроматографии на пластинках марки «Sorbfil» ПТСХ-АФ-А-УФ. В качестве стандартного образца (СО) использовали растворы рутина (98,5%, ООО «Геофарма»), кверцетина (98,5%, ООО «Геофарма»), витексина (98%, кат. № 49513, Sigma-Aldrich), изовитексина (98%, кат. № 17804, Sigma-Aldrich), ориентина (97%, кат. № O9765, Sigma-Aldrich), изоориентина (95%, кат. № I1536, Sigma-Aldrich). Элюирование проводили в системе н-бутанол (ч.д.а., 99,70%, ООО «НеваРеактив») — ледяная уксусная кислота (х.ч., 99,8%, ООО «Компонент-Реактив») — вода (4:1:2), после полного высушивания детекцию осуществляли в видимом свете; далее при облучении УФ-светом с длинами волн λ=254 и λ=365 нм в флуоресцентном аналитическом кабинете УФС-254/365 («Петролазер»). В последующем пластинки обрабатывали 3% спиртовым раствором алюминия хлорида (ч., 98,50%, ACROS).
Для определения количественного содержания суммы флавоноидов в траве гречихи красностебельной использовали метод дифференциальной спектрофотометрии, основанный на батохромном сдвиге спектра поглощения в присутствии раствора алюминия хлорида. К 0,5 мл водно-спиртовых извлечений прибавляли 2 мл раствора алюминия хлорида 3% и несколько капель 30% уксусной кислоты. В качестве раствора сравнения использовали раствор, приготовленный при тех же условиях, но в отсутствие алюминия хлорида. Определение оптической плотности проводили на спектрофотометре СФ-102 (ЗАО «НПКФ Аквилон»). Для расчета суммы флавоноидов в пересчете на рутин в сырье гречихи красностебельной использовали раствор СО рутина.
Статистическая обработка результатов исследования и валидация методики проведены в соответствии с требованиями Государственной фармакопеи Российской Федерации1 с использованием компьютерной программы Microsoft Office Excel 2019.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для качественной идентификации флавоноидов в извлечениях гречихи красностебельной использовали метод тонкослойной хроматографии. В результате проведенного исследования выделены шесть зон (рис. 1), которые имели окраску от светло-желтого до желто-коричневого цвета. Обработка пластины раствором алюминия хлорида 3% повышает селективность проявления флавоноидов при рассмотрении в УФ свете с λ=365 нм (желтая флуоресценция). Сравнение факторов замедления (Rf) зон флавоноидов на хроматограммах исследуемого и стандартных образцов позволило сделать вывод о наличии в траве гречихи красностебельной рутина, кверцетина, витексина, изовитексина, ориентина и изоориентина.
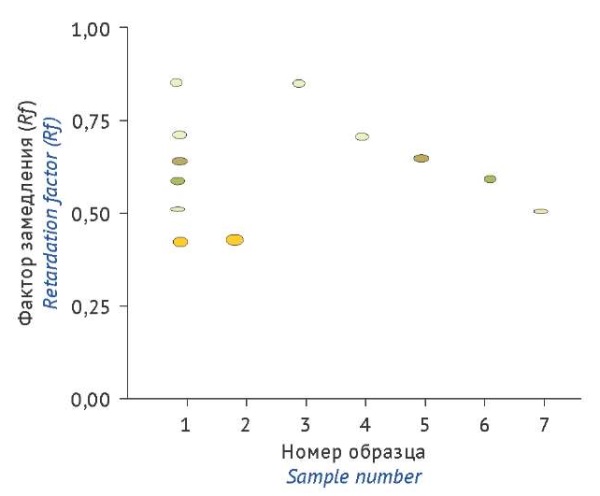
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using his own data
Рис. 1. Хроматограммы образцов: 1 — спиртовое извлечение из травы гречихи красностебельной; растворы стандартных образцов: 2 — рутин 0,05%, 3 — кверцетин 0,05%, 4 — витексин 0,03%, 5 — изовитексин 0,03%, 6 — ориентин 0,03%, 7 — изоориентин 0,03%
Fig. 1. Results of thin-layer chromatography of an ethanol extract of Fagopyrum rubricaulis herb (1); 0.05% solutions of reference standards for rutin (2) and quercetin (3); and 0.03% solutions of reference standards for vitexin (4), isovitexin (5), orientin (6), and isoorientin (7)
Спектры поглощения извлечений исследуемого растения имеют максимумы при 352 нм, характерные для веществ флавоноидной природы [22]. Следует отметить, что природа экстрагента не влияла на величину длины волны максимума поглощения. В присутствии алюминия хлорида наблюдался батохромный сдвиг электронного спектра поглощения экстрактов травы гречихи красностебельной с максимумом поглощения, аналогичным раствору СО рутина (410 нм) (рис. 2), поэтому при проведении количественного определения суммы флавоноидов в экстрактах из травы гречихи красностебельной в качестве стандартного образца нами был выбран рутин.
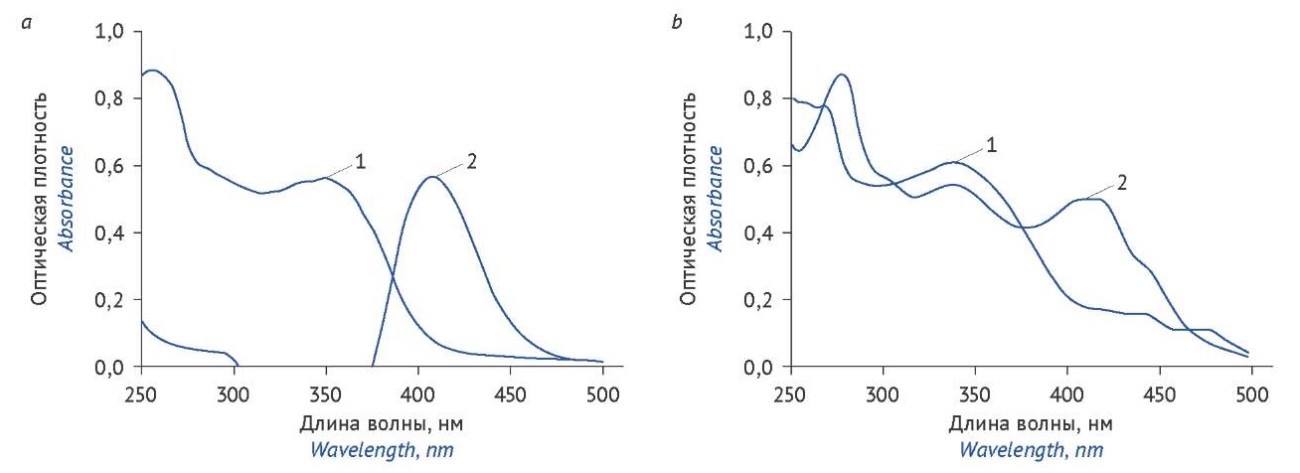
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 2. УФ-спектры поглощения 40% спиртового извлечения образца гречихи красностебельной (а), спиртового раствора рутина (b) в отсутствие (1) и в присутствии (2) 3% раствора алюминия хлорида
Fig. 2. UV absorption spectra of the 40% ethanol extract of Fagopyrum rubricaulis (a) and alcoholic solutions of the reference standard for rutin (b) without (1) and with (2) 3% aluminium chloride
При разработке методики количественного определения суммы флавоноидов в сырье гречихи красностебельной были определены оптимальные условия проведения экстракции (табл. 1). Учитывая, что увеличение числа операций на стадии пробоподготовки ведет к возрастанию ошибки, выбор сделан в пользу одностадийного процесса экстракции с подтверждением требуемой точности количественного определения.
Таблица 1. Показатели экстрагирования суммы флавоноидов из надземной части гречихи красностебельной (n=3)
Table 1. Extraction parameters for quantifying total flavonoids in the aerial parts of Fagopyrum rubricaulis (n=3)
|
Экстрагент Extraction solvent |
Соотношение сырье : экстрагент Sample-to-solvent ratio |
Время экстракции, мин Extraction time, min |
Степень измельчения не более, мм Fragment size (not more than), mm |
Содержание суммы флавоноидов, % Total flavonoid content, % |
|
Степень измельчения Fragment size |
||||
|
Спирт этиловый 40% Ethanol 40% |
1:25 |
30 |
1 |
8,33±0,08 |
|
Спирт этиловый 40% Ethanol 40% |
1:25 |
30 |
2 |
8,96±0,07 |
|
Спирт этиловый 40% Ethanol 40% |
1:25 |
30 |
5 |
8,45±0,10 |
|
Тип экстрагента Extraction solvent type |
||||
|
Спирт этиловый 40% Ethanol 40% |
1:25 |
60 |
2 |
8,72±0,21 |
|
Спирт этиловый 70% Ethanol 70% |
1:25 |
60 |
2 |
7,91±0,03 |
|
Спирт этиловый 95% Ethanol 95% |
1:25 |
60 |
2 |
6,96±0,09 |
|
Время экстракции Extraction time |
||||
|
Спирт этиловый 40% Ethanol 40% |
1:25 |
30 |
2 |
10,01±0,12 |
|
Спирт этиловый 40% Ethanol 40% |
1:25 |
60 |
2 |
8,83±0,14 |
|
Спирт этиловый 40% Ethanol 40% |
1:25 |
90 |
2 |
9,21±0,11 |
|
Спирт этиловый 40% Ethanol 40% |
1:25 |
120 |
2 |
9,57±0,21 |
|
Сырье : экстрагент Sample-to-solvent ratio |
||||
|
Спирт этиловый 40% Ethanol 40% |
1:25 |
30 |
2 |
9,49±0,09 |
|
Спирт этиловый 40% Ethanol 40% |
1:50 |
30 |
2 |
5,92±0,18 |
|
Спирт этиловый 40% Ethanol 40% |
1:100 |
30 |
2 |
3,33±0,23 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. n — число параллельных проб. Полужирным шрифтом выделен наилучший результат.
Note. n, number of replicates. The best result is highlighted in bold.
По результатам проведенных экспериментов разработана методика количественного определения суммы флавоноидов в сырье гречихи красностебельной. Точную навеску сырья гречихи с влажностью 8%, проходящего через сито с диаметром отверстий 2 мм, массой 1 г помещали в коническую колбу со шлифом вместимостью 100 мл и заливали 25 мл спирта этилового 40%. Колбу закрывали пробкой, взвешивали на лабораторных весах с точностью ±0,01 г, присоединяли к обратному холодильнику и нагревали на кипящей водяной бане 30 мин. Затем колбу охлаждали в течение 30 мин, закрывали той же пробкой, снова взвешивали и восполняли недостающий экстрагент до первоначальной массы колбы. Извлечения фильтровали через бумажный беззольный фильтр (красный) (раствор А).
0,5 мл извлечения (раствора А) количественно переносили в мерную колбу на 50 мл, прибавляли 2 мл раствора алюминия хлорида 3% в спирте этиловом 95% и через 10 мин — 2 капли уксусной кислоты 30%. Объем раствора доводили до метки экстрагентом и оставляли на 30 мин (раствор Б).
0,5 мл извлечения (раствора А) количественно переносили в мерную колбу на 50 мл, прибавляли через 10 мин — 2 капли уксусной кислоты 30%. Объем раствора доводили до метки экстрагентом и оставляли на 30 мин (раствор сравнения).
Измерение оптической плотности раствора Б проводили через 30 мин на спектрофотометре СФ-102 при 410 нм относительно раствора сравнения.
Приготовление раствора СО рутина: 20 мг СО с содержанием основного вещества 98,5% помещали в мерную колбу вместимостью 25 мл и растворяли при нагревании на водяной бане в 10 мл спирта этилового 40%, охлаждали, недостающий объем раствора восполняли спиртом этиловым 40% и перемешивали (раствор А СО рутина).
1 мл раствора А СО рутина количественно переносили в мерную колбу на 25 мл, прибавляли 2 мл раствора алюминия хлорида 3% в спирте этиловом 95% и через 10 мин — 2 капли уксусной кислоты 30%. Объем раствора доводили до метки экстрагентом и оставляли на 30 мин (раствор Б).
1 мл раствора А СО рутина количественно переносили в мерную колбу на 25 мл, прибавляли через 10 мин 2 капли уксусной кислоты 30%. Объем раствора доводили до метки экстрагентом и оставляли на 30 мин (раствор сравнения).
Содержание суммы флавоноидов в пересчете на рутин и сухое сырье (X, %) вычисляли по формуле (1):
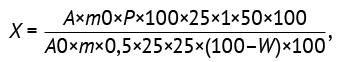 (1)
(1)
где A — оптическая плотность испытуемого раствора; А0 — оптическая плотность раствора СО рутина; m0 — масса СО рутина, г; m — масса сырья, г; W — потеря в массе при высушивании, %; Р — содержание основного вещества в СО рутина, %.
Проведена метрологическая оценка предложенной методики. В результате пяти параллельных определений (X=9,43) установлена дисперсия (S²=0,03), стандартное отклонение (S=0,17), стандартное отклонение среднего результата (SX=0,07), относительное стандартное отклонение среднего результата (RSD=1,8%), полуширина доверительного интервала (ΔX=0,21). Погрешность среднего результата (ε, %) суммы флавоноидов с доверительной вероятностью (Р, %) 95% в сырье гречихи красностебельной составила ±2,23%.
Специфичность методики оценивали по соответствию максимумов поглощения комплексов флавоноидов из травы гречихи красностебельной и раствора стандартного образца рутина с раствором алюминия хлорида 3% (рис. 2). Линейность методики определяли для серии растворов рутина (с концентрацией от 0,002 до 0,012 мг/мл). По полученным данным строили график зависимости значений оптической плотности раствора рутина от концентрации рутина и рассчитывали параметры уравнения линейной регрессии. Коэффициент корреляции составил 0,9967.
Прецизионность методики оценивали путем анализа исследуемого образца гречихи красностебельной в 5-кратной повторности при одинаковых условиях. Согласно полученным результатам среднее значение (X) составило 10,08%, стандартное отклонение S=0,19, относительное стандартное отклонение среднего результата RSD=1,88%, полуширина доверительного интервала ΔX=0,23). Погрешность среднего результата (ε, %) суммы флавоноидов с доверительной вероятностью (Р, %) 95% в сырье гречихи красностебельной составила ±2,28%.
Для оценки внутрилабораторной прецизионности количественный анализ спиртового экстракта проводился другим аналитиком в другие дни с использованием того же оборудования пятикратно. Выявлено, что ошибка среднего результата с доверительной вероятностью 95% составляет не более 3,12% при определении суммы флавоноидов методом спектрофотометрии в пересчете на рутин. Расчетное значение t-критерия Стьюдента 0,01<2,306 (95%; 8); F-критерия Фишера 1,5<5,05. Следовательно, дисперсии результатов анализа обоих химиков статистически эквивалентны и различия между полученными значениями не значимы.
Правильность методики определяли путем рассмотрения результатов изучения линейности валидируемой методики по формуле (2):
Δb=t(0,05, n–1)×Sb , (2)
где Δb — доверительный интервал свободного члена; t(0,05; n–1) — коэффициент Стьюдента, где 0,05 — уровень значимости; Sb — стандартное отклонение свободного члена.
В результате расчета выявили, что свободный член уравнения (2) меньше доверительного интервала (0,0227<0,25). Полученные данные свидетельствуют об отсутствии систематической ошибки разработанной нами методики и позволяют рекомендовать ее для количественного определения суммарного содержания флавоноидов в траве гречихи красностебельной в пересчете на рутин.
С помощью разработанной методики были проанализированы четыре образца травы гречихи красностебельной производства ООО «Парафарм». Содержание суммы флавоноидов в пересчете на рутин варьировало от 9,15±0,20 до 9,55±0,11%.
ЗАКЛЮЧЕНИЕ
Наличие флавоноидов в спиртовом экстракте травы гречихи красностебельной было подтверждено методом тонкослойной хроматографии. Разработана методика количественного определения суммы флавоноидов в сырье исследуемого растения методом дифференциальной спектрофотомерии с использованием стандартного образца рутина при аналитической длине волны 410 нм. Установлены оптимальные параметры экстракции флавоноидов из травы гречихи красностебельной: экстрагент — спирт этиловый 40%, соотношение сырье : экстрагент 1:25 и продолжительность экстракции 30 мин при температуре 90 °С.
На основе результатов валидационной оценки эксперимента можно сделать вывод о возможности использования данной методики для количественного определения содержания флавоноидов в пересчете на рутин в сырье гречихи красностебельной. Полученные результаты имеют большое значение для дальнейших исследований гречихи красностебельной в качестве перспективного источника биологически активных соединений.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: А.В. Митишев — написание текста рукописи, валидация методики, формулировка выводов, статистическая обработка результатов; Е.Е. Курдюков — разработка методики, написание текста рукописи; М.Г. Макарцева — разработка методики; Я.М. Немова — работа с источниками литературы; Д.Г. Елистратов — концепция работы, утверждение окончательной версии рукописи для публикации; А.С. Паксяев — участие в формулировании выводов, концепция работы.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Alexander V. Mitishev drafted the manuscript, validated the analytical procedure, formulated the conclusions, and performed statistical analysis of the results. Evgeny E. Kurdyukov developed the analytical procedure and drafted the manuscript. Marina G. Makartseva developed the analytical procedure. Yana M. Nemova worked with literature sources. Dmitry G. Elistratov conceptualised the study and approved the final version of the manuscript for publication. Alexey S. Paksyaev formulated the conclusions and conceptualised the study.
1. ОФС.1.1.0012 «Валидация аналитических методик»; ОФС.1.1.0013 «Статистическая обработка результатов физических, физико-химических и химических испытаний». Государственная фармакопея Российской Федерации. XV изд. М.; 2023.
Список литературы
1. Митишев АВ, Феднина АС, Курдюков ЕЕ, Уланова МИ. Некоторые представители рода Fagopyrum: химический состав, фармакологические эффекты, перспективы использования. Химия растительного сырья. 2024;(1):31–56. https://doi.org/10.14258/jcprm.20240112933
2. Феднина АС, Макарцева МГ, Курдюков ЕЕ, Моисеева ИЯ, Елистратов ДГ, Митишев АВ. Современное состояние исследований химического состава некоторых представителей рода Fagopyrum. Вопросы биологической, медицинской и фармацевтической химии. 2023;26(9):3–11. https://doi.org/10.29296/25877313-2023-09-04
3. Магафурова ФФ, Хуснутдинов ВВ. Предварительные результаты селекции на повышение урожайности у гибридных комбинаций гречихи с высоким содержанием рутина. Вестник КрасГАУ. 2022;(9):27–32. https://doi.org/10.36718/1819-4036-2022-9-27-32
4. Borovaya SA, Klykov AG. Some aspects of flavonoid biosynthesis and accumulation in buckwheat plants. Plant Biotechnol Rep. 2020;14:213–25. https://doi.org/10.1007/s11816-020-00614-9
5. Li J, Yang P, Yang Q. Analysis of flavonoid metabolites in buckwheat leaves using UPLC-ESI-MS/MS. Molecules. 2019;24(7):1310. https://doi.org/10.3390/molecules24071310
6. Jing R, Li H-Q, Hu C-L, Jiang Y-P, Qin L-P, Zheng C-J. Phytochemical and pharmacological profiles of three Fagopyrum buckwheats. Int J Mol Sci. 2016;17(4):589. https://doi.org/10.3390/ijms17040589
7. Yilmaz HO, Nurcan YN, Meriç ÇS. Buckwheat: A useful food and its effects on human health. Curr Nutr Food Sci. 2020;16(1):29–34. https://doi.org/10.2174/1573401314666180910140021
8. Sonam T, Talat A, Sanjay S. An incisive review on buckwheat—A potential underutilized millet. J Drug Res Ayurvedic Sci. 2023;8(Suppl 1):64–75. https://doi.org/10.4103/jdras.jdras_214_23
9. Bao T, Wang Y, Sun C. Optimization of flavonoids extraction from Tartary buckwheat rice and analysis of its hypoglycemic activity. Trans Chin Soc Agricultur Eng. 2016;32(2):383–9. https://doi.org/10.11975/j.issn.1002-6819.2016.z2.054
10. He WP, Li JC, Wang GM. Effect of total flavonoids of buckwheat flower and leaf on myocardial cell apoptosis and Wnt/β-catenin/PPARγ pathway in arrhythmic rats. China J Chinese Materia Medica. 2023;48:220–5. https://doi.org/10.19540/j.cnki.cjcmm.20221014.701
11. Zhong L, Lin Y, Wang C, Niu B, Xu Y, Zhao G, Zhao J. Chemical profile, antimicrobial and antioxidant activity assessment of the crude extract and its main flavonoids from Tartary buckwheat sprouts. Molecules. 2022;27(2):374. https://doi.org/10.3390/molecules27020374
12. Лабковская МВ, Куркин ВА, Шмыгарева АА, Саньков АН. Разработка методики количественного определения травы астрагала перепончатого Astragalus membranaceus L. Вестник Смоленской государственной медицинской академии. 2022;21(4):225–9. https://doi.org/10.37903/vsgma.2022.4.31
13. Калашникова ОА, Рыжов ВМ, Куркин ВА. Методика количественного определения суммы флавоноидов в цветках цефалярии гигантской. Химия растительного сырья. 2024;(2):207–15. https://doi.org/10.14258/jcprm.20240212969
14. Куркин ВА, Куркина АВ, Косенко АА. Разработка методики количественного определения суммы флавоноидов в почках Populus alba L. Химия растительного сырья. 2024;(2):168–75. https://doi.org/10.14258/jcprm.20240212904
15. Lund JA, Brown PN, Shipley PR. Quantification of North American and European Crataegus flavonoids by nuclear magnetic resonance spectrometry. Fitoterapia. 2020;143:104537. https://doi.org/10.1016/j.fitote.2020.104537
16. Лубсандоржиева ПБ, Болданова НБ, Попов ДВ. Количественный анализ флавоноидов в растительном средстве методом высокоэффективной жидкостной хроматографии. Сибирский медицинский журнал. 2013;116(1):114–5. EDN: RVPDUN
17. Omeje KO, Ezema BO, Onaebi CN. HPLC fingerprint of flavonoids, enzyme inhibition and antioxidant activity of Newbouldia laevis stem-bark: An in vitro and in silico study. Futur J Pharm Sci. 2023;9:36. https://doi.org/10.1186/s43094-023-00486-0
18. Шевлякова ОА, Ихалайнен АА, Антохин АМ, Таранченко ВФ, Гончаров ВМ, Аксенов АВ и др. Современные способы определения и идентификации флавоноидов горянки (Еpimedium). Вестник Московского университета. Серия 2: Химия. 2016;57(3):172–83. EDN: VVVKID https://doi.org/10.3103/S0027131416030093
19. March R, Brodbelt J. Analysis of flavonoids: Tandem mass spectrometry, computational methods, and NMR. J Mass Spectrom. 2008;43(12):1581–617. https://doi.org/10.1002/jms.1480
20. Куркин ВА, Савельева АЕ, Куркина АВ, Трифонова ПВ. Флавоноиды надземной части бархатцев отклоненных (Tagetes patula L.). Химия растительного сырья. 2023;(3):143–51. https://doi.org/10.14258/jcprm.20230312189
21. Рязанова ТК, Куркин ВА. Вопросы использования стандартных образцов при анализе лекарственного растительного сырья и лекарственных растительных препаратов. Эталоны. Стандартные образцы. 2023;19(2):47–60. https://doi.org/10.20915/2077-1177-2023-19-2-47-60
22. Куркина АВ. Флавоноиды фармакопейных растений. Самара: Офорт; 2012. EDN: UCPGGZ
Об авторах
А. В. МитишевРоссия
Митишев Александр Владимирович
ул. Красная, д. 40, г. Пенза, 440026
Е. Е. Курдюков
Россия
Курдюков Евгений Евгеньевич, канд. фарм. наук
ул. Красная, д. 40, г. Пенза, 440026
М. Г. Макарцева
Россия
Макарцева Марина Геннадьевна
ул. Красная, д. 40, г. Пенза, 440026
Я. М. Немова
Россия
Немова Яна Михайловна
ул. Красная, д. 40, г. Пенза, 440026
Д. Г. Елистратов
Россия
Елистратов Дмитрий Геннадьевич
ул. Добровольцев, д. 62, лит. А, Санкт-Петербург, 198334
А. С. Паксяев
Россия
Паксяев Алексей Сергеевич
ул. Коммунистическая, д. 21-б, г. Пенза, 440039
Дополнительные файлы
Рецензия
Для цитирования:
Митишев А.В., Курдюков Е.Е., Макарцева М.Г., Немова Я.М., Елистратов Д.Г., Паксяев А.С. Разработка и валидация методики количественного определения суммы флавоноидов в траве гречихи красностебельной (Fagopyrum rubricaulis) методом спектрофотометрии. Регуляторные исследования и экспертиза лекарственных средств. 2025;15(5):565-573. https://doi.org/10.30895/1991-2919-2025-689
For citation:
Mitishev A.V., Kurdyukov E.E., Makartseva M.G., Nemova Ya.M., Elistratov D.G., Paksyaev A.S. Development and Validation of an Analytical Procedure for the Quantitative Determination of Total Flavonoids in Red-Stem Buckwheat Herb (Fagopyrum rubricaulis) by Spectrophotometry. Regulatory Research and Medicine Evaluation. 2025;15(5):565-573. (In Russ.) https://doi.org/10.30895/1991-2919-2025-689



































