Перейти к:
Определение биологической активности гонадотропинов на крысах беспородных и линии Sprague Dawley. Часть 2. Определение биологической активности лютеинизирующего гормона
https://doi.org/10.30895/1991-2919-2024-14-3-330-337
Резюме
ВВЕДЕНИЕ. Тенденция к сокращению использования лабораторных животных при оценке качества лекарственных препаратов, а также появление новых технологий получения гонадотропных препаратов обусловливают необходимость разработки новых методик определения биологической активности природных и рекомбинантных препаратов передней доли гипофиза.
ЦЕЛЬ. Выбор оптимальных условий определения биологической активности лютеинизирующего гормона в мочевых и генно-инженерных препаратах в испытаниях на крысах беспородных и линии Sprague Dawley.
МАТЕРИАЛЫ И МЕТОДЫ. Определение величины биологической активности мочевых и рекомбинантных препаратов лютеинизирующего гормона (ЛГ) проводили трехдозовым рандомизированным методом in vivo по схеме Steelman and Pohley путем сравнения биологической активности испытуемых и стандартных (СО) образцов. Для анализа были использованы результаты, полученные в течение двух лет. В качестве СО использовали стандарт ВОЗ, содержащий 183 МЕ фолликулостимулирующего гормона и 177 МЕ ЛГ/амп. Испытание проводили на неполовозрелых крысах-самцах беспородных и линии Sprague Dawley. В зависимости от статуса крыс выбирали условия проведения испытания.
РЕЗУЛЬТАТЫ. Проведен сравнительный анализ результатов определения активности ЛГ in vivo на крысах-самцах по интегральному показателю s/b, позволяющему оценить одновременно разброс ответов и дозозависимость. Было показано, что использование самцов крыс линии Sprague Dawley (s/b=0,82±0,44) для определения биологической активности ЛГ возможно наравне с беспородными животными (s/b=0,68±0,58). Значения показателей s/b близки, несмотря на то что количество животных линии Sprague Dawley в испытаниях было в два раза меньше.
ВЫВОДЫ. Показана возможность определения биологической активности ЛГ в препаратах менотропинов не только на беспородных, но и на линейных крысах-самцах. Проведение испытания на крысах линии Sprague Dawley позволяет подтвердить достоверность результатов, используя меньшее количество животных, что, в свою очередь, является не только гуманным, но и более выгодным экономически.
Ключевые слова
Для цитирования:
Батуашвили Т.А., Чечетова Е.О., Шадрин П.В., Неугодова Н.П. Определение биологической активности гонадотропинов на крысах беспородных и линии Sprague Dawley. Часть 2. Определение биологической активности лютеинизирующего гормона. Регуляторные исследования и экспертиза лекарственных средств. 2024;14(3):330-337. https://doi.org/10.30895/1991-2919-2024-14-3-330-337
For citation:
Batuashvili T.A., Chechetova E.O., Shadrin P.V., Neugodova N.P. Determination of Biological Activity of Gonadotrophins in Randombred and Sprague Dawley Rats. Part 2. Determination of Biological Activity of Luteinising Hormone. Regulatory Research and Medicine Evaluation. 2024;14(3):330-337. (In Russ.) https://doi.org/10.30895/1991-2919-2024-14-3-330-337
ВВЕДЕНИЕ
Для успешного фолликулогенеза наряду с фолликулостимулирующим гормоном (ФСГ) в состав мочевых и рекомбинантных гонадотропных препаратов входит лютеинизирующий гормон (ЛГ) — гликопротеин, состоящий из двух субъединиц, биологические свойства которого определяет β-субъединица. Молекулы ЛГ отличаются от ФСГ наличием сульфидных мостиков. В организме секреция гормона происходит под воздействием гонадолиберина (гонадотропин-рилизинг-гормон), который синтезируется в гипоталамусе. Помимо участия в выработке эстрогенов, прогестерона и тестостерона ЛГ способствует формированию желтого тела, процессу овуляции, а также созреванию фолликулов [1].
Как и хорионический гонадотропин человека, ЛГ обладает лютеинизирующей активностью, но имеет существенные молекулярные и функциональные отличия, которые хорошо улавливает рецептор, находящийся на гранулезных клетках и взаимодействующий с обоими гормонами. Только гетеродимерные полностью гликозилированные формы гормонов способны проявлять биологическую активность (БА). По этой причине для получения рекомбинантных гормонов пригодны только культивируемые клетки млекопитающих, в которых происходит корректное гликозилирование целевых белков [2][3]. Учитывая особенности и технологии получения мочевых и рекомбинантных гонадотропинов, требуется обязательный контроль биологической активности препаратов данной группы.
Большинство препаратов группы менотропинов содержат ЛГ и ФСГ в соотношении 1:1 или 1:21. Однако рекомбинантные гонадотропные препараты выпускают как в виде монопрепаратов (содержащих либо рекомбинантный ФСГ (рФСГ), либо рекомбинантный ЛГ (рЛГ), так и в виде препаратов содержащих оба гормона (рФСГ и рЛГ).
Цель работы — выбор оптимальных условий определения биологической активности лютеинизирующего гормона в мочевых и генно-инженерных препаратах в испытаниях на крысах беспородных и линии Sprague Dawley.
Задачи исследования:
- изучениечувствительности крыс линии Sprague Dawley в сравнении с беспородными животными к ЛГ;
- оценка возможности использования крыс линии Sprague Dawley в определении биологической активности препаратов.
МАТЕРИАЛЫ И МЕТОДЫ
Определение величины биологической активности ЛГ проводили биологическим трехдозовым рандомизированным методом по схеме Steelman and Pohley, сравнивая биологическую активность испытуемого образца (ИО) со стандартным образцом (СО) [4].
В качестве СО использовали стандарт ВОЗ, содержащий 183 МЕ ФСГ и 177 МЕ ЛГ/амп. (кат. №10/286)2. Испытания проводили с использованием крыс-самцов беспородных3 и линии Sprague Dawley4. Животных содержали в стандартных условиях вивария. Доступ к воде и пище был свободным. Все манипуляции на животных проводили в соответствии с требованиями нормативных документов5. Масса крыс на начало опыта составляла 32–36 г. В качестве ответа принимали относительную массу органа (ОМО), в данном случае — комплекса добавочных половых желез (mоргана/mтела, мг/г).
В качестве растворителя для приготовления растворов в рабочих концентрациях использовали альбумино-фосфатный буфер6.
В испытание брали шесть групп животных, в каждой из которых было от 5 до 10 крыс в зависимости от выбранной методики. Во время проведения опыта ежедневно в течение четырех суток крысы получали подкожные инъекции 1 раз/сут в одно и то же время. Трем группам вводили растворы СО (малая, средняя, большая дозы), а трем другим — ИО соответственно. Курсовые дозы, полученные каждым животным в течение опыта, соответствовали требованиям выбранной методики (табл. 1, 2). На пятый день проводили эвтаназию и выделяли комплекс добавочных половых желез. Очищенные и просушенные фильтровальной бумагой органы взвешивали и вычисляли ОМО. БА рассчитывали в соответствии с требованиями Государственной фармакопеи Российской Федерации7. В общей сложности в течение двух лет было использовано 360 беспородных и 180 животных линии Sprague Dawley.
Таблица 1. Реакция беспородных самцов крыс
на введение стандартного образца лютеинизирующего гормона
(добавочные половые железы)
Table 1. Responses of male randombred rats
to the international standard for luteinising hormone (accessory sex organs)
|
Курсовая доза лютеинизирующего гормона, МЕ/животное Accumulated luteinising hormone dose, IU/animal |
Среднее значение относительной массы органов (ОМО) и полуширина доверительного интервала (ОМО±ΔОМО) при доверительной вероятности P=95% Average accessory sex organ-to-body weight ratio and confidence interval half-width (ОМО±ΔОМО) (P=95%) |
|
4,5 |
1,45±0,11 |
|
16,5 |
1,60±0,07 |
|
39,0 |
1,86±0,12 |
Таблица составлена авторами по собственным данным /
The table is prepared by the authors using their own data
Таблица 2. Реакция самцов крыс линии Sprague Dawley
на введение стандартного образца лютеинизирующего гормона
(добавочные половые железы)
Table 2. Responses of male Sprague Dawley rats
to the international standard for luteinising hormone (accessory sex organs)
|
Курсовая доза лютеинизирующего гормона, МЕ/животное Accumulated luteinising hormone dose, IU/animal |
Среднее значение относительной массы органов (ОМО) и полуширина доверительного интервала (ОМО±ΔОМО) при доверительной вероятности P=95% Average accessory sex organ-to-body weight ratio and confidence interval half-width (ОМО±ΔОМО) (P=95%) |
|
4,5 |
1,29±0,07 |
|
14,3 |
1,92±0,16 |
|
35,0 |
2,24±0,26 |
Таблица составлена авторами по собственным данным /
The table is prepared by the authors using their own data
На первом этапе была проведена оценка собранных за весь период проведения испытания данных, характеризующих ответ животных беспородных и линии Sprague Dawley на подкожное введение СО ЛГ при определении БА менотропинов. Графики зависимости эффекта от дозы проанализировали по тангенсу угла наклона (коэффициенту регрессии b) и разбросу (дисперсии s²). Чем больше угол наклона линии, тем выше дозозависимость; чем меньше дисперсия результатов в испытании, тем они более точны и воспроизводимы. Для крыс каждого статуса вычисляли интегральный коэффициент s/b. Чем меньше его значение, тем выше чувствительность крыс.
Вторым этапом работы стал анализ ответов, полученных при определении БА (сравнение ИО с СО) различных препаратов менотропинов на беспородных и линейных животных. Регрессионный и дисперсионный анализ данных, а также вычисление БА ЛГ проводили с помощью электронных таблиц Microsoft Excel.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При оценке данных СО ЛГ величины курсовых доз и соответствующие ответы животных, в которых значения ОМО различались статистически незначимо, усреднили и объединили. Полученные результаты представлены в таблицах 1, 2 и на рисунке 1.
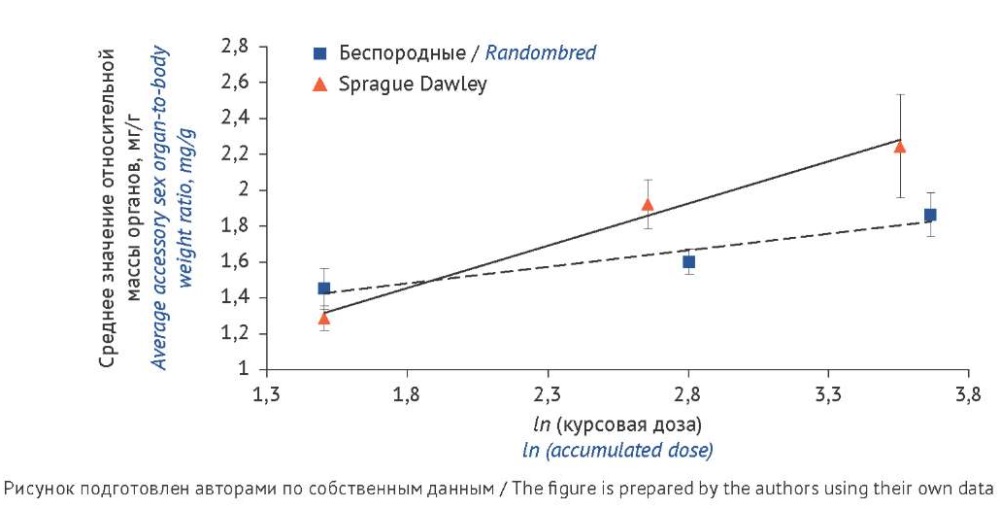
Рис. 1. Объединенная реакция крыс-самцов беспородных и линии Sprague Dawley
на введение стандартного образца лютеинизирующего гормона с линейной аппроксимацией
Fig. 1. Pooled responses of male randombred and Sprague Dawley rats
to the international standard for luteinising hormone, with linear approximation
Следующим этапом исследования была оценка статистической значимости дозозависимости с помощью дисперсионного анализа и ее сравнение для крыс беспородных и линии Sprague Dawley, получавших СО ЛГ.
Для применения модели параллельных прямых дозозависимость должна быть линейна и статистически значима. Эти параметры характеризуют источники дисперсии — показатели «Нелинейность» и «Регрессия» соответственно. Наблюдаемое значение критерия Фишера для первого показателя должно быть меньше, а для второго — больше критического.
Дисперсионный анализ полученных линий регрессии показал наличие статистически значимой дозозависимости и незначимой нелинейности (табл. 3, 4) для реакции животных на введение растворов СО ЛГ [5].
Таблица 3. Результаты оценки реакции беспородных крыс-самцов
на введение стандартного образца лютеинизирующего гормона
(методом дисперсионного анализа)
Table 3. Analysis of variance of pooled responses of male randombred rats
to the international standard for luteinising hormone
|
Определяемый показатель Test parameter |
Число степеней свободы (f) Number of degrees of freedom (f) |
Сумма квадратов Sum of squares |
Средний квадрат Mean square |
Значение критерия Фишера Fisher test value |
Доверительная вероятность (Р, %) Confidence probability (P, %) |
|
|
Fнабл Fcalculated |
Fкритич Fcritical |
|||||
|
Регрессия Regression |
1 |
1,94 |
1,94 |
19,41>6,83 |
99 |
|
|
Отклонение от регрессии (нелинейность) Departure from regression (non-linearity) |
1 |
0,27 |
0,27 |
2,68<3,92 |
95 |
|
|
Постановки (межгрупповая дисперсия) Treatments (intergroup variance) |
2 |
2,21 |
1,10 |
11,05>3,07 |
95 |
|
|
Отклонение (внутригрупповая дисперсия) Error (intragroup variance) |
136 |
13,58 |
0,10 |
– |
– |
|
|
Итого (Σуy) Total (Σуy ) |
138 |
15,79 |
0,11 |
– |
– |
|
Таблица составлена авторами по собственным данным /
The table is prepared by the authors using their own data
Примечание. «–» — не применимо.
Note. —, not applicable.
Таблица 4. Результаты оценки реакции крыс-самцов линии Sprague Dawley
на введение стандартного образца лютеинизирующего гормона
(методом дисперсионного анализа)
Table 4. Analysis of variance of pooled responses of male Sprague Dawley rats
to the international standard for luteinising hormone
|
Определяемый показатель Test parameter |
Число степеней свободы (f) Number of degrees of freedom (f) |
Сумма квадратов Sum of squares |
Средний квадрат Mean square |
Значение критерия Фишера Fisher test value |
Доверительная вероятность (Р, %) Confidence probability (P, %) |
|
|
Fнабл Fcalculated |
Fкритич Fcritical |
|||||
|
Регрессия Regression |
1 |
12,56 |
12,56 |
37,64>6,86 |
99 |
|
|
Отклонение от регрессии (нелинейность) Departure from regression (non-linearity) |
1 |
0,14 |
0,14 |
0,43<3,93 |
95 |
|
|
Постановки (межгрупповая дисперсия) Treatments (intergroup variance) |
2 |
12,7 |
6,35 |
19,03>3,08 |
95 |
|
|
Отклонение (внутригрупповая дисперсия) Error (intragroup variance) |
122 |
40,7 |
0,33 |
– |
– |
|
|
Итого (Σуy) Total (Σуy ) |
124 |
53,41 |
0,43 |
– |
– |
|
Таблица составлена авторами по собственным данным /
The table is prepared by the authors using their own data
Примечание. «–» — не применимо.
Note. —, not applicable.
На основании полученных данных (табл. 1, 2) был проведен анализ линий дозозависимости СО ЛГ беспородных и линейных крыс [6]. Сравнить коэффициенты регрессии с помощью t-критерия не представлялось возможным, так как линии характеризовались разным разбросом (рис. 1, табл. 1, 2). При этом дисперсия дозозависимости животных линии Sprague Dawley была значительно выше, чем у беспородных (Fнабл > Fкритич). Поэтому о непараллельности линий дозозависимости реакции крыс беспородных и линии Sprague Dawley на введение СО ЛГ судили по непересекающимся доверительным границам коэффициентов регрессии b: 0,16±0,07 (беспородные животные) и 0,47±0,15 (линейные животные) при P=95% (табл. 5) [5]. Интервалы доверительных границ не пересекаются, поэтому различие реакции животных следует считать статистически значимым (рис. 1). Следовательно, при введении СО ЛГ дозозависимость у животных линии Sprague Dawley (P=95%) значительно выше, чем у беспородных (табл. 6) [6][7].
Таблица 5. Анализ линий регрессии,
характеризующих реакцию крыс-самцов беспородных и линии Sprague Dawley
на введение стандартного образца лютеинизирующего гормона
Table 5. Analysis of regression lines
characterising responses of male randombred and Sprague Dawley rats
to the international standard for luteinising hormone
|
Показатель Parameter |
Значение показателя у животных Parameter value in animals |
||
|
Беспородные Randombred |
Sprague-Dawley |
||
|
Коэффициент линейной регрессии b Slope, b |
0,16 |
0,47 |
|
|
Дисперсия s² Variance, s² |
0,10 |
0,34 |
|
|
Среднее значение натурального логарифма курсовой дозы x Mean ln (accumulated dose) x |
2,55 |
2,64 |
|
|
Средний ответ y Mean response y, mg/g |
81,59 |
81,87 |
|
|
Сравнение дисперсий s² Comparison of variances, s² |
|||
|
Fнабл (Fcalculated )=3,37 |
f большей дисперсии f, maximum variance |
f меньшей дисперсии f, minimum variance |
Дисперсии статистически значимо различаются Significant difference between variances |
|
Fкритич (Fcritical )=1,34 (P=95%) |
118 |
137 |
|
Таблица составлена авторами по собственным данным /
The table is prepared by the authors using their own data
Примечание. F — критерий Фишера; f — число степеней свободы.
Note. F, Fisher’s test; f, number of degrees of freedom.
Таблица 6. Показатели, характеризующие реакцию
крыс-самцов беспородных и линии Sprague Dawley
на введение стандартного образца лютеинизирующего гормона
Table 6. Parameters characterising responses
of male randombred and Sprague Dawley rats
to the international standard of luteinising hormone
|
Показатель Parameter |
Значение показателя в группе животных Parameter value in the group of animals |
|
|
Беспородные Randombred |
Sprague Dawley |
|
|
Коэффициент линейной регрессии (опорное значение ± полуширина доверительного интервала b±Δb, P=95%) Slope (average value ± confidence interval half-width b±Δb, P=95%) |
0,16±0,07 |
0,47±0,15 |
|
Дисперсия (s²) Variance (s²) |
0,10 |
0,34 |
|
Интегральный показатель s/b Standard deviation/slope ratio (s/b) |
1,93 |
1,25 |
Таблица составлена авторами по собственным данным /
The table is prepared by the authors using their own data
Примечание. s — среднее квадратическое отклонение; P — доверительная вероятность.
Note. s, standard deviation; P, confidence probability.
Таким образом, у беспородных животных меньше разброс результатов, а у крыс линии Sprague Dawley выше дозозависимость. Для сравнительной оценки чувствительности крыс разных статусов применили интегральный коэффициент s/b, который характеризует баланс разброса ответов и степени дозозависимости. Чем ниже значение данного коэффициента, тем выше чувствительность. Значение для линейных животных составило 1,25, для беспородных — 1,93 (табл. 6), что свидетельствует о более высокой чувствительности линейных животных к СО ЛГ.
Анализ результатов определения БА (сравнение ИО с СО) показал, что различие средних значений интегрального показателя для животных обоих статусов (0,68±0,58 и 0,82±0,44 для беспородных и линейных крыс соответственно) статистически незначимо при том, что число линейных животных в каждом испытании было в два раза меньше, чем беспородных. Таким образом, можно сделать вывод, что для сокращения числа животных при определении биологической активности ЛГ в препаратах менотропина возможно использовать крыс линии Sprague Dawley.
ЗАКЛЮЧЕНИЕ
По результатам проведенного анализа установлено, что:
- для определения биологической активности лютеинизирующего гормона в препаратах гонадотропинов возможно использование крыс-самцов линии Sprague Dawley наряду с беспородными, указанными в методике Государственной фармакопеи Российской Федерации;
- чувствительность крыс линии Sprague Dawley выше, чем у беспородных, что подтверждается интегральным показателем, сочетающим оценку разброса и дозозависимости;
- благодаря более высокой чувствительности крыс линии Sprague Dawley возможно сокращение вдвое количества используемых особей в испытаниях для получения статистически достоверных результатов при определении биологической активности, что экономически выгодно и соответствует мировой тенденции сокращения количества лабораторных животных, используемых в исследованиях (концепция 3R).
Результаты исследования будут учтены при пересмотре общей фармакопейной статьи «Биологические испытания гонадотропинов» для следующего издания отечественной фармакопеи.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Т.А. Батуашвили — планирование исследования, выполнение эксперимента, проведение сравнительного анализа полученных результатов, сбор данных литературы; Е.О. Чечетова — выполнение эксперимента, анализ полученных данных, систематизация и оформление результатов исследования, редактирование текста рукописи; П.В. Шадрин — проведение вычислений, выполнение сравнительного анализа полученных результатов, работа с графическим материалом; Н.П. Неугодова — идея исследования, редактирование текста рукописи, утверждение окончательного варианта рукописи для публикации.
Соответствие принципам этики. Проведение исследования было одобрено на заседании локального этического комитета ФГБУ «НЦЭСМП» Минздрава России (протокол заседания № 3 от 16.11.2023).
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Tamara A. Batuashvili planned the study, conducted experiments, performed the comparative analysis of the results obtained, and collected literature data. Ekaterina O. Chechetova conducted experiments, analysed the data obtained, collated and formatted the study results, and edited the manuscript. Pavel V. Shadrin carried out calculations, performed the comparative analysis of the results obtained, and worked with the graphical material. Natalia P. Neugodova elaborated the main idea of the study, edited the manuscript, and approved the final version of the manuscript for publication.
Ethics approval. The study was approved at a meeting of the Local Ethics Committee of the Scientific Centre for Expert Evaluation of Medicinal Products (Minutes of Meeting No. 3 dated 16.11.2023).
1. https://www.rlsnet.ru/active-substance/menotropiny-757
2. https://cdn.who.int/media/docs/default-source/biologicals/blood-products/catalogue/alphabetical-list.pdf?sfvrsn=15455482_2
3. ФГБУН «Научный центр биомедицинских технологий» ФМБА России, Филиал «Андреевка».
4. НПП «Питомник лабораторных животных» ФИБХ РАН.
5. СП 2.2.1.3218-14 Санитарно-эпидемиологические требования к устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев). 2014.
6. ОФС.1.2.4.0014.18 Биологические испытания гонадотропинов. Государственная фармакопея Российской Федерации. XIV изд. Т. 1. М.; 2018.
7. ОФС.1.1.0014.15 Статистическая обработка результатов определения специфической фармакологической активности лекарственных средств биологическими методами. Государственная фармакопея Российской Федерации. XIV изд. Т. 1. М.; 2018.
Список литературы
1. Рудакова ЕБ, Серова ОФ, Стрижова ТВ, Федорова ЕА, Острина СЯ. Роль лютеинизирующего гормона в овариальной стимуляции в программах экстракорпорального оплодотворения (обзор литературы). Проблемы репродукции. 2022;28(1):129–35. https://doi.org/10.17116/repro202228011129
2. Орлова НА, Ковнир СВ, Ходак ЮА, Ползиков МА, Воробьев ИИ. Рекомбинантный лютеинизирующий гормон человека для лечения бесплодия: получение линий-продуцентов. Акушерство, гинекология и репродукция. 2017;11(3):33–42. https://doi.org/10.17749/2313-7347.2017.11.3.033-042
3. Mullen MP, Cooke D, Crow M. Structural and functional roles of FSH and LH as glycoproteins regulating reproduction in mammalian species. In: Vizcarra J, ed. Gonadotropin. Chapter 8. InTech; 2013. P. 155–80. https://doi.org/10.5772/48681
4. Steelman SL, Pohley FM. Assay of the follicle-stimulating hormone based on the augmentation with human chorionic gonadotropin. Endocrinology. 1953;53(6):604–16. https://doi.org/10.1210/endo-53-6-604
5. Burn JH, Finney DJ, Goodwin LG. Biological standardization. London: Oxford University Press; 1952.
6. Урбах ВЮ. Биометрические методы. Статистическая обработка опытных данных в биологии, сельском хозяйстве и медицине. М.: Наука; 1964.
7. Беленький МЛ. Элементы количественной оценки фармакологического эффекта. Л.: Медгиз; 1963.
Об авторах
Т. А. БатуашвилиРоссия
Батуашвили Тамара Ариеловна, канд. биол. наук
Петровский бульвар, д. 8, стр. 2, Москва, 127051
Е. О. Чечетова
Россия
Чечетова Екатерина Олеговна
Петровский бульвар, д. 8, стр. 2, Москва, 127051
П. В. Шадрин
Россия
Шадрин Павел Валерьевич
Петровский бульвар, д. 8, стр. 2, Москва, 127051
Н. П. Неугодова
Россия
Неугодова Наталия Петровна, канд. биол. наук
Петровский бульвар, д. 8, стр. 2, Москва, 127051
Дополнительные файлы
Рецензия
Для цитирования:
Батуашвили Т.А., Чечетова Е.О., Шадрин П.В., Неугодова Н.П. Определение биологической активности гонадотропинов на крысах беспородных и линии Sprague Dawley. Часть 2. Определение биологической активности лютеинизирующего гормона. Регуляторные исследования и экспертиза лекарственных средств. 2024;14(3):330-337. https://doi.org/10.30895/1991-2919-2024-14-3-330-337
For citation:
Batuashvili T.A., Chechetova E.O., Shadrin P.V., Neugodova N.P. Determination of Biological Activity of Gonadotrophins in Randombred and Sprague Dawley Rats. Part 2. Determination of Biological Activity of Luteinising Hormone. Regulatory Research and Medicine Evaluation. 2024;14(3):330-337. (In Russ.) https://doi.org/10.30895/1991-2919-2024-14-3-330-337



































