Перейти к:
Комплексная оценка функционального состояния мочевыделительной системы в доклинических исследованиях. Часть 2. Маркеры нефротоксичности (обзор)
https://doi.org/10.30895/1991-2919-2024-631
Резюме
ВВЕДЕНИЕ. Определение маркеров нефротоксичности является целесообразным и необходимым этапом детекции почечного поражения в экспериментах на животных, позволяющим точно определить локализацию повреждения органа. В связи с разнообразием существующих повреждающих агентов и установленных механизмов нефротоксичности, а также с учетом видового разнообразия лабораторных животных на сегодня не существует общепризнанного маркера почечного повреждения, который соответствовал бы всем предъявляемым требованиям.
ЦЕЛЬ. Систематизация данных литературы о маркерах нефротоксичности, анализ их прогностической значимости, формирование общих рекомендаций для оценки функционального состояния мочевыделительной системы в доклинических исследованиях.
ОБСУЖДЕНИЕ. Проведен сравнительный анализ маркеров нефротоксичности, рекомендованных регуляторными органами для мониторинга лекарственно-индуцированного повреждения почек. Отмечено, что наиболее часто используемыми и прогностически значимыми маркерами острого повреждения почек в доклинических исследованиях являются цистатин С, альбумин, общий белок, молекула повреждения почек-1 (KIM-1), липокалин-2 (NGAL) и кластерин. Маркерами хронического повреждения почек являются как вышеперечисленные маркеры, так и скорость клубочковой фильтрации, креатинин, мочевина и остеопонтин. Определение содержания электролитов может быть использовано для дифференциальной диагностики преренальной азотемии и острого повреждения почек. Возможными ограничениями при использовании маркеров в рутинной практике исследований являются высокая стоимость их количественного анализа и недостаток информации о применимости данных на разных видах лабораторных животных.
ВЫВОДЫ. На основании сравнительной оценки прогностической значимости используемых биомаркеров предложены общие рекомендации для комплексной оценки функционального состояния мочевыделительной системы в доклинических исследованиях, включающей проведение лабораторных, инструментальных, а также гистопатологических исследований. Дизайн исследования следует выбирать в зависимости от целей работы, вида или видов лабораторных животных, их количества, специфики тестируемого объекта.
Ключевые слова
Для цитирования:
Мирошников М.В., Султанова К.Т., Макарова М.Н., Фаустова Н.М., Хан С.О., Лосева Е.А. Комплексная оценка функционального состояния мочевыделительной системы в доклинических исследованиях. Часть 2. Маркеры нефротоксичности (обзор). Регуляторные исследования и экспертиза лекарственных средств. 2024;14(4):448-462. https://doi.org/10.30895/1991-2919-2024-631
For citation:
Miroshnikov M.V., Sultanova K.T., Makarova M.N., Faustova N.M., Khan S.O., Loseva E.A. Complex Assessment of the Functional State of the Urinary System in Preclinical Studies. Part 2. Markers of Nephrotoxicity (Review). Regulatory Research and Medicine Evaluation. 2024;14(4):448-462. (In Russ.) https://doi.org/10.30895/1991-2919-2024-631
ВВЕДЕНИЕ
Повреждение почек — часто встречающийся побочный эффект фармакотерапии [1]. Для оценки функционального состояния мочевыделительной системы в доклинических исследованиях, наряду с малоинвазивными лабораторными и инструментальными методами (общий анализ мочи и микроскопия) и более углубленными методами гистологического и иммуногистохимического исследования тканей органов мочевыделительной системы животных, также используют маркеры нефротоксичности, которые могут быть определены у значительного количества видов лабораторных животных [2].
Использование маркеров нефротоксичности позволяет провести углубленную оценку функционального состояния мочевыделительной системы. Идеальный маркер, отражающий нефротоксичность, должен быть высокоспецифичным и высокочувствительным, при этом определяемая величина должна коррелировать с локализацией повреждения в определенном органе и со степенью этого повреждения [3]. На сегодня нет общепризнанного маркера почечного повреждения, соответствующего всем вышеуказанным требованиям. Это связано с разнообразием повреждающих агентов и механизмов нефротоксичности, а в контексте доклинических исследований еще и с видовым разнообразием лабораторных животных [4].
Цель работы — систематизация данных литературы о маркерах нефротоксичности, анализ их прогностической значимости, формирование общих рекомендаций для оценки функционального состояния мочевыделительной системы в доклинических исследованиях.
В обзор включены публикации, доступные для поиска в базах данных PubMed и Google Scholar на 16 февраля 2024 г. В приоритете были научные статьи, опубликованные за последние 5 лет. Ключевыми словами для поиска необходимой информации являлись: «общий белок», «альбумин», «β2-микроглобулин», «молекула повреждения почек-1», «кластерин», «остеопонтин», «альфа-глутатион S-трансфераза», «цистатин С», «липокалин, ассоциированный с желатиназой нейтрофилов», «N-ацетил-β-D- глюкозаминидаза», «белок, связывающий жирные кислоты 1», «фактор трилистника 3», «нетрин-1», «кальбиндин» и их английские варианты: «total protein», «albumin», «β2-microglobulin», «KIM-1, kidney injury molecule-1», «clusterin», «osteopontin», «α-GST, alpha-glutathione S-transferase», «cystatin C, «neutrophil gelatinase-associated lipocalin, NGAL», «N-acetyl-beta-D-glucosaminidase, NAG», «L-type fatty acid binding protein 1, FABP1», «trefoil factor 3, TFF-3», «netrin-1», «calbindin». Особое внимание в статьях уделялось используемым тест-системам (мышь, крыса, кролик, хорек, собака, кошка, карликовая свинья, обезьяна), методам исследования, полученным результатам и выводам.
ОСНОВНАЯ ЧАСТЬ
Доступными маркерами почечного повреждения являются мочевина и креатинин, определяемые в сыворотке крови и моче. Однако значимые изменения концентрации данных маркеров произойдут только при существенном повреждении органа (более 65%) [5].
Еще один часто используемый маркер — скорость клубочковой фильтрации (СКФ) — используется при оценке нефротоксичного потенциала новых лекарственных веществ. На сегодняшний день оценку СКФ редко включают в рутинную практику токсикологических исследований, так как эту величину сложно измерить напрямую и ее, как правило, оценивают с использованием болюсно-инъецированных суррогатов (креатинин, инулин) или меченых радиоактивным изотопом молекул (йогексол). Однако все эндогенные фильтрационные биомаркеры имеют свои особенности, которые могут повлиять на точность оценки СКФ (канальцевая секреция, реабсорбция, внепочечный клиренс) [6].
Информативным является измерение электролитов (калий, натрий и хлор) в моче животных. Данные показатели можно использовать для дифференциальной диагностики преренальной азотемии и острого повреждения почек. Фракционная экскреция электролитов обычно используется для выявления недостаточности почечных канальцев, а у животных с гипонатриемией или гипокалиемией тест используют для определения роли почек в развитии этих состояний и в снижении уровня электролитов [7].
В последние годы достигнут значительный прогресс в поиске более чувствительных и специфичных биомаркеров для выявления острого повреждения почек (ОПП) из-за нефротоксического действия препаратов, при искусственном кровообращении или при возникновении острого канальцевого некроза. В 2008 году такие показатели, как молекула повреждения почек-1 (kidney injury molecule-1, KIM-1), альбумин, общий белок, β2-микроглобулин, кластерин, фактор трилистника 3 (trefoil factor 3, TFF-3) и цистатин C, были признаны Управлением по контролю за качеством продуктов питания и лекарственных средств (Food and Drug Administration, FDA)1 и Европейским агентством по лекарственным средствам (European Medicines Agency, EMA)2 в качестве высокочувствительных и специфичных биомаркеров мочи для мониторинга лекарственно-индуцированного повреждения почек в доклинических исследованиях, в первую очередь на грызунах (крысах), и в отдельных случаях в клинических исследованиях. В большинстве случаев новые биомаркеры были более чувствительными и специфичными при повреждении почек по сравнению с мочевиной и креатинином. KIM-1, альбумин, кластерин и TFF-3 были одобрены FDA для использования в качестве биомаркеров лекарственно-индуцированных острых изменений почечных канальцев, а общий белок, β2-микроглобулин и цистатин С — для использования в качестве биомаркеров лекарственно-индуцированных острых изменений клубочков, повреждения и (или) нарушения реабсорбции почечных канальцев. В 2010 г. FDA квалифицировало еще несколько биомаркеров лекарственной нефротоксичности у крыс — кластерин мочи, почечный папиллярный антиген (Renal Papillary Antigen 1, RPA-1) и альфа-глутатион S-трансферазу (α-glutathione S-transferase, α-GST)3.
Данные об используемых в настоящее время биомаркерах оценки почечного поражения в доклинических исследованиях, а также их преимущества и ограничения приведены в таблицах 1, 2.
Таблица 1. Характеристики основных маркеров поражения почек,
используемых в доклинических исследованиях
Table 1. Characteristics of the primary markers of kidney injury used in preclinical studies
|
Маркер Marker |
Общая информация General information |
Локализация в нефроне Localisation in the nephron |
Биоматериал Biomaterial |
Характер повреждения почек Course of kidney injury |
Тип поражения почек Type of kidney injury |
Источник литературы References |
|
Общий белок Total protein |
Средние и высокомолекулярные белки. Высокая прогностическая ценность, используются у большого количества лабораторных животных как маркеры острого и хронического поражения почек These markers are medium and high molecular weight proteins of high prognostic significance. They are actively used to detect acute kidney injury (AKI) and chronic kidney disease in a large number of laboratory animals |
Клубочек, проксимальный извитой каналец, дистальный извитой каналец Glomerulus, proximal and distal convoluted tubules |
Сыворотка крови, моча Serum, urine |
Острое, хроническое Acute, chronic |
Структурное и клеточное повреждение, поражение клубочка и канальцев Structural and cellular damage, damage to the glomerulus and tubules |
[8–13] |
|
Альбумин Albumin |
||||||
|
β2-микроглобулин β2-microglobulin |
Белок, который обнаруживается в каждой ядросодержащей клетке и образует компонент легкой цепи антигенов гистосовместимости класса I. В норме фильтруется через клубочки, а затем почти полностью реабсорбируется в проксимальных канальцах. Повышенная экскреция с мочой является ранним маркером повреждения. Отмечена низкая стабильность при комнатной температуре и в кислой моче β2-microglobulin is a protein present in every nucleated cell. This protein forms the light chain subunit of class I histocompatibility antigens. Normally, β2-microglobulin is filtered through the glomeruli and then almost completely reabsorbed in the proximal tubules. An increase in its urinary excretion is an early marker of renal injury. β2-microglobulin is characterised by poor stability at room temperature and in acidic urine |
Клубочек, проксимальный извитой каналец Glomerulus, proximal convoluted tubule |
Моча Urine |
Острое Acute |
Структурное и клеточное повреждение, поражение проксимальных канальцев при нормальной функции клубочков Structural and cellular damage, damage to the proximal tubules in normal glomerular function |
[14–21] |
|
Молекула повреждения почек-1 (KIM-1) Kidney injury molecule-1 (KIM-1) |
Трансмембранный гликопротеин, в норме присутствует в почечной ткани в минимальном количестве, его экспрессия повышается после острого повреждения почек. Определяется в биоматериале раньше, чем креатинин и мочевина KIM-1 is a transmembrane glycoprotein. Its presence in normal renal tissue is minimal, but its expression increases following AKI. KIM-1 can be detected in biological samples earlier than creatinine and urea |
Проксимальный извитой каналец Proximal convoluted tubule |
Сыворотка крови, моча Serum, urine |
Острое Acute |
Структурное и клеточное повреждение, поражение тубулоинтерстиция Structural and cellular damage, tubulointerstitial injury |
[10][22–33] |
|
Кластерин Clusterin |
Димерный гликопротеин. В почках оказывает антиапоптотическое действие и обеспечивает защиту клеток, рециркуляцию липидов, прикрепление клеток и агрегацию. Экспрессия возрастает после нарушений различной этиологии. Не фильтруется через клубочки в норме Clusterin is a dimeric glycoprotein that has an anti-apoptotic effect in the kidneys, contributing to cell protection, lipid recycling, cell attachment, and cell aggregation. The expression of clusterin increases after injury of different aetiology. Normally, clusterin is not filtered through the glomeruli |
Проксимальный извитой каналец, дистальный извитой каналец, собирательные трубочки Proximal and distal convoluted tubules, collecting tubules |
Моча Urine |
Острое Acute |
Структурное и клеточное поражение, тубулярная регенерация Structural and cellular damage, tubular regeneration |
[17][34–43] |
|
Остеопонтин Osteopontin |
Фосфопротеин внеклеточного матрикса. Ингибирует активность синтазы закиси азота и снижает выработку активных форм азота. Обладает нефропротективным действием и может рассматриваться как косвенный биомаркер окислительного повреждения почечных канальцев. Концентрация повышается в ответ на повреждение Osteopontin is a phosphoprotein of the extracellular matrix. It inhibits the activity of nitrous oxide synthase, thereby reducing the production of reactive nitrogen species. Osteopontin has a nephroprotective effect. Osteopontin can be considered as an indirect biomarker of oxidative damage in renal tubules; its levels rise in response to injury |
Проксимальный извитой каналец, петля Генле, дистальный извитой каналец Proximal and distal convoluted tubules, Henle loop |
Моча Urine |
Острое, хроническое Acute, chronic |
Повреждение почечных канальцев Damage to the renal tubules |
[17][34–43] |
|
Альфа-глутатион S-трансфераза (α-GST) Alpha-glutathione S-transferase (α-GST) |
Цитозольный фермент, 2% растворимого белка почечных канальцев. Высоко индуцируется в ответ на повреждения различной этиологии. Высвобождается исключительно в мочу. Ранний индикатор повреждения. В настоящее время требует более подробного изучения на широком количестве видов лабораторных животных. Плохая стабильность в моче A-GST is a cytosolic enzyme that constitutes 2% of the soluble protein content in the renal tubules and is highly induced in response to renal injury. It is exclusively released into urine during injury, which makes it an early indicator of damage. Currently, α-GST requires further investigation in a wide range of laboratory animal species. This marker is characterised by poor stability in urine |
Проксимальный извитой каналец Proximal convoluted tubule |
Моча Urine |
Острое Acute |
Повреждение проксимального канальца Damage to the proximal tubule |
[17][29][44–47] |
|
Цистатин С Cystatin C |
Белок массой 13 кДа, один из наиболее важных внеклеточных ингибиторов цистеиновых протеаз, продуцируется всеми ядросодержащими клетками, свободно фильтруется клубочками и увеличивается в моче вследствие дисфункции канальцев. Высокая прогностическая ценность. Определяется в биоматериале раньше, чем креатинин и мочевина Cystatin C is a 13 kDa protein, one of the most important extracellular inhibitors of cysteine proteases. It is produced by all nucleated cells. It is freely filtered by the glomeruli. The urinary levels of cystatin C increase in tubular dysfunction. This marker has high prognostic significance. Cystatin C can be detected in biological samples earlier than creatinine and urea |
Проксимальный извитой каналец Proximal convoluted tubule |
Сыворотка крови, моча Serum, urine |
Острое, хроническое Acute, chronic |
Дисфункция канальцев Dysfunction of the tubules |
[48–55] |
|
Липокалин, ассоциированный с желатиназой нейтрофилов (липокалин 2, NGAL) Neutrophil gelatinase-associated lipocalin (lipocalin-2, NGAL) |
Белок массой 25 кДа, принадлежит к семейству липокалинов. Синтезируется в эпителиальных клетках в условиях воспаления или злокачественного новообразования. В сыворотке крови и моче является чувствительным и специфичным биомаркером для прогнозирования острого поражения почек NGAL is a 25 kDa protein from the lipocalin family. It is produced in epithelial cells during inflammation or malignant conditions. It is a sensitive and specific biomarker detected in serum and urine for predicting AKI |
Проксимальный и дистальный извитые канальцы Proximal and distal convoluted tubules |
Сыворотка крови, моча Serum, urine |
Острое Acute |
Повреждение канальцев Damage to the tubules |
[34–61] |
|
N-ацетил-β-D- глюкозаминидаза (NAG) N-acetyl-beta-D-glucosaminidase (NAG) |
Лизосомальный фермент массой более 130 кДа, присутствует в эпителиальных клетках канальцев. Высокая активность зафиксирована в почках, печени, селезенке, плаценте, слизистой оболочке желудка и кишечника, в тканях, подвергающихся неопластической трансформации. Концентрация в моче возрастает при различных патологических процессах NAG is a lysosomal enzyme with a molecular mass of over 130 kDa, which is present in tubular epithelial cells. NAG is highly active in the kidneys, liver, spleen, placenta, gastric and intestinal mucosa, and tissues undergoing neoplastic transformation. Its urinary levels increase in different pathological processes |
Проксимальный извитой каналец Proximal convoluted tubule |
Моча Urine |
Острое Acute |
Повреждение проксимального канальца Damage to the proximal tubule |
[17][62–71] |
|
Белок, связывающий жирные кислоты 1 (FABP1) L-type fatty acid binding protein 1 (FABP1) |
Связывает жирные кислоты и транспортирует их в митохондрии или пероксисомы, где они метаболизируются посредством β-окисления и обеспечивают энергией эпителиальные клетки канальцев. Концентрация повышается в моче при наличии большого количества патологических процессов FABP1 binds fatty acids and transports them to mitochondria or peroxisomes, where the fatty acids are metabolised by β-oxidation and provide energy to epithelial tubule cells. The urinary levels of this marker increase in a wide variety of pathological processes |
Проксимальный и дистальный извитые канальцы Proximal and distal convoluted tubules |
Моча Urine |
Острое, хроническое Acute, chronic |
Повреждение проксимального канальца Damage to the proximal tubule |
[62–76] |
|
Фактор трилистника 3 (TFF-3) Trefoil factor 3 (TFF-3) |
Муцин-ассоциированный белок. Экспрессируется в ответ на повреждение канальцев нефрона в моче и сыворотке. В настоящий момент прогностическая ценность является невысокой TFF-3 is a mucin-associated protein released into urine and serum in response to injury of nephron tubules. At the moment, its prognostic significance is low |
Проксимальный и дистальный извитые канальцы, собирательные трубочки Proximal and distal convoluted tubules, collecting tubules |
Сыворотка крови, моча Serum, urine |
Хроническое Chronic |
Дисфункция канальцев Dysfunction of the tubules |
[10][46][77][78] |
|
Нетрин-1 Netrin-1 |
Ламининоподобная молекула. Почки имеют высокий уровень экспрессии нетрина. Экспрессия увеличивается на ранних стадиях в канальцах во время ишемического острого поражения почек Netrin-1 is a laminin-like molecule. The kidneys have a high level of netrin-1 expression, which increases in the tubules in early ischaemic AKI |
Проксимальный извитой каналец Proximal convoluted tubule |
Моча Urine |
Острое, хроническое Acute, chronic |
Структурное и клеточное повреждение Structural and cellular damage |
[79–82] |
|
Кальбиндин Calbindin |
Высокоаффинные кальций-связывающие белки. Недостаточно данных по прогностической ценности в доклинических исследованиях Calbindins are high-affinity calcium-binding proteins. There is little data on their prognostic significance in preclinical studies |
Дистальный извитой каналец, собирательные трубочки Distal convoluted tubule, collecting tubules |
Сыворотка крови, моча Serum, urine |
Острое, хроническое Acute, chronic |
Поражение дистального извитого канальца Damage to the distal convoluted tubule |
[77][83][84] |
Таблица составлена авторами / The table is prepared by the authors
Таблица 2. Возможность использования основных маркеров поражения почек
у различных видов лабораторных животных
Table 2. Applicability of the primary markers of kidney injury
to various laboratory animal species
|
Маркер Marker |
Источник литературы References |
Тест-система in vivo In vivo test system |
|||||||
|
Мышь Mouse |
Крыса Rat |
Кролик Rabbit |
Хорек Ferret |
Собака Dog |
Кошка Cat |
Карликовая свинья Miniature pig |
Обезьяна Monkey |
||
|
Общий белок Total protein |
[8–13] |
+/– |
+/– |
+ |
+ |
+ |
+ |
+ |
+ |
|
Альбумин Albumin |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
|
β2-микроглобулин β2-microglobulin |
[14–21] |
? |
+/– |
? |
? |
+/– |
? |
? |
? |
|
Молекула повреждения почек-1 (KIM-1) Kidney injury molecule-1 (KIM-1) |
[10][22–33] |
+ |
+ |
+ |
? |
+/– |
+ |
? |
? |
|
Кластерин Clusterin |
[17][34–43] |
? |
+ |
? |
? |
+ |
? |
? |
? |
|
Остеопонтин Osteopontin |
[17][34–43] |
+ |
+ |
? |
? |
+ |
? |
? |
? |
|
Альфа-глутатион S-трансфераза (α-GST) Alpha-glutathione S-transferase (α-GST) |
[17][29, 44–47] |
? |
+/– |
? |
? |
? |
? |
? |
? |
|
Цистатин С Cystatin C |
[48–55] |
+ |
+ |
? |
? |
+ |
+ |
+ |
+ |
|
Липокалин, ассоциированный с желатиназой нейтрофилов (липокалин 2, NGAL) Neutrophil gelatinase-associated lipocalin (lipocalin-2, NGAL) |
[34–61] |
+ |
+ |
+ |
? |
+ |
? |
+ |
+ |
|
N-ацетил-β-D- глюкозаминидаза (NAG) N-acetyl-beta-D-glucosaminidase (NAG) |
[17][62–71] |
? |
+/– |
+ |
? |
+/– |
+/– |
? |
+ |
|
Белок, связывающий жирные кислоты 1 (FABP1) L-type fatty acid binding protein 1 (FABP1) |
[62–76] |
+ |
+ |
? |
? |
+ |
+ |
? |
+/– |
|
Фактор трилистника 3 (TFF-3) Trefoil factor 3 (TFF-3) |
[10][46][77][78] |
+/– |
? |
? |
? |
? |
? |
? |
? |
|
Нетрин-1 Netrin-1 |
[79–82] |
+ |
+ |
? |
? |
? |
? |
? |
? |
|
Кальбиндин Calbindin |
[77][83][84] |
? |
+ |
? |
? |
? |
? |
? |
? |
Таблица составлена авторами / The table is prepared by the authors
Примечание. «+» — показатель изучался на данном виде лабораторных животных, зарегистрирована связь между функциональным поражением мочевыделительной системы и изменением концентрации маркера; «+/–» — показатель изучался на данном виде лабораторных животных, имеются противоречивые данные о связи между функциональным поражением мочевыделительной системы и изменением концентрации маркера; «?» — неизвестно, проводилось ли исследование, данные в ходе подготовки обзора не были найдены.
Note. +, this marker has been studied in this laboratory animal species, and a causal relationship has been established between a functional impairment of the urinary system and a change in the concentration of the marker; +/–, this marker has been studied in this laboratory animal species, but there are conflicting data on the relationship between functional impairments of the urinary system and changes in the concentration of the marker; ?, no relevant studies were found in the making of this review.
Представленные в таблицах данные позволяют выбрать показатели, которые могут быть использованы в качестве биомаркеров поражения почек. Так, для оценки поражения клубочка нефрона наиболее информативными маркерами являются общий белок и альбумин [8–13]. В целом изменение уровня белка в моче остается одним из наиболее надежных методов мониторинга прогрессирования заболевания клубочков у животных. Уровни альбумина в моче, как правило, соответствуют изменению общего белка у большинства видов. А протеинурия является наиболее часто используемым маркером повреждения и дисфункции почек как в клинике, так и в доклинических исследованиях.
Другим биомаркером, также используемым для обнаружения раннего нарушения клубочковой фильтрации, является β2-микроглобулин [14–21]. К сожалению, его значимость в качестве биомаркера в настоящее время ограничена ввиду нестабильности этого белка в моче. При этом его быстрая денатурация наблюдается при комнатной температуре и в моче с pH менее 6,0. β2-микроглобулин использовался в качестве биомаркера в исследованиях на грызунах и собаках, однако связь между увеличением его концентрации в моче и развитием клинического острого поражения почек в настоящее время остается неопределенной. Несмотря на имеющиеся ограничения, β2-микроглобулин может использоваться в качестве вспомогательного маркера.
Выявлены маркеры повреждения проксимальных и дистальных канальцев почек, которые особенно уязвимы к обструктивным, ишемическим, гипоксическим, окислительным и метаболическим нарушениям, приводящим к гибели клеток. Наиболее показательными являются KIM-1 [10][22–33], NGAL [34–61] и цистатин С [48–55]. Согласно представленным в литературе данным эти биомаркеры успешно использованы в доклинических исследованиях по оценке нефротоксичности, в которых индукторами патологии являлись цисплатин, фолиевая кислота, амфотерицин, гентамицин, ртуть, хром, кадмий, йодсодержащие контрастные вещества, ванкомицин, циклоспорин, а также некоторые методы хирургического воздействия. Прогностическая значимость рассматриваемых маркеров для оценки нефротоксичности успешно изучалась на большом количестве лабораторных животных: грызунах, хищниках, приматах и свиньях, что свидетельствует о перспективности использования этих маркеров в доклинических исследованиях [10][22–55]. Определение данных показателей возможно осуществить как в сыворотке крови, так и моче.
Возможно внедрение в практику доклинических исследований и других маркеров. Так, L-FABP [62–76] уже успешно использовался в ряде исследований на грызунах и хищниках, но не показал значительного результата на свиньях или приматах. Другим заслуживающим внимания показателем является кластерин [17][34–43]. Имеющиеся данные литературы свидетельствуют, что кластерин наряду с KIM-1 является самым ранним маркером повреждения проксимальных канальцев. Однако важно отметить, что информация о кластерине, известная на данный момент, получена либо в исследованиях на грызунах (крысы), либо на собаках, что ограничивает его прогностическую ценность для других видов животных и трансляционность в клинические исследования. Также кластерин может рассматриваться в качестве маркера повреждения дистального извитого канальца и собирательных трубочек.
Остеопонтин [17][77–92] считается перспективным показателем нефротоксичности при поражении петли Генле и дистального отдела нефрона, но его применение в настоящее время также ограничено исследованиями на грызунах и собаках. Это может указывать на наличие пробелов в понимании биологической роли данного маркера.
К вспомогательным показателям поражения проксимального канальца также можно отнести нетрин-1 [79–82]. Прогностическое значение его как биомаркера острого и субхронического лекарственного повреждения почек является перспективным, но недостаточно изученным, к тому же ограничивается только исследованиями на грызунах.
Информация об α-GST [17][29, 44–47] и TFF-3 [10][46][77][78] как о маркерах нефротоксичности в настоящее время носит спорный характер, и часто данные одних исследований противоречат другим, даже на одних и тех же видах животных. Отмечено, что концентрация α-GST в исследованиях на грызунах либо не изменялась после введения нефротоксикантов, либо увеличивалась. А концентрация маркера TFF-3 снижается при наличии почечной патологии у грызунов, но у людей, наоборот, — повышается. Очевидно, что в настоящий момент необходимы дополнительные исследования в различных контекстах поражения функции почек на разных видах животных, чтобы подтвердить релевантность этих биомаркеров.
Отдельно следует обсудить маркер NAG [17][62–71], который широко применяется в доклинических исследованиях на разных видах лабораторных животных. Его прогностическая значимость подвергается сомнению, особенно на грызунах и хищниках, однако в ряде работ на приматах рассматриваемый фермент успешно использовался в качестве маркера нефротоксичности. Возможно, ему присуща высокая видоспецифичность, и он в большей степени подходит именно для приматов.
Белок кальбиндин [77][83][84] может выступать в роли маркера повреждения дистального отдела нефрона, а также собирательных трубочек. Имеется ряд сообщений об успешном применении данного маркера на грызунах, но каких-либо других значимых публикаций и исследований на различных видах лабораторных животных в ходе подготовки обзора найдено не было, и это может свидетельствовать, что данный маркер еще мало изучен.
Следует отметить, что в большинстве исследований оценивали не только изменение концентрации интересующего маркера до и после введения нефротоксиканта, но еще и его соотношение с креатинином (KIM-1/креатинин, L-FABP/креатинин, NGAL/креатинин) [9][12][16][83][93–95]. Простое определение интересующего показателя в порциях мочи может давать вариабельные результаты, поскольку на концентрацию маркера могут значительно влиять питьевой режим, стресс и ряд других факторов. Поэтому более надежным является тестирование образцов мочи, взятых в стандартных условиях, с одновременным определением концентрации креатинина и расчетом соотношения. Нормализация по креатинину (изменения концентрации которого в моче отражают различия ее концентрированности) устраняет вклад этого фактора в вариабельность оценки.
В настоящее время ведется поиск и других высокоэффективных маркеров повреждения почек, достоверность которых пока еще требует дополнительных исследований. К таким маркерам относятся подоцин, подокаликцин, нефрин, уромодулин, миндин, CR1 (Complement Receptor 1), CD59 (Cluster of Differentiation 59), CD80 (Cluster of Differentiation 80), мочевые экзосомы и другие [96][97]. В настоящий момент информация о перечисленных показателях как о маркерах оценки нефротоксичности является спорной или недостаточной.
Количественное определение биомаркеров поражения почек в большинстве случаев проводят методом иммуно-ферментного анализа, который является дорогостоящим, что ограничивает его использование в рутинной практике. Поэтому одним из оптимальных решений при планировании исследования будет являться поиск научной литературы, определение релевантного вида или видов лабораторных животных, разработка дизайна исследования, выбор биохимических показателей (ионы, креатинин, мочевина, СКФ) и нескольких (1–3) необходимых биомаркеров, которые в наибольшей степени могут оказаться полезными в исследовании.
Обобщенный перечень методов оценки функционального состояния мочевыделительной системы на доклиническом этапе представлен на рисунке 1. Оценку нефротоксичности в доклинических исследованиях целесообразно начинать с малоинвазивных лабораторных и инструментальных методов [98].
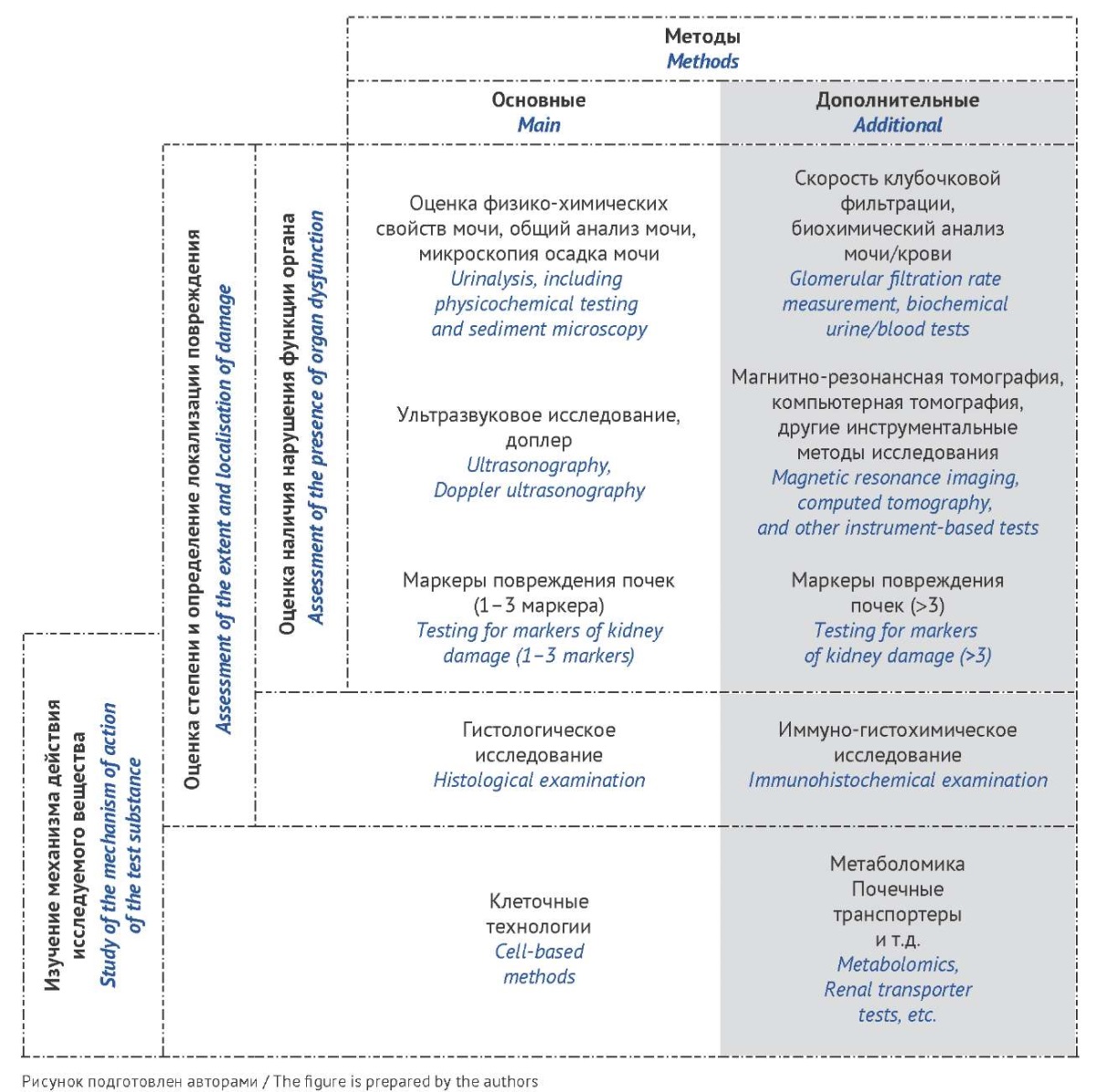
Рис 1. Схема комплексной оценки функционального состояния
мочевыделительной системы лабораторных животных
Fig 1. Schematic representation of the comprehensive assessment
of urinary system function in laboratory animals
ЗАКЛЮЧЕНИЕ
Необходимым этапом в ходе изучения безопасности любого лекарственного препарата является оценка его влияния на функциональное состояние органов мочевыделительной системы.
Оптимальным вариантом выявления нарушений функции почек является комплексный подход, в ходе которого будут постепенно задействованы малоинвазивные лабораторные и инструментальные методы с переходом к методам определения специфических маркеров повреждения почек, которые в совокупности с дополнительными патоморфологическими исследованиями тканей органов мочевыделительной системы животных позволят оценить степень и локализацию поражения.
На основании систематизации данных литературы о маркерах нефротоксичности, анализа преимуществ их использования и возможных ограничений можно сделать вывод, что на сегодняшний день наиболее часто используемыми и прогностически верными маркерами острого повреждения почек в доклинических исследованиях являются цистатин С, альбумин, общий белок, KIM-1, NGAL и кластерин. Маркерами подострого/субхронического повреждения почек являются как вышеперечисленные, так и скорость клубочковой фильтрации, креатинин и мочевина. Маркерами хронического повреждения почек: общий белок, альбумин, скорость клубочковой фильтрации, креатинин, мочевина, а также маркеры с поправкой на вид лабораторного животного (остеопонтин — грызуны и хищники, нетрин-1 — грызуны). Конечно, полученная на основании данных литературы информация требует многократного практического подтверждения.
Дизайн исследования следует выбирать в зависимости от целей работы, вида или видов лабораторных животных, их количества, специфики тестируемого объекта. Предложенный подход является оптимальным при разработке дизайна исследования, предполагающего оценку нефротоксического потенциала изучаемого вещества.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: М.В. Мирошников — сбор, анализ и систематизация данных литературы, написание текста и оформление рукописи; К.Т. Султанова — анализ и обобщение данных литературы, оформление, редактирование и переработка текста рукописи; М.Н. Макарова — идея работы, критический пересмотр текста рукописи, утверждение окончательного варианта рукописи для публикации; Н.М. Фаустова, С.О. Хан и Е.А. Лосева — сбор и систематизация данных литературы.
Authors’ contributions. All authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Mikhail V. Miroshnikov collected, analysed, and systematised literature data; drafted and designed the manuscript. Kira T. Sultanova analysed and summarised literature data; designed, edited, and revised the manuscript. Marina N. Makarova conceived the study idea, critically revised the manuscript, and approved the final version of the manuscript for publication. Natalia M. Faustova, Stanislav O. Khan, and Ekaterina A. Loseva collected and systematised literature data.
1. Blank M, Felice AD, Goodsaid F, Harlow P, Hausner E, Jacobson-Kram D, et al. Review of qualification data for biomarkers of nephrotoxicity submitted by the Predictive Safety Testing Consortium. U.S. Food and Drug Administration. 2009.
Woodcock J, Jenkins J. Review submission of the qualification of seven biomarkers of drug-induced nephrotoxicity in rats. 2008
2. European Medicines Agency. Final conclusions on the pilot joint EMEA/FDA VXDS experience on qualification of nephrotoxicity biomarkers. 2008.
3. Blank M, Cai F, DeFelice A, Harlow P, Hausner E, Thompson A, et al. Review of qualification data for biomarkers of nephrotoxicity submitted by the ILSI-HESI Nephrotoxicity Working Group. 2010.
Список литературы
1. Смирнов АВ, Наточин ЮВ. Нефрология: фундаментальная и клиническая. Нефрология. 2019;23(4):9–26. https://doi.org/10.24884/1561-6274-2019-23-4-9-26
2. Брюханов ВМ, Зверев ЯФ, Лампатов ВВ, Жариков АЮ. Методические подходы к изучению функции почек в эксперименте на животных. Нефрология. 2009;13(3):52–62. EDN: LKFRPV
3. Al-Naimi MS, Rasheed HA, Hussien NR, Al-Kuraishy HM, Al-Gareeb AI. Nephrotoxicity: role and significance of renal biomarkers in the early detection of acute renal injury. J Adv Pharm Technol Res. 2019;10(3):95–9. https://doi.org/10.4103/japtr.JAPTR_336_18
4. Zhang WR, Parikh CR. Biomarkers of acute and chronic kidney disease. Annu Rev Physiol. 2019;81:309–33. https://doi.org/10.1146/annurev-physiol-020518-114605
5. Vaidya VS, Ferguson MA, Bonventre JV, Ferguson MA, Bonventre JV. Biomarkers of acute kidney injury. Annu Rev Pharmacol Toxicol. 2008;48:463–93. https://doi.org/10.1146/annurev.pharmtox.48.113006.094615
6. Gu X, Yang B. Methods for assessment of the glomerular filtration rate in laboratory animals. Kidney Dis (Basel). 2022;8(5):381–91. https://doi.org/10.1159/000525049
7. Waldrop JE. Urinary electrolytes, solutes, and osmolality. Vet Clin North Am Small Anim Pract. 2008;38(3):503–12. https://doi.org/10.1016/j.cvsm.2008.01.011
8. Hard GC. Species comparison of the content and composition of urinary proteins. Food Chem Toxicol. 1995;33(9):731–46. https://doi.org/10.1016/0278-6915(95)00041-y
9. Maddens B, Heiene R, Smets P, Svensson M, Aresu L, Van der Lugt J, et al. Evaluation of kidney injury in dogs with pyometra based on proteinuria, renal histomorphology, and urinary biomarkers. J Vet Intern Med. 2011;25(5):1075–83. https://doi.org/10.1111/j.1939-1676.2011.0772.x
10. Griffin BR, Faubel S, Edelstein CL. Biomarkers of drug-induced kidney toxicity. Ther Drug Monit. 2019;41(2):213–26. https://doi.org/10.1097/FTD.0000000000000589
11. Sato T, Ishikawa A, Homma Y. Effect of reduced form of coenzyme Q10 on cyclosporine nephrotoxicity. Exp Clin Transplant. 2013;11(1):17–20. https://doi.org/10.6002/ect.2012.0126
12. Abdel-Latif RG, Morsy MA, El-Moselhy MA, Khalifa MA. Sildenafil protects against nitric oxide deficiency-related nephrotoxicity in cyclosporine A treated rats. Eur J Pharmacol. 2013;705(1–3):126–34. https://doi.org/10.1016/j.ejphar.2013.02.039
13. Fuchs TC, Hewitt P. Preclinical perspective of urinary biomarkers for the detection of nephrotoxicity: what we know and what we need to know. Biomark Med. 2011;5(6):763–79. https://doi.org/10.2217/bmm.11.86
14. Ennulat D, Adler S. Recent successes in the identification, development, and qualification of translational biomarkers: the next generation of kidney injury biomarkers. Toxicol Pathol. 2015;43(1):62–9. https://doi.org/10.1177/0192623314554840
15. Kim YD, Yim DH, Eom SY, Moon SI, Park CH, Kim GB, et al. Temporal changes in urinary levels of cadmium, N-acetyl-β-d-glucosaminidase and β2-microglobulin in individuals in a cadmium-contaminated area. Environ Toxicol Pharmacol. 2015;39(1):35–41. https://doi.org/10.1016/j.etap.2014.10.016
16. Viau C, Bernard A, Ouled A, Lauwerys R. Determination of rat β2-microglobulin in urine and in serum. II. Application of its urinary measurement to selected nephrotoxicity models. J Appl Toxicol. 1986;6(3):191–5. https://doi.org/10.1002/jat.2550060310
17. Vlasakova K, Erdos Z, Troth SP, McNulty K, Chapeau-Campredon V, Mokrzycki N, et al. Evaluation of the relative performance of 12 urinary biomarkers for renal safety across 22 rat sensitivity and specificity studies. Toxicol Sci. 2014;138(1):3–20. https://doi.org/10.1093/toxsci/kft330
18. Kuwata K, Nakamura I, Ide M, Sato H, Nishikawa S, Tanaka M. Comparison of changes in urinary and blood levels of biomarkers associated with proximal tubular injury in rat models. J Toxicol Pathol. 2015;28(3):151–64. https://doi.org/10.1293/tox.2014-0039
19. Dieterle F, Perentes E, Cordier A, Roth DR, Verdes P, Grenet O, et al. Urinary clusterin, cystatin C, β2-microglobulin and total protein as markers to detect drug-induced kidney injury. Nat Biotechnol. 2010;28(5):463–9. https://doi.org/10.1038/nbt.1622
20. Nabity MB, Lees GE, Cianciolo R, Boggess MM, Steiner JM, Suchodolski JS. Urinary biomarkers of renal disease in dogs with X-linked hereditary nephropathy. J Vet Intern Med. 2012;26(2):282–93. https://doi.org/10.1111/j.1939-1676.2012.00891.x
21. Vinge L, Lees GE, Nielsen R, Kashtan CE, Bahr A, Christensen EI. The effect of progressive glomerular disease on megalin-mediated endocytosis in the kidney. Nephrol Dial Transplant. 2010;25(8):2458–67. https://doi.org/10.1093/ndt/gfq044
22. Ozer JS, Dieterle F, Troth S, Perentes E, Cordier A, Verdes P, et al. A panel of urinary biomarkers to monitor reversibility of renal injury and a serum marker with improved potential to assess renal function. Nat Biotechnol. 2010;28(5):486–94. https://doi.org/10.1038/nbt.1627
23. Vaidya VS, Ramirez V, Ichimura T, Bobadilla NA, Bonventre JV. Urinary kidney injury molecule-1: a sensitive quantitative biomarker for early detection of kidney tubular injury. Am J Physiol Renal Physiol. 2006;290(2):F517–29. https://doi.org/10.1152/ajprenal.00291.2005
24. Ichimura T, Hung CC, Yang SA, Stevens JL, Bonventre JV. Kidney injury molecule-1: a tissue and urinary biomarker for nephrotoxicant-induced renal injury. Am J Physiol Renal Physiol. 2004;286(3):F552–63. https://doi.org/10.1152/ajprenal.00285.2002
25. Zhou Y, Vaidya VS, Brown RP, Zhang J, Rosenzweig BA, Thompson KL, et al. Comparison of kidney injury molecule-1 and other nephrotoxicity biomarkers in urine and kidney following acute exposure to gentamicin, mercury, and chromium. Toxicol Sci. 2008;101(1):159–70. https://doi.org/10.1093/toxsci/kfm260
26. Zhao X, Zhang Y, Li L, Mann D, Imig JD, Emmett N, et al. Glomerular expression of kidney injury molecule-1 and podocytopenia in diabetic glomerulopathy. Am J Nephrol. 2011;34(3):268–80. https://doi.org/10.1159/000330187
27. Dong Y, Zhang Q, Wen J, Chen T, He L, Wang Y, et al. Ischemic duration and frequency determines AKI-to-CKD progression monitored by dynamic changes of tubular biomarkers in IRI mice. Front Physiol. 2019;10:153. https://doi.org/10.3389/fphys.2019.00153
28. Kramer AB, van Timmeren MM, Schuurs TA, Vaidya VS, Bonventre JV, van Goor H, et al. Reduction of proteinuria in adriamycin-induced nephropathy is associated with reduction of renal kidney injury molecule (KIM-1) over time. Am J Physiol Renal Physiol. 2009;296(5):F1136-45. https://doi.org/10.1152/ajprenal.00541.2007
29. Rouse RL, Zhang J, Stewart SR, Rosenzweig BA, Espandiari P, Sadrieh NK. Comparative profile of commercially available urinary biomarkers in preclinical drug-induced kidney injury and recovery in rats. Kidney Int. 2011;79(11):1186–97. https://doi.org/10.1038/ki.2010.463
30. Jeong M, Kim YW, Min JR, Kwon M, Han BS, Kim JG, et al. Kidney toxicity induced by 13 weeks exposure to the fruiting body of Paecilomyces sinclairii in rats. Toxicol Res. 2012;28(3):179–85. https://doi.org/10.5487/TR.2012.28.3.179
31. Hussein AM, Malek HA, Saad MA. Renoprotective effects of aliskiren on adenine-induced tubulointerstitial nephropathy: possible underlying mechanisms. Can J Physiol Pharmacol. 2016;94(8):829–37. https://doi.org/10.1139/cjpp-2015-0364
32. Lippi I, Perondi F, Meucci V, Bruno B, Gazzano V, Guidi G. Clinical utility of urine kidney injury molecule-1 (KIM-1) and gamma-glutamyl transferase (GGT) in the diagnosis of canine acute kidney injury. Vet Res Commun. 2018;42(2):95–100. https://doi.org/10.1007/s11259-018-9711-7
33. Ennulat D, Ringenberg M, Frazier KS. Toxicologic Pathology Forum Opinion Paper*: recommendations for a tiered approach to nonclinical mechanistic nephrotoxicity evaluation. Toxicol Pathol. 2018;46(6):636–46. https://doi.org/10.1177/0192623318788302
34. Kharasch ED, Schroeder JL, Bammler T, Beyer R, Srinouanprachanh S. Gene expression profiling of nephrotoxicity from the sevoflurane degradation product fluoromethyl-2,2-difluoro-1-(trifluoromethyl) vinyl ether (“compound A”) in rats. Toxicol Sci. 2006;90(2):419–31. https://doi.org/10.1093/toxsci/kfj088
35. Rached E, Hoffmann D, Blumbach K, Weber K, Dekant W, Mally A. Evaluation of putative biomarkers of nephrotoxicity after exposure to ochratoxin A in vivo and in vitro. Toxicol Sci. 2008;103(2):371–81. https://doi.org/10.1093/toxsci/kfn040
36. Tsuchiya Y, Tominaga Y, Matsubayashi K, Jindo T, Furuhama K, Suzuki KT. Investigation on urinary proteins and renal mRNA expression in canine renal papillary necrosis induced by nefiracetam. Arch Toxicol. 2005;79(9):500–7. https://doi.org/10.1007/s00204-005-0666-4
37. Yoshida T, Kurella M, Beato F, Min H, Ingelfinger JR, Stears RL, et al. Monitoring changes in gene expression in renal ischemia-reperfusion in the rat. Kidney Int. 2002;61(5):1646–54. https://doi.org/10.1046/j.1523-1755.2002.00341.x
38. Correa-Rotter R, Hostetter TH, Manivel JC, Eddy AA, Rosenberg ME. Intrarenal distribution of clusterin following reduction of renal mass. Kidney Int. 1992;41(4):938–50. https://doi.org/10.1038/ki.1992.144
39. Ishii A, Sakai Y, Nakamura A. Molecular pathological evaluation of clusterin in a rat model of unilateral ureteral obstruction as a possible biomarker of nephrotoxicity. Toxicol Pathol. 2007;35(3):376–82. https://doi.org/10.1080/01926230701230320
40. Hidaka S, Kränzlin B, Gretz N, Witzgall R. Urinary clusterin levels in the rat correlate with the severity of tubular damage and may help to differentiate between glomerular and tubular injuries. Cell Tissue Res. 2002;310(3):289–96. https://doi.org/10.1007/s00441-002-0629-5
41. Harpur E, Ennulat D, Hoffman D, Betton G, Gautier JC, Riefke B, et al. Biological qualification of biomarkers of chemical-induced renal toxicity in two strains of male rat. Toxicol Sci. 2011;122(2):235–52. https://doi.org/10.1093/toxsci/kfr112
42. Eti S, Cheng CY, Marshall A, Reidenberg MM. Urinary clusterin in chronic nephrotoxicity in the rat. Proc Soc Exp Biol Med. 1993;202(4):487–90. https://doi.org/10.3181/00379727-202-43564
43. Zhou X, Ma B, Lin Z, Qu Z, Huo Y, Wang J, et al. Evaluation of the usefulness of novel biomarkers for drug-induced acute kidney injury in beagle dogs. Toxicol Appl Pharmacol. 2014;280(1):30–5. https://doi.org/10.1016/j.taap.2014.07.002
44. McMahon BA, Koyner JL, Murray PT. Urinary glutathione S-transferases in the pathogenesis and diagnostic evaluation of acute kidney injury following cardiac surgery: a critical review. Curr Opin Crit Care. 2010;16(6):550–5. https://doi.org/10.1097/MCC.0b013e32833fdd9a
45. Swain A, Turton J, Scudamore CL, Pereira I, Viswanathan N, Smyth R, et al. Urinary biomarkers in hexachloro-1: 3-butadiene-induced acute kidney injury in the female Hanover Wistar rat; correlation of α-glutathione S-transferase, albumin and kidney injury molecule-1 with histopathology and gene expression. J Appl Toxicol. 2011;31(4):366–77. https://doi.org/10.1002/jat.1624
46. Wadey RM, Pinches MG, Jones HB, Riccardi D, Price SA. Tissue expression and correlation of a panel of urinary biomarkers following cisplatin-induced kidney injury. Toxicol Pathol. 2014;42(3):591–602. https://doi.org/10.1177/0192623313492044
47. Chen Y, Brott D, Luo W, Gangl E, Kamendi H, Barthlow H, et al. Assessment of cisplatin-induced kidney injury using an integrated rodent platform. Toxicol Appl Pharmacol. 2013;268(3):352–61. https://doi.org/10.1016/j.taap.2013.01.032
48. Miyagawa Y, Takemura N, Hirose H. Evaluation of the measurement of serum cystatin C by an enzyme-linked immunosorbent assay for humans as a marker of the glomerular filtration rate in dogs. J Vet Med Sci. 2009;71(9):1169–76. https://doi.org/10.1292/jvms.71.1169
49. Wehner A, Hartmann K, Hirschberger J. Utility of serum cystatin C as a clinical measure of renal function in dogs. J Am Anim Hosp Assoc. 2008;44(3):131–8. https://doi.org/10.5326/0440131
50. Braun JP, Perxachs A, Chereau D, De La Farge F. Plasma cystatin C in the dog: reference values and variations with renal failure. Comp Clin Path. 2002;11:44–9. https://doi.org/10.1007/s580-002-8081-2
51. Togashi Y, Sakaguchi Y, Miyamoto M, Miyamoto Y. Urinary cystatin C as a biomarker for acute kidney injury and its immunohistochemical localization in kidney in the CDDP-treated rats. Exp Toxicol Pathol. 2012;64(7–8):797–805. https://doi.org/10.1016/j.etp.2011.01.018
52. Song S, Meyer M, Türk TR, Wilde B, Feldkamp T, Assert R, et al. Serum cystatin C in mouse models: a reliable and precise marker for renal function and superior to serum creatinine. Nephrol Dial Transplant. 2009;24(4):1157–61. https://doi.org/10.1093/ndt/gfn626
53. Song L, Wang, K, Yin J, Yang Y, Li B, Zhang D, et al. Traditional Chinese Medicine Fufang-Zhenzhu-Tiaozhi capsule prevents renal injury in diabetic minipigs with coronary heart disease. Chin Med. 2022;17(1):102. https://doi.org/10.1186/s13020-022-00648-x
54. Uchino H, Fujishima J, Fukuoka K, Iwakiri T, Kamikuri A, Maeda H, et al. Usefulness of urinary biomarkers for nephrotoxicity in cynomolgus monkeys treated with gentamicin, cisplatin, and puromycin aminonucleoside. J Toxicol Sci. 2017;42(5):629–40. https://doi.org/10.2131/jts.42.629
55. Yamaguchi I, Myojo K, Sanada H, Takami A, Suzuki Y, Imaizumi M, et al. Five-sixth nephrectomy in female common marmosets (Callithrix jacchus) as a chronic renal failure model — a longitudinal course of serum biochemical, hema tological and histopathological changes. J Toxicol Pathol. 2014;27(3–4):183–95. https://doi.org/10.1293/tox.2013-0055
56. Bolignano D, Donato V, Coppolino G, Campo S, Buemi A, Lacquaniti A, et al. Neutrophil gelatinase-associated lipocalin (NGAL) as a marker of kidney damage. Am J Kidney Dis. 2008;52(3):595–605. https://doi.org/10.1053/j.ajkd.2008.01.020
57. Lee YJ, Hu YY, Lin YS, Chang CT, Lin FY, Wong ML, et al. Urine neutrophil gelatinase-associated lipocalin (NGAL) as a biomarker for acute canine kidney injury. BMC Vet Res. 2012;8:248. https://doi.org/10.1186/1746-6148-8-248
58. Silberstein JL, Sprenkle PC, Su D, Power NE, Tarin TV, Ezell P, et al. Neutrophil gelatinase-associated lipocalin (NGAL) levels in response to unilateral renal ischaemia in a novel pilot two-kidney porcine model. BJU Int. 2013;112(4):517–25. https://doi.org/10.1111/bju.12066
59. Palm CA, Segev G, Cowgill LD, LeRoy BE, Kowalkowski KL, Kanakubo K, et al. Urinary neutrophil gelatinase-associated lipocalin as a marker for identification of acute kidney injury and recovery in dogs with gentamicin-induced nephrotoxicity. J Vet Intern Med. 2016;30(1):200–5. https://doi.org/10.1111/jvim.13819
60. Burt D, Crowell SJ, Ackley DC, Magee TV, Aubrecht J. Application of emerging biomarkers of acute kidney injury in development of kidney-sparing polypeptide-based antibiotics. Drug Chem Toxicol. 2014;37(2):204–12. https://doi.org/10.3109/01480545.2013.834360
61. Wang Y, Wang B, Qi X, Zhang X, Ren K. Resveratrol protects against post-contrast acute kidney injury in rabbits with diabetic nephropathy. Front Pharmacol. 2019;10:833. https://doi.org/10.3389/fphar.2019.00833
62. Bazzi C, Rizza V, Olivieri G, Casellato D, D’Amico G. Tubular reabsorption of high, middle and low molecular weight proteins according to the tubulo-interstitial damage marker N-acetyl-β-D-glucosaminidase in glomerulonephritis. J Nephrol. 2015;28(5):541–8. https://doi.org/10.1007/s40620-014-0139-z
63. Śliwińska-Mossoń M, Sobiech K, Dolezych B, Madej P, Milnerowicz H. N-acetyl-beta-d-glucosaminidase in tissues of rats chronically exposed to cadmium and treated with ozone. Ann Clin Lab Sci. 2019;49(2):193–203. PMID: 31028064
64. Bosomworth MP, Aparicio SR, Hay AW. Urine N-acetyl-beta-D-glucosaminidase — a marker of tubular damage? Nephrol Dial Transplantat. 1999;14(3):620–6. https://doi.org/10.1093/ndt/14.3.620
65. Hanbeyoğlu A, Kazez A, Üstündağ B, Akpolat N. Determination of urinary N-acetyl-β-D glucosaminidase (NAG) levels in experimental blunt renal trauma. Ulus Travma Acil Cerrahi Derg. 2011;17(6):475–81. https://doi.org/10.5505/tjtes.2011.57973
66. Suzuki CAM, Thomas BH, Mueller R. Evaluation of enzymuria as an indicator of amikacin-induced renal damage in guinea pigs. Toxicol Lett. 1992;62(1):101–14. https://doi.org/10.1016/0378-4274(92)90083-v
67. Türkmen M, Kavukcu S, Islekel H, Sarioğlu S, Akhunlar H, Gökden N, et al. Urinary N-acetyl-β-D-glucosaminidase activity in rabbits with experimental hypercalciuria. Pediatr Nephrol. 1997;11:481–4. https://doi.org/10.1007/s004670050321
68. Pressler BM. Clinical approach to advanced renal function testing in dogs and cats. Clin Lab Med. 2015;35(3):487–502. https://doi.org/10.1016/j.cll.2015.05.001
69. Adedeji AO, Sonee M, Chen Y, Lynch K, Peron K, King N, et al. Evaluation of novel urinary biomarkers in beagle dogs with Amphotericin B-induced kidney injury. Int J Toxicol. 2023;42(2):146–55. https://doi.org/10.1177/10915818221142542
70. Ruiz P, Durán Á, Duque FJ, González MA, Cristóbal JI, Nicolás P, et al. Urinary cystatin C and N-acetyl-beta-D-gluco saminidase (NAG) as early biomarkers for renal disease in dogs with leishmaniosis. Vet Parasitol. 2023;318:109930. https://doi.org/10.1016/j.vetpar.2023.109930
71. Gautier JC, Zhou X, Yang Y, Gury T, Qu Z, Palazzi X, et al. Evaluation of novel biomarkers of nephrotoxicity in Cynomolgus monkeys treated with gentamicin. Toxicol Appl Pharmacol. 2016;303:1–10. https://doi.org/10.1016/j.taap.2016.04.012
72. Watanabe A, Ohata K, Oikawa T, Sugaya T, Miyazaki M, Satoh H, et al. Preliminary study of urinary excretion of liver-type fatty acid-binding protein in a cat model of chronic kidney disease. Can J Vet Res. 2021;85(2):156–60.
73. Matsui K, Kamijo-Ikemorif A, Sugaya T, Yasuda T, Kimura K. Renal liver-type fatty acid binding protein (L-FABP) attenuates acute kidney injury in aristolochic acid nephrotoxicity. Am J Pathol. 2011;178(3):1021–32. https://doi.org/10.1016/j.ajpath.2010.12.002
74. Kamijo-Ikemori A, Ichikawa D, Matsui K, Yokoyama T, Sugaya T, Kimura K. Urinary L-type fatty acid binding protein (L-FABP) as a new urinary biomarker promulgated by the Ministry of Health, Labour and Welfare in Japan. Rinsho Byori. 2013;61(7):635–40 (In Japanese). PMID: 24205707
75. Yamamoto T, Noiri E, Ono Y, D o i K, Negishi K, Kamijo A, et al. Renal L-type fatty acid-binding protein in acute ischemic injury. J Am Soc Nephrol. 2007;18(11):2894–902. https://doi.org/10.1681/ASN.2007010097
76. Kanaguchi Y, Suzuki Y, Osaki K, Sugaya T, Horikoshi S, Tomino Y. Protective effects of L-type fatty acid-binding protein (L-FABP) in proximal tubular cells against glomerular injury in anti-GBM antibody-mediated glomerulonephritis. Nephrol Dial Transplant. 2011;26(11):3465–73. https://doi.org/10.1093/ndt/gfr110
77. Lin Z, Wan X, Zhang T, Huo H, Zhang X, Li K, et al. Trefoil factor 3: new highlights in chronic kidney disease research. Cell Signal. 2022;100:110470. https://doi.org/10.1016/j.cellsig.2022.110470
78. Yu Y, Jin H, Holder D, Ozer JS, Villarreal S, Shughrue P, et al. Urinary biomarkers trefoil factor 3 and albumin enable early detection of kidney tubular injury. Nat Biotechnol. 2010;28(5):470–7. https://doi.org/10.1038/nbt.1624
79. Reeves BW, Kwon O, Ramesh G. Netrin-1 and kidney injury. II. Netrin-1 is an early biomarker of acute kidney injury. Am J Physiol Renal Physiol. 2008;294(4):F731–8. https://doi.org/10.1152/ajprenal.00507.2007
80. Rajasundari A, Pays L, Mehlen P, Ramesh G. Netrin-1 overexpression in kidney proximal tubular epithelium ameliorates cisplatin nephrotoxicity. Lab Invest. 2011;91(12):1717–26. https://doi.org/10.1038/labinvest.2011.126
81. White JJ, Mohamed R, Jayakumar C, Ramesh G. Tubular injury markers netrin-1 is elevated early in experimental diabetes. J Nephrol. 2013;26(6):1055–64. https://doi.org/10.5301/jn.5000303
82. Bai J, Hao J, Zhang X, Cui H, Han J, Cao N. Netrin-1 attenuates the progression of renal dysfunction by blocking endothelial-to-mesenchymal transition in the 5/6 nephrectomy rat model. BMC Nephrol. 2016;17(1):47. https://doi.org/10.1186/s12882-016-0260-4
83. García-Martínez JD, Tvarijonaviciute A, Cerón JJ, Caldin M, Martínez-Subiela S. Urinary clusterin as a renal marker in dogs. J Vet Diagn Invest. 2012;24(2):301–6. https://doi.org/10.1177/1040638711435112
84. Son JY, Kang YJ, Kim KS, Kim TH, Lim SK, Lim HJ, et al. Evaluation of renal toxicity by combination exposure to melamine and cyanuric acid in male Sprague-Dawley rats. Toxicol Res. 2014;30(2):99–107. https://doi.org/10.5487/TR.2014.30.2.099
85. Adedeji AO, Gu YZ, Pourmohamad T, Kanerva J, Chen Y, Atabakhsh E, et al. The utility of novel urinary biomarkers in mice for drug development studies. Int J Toxicol. 2021;40(1):15–25. https://doi.org/10.1177/1091581820970498
86. Stubbs JR, Zhang S, Jansson KP, Fields TA, Boulanger J, Liu S, et al. Critical role of osteopontin in maintaining urinary phosphate solubility in CKD. Kidney360. 2022;3(9):1578–89. https://doi.org/10.34067/KID.0007352021
87. Phillips JA, Holder DJ, Ennulat D, Gautier JC, Sauer JM, Yang Y, et al. Rat urinary osteopontin and neutrophil gelatinase-associated lipocalin improve certainty of detecting drug-induced kidney injury. Toxicol Sci. 2016;151(2):214–23. https://doi.org/10.1093/toxsci/kfw038
88. Zhang Q, Davis KJ, Hoffmann D, Vaidya VS, Brown RP, Goering PL. Urinary biomarkers track the progression of nephropathy in hypertensive and obese rats. Biomark Med. 2014;8(1):85–94. https://doi.org/10.2217/bmm.13.106
89. Dobrek Ł, Arent Z, Nalik-Iwaniak K, Fic K, Kopańska M. Osteopontin and fatty acid binding protein in ifosfamide-treated rats. Open Medicine. 2019;14(1):561–71. https://doi.org/10.1515/med-2019-0063
90. Carlos CP, Sonehara NM, Oliani SM, Burdmann EA. Predictive usefulness of urinary biomarkers for the identification of cyclosporine A-induced nephrotoxicity in a rat model. PLoS One. 2014;9(7):e103660. https://doi.org/10.1371/journal.pone.0103660
91. Harjen HJ, Nicolaysen TV, Negard T, Lund H, Sævik BK, Anfinsen KP, et al. Serial serum creatinine, SDMA and urinary acute kidney injury biomarker measurements in dogs envenomated by the European adder (Vipera berus). BMC Vet Res. 2021;17(1):154. https://doi.org/10.1186/s12917-021-02851-8
92. Gu YZ, Vlasakova K, Troth SP, Peiffer RL, Tournade H, Pasello dos Santos FR, et al. Performance assessment of new urinary translational safety biomarkers of drug-induced renal tubular injury in tenofovir-treated cynomolgus monkeys and beagle dogs. Toxicol Pathol. 2018;46(5):553–63. https://doi.org/10.1177/0192623318775023
93. Monti P, Benchekroun G, Berlato D, Archer J. Initial evaluation of canine urinary cystatin C as a marker of renal tubular function. J Small Anim Pract. 2012;53(5):254–9. https://doi.org/10.1111/j.1748-5827.2012.01198.x
94. Ghys LFE, Meyer E, Paepe D, Delanghe J, Daminet S. Analytical validation of a human particle-enhanced nephelometric assay for cystatin C measurement in feline serum and urine. Vet Clin Pathol. 2014;43(2):226–34. https://doi.org/10.1111/vcp.12144
95. Gil A, Brod V, Awad H, Heyman SN, Abassi Z, Frajewicki V. Neutrophil gelatinase-associated lipocalin in a triphasic rat model of adenine-induced kidney injury. Ren Fail. 2016;38(9):1448–54. https://doi.org/10.1080/0886022X.2016.1194164
96. Sekulic M, Pichler Sekulic S. A compendium of urinary biomarkers indicative of glomerular podocytopathy. Patholog Res Int. 2013;2013:782395. https://doi.org/10.1155/2013/782395
97. Pan QR, Ren YL, Zhu JJ, Hu YJ, Zheng JS, Fan H, et al. Resveratrol increases nephrin and podocin expression and alleviates renal damage in rats fed a high-fat diet. Nutrients. 2014;6(7):2619–31. https://doi.org/10.3390/nu6072619
98. Мирошников МВ, Султанова КТ, Макарова МН, Фаустова НМ, Хан СО, Лосева Е.А. Комплексная оценка функционального состояния мочевыделительной системы в доклинических исследованиях. Часть 1: инструментальные и лабораторные методы оценки (обзор). Регуляторные исследования и экспертиза лекарственных средств. 2024;14(3):283–94. https://doi.org/10.30895/1991-2919-2024-14-3-283-294
Об авторах
М. В. МирошниковРоссия
Мирошников Михаил Владимирович, канд. мед. наук
Заводская ул., д. 3, к. 245, г.п. Кузьмоловский, Всеволожский район, Ленинградская обл., 188663
К. Т. Султанова
Россия
Султанова Кира Тимуровна, канд. мед. наук
Заводская ул., д. 3, к. 245, г.п. Кузьмоловский, Всеволожский район, Ленинградская обл., 188663
М. Н. Макарова
Россия
Макарова Марина Николаевна, д-р мед. наук
Заводская ул., д. 3, к. 245, г.п. Кузьмоловский, Всеволожский район, Ленинградская обл., 188663
Н. М. Фаустова
Россия
Фаустова Наталья Михайловна, канд. хим. наук
Заводская ул., д. 3, к. 245, г.п. Кузьмоловский, Всеволожский район, Ленинградская обл., 188663
С. О. Хан
Россия
Хан Станислав Олегович
Заводская ул., д. 3, к. 245, г.п. Кузьмоловский, Всеволожский район, Ленинградская обл., 188663
Е. А. Лосева
Россия
Лосева Екатерина Александровна
Заводская ул., д. 3, к. 245, г.п. Кузьмоловский, Всеволожский район, Ленинградская обл., 188663
Дополнительные файлы
Рецензия
Для цитирования:
Мирошников М.В., Султанова К.Т., Макарова М.Н., Фаустова Н.М., Хан С.О., Лосева Е.А. Комплексная оценка функционального состояния мочевыделительной системы в доклинических исследованиях. Часть 2. Маркеры нефротоксичности (обзор). Регуляторные исследования и экспертиза лекарственных средств. 2024;14(4):448-462. https://doi.org/10.30895/1991-2919-2024-631
For citation:
Miroshnikov M.V., Sultanova K.T., Makarova M.N., Faustova N.M., Khan S.O., Loseva E.A. Complex Assessment of the Functional State of the Urinary System in Preclinical Studies. Part 2. Markers of Nephrotoxicity (Review). Regulatory Research and Medicine Evaluation. 2024;14(4):448-462. (In Russ.) https://doi.org/10.30895/1991-2919-2024-631



































