Перейти к:
Разработка состава и технологии матричных таблеток этилтиобензимидазола фумарата в соответствии с заданным профилем высвобождения
https://doi.org/10.30895/1991-2919-2025-763
Резюме
ВВЕДЕНИЕ. Этилтиобензимидазола фумарат (ЭТБИФ) — актопротекторная и адаптогенная активная фармацевтическая субстанция. Установлено, что эффективность терапии ЭТБИФ достигается при курсовом введении с высокой частотой приема, также отмечены нежелательные действия, связанные с растворением ЭТБИФ в среде желудка. В связи с этим актуальной является разработка матричной лекарственной формы с профилем высвобождения, который позволит нивелировать описанный побочный эффект, снизить частоту приема и тем самым повысить комплаентность к терапии.
ЦЕЛЬ. Разработка состава и технологии матричных таблеток этилтиобензимидазола фумарата в соответствии с заданным профилем высвобождения (полное высвобождение в течение 12 ч, не более 50% ЭТБИФ высвобождается в кислой среде в течение первых 2 ч, оставшееся количество равномерно высвобождается за последующие 10 ч в среде, моделирующей условия кишечника).
МАТЕРИАЛЫ И МЕТОДЫ. Объектом исследования является субстанция этилтиобензимидазола фумарата, а также матричные таблетки с гидроксипропилметилцеллюлозой и этилцеллюлозой на ее основе. Изучены механические свойства таблеток, определены показатели «прочность на раздавливание» и «истираемость». Изучение профилей высвобождения ЭТБИФ проводили в фосфатных буферных средах (pH 1,2; 4,5 и 6,8) с использованием тестера растворения и УФ-спектрометрии.
РЕЗУЛЬТАТЫ. Изучена кинетика высвобождения ЭТБИФ из матричных систем, содержащих матрицеобразующие агенты с разными принципами образования матрицы. Для составов на основе гидроксипропилметилцеллюлозы удалось достичь пролонгированного высвобождения субстанции ЭТБИФ с 90%-ным высвобождением активной фармацевтической субстанции из таблеток через 12 ч. Для составов с этилцеллюлозой высвобождение субстанции составило от 60 до 90%, при этом в кислой среде высвобождается большая часть ЭТБИФ. Установлено, что введение кислотного агента не влияет на профиль высвобождения ЭТБИФ из матричных таблеток.
ВЫВОДЫ. В ходе исследования разработан состав матричных таблеток, удовлетворяющий заданному профилю высвобождения. Наиболее полное и равномерное высвобождение субстанции в среде, моделирующей условия желудочно-кишечного тракта, достигнуто из матричных таблеток на основе гидроксипропилметилцеллюлозы. Показано, что введение кислотного агента не оказывает влияния на высвобождение ЭТБИФ, несмотря на повышенную растворимость субстанции в кислой среде.
Ключевые слова
Для цитирования:
Касымов И.Д., Марченко А.Л., Басевич А.В. Разработка состава и технологии матричных таблеток этилтиобензимидазола фумарата в соответствии с заданным профилем высвобождения. Регуляторные исследования и экспертиза лекарственных средств. 2025;15(5):533-540. https://doi.org/10.30895/1991-2919-2025-763
For citation:
Kasymov I.D., Marchenko A.L., Basevich A.V. Developing Composition and Technology of Ethylthiobenzimidazole Fumarate Matrix Tablets According to Specified Release Profile. Regulatory Research and Medicine Evaluation. 2025;15(5):533-540. (In Russ.) https://doi.org/10.30895/1991-2919-2025-763
ВВЕДЕНИЕ
Этилтиобензимидазола фумарат (ЭТБИФ) — активная фармацевтическая субстанция (АФС), относится к группе А13А «Общетонизирующие препараты и адаптогены» по АТХ-классификации. Повышает работоспособность и способствует ускоренному восстановлению организма после длительных экстремальных физических нагрузок, что актуально, в частности, для профессиональных спортсменов, спасателей, военных и других представителей физически тяжелых профессий. Ближайшим аналогом является этилтиобензимидазола гидробромид (Бемитил и Метапрот®), однако у субстанции ЭТБИФ более выражено антигипоксическое действие [1–4].
Отмечено, что наибольший терапевтический эффект достигается при курсовом приеме не менее двух раз в сутки [2–4], что снижает приверженность терапии. Для повышения приверженности интерес представляют пролонгированные лекарственные формы, позволяющие снизить частоту приема и повысить удобство применения. Ранее были изучены технологические аспекты микрокапсулирования субстанции ЭТБИФ в пролонгирующий полимер [5]. Другой пролонгированной формой являются матричные таблетки, преимуществом которых перед микрокапсулами является доступность и простота технологии.
В ходе предварительных исследований установлено, что АФС мало растворима в нейтральной водной среде, легко растворима в кислой среде (pH 1–2) и плохо в щелочной, причем растворимость линейно уменьшается с повышением pH. При этом отмечается, что при высокой концентрации ЭТБИФ в кислой среде желудка у пациента возникают болезненные ощущения в области живота [6]. Разработка лекарственного препарата с пролонгированным высвобождением позволит снизить дискомфорт у пациента при приеме таблетки за счет постепенного высвобождения субстанции в желудочно-кишечном тракте (ЖКТ) и исключения создания локальной избыточной концентрации. При этом матричные таблетки как лекарственная форма не должны препятствовать полному растворению субстанции в нейтральной и щелочной средах.
Цель работы — разработка состава и технологии матричных таблеток этилтиобензимидазола фумарата в соответствии с заданным профилем высвобождения (полное высвобождение в течение 12 ч, не более 50% АФС высвобождается в кислой среде в течение первых 2 ч, оставшееся количество равномерно высвобождается за последующие 10 ч в среде, моделирующей условия кишечника).
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования является субстанция ЭТБИФ. В качестве матрицеобразующих компонентов использовали гидроксипропилметилцеллюлозу марки 60HD6 (вязкость 2% раствора 6 мПа×с) и марки 60HD15 (вязкость 2% раствора 15 мПа×с) — оба реагента производства Shandong Head, Китай, а также этилцеллюлозу E7 (Colorcon, Великобритания). Выбор данных веществ позволяет сравнить разные по принципу действия типы замедляющей высвобождение матрицы. В качестве наполнителя были выбраны лактоза (DFE Pharma, Германия) и микрокристаллическая целлюлоза (JRS Pharma, Германия), поливинилпирролидон (Plasdone K-25, Ashland Inc., США) — связующее, стеарат кальция (Nitika, Индия) в качестве лубриканта. Также в состав таблеток вводили винную кислоту (х.ч., ООО «Вектон», Россия) как кислотный агент, предположительно локально повышающий растворимость ЭТБИФ. Сырье для получения таблеток предварительно было просеяно (размер отверстий сита 0,5 мм). Количества компонентов в составах представлены в таблице 1.
Таблица 1. Модельные составы матричных таблеток, содержащих этилтиобензимидазола фумарат
Table 1. Model compounds of matrix tablets containing ethylthiobenzimidazole fumarate
|
№ состава Compound No. |
Компоненты Components |
Прочностные показатели Strength indicators |
||||||||||
|
Этилтиобензимидазола фумарат, мг Ethylthiobenzimidazole fumarate, mg |
Этилцеллюлоза, мг Ethyl cellulose, mg |
Гидроксипропилметилцеллюлоза (60HD6), мг Hydroxypropylmethylcellulose (60HD6), mg |
Гидроксипропилметилцеллюлоза (60HD15), мг Hydroxypropylmethylcellulose (60HD15), mg |
Винная кислота, мг Tartaric acid, mg |
Стеарат кальция, мг Calcium Stearate, mg |
Микрокристаллическая целлюлоза, мг Microcrystalline cellulose, mg |
Лактоза, мг Lactose, mg |
Поливинилпирролидон, мг Polyvinylpyrrolidone, mg |
Итого, мг Total, mg |
Истираемость, % Friability, % |
Прочность на раздавливание, Н Hardness, N |
|
|
Прямое прессование / Direct pressing |
||||||||||||
|
1 |
200 |
– |
80 |
– |
28 |
4 |
48 |
40 |
– |
400 |
0,19±0,05 |
99,8±6 |
|
2 |
200 |
– |
140 |
– |
28 |
4 |
16 |
12 |
– |
400 |
0,18±0,06 |
90,9±7 |
|
3 |
200 |
– |
140 |
– |
– |
4 |
32 |
24 |
– |
400 |
0,14±0,05 |
109,3±8 |
|
4 |
200 |
80 |
– |
– |
28 |
4 |
60 |
– |
28 |
400 |
0,08±0,05 |
130,4±7 |
|
5 |
200 |
140 |
– |
– |
28 |
4 |
– |
– |
28 |
400 |
0,05±0,04 |
124,9±4 |
|
6 |
200 |
140 |
– |
– |
– |
4 |
28 |
– |
28 |
400 |
0,07±0,04 |
160,6±7 |
|
7 |
200 |
– |
– |
80 |
– |
4 |
108 |
– |
8 |
400 |
0,12±0,05 |
102,3±4 |
|
8 |
200 |
– |
– |
120 |
– |
4 |
68 |
– |
8 |
400 |
0,21±0,04 |
95,6±5 |
|
9 |
200 |
– |
– |
160 |
– |
4 |
28 |
– |
8 |
400 |
0,16±0,03 |
90,8±6 |
|
10 |
200 |
40 |
– |
– |
– |
4 |
148 |
– |
8 |
400 |
0,09±0,04 |
100,5±6 |
|
11 |
200 |
80 |
– |
– |
– |
4 |
108 |
– |
8 |
400 |
0,07±0,03 |
104,6±7 |
|
12 |
200 |
120 |
– |
– |
– |
4 |
68 |
– |
8 |
400 |
0,11±0,04 |
112,7±4 |
|
Влажная грануляция / Wet granulation |
||||||||||||
|
13 |
200 |
– |
– |
120 |
– |
4 |
68 |
– |
8 |
400 |
0,20±0,06 |
98,5±5 |
|
14 |
200 |
– |
– |
160 |
– |
4 |
28 |
– |
8 |
400 |
0,15±0,05 |
92,4±7 |
|
15 |
200 |
40 |
– |
– |
– |
4 |
148 |
– |
8 |
400 |
0,09±0,03 |
108,4±7 |
|
16 |
200 |
80 |
– |
– |
– |
4 |
108 |
– |
8 |
400 |
0,07±0,04 |
105,6±5 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. «–» — отсутствует.
Note. –, not found.
Массу для таблетирования в случае прямого прессования получали путем сухого смешивания. В случае влажной грануляции смесь увлажняли водой очищенной, протирали через сито с диаметром отверстий 3 мм, сушили в сушильном шкафу при температуре 60 °С не менее 30 мин до остаточной влажности 2%, протирали через сито с диаметром отверстий 1 мм, полученный гранулят опудривали кальция стеаратом. Прессование таблеток осуществляли на лабораторном таблетпрессе ПГР-10 (ООО «ЛабТулс», Россия), масса таблеток составила 400 мг, диаметр — 12 мм.
Для изучения профилей высвобождения был использован прибор для теста «Растворение» DT620 (ERWEKA, Германия) с лопастной мешалкой (100 об./мин), шприцевые фильтры (диаметр пор 0,22 мкм, материал PTFE), рН-метр FiveEasy F20-Standard (Mettler-Toledo, Швейцария), спектрофотометр СФ-2000 (ОКБ «Спектр», Россия). В качестве среды растворения были использованы фосфатные буферы с pH 1,2; 4,5 и 6,8, приготовленные в соответствии с Государственной фармакопеей Российской Федерации XV изд. (далее — ГФ РФ)1. В тесте с имитацией условий ЖКТ изменение pH среды растворения с 1,2 на 6,8 осуществляли добавлением 10% раствора Na2HPO4 (х.ч., ЗАО «Вектон», Россия), необходимый объем которого (100 мл) был установлен заранее, увеличение объема среды учитывали при измерении концентраций. Для проведения теста использовали 3 стакана тестера растворения, каждый стакан наполняли 1000 мл буфера при температуре 37,0±0,1 °С, в каждый стакан помещали одну таблетку с содержанием ЭТБИФ 200 мг. После начала теста отбирали пробы объемом 5 мл с восполнением среды растворения в указанные в результатах промежутки времени и фильтровали их.
Отфильтрованные пробы в объеме 2,5 мл переносили в колбу на 50 мл, добавляли 1 мл спирта этилового 96%, добавляли 1 мл раствора 0,5 М NaOH (х.ч., ЗАО «Вектон», Россия), доводили раствор до метки водой очищенной, после чего определяли содержание перешедшего в раствор ЭТБИФ методом УФ-спектрофотометрии при длине волны 289±2 нм. Раствор стандарта готовили следующим образом. Точную навеску ЭТБИФ (100 мг) растворяли в 100 мл спирта этилового 96%, 1 мл полученного раствора переносили в мерную колбу на 100 мл, добавляли 0,5 мл раствора 2М NaOH и доводили водой очищенной до метки. Раствором сравнения был выбран раствор 0,01 М NaOH в воде очищенной. Описанная методика количественного определения ЭТБИФ основана на методике определения Метапрота (этилтиобензимидазола гидробромид) [7][8], ее пригодность обоснована предварительной оценкой авторами по показателям «специфичность» и «линейность».
Статистическую обработку полученных результатов проводили в соответствии с ГФ РФ2.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Известно, что в составах матричных таблеток гидроксипропилметилцеллюлоза (ГПМЦ) и этилцеллюлоза (ЭЦ) создают разный тип замедляющей матрицы: ГПМЦ образует гидрогелевый барьер на поверхности таблетки, а ЭЦ создает нерастворимый гидрофобный каркас [9–11]. Для сравнения влияния матрицеобразующих компонентов и их количеств на высвобождение ЭТБИФ были изготовлены и проанализированы 16 составов таблеток. Результаты контроля качества таблеток по показателям «истираемость» и «прочность на раздавливание» представлены в таблице 1, все таблетки обладают удовлетворительными прочностными характеристиками.
Составы № 1–12 были получены методом прямого прессования, № 13–16 — методом влажного гранулирования. Лактозу вводили для повышения прочности и как порообразователь, поливинилпирролидон — для повышения прочности таблеток с ЭЦ, винная кислота введена в составы № 1, 2, 4, 5 для предполагаемого повышения растворимости субстанции ЭТБИФ и отсутствует в составах № 3 и 6 для сравнения. Чтобы не ограничивать высвобождение растворимостью субстанции и оценивать именно влияние матриц, средой растворения на первом этапе (составы № 1–6) был выбран фосфатный буфер с рН 4,5.
В случае таблеток, содержащих этилцеллюлозу, не удалось достичь высвобождения ЭТБИФ более 15% (рис. 1a), что может быть связано с избыточным количеством ЭЦ и гидрофобными свойствами матрицы. Составы с ГПМЦ, наоборот, высвобождали более 60% АФС в течение первого часа, что говорит о недостаточной вязкости образующегося на поверхности таблетки гидрогелевого слоя. Таким образом, ни один состав не соответствует заданному профилю высвобождения. Также установлено, что, несмотря на зависимость растворимости субстанции ЭТБИФ от значения pH среды, наличие винной кислоты в составе таблеток в выбранном количестве не оказывает значимого влияния на скорость или степень высвобождения субстанции в выбранных количествах.
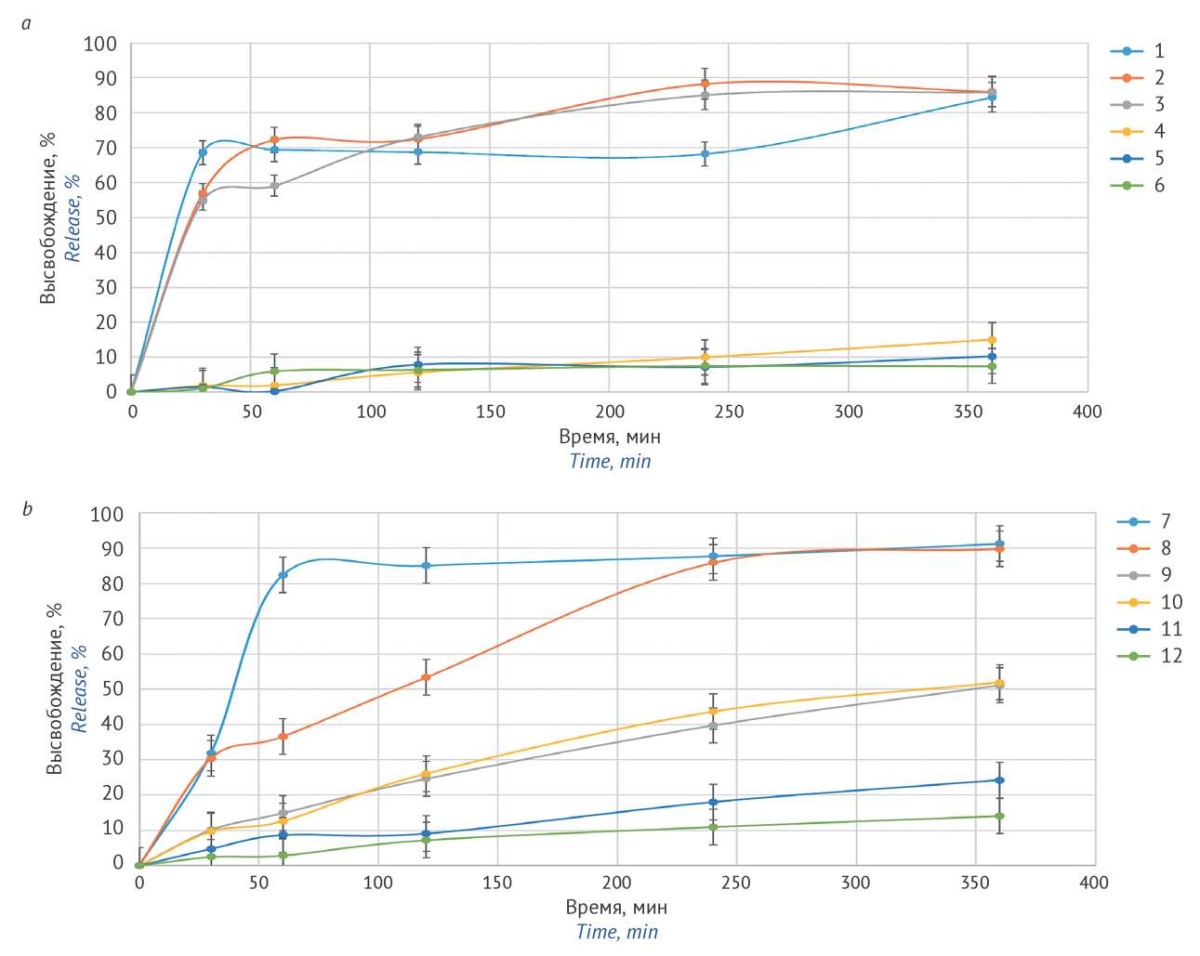
Рисунок подготовлен авторами по собственным данным / Figure is prepared by the authors using their own data
Рис. 1. Профили высвобождения этилтиобензимидазола фумарата в среде объемом 1000 мл с pH 4,5 из матричных таблеток составов: а — № 1–6; b — № 7–12
Fig. 1. Release profiles of ethylthiobenzimidazole fumarate from matrix tablets of compounds No. 1–6 in a 1,000 mL medium, with a pH of 4.5; No. 7–12 in a–b
С учетом полученных результатов были сформированы составы № 7–12 (табл. 1). Была выбрана более вязкая ГПМЦ марки 60HD15, этилцеллюлоза добавлена в меньших количествах, а винная кислота и лактоза удалены из составов.
Введение ГПМЦ марки 60HD15 в количестве 30–40% замедляет высвобождение ЭТБИФ: с увеличением концентрации ГПМЦ снижается скорость высвобождения субстанции (рис. 1b). Аналогичная зависимость установлена и для ЭЦ в количестве 10–20%. Вероятно, с увеличением содержания МКЦ увеличивается количество пор в матрице таблетки, через которые среда растворения попадает внутрь и способствует растворению АФС.
Таблетки составов № 13–16 были получены путем влажной грануляции. Выбор влажной грануляции обоснован неудовлетворительными технологическими свойствами субстанции ЭТБИФ при ее высоком содержании, что не позволяет обеспечить однородность дозирования при сухом смешении в условиях производства. В качестве среды растворения были выбраны буферные растворы, моделирующие условия ЖКТ: первые 2 ч в среде с pH 1,2; последующие 10 ч — в среде 6,8.
Наиболее полно заданному профилю высвобождения соответствует состав № 13 (рис. 2). Из него высвобождается более 90% ЭТБИФ в течение 12 ч, при этом в первые 2 ч в среду растворения переходит не более 50% АФС. Состав № 14, несмотря на большее содержание матрицеобразующего компонента, высвобождает АФС уже через 8 ч. Такие результаты предположительно связаны с более высоким содержанием МКЦ в составе № 13 — данное вещество оказывает порообразующий эффект и проводит жидкость среды растворения вглубь таблетки. При большем количестве пор на поверхности таблетки образуется более толстый гидрогелевый слой ГПМЦ за счет более глубокого проникновения среды растворения в таблетку, что и препятствует диффузии ЭТБИФ.
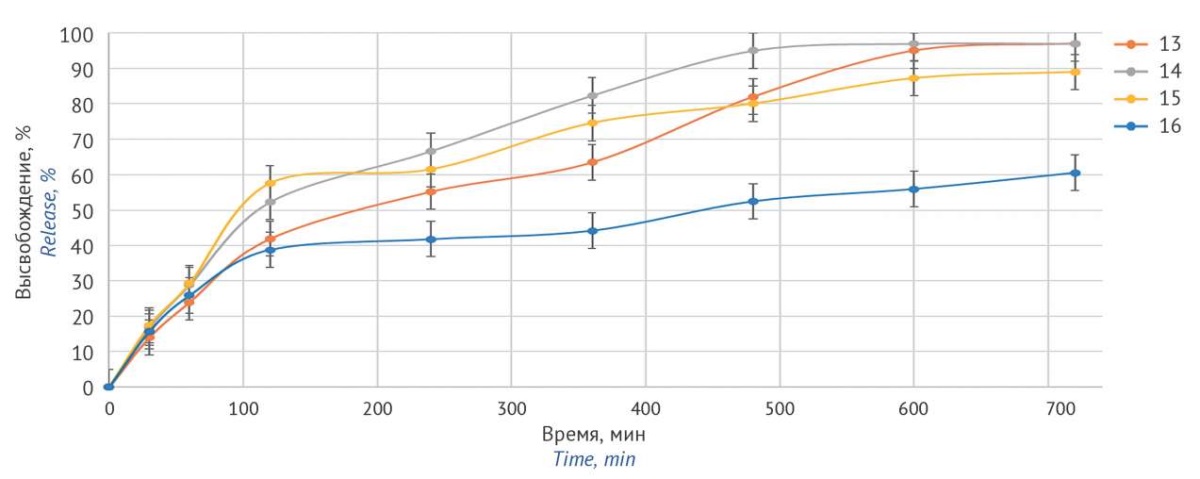
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 2. Профили высвобождения этилтиобензимидазола фумарата из матричных таблеток составов № 13–16 в среде объемом 1000 мл, моделирующей условия желудочно-кишечного тракта
Fig. 2. Release profiles of ethylthiobenzimidazole fumarate from matrix tablets of compounds No. 13–16 in a 1,000 mL medium simulating gastrointestinal conditions
Из состава № 15 высвободилось около 90% ЭТБИФ за 12 ч. Однако в среде, моделирующей условия желудка, из этого состава высвобождалось ~60% субстанции, что не соответствует заданному профилю высвобождения. Увеличение содержания матрицеобразующего агента ЭЦ в составе № 16 приводит к значительному ухудшению растворения активной фармацевтической субстанции в среде, моделирующей условия кишечника.
ЗАКЛЮЧЕНИЕ
В ходе работы разработаны состав и технология матричных таблеток ЭТБИФ на основе ГПМЦ — состав № 13, обладающий необходимыми прочностными характеристиками и удовлетворяющий заданному профилю высвобождения (этилтиобензимидазола фумарат 200 мг, гидроксипропилметилцеллюлоза (60HD15) 120 мг, стеарат кальция 4 мг, микрокристаллическая целлюлоза 68 мг, поливинилпирролидон 8 мг).
Изучено влияние матрицеобразователей с разными типами образования матрицы на высвобождение ЭТБИФ. Показано, что гидрогелевая матрица ГПМЦ обеспечивает более равномерное высвобождение АФС, растворимость которой зависит от pH среды растворения, чем гидрофобная матрица из ЭЦ.
Установлено, что, несмотря на лучшую растворимость ЭТБИФ в кислой среде, введение в состав кислотного агента в виде винной кислоты не оказывает значимого влияния на высвобождение ЭТБИФ из матричных таблеток.
Показано влияние МКЦ как порообразователя на кинетику высвобождения АФС. Таким образом, желаемый профиль высвобождения АФС из матричной таблетки может быть достигнут не только за счет матрицеобразующего агента, но и путем подбора порообразователя.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: И.Д. Касымов — проведение экспериментов; И.Д. Касымов, А.Л. Марченко, А.В. Басевич — написание текста рукописи, обработка полученных данных.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Ilya D. Kasymov conducted experiments and processed the obtained data. Ilya D. Kasymov, Alexei L. Marchenko, Anna V. Basevich wrote the manuscript and discussed the results.
1. ОФС.1.3.0003 Буферные растворы. Государственная фармакопея Российской Федерации XV изд. М.; 2023.
2. ОФС.1.1.0013 Статистическая обработка результатов физических, физико-химических и химических испытаний. Государственная фармакопея Российской Федерации XV изд. М.; 2023.
Список литературы
1. Оковитый СВ, Радько СВ, Дулепов АД, Юсковец ВН. Антигипоксическое и актопротекторное средство на основе 2-(этилсульфанил)-1Н-бензимидазол-3-ия (2Е)-3-карбоксипроп-2-еноата. Патент Российской Федерации № 2673338; 2017. EDN: LVGMNC
2. Болотина ЮД, Болотова ВЦ. Изучение антигипоксической активности нового производного бензимидазола с дикарбоновой кислотой в условиях гистотоксической гипоксии. Биомедицина. 2020;16(3):102–5. https://doi.org/10.33647/2074-5982-16-3-102-105
3. Болотова ВЦ, Болотина ЮД, Шустов ЕБ. Влияние этилтиобензимидазола фумарата на физическую работоспособность мышей в условиях одновременного гипоксического и гипертермического воздействия. Биомедицина. 2021;17(3E):139–43. https://doi.org/10.33647/2713-0428-17-3E-139-143
4. Дулепов АД, Радько СВ. Острая токсичность и влияние на физическую работоспособность нового производного этилтиобензимидазола при однократном и курсовом введении. В кн.: Фундаментальная наука в современной медицине — 2018. Сборник материалов сателлитной дистанционной научно-практической конференции студентов и молодых ученых. Минск; 2018. С. 109–13.
5. Касымов ИД, Марченко АЛ, Басевич АВ, Валеева МЕ. Влияние параметров технологического процесса на микрокапсулирование субстанций с неудовлетворительными технологическими свойствами. Разработка и регистрация лекарственных средств. 2023;12(4):146–54. https://doi.org/10.33380/2305-20662023-12-4-1574
6. Лызиков АН, Питкевич ЭС, Мельник СН. Перспективы клинического применения антигипоксанта «Бемитил» (обзор литературы). Проблемы здоровья и экологии. 2011;(1):7–14. https://doi.org/10.51523/2708-6011.2011-8-1-1
7. Вергейчик ТХ, Линникова ВА, Гуськова ГБ. Использование УФ-спектрофотометрии для выявления условий экстракции метапрота из водных растворов. Фармация и фармакология. 2014;2(5(6)):11–6. https://doi.org/10.19163/2307-9266-2014-2-5(6)-11-16
8. Вергейчик ТХ, Линникова ВА, Гуськова ГБ, Саркисян МС. Обнаружение и определение метапрота в печени и почках. Журнал научных статей Здоровье и образование в XXI веке. 2017;19(8):210–4. EDN: YORPFJ
9. Демина НБ. Современные тенденции развития технологии матричных лекарственных форм с модифицированным высвобождением (обзор). Химико-фармацевтический журнал. 2016;50(7):44–50. https://doi.org/10.30906/0023-1134-2016-50-7-4450.
10. Анурова МН, Бахрушина ЕО, Демина НБ. Обзор современных гелеобразователей в технологии лекарственных форм. Химико-фармацевтический журнал. 2015;49(9):39–46. https://doi.org/10.30906/0023-11342015-49-9-39-46.
11. Agarwal P, Semimul A. A comprehensive review on sustained release matrix tablets: a promising dosage form. Univ J Pharm Res. 2018;3(6):49–54. https://doi.org/10.22270/ujpr.v3i6.222
12. Nandhakumar S, Sugreevudu G, Harikrishnan N. Formulation design and evaluation of extended-release tablets of oxybutynin for effective management of overactive bladder syndrome. Research J Pharm Tech. 2021;14(12):6558–64. https://doi.org/10.52711/0974-360X.2021.01135
13. Алходри А, Суслина СН. Разработка гранул целекоксиба для получения капсул и таблеток пролонгированного высвобождения. Разработка и регистрация лекарственных средств. 2022;11(1):68–73. https://doi.org/10.33380/2305-2066-2022-11-1-68-73
14. Коцур ЮМ, Флисюк ЕВ, Сидоров KO и др. Изучение влияния матрицеобразующих полимеров на скорость высвобождения 4,4’-(пропандиамидо)дибензоата натрия из таблеток. Разработка и регистрация лекарственных средств. 2023;12(4):91–5. https://doi.org/10.33380/23052066-2023-12-4-1579
15. Филиппова НИ, Вайнштейн ВА, Сон АВ, Минина СА. Регулирование высвобождения ибупрофена из матричных таблеток на основе карбопола. Разработка и регистрация лекарственных средств. 2017;(1):58–64. EDN: YKPHCB
16. Касымов ИД, Басевич АВ. Изучение технологических свойств вспомогательных веществ при разработке состава орально диспергируемых таблеток. Разработка и регистрация лекарственных средств. 2021;10(4):46–53. https://doi.org/10.33380/2305-2066-2021-10-4(1)-46-53
Об авторах
И. Д. КасымовРоссия
Касымов Илья Данисович
ул. Проф. Попова, д. 14, лит. А, Санкт-Петербург, 197376
А. Л. Марченко
Россия
Марченко Алексей Леонидович, канд. фарм. наук, доцент
ул. Проф. Попова, д. 14, лит. А, Санкт-Петербург, 197376
А. В. Басевич
Россия
Басевич Анна Викторовна, канд. фарм. наук, доцент
ул. Проф. Попова, д. 14, лит. А, Санкт-Петербург, 197376
Дополнительные файлы
Рецензия
Для цитирования:
Касымов И.Д., Марченко А.Л., Басевич А.В. Разработка состава и технологии матричных таблеток этилтиобензимидазола фумарата в соответствии с заданным профилем высвобождения. Регуляторные исследования и экспертиза лекарственных средств. 2025;15(5):533-540. https://doi.org/10.30895/1991-2919-2025-763
For citation:
Kasymov I.D., Marchenko A.L., Basevich A.V. Developing Composition and Technology of Ethylthiobenzimidazole Fumarate Matrix Tablets According to Specified Release Profile. Regulatory Research and Medicine Evaluation. 2025;15(5):533-540. (In Russ.) https://doi.org/10.30895/1991-2919-2025-763



































