Перейти к:
Фосфодиэстераза 10А как терапевтическая мишень в нейропсихофармакологии: обзор
https://doi.org/10.30895/1991-2919-2025-723
Резюме
ВВЕДЕНИЕ. Фосфодиэстеразы (ФДЭ) — ферменты, регулирующие внутриклеточный сигналинг путем гидролиза циклических нуклеотидов. Коммерческий успех селективных ингибиторов ФДЭ5 при эректильной дисфункции и ФДЭ4 при респираторных и кожных заболеваниях привлек пристальное внимание фармацевтических компаний и к другим ФДЭ. Отдельного внимания заслуживает ФДЭ10А — перспективная мишень в психофармакологии, для которой характерна экспрессия в среднеразмерных шипиковых нейронах (MSNs) полосатого тела.
ЦЕЛЬ. Анализ существующих доклинических и клинических данных о применении ингибиторов ФДЭ10А и оценка возможных трудностей, возникающих при разработке лекарственных препаратов данного класса в нейропсихофармакологии.
ОБСУЖДЕНИЕ. Результаты доклинических исследований ингибиторов ФДЭ10А, повышающих уровень аденозин-3’,5’-циклофосфата (цАМФ) и гуанозин-3’,5’-циклофосфата (цГМФ) в MSNs, продемонстрировали, что фармакологические агенты данной группы обладают антипсихотическим и противопаркинсоническим, а также прокогнитивным действием. Несмотря на многообещающие результаты доклинических испытаний, клинические исследования ингибиторов ФДЭ10А не достигли успеха. В обзоре проанализированы возможные причины этих неудач, включая недостаточное понимание функции стриатальных ФДЭ в норме и патологии, потенциальное развитие толерантности к некоторым из эффектов, сложное взаимодействие внутриклеточных сигнальных путей цАМФ и цГМФ, а также особенности функционирования кортико-стриато-таламо-кортикальных путей.
ВЫВОДЫ. Для полного раскрытия терапевтического потенциала ингибиторов ФДЭ10А необходимы дальнейшие исследования, направленные на более детальное изучение механизма действия ФДЭ, активности MSNs и кортико-стриато-таламо-кортикальных путей. Новые данные на всех этих трех уровнях изучения (субклеточный, клеточный и системный) позволят создать условия для дальнейшей разработки ингибиторов ФДЭ10А.
Ключевые слова
Для цитирования:
Доротенко А.Р., Суханов И.М., Искаревский Г.В., Улитина А.С., Савченко А.А., Тур М.А. Фосфодиэстераза 10А как терапевтическая мишень в нейропсихофармакологии: обзор. Регуляторные исследования и экспертиза лекарственных средств. 2025;15(2):148-167. https://doi.org/10.30895/1991-2919-2025-723
For citation:
Dorotenko A.R., Sukhanov I.M., Iskarevskii G.V., Ulitina A.S., Savchenko A.A., Tur M.А. Phosphodiesterase 10A as a Therapeutic Target in Neuropsychopharmacology: A Review. Regulatory Research and Medicine Evaluation. 2025;15(2):148-167. (In Russ.) https://doi.org/10.30895/1991-2919-2025-723
ВВЕДЕНИЕ
Выполнение клетками ряда биологических функций связано с необходимостью передавать полученную извне информацию внутрь клетки, то есть осуществлять внутриклеточный сигналинг. Существует несколько систем внутриклеточного сигналинга; одними из самых подробно изученных и описанных являются системы, связанные с изменением уровня аденозин-3’,5’-циклофосфата (цАМФ) и гуанозин-3’,5’-циклофосфата (цГМФ) [1].
Согласно классическим представлениям при активации рецептора, сопряженного с G-белком, происходит изменение конформации данного протеина, что приводит к последующим изменениям концентрации вторичного посредника. В случае цАМФ/цГМФ-опосредованных сигнальных систем может наблюдаться как увеличение, так и уменьшение концентраций циклических нуклеотидов за счет, соответственно, стимуляции или снижения активности специфических ферментов — циклаз (аденилатциклазы и гуанилатциклазы) [2]. При увеличении продукции цАМФ и цГМФ инициируется нисходящий сигнальный каскад, включающий в себя протеинкиназы A и G соответственно, ионные каналы и многие другие внутриклеточные посредники. Эти сигнальные системы участвуют в регуляции ряда важнейших физиологических процессов, в том числе пролиферации и дифференцировки клеток, экспрессии генов, метаболических реакций (липолиза, липогенеза, стероидогенеза, синтеза гликогена, секреции инсулина и пр.), сокращения гладкомышечных клеток различных тканей, зрительной фототрансдукции, реакции ольфакторного эпителия и многих других [1][3].
Важную роль во внутриклеточном сигналинге играют механизмы остановки трансдукции сигнала. В случае каскадов, связанных с повышением концентрации циклических нуклеотидов, остановка сигналинга связана с работой внутриклеточных ферментов из надсемейства фосфодиэстераз (ФДЭ) [1]. Функция данных ферментов заключается в катализе реакции гидролиза 3’-фосфодиэфирной связи циклических нуклеотидов, что приводит к снижению активности соответствующих сигнальных путей и, как следствие, снижению интенсивности связанных с ними физиологических эффектов. Все ФДЭ на основе строения их молекул подразделяют на I, II и III классы. В организме млекопитающих встречаются только ФДЭ I класса, характеризующиеся наличием гомеодомена на карбоксильном конце. Гистидин-аспартатные аминокислотные последовательности данного домена обеспечивают высокую аффинность к цАМФ и (или) цГМФ. Все ФДЭ I класса подразделяют на 11 семейств в соответствии с гомологией нуклеотидных последовательностей их генов, схожестью структуры, специфичностью к субстрату и особенностями экспрессии в различных тканях и органах [4].
Клинический и коммерческий успех имеющихся селективных ингибиторов ФДЭ стимулировал изучение терапевтического потенциала селективных ингибиторов других ФДЭ, среди которых особенно важное значение для психофармакологов имеет ФДЭ10A. В рамках данного обзора подробно описан механизм действия ингибиторов ФДЭ10А, определяющий возможность клинического использования данных соединений в качестве антипсихотических и противопаркинсонических средств, а также для лечения других нейродегенеративных растройств.
Цель работы — анализ существующих доклинических и клинических данных применения ингибиторов ФДЭ10А и оценка возможных трудностей, возникающих при разработке лекарственных препаратов данного класса в нейропсихофармакологии.
Поиск источников литературы проводился в сети Интернет (поисковые системы Yandex, Google) и в специализированных базах данных eLIBRARY.ru, Pubmed, Google Scholar за период до 2024 г. (глубина поиска — 10 лет; использованные ключевые слова — “PDE10A inhibitor” и “phospodiesterase 10A inhibitors”). В обзор также включены более ранние публикации, если в них были представлены значимые доклинические данные об эффектах ингибиторов ФДЭ10А.
ОСНОВНАЯ ЧАСТЬ
Фосфодиэстеразы как фармакологические мишени
Неселективные ингибиторы ФДЭ давно нашли клиническое применение в различных областях медицины. Так, метилксантины (кофеин, теофиллин, пентоксифиллин, теобромин) обладают психостимулирующим, бронходилатирующим, дезагрегантным и диуретическим действием. Интенсивный поиск и изучение молекул, способных селективно влиять на активность определенных ФДЭ, связан в первую очередь с уникальным свойством тканеспецифичной (а иногда и клеточноспецифичной) экспрессии данных ферментов. Благодаря особенностям паттернов экспрессии различных ФДЭ возможна разработка препаратов, прицельно влияющих на биологические процессы именно в органах-мишенях. Сводная информация об особенностях экспрессии семейств ФДЭ и их ингибиторах представлена в таблице 11.
Таблица 1. Семейства фосфодиэстераз (ФДЭ): тканеспецифичность и терапевтический потенциал ингибиторов ФДЭ
Table 1. Phosphodiesterase (PDE) families: tissue specificity and therapeutic potential of PDE inhibitors1
Семейство ФДЭ, источники литературы | Паттерн экспрессии | Селективные ингибиторы ФДЭ | Показания | ||
Препараты на этапе разработки* | Препараты, одобренные к медицинскому применению | Препараты на этапе разработки* | Препараты, одобренные к медицинскому применению | ||
ФДЭ1 [5][6] | Головной мозг (1A5, 1A6, 1C) (в том числе полосатое тело (1B1)), гладкая мускулатура, сердце (1C), семенники (1A10) | Ленрисподун | – | Болезнь Паркинсона (моторные флуктуации при терапии леводопой) | – |
ФДЭ2 [4][7] | Головной мозг (2A3), сердце (2A3) | – | – | – | – |
ФДЭ3 [4][8] | Сердце (3A2), гладкая мускулатура сосудов (3A2), гладкая мускулатура кавернозных тел, адипоциты, тромбоциты | PCS-499 | Цилостазол, левосимендан, эноксимон, амринон, милринон, олпринон | Диабетическая нефропатия | Облитерирующий тромбангиит, перемежающаяся хромота, хроническая сердечная недостаточность |
ФДЭ4 [4][9] | В большинстве тканей, преимущественно в Т-лимфоцитах, эозинофилах, нейтрофилах, моноцитах | ART-648, дифамиласт, муфемиласт, Hemay808, лотамиласт, PF-07038124, UNI-500 | Апремиласт, рофлумиласт, крисаборол, дротаверин, ибудиласт, ирсогладин | Себорея, буллезный пемфигоид | Псориаз, атопический дерматит, болезнь Бехчета, хроническая обструктивная болезнь легких, спазмы гладкой мускулатуры |
ФДЭ5 [4][10] | В большинстве тканей (5A1, 5A2), сердце (5A3), гладкая мускулатура, в том числе кавернозных тел (5A3) | AR-1001, фаданафил, TPN-171, TPN-729 | Тадалафил, силденафил, аванафил, мироденафил, уденафил, варденафил | Болезнь Альцгеймера | Эректильная дисфункция, доброкачественная гиперплазия предстательной железы, артериальная легочная гипертензия |
ФДЭ6 [4][11] | Палочки сетчатки (6A, 6B), колбочки сетчатки (6C) | CTx-ФДЭ6B | – | Пигментный ретинит | – |
ФДЭ7 [4][12] | В большинстве тканей (7A1), почки (7A2), сердце, поперечнополосатые мышечные клетки (7A2), головной мозг (7B) | – | – | – | – |
ФДЭ8 [4][13] | Печень (8A), семенники (8A), щитовидная железа (8A) | – | – | – | – |
ФДЭ9 [4][14] | Селезенка (8A), тонкий кишечник (8A), головной мозг (8A), простата (8A), почки (8A), плацента (8A) | BI-409306, ирсенонтрин малеат, товинонтрин | – | Психозы, шизофрения, болезнь Альцгеймера, болезнь Паркинсона, деменция с тельцами Леви, серповидноклеточная анемия | – |
ФДЭ10 [4][15] | Полосатое тело головного мозга (10A), тестикулы (10A) | CPL-500036, MK-8189, гемлаподект, мардеподект, балиподект, Lu | – | Психозы, шизофрения, дискинезия (вызванная приемом леводопы), синдром Туретта, болезнь Гентингтона | – |
ФДЭ11 [4][16] | Простата (11A4), семенники (11A4) | – | – | – | – |
Таблица составлена авторами по данным электронного ресурса GlobalData.com / The table is prepared by the authors using GlobalData.com
Примечание. «–» — нет данных.
* Только клинические исследования II–III фаз.
Note. –, no data.
* Only clinical trials of phases II–III
Интенсивное исследование селективных ингибиторов ФДЭ5 началось с разработки силденафила, одобренного к медицинскому применению Управлением по контролю за качеством продуктов питания и лекарственных средств (Food and Drug Administration, FDA) в 1998 г. Силденафил в форме цитрата стал первым эффективным пероральным средством для лечения эректильной дисфункции, что, в связи с имеющейся неудовлетворенной медицинской потребностью, сделало крайне привлекательными для клинической разработки и другие ингибиторы ФДЭ5 [17]. На сегодняшний день препараты данного фармакологического класса относятся к первой линии терапии эректильной дисфункции; зарегистрировано несколько препаратов в различных лекарственных формах, а также новые для них показания (в частности, артериальная легочная гипертензия) [17].
Изучение ФДЭ4 и паттерна экспрессии данного фермента позволило разработать и зарегистрировать ряд препаратов для лечения воспалительных заболеваний легких и кожи. Рофлумиласт на данный момент является единственным ингибитором ФДЭ4 для лечения хронической обструктивной болезни легких [18]. В масштабных клинических исследованиях (КИ) показано, что применение рофлумиласта снижает число обострений и улучшает показатели функции внешнего дыхания (объем форсированного выдоха за первую секунду) [19]. Также ведется активная разработка ингаляционных форм рофлумиласта для преодоления трудностей в применении препарата, связанных с его узким терапевтическим диапазоном. Помимо рофлумиласта в мире на сегодняшний день зарегистрировано еще как минимум два соединения, способных селективно ингибировать ФДЭ4: крисаборол (для лечения атопического дерматита) и апремиласт (для лечения псориаза) [20]. Также к селективным ингибиторам ФДЭ4 принадлежит хорошо известный в России и других странах постсоветского пространства препарат дротаверин, используемый в качестве спазмолитика.
Относительно многочисленная группа селективных ингибиторов ФДЭ3 включает как негликозидные кардиотоники (левосимендан), так и препараты венодилатирующего действия (цилостазол), которые используют для терапии перемежающейся хромоты и облитерирующего тромбангиита. В июле 2024 г. FDA одобрен для медицинского применения двойной ингибитор ФДЭ энсифетрин для лечения хронической обструктивной болезни легких, обладающий как бронходилатирующим (за счет блокады ФДЭ3), так и противовоспалительным (за счет выключения ФДЭ4) действием.
Общая характеристика ФДЭ10А
Клинический и коммерческий успех вышеописанных селективных ингибиторов ФДЭ пробудил интерес к изучению терапевтического потенциала селективных ингибиторов других ФДЭ, среди которых особенно важное значение для психофармакологов имеет ФДЭ10A. Данный тип ФДЭ, способный катализировать гидролиз как цАМФ, так и цГМФ, был открыт в 1999 г. [15]. Первоначально была опубликована нуклеотидная последовательность гена человеческой ФДЭ10А (PDE10A), затем эта информация была дополнена структурами того же гена для мышей и других грызунов [21]. Полученные данные о нуклеотидных последовательностях генов, кодирующих ФДЭ10A у организмов разных видов, свидетельствуют о высокой степени гомологии белка ФДЭ10A у млекопитающих, достигающей 95% для молекулы в целом и 98% для каталитического центра фермента [22]. Высокая межвидовая консервативность ФДЭ10А облегчает трансляцию результатов исследований фармакодинамических свойств веществ-ингибиторов от лабораторных животных в клинику.
Ген PDE10A имеет сложное строение (32 экзона у человека, по 30 экзонов у крыс и мышей), поэтому вследствие альтернативного сплайсинга мРНК могут образовываться различные транскрипты и структурные варианты (изоформы) белка ФДЭ10А. В 1999 г. были описаны два варианта этого фермента у человека: 10А1 (цитоплазматический) и 10А2 (мембранный) [23][24]. В 2016 г. при изучении образцов человеческого стриатума была описана третья изоформа — ФДЭ10А19. Иммуноцитохимическим методом было показано, что вариант фермента 10А19, так же как и 10А1, функционирует преимущественно в цитоплазме [25]. В 2017 г. в головном мозге человека методом РНК-секвенирования были детектированы еще 12 изоформ ФДЭ10А (10А20–10А31) [26]. Таким образом, на сегодняшний день известно не менее 15 вариантов белка ФДЭ10А, способных функционировать в головном мозге человека, из них наиболее подробно описаны 10А1, 10А2 и 10А19 [26].
У крыс также существуют несколько сплайсинговых вариантов ФДЭ10А [22]. В целом у млекопитающих описаны более 30 транскриптов ФДЭ10А, образующихся в результате альтернативного сплайсинга [27]. Важно отметить, что все изоформы ФДЭ10А различаются между собой со стороны N-конца полипептидной цепи (то есть в области регуляторного домена фермента), в то время как часть молекулы со стороны C-конца (каталитический домен фермента) является консервативной [24].
Распределение ФДЭ10А в организме отличается высоким уровнем специфичности в отношении головного мозга и семенников. В головном мозге детектирован высокий уровень экспрессии в дорсальном стриатуме, то есть в хвостатом ядре и скорлупе [28]. В частности, при исследовании микросрезов головного мозга крысы методом количественной полимеразной цепной реакции [29] выявлено, что содержание мРНК ФДЭ10А в полосатом теле на порядок выше, чем в других отделах головного мозга (табл. 2). Бóльшая часть опубликованных данных об экспрессии ФДЭ данного семейства получена при проведении исследований на крысах, но установлено, что паттерн экспрессии ФДЭ10 у млекопитающих не имеет существенных межвидовых различий [21].
Таблица 2. Количественное распределение мРНК фосфодиэстеразы типа 10А (ФДЭ10А) в тканях крыс
Table 2. Quantitative distribution of phosphodiesterase 10A (PDE10A) mRNA in rat tissues
Ткань крысы Rat tissue | Экспрессия мРНК ФДЭ10А* (доля относительно префронтальной коры) PDE10A mRNA expression* (relative to that in the prefrontal cortex) |
Центральная нервная система Central nervous system | |
Головной мозг в целом Total brain | 1,1 |
Префронтальная кора Prefrontal cortex | 1 |
Полосатое тело Corpus striatum | 13,1 |
Гиппокамп Hippocampus | 0,62 |
Мозжечок Cerebellum | 0,54 |
Кора головного мозга Cortex | 0,89 |
Таламус Thalamus | 0,34 |
Спинной мозг Spinal cord | 0,18 |
Периферические ткани Peripheral tissues | |
Печень Liver | 0,0004 |
Легкие Lungs | 0,0024 |
Семенники Testes | 0,5 |
Сердце Heart | 0,033 |
Почки Kidneys | 0,013 |
Таблица составлена авторами по данным источника [29] / The table is adapted from [29]
* Уровни мРНК ФДЭ10A определяли методом количественной полимеразной цепной реакции и нормализовали по отношению к экспрессии, наблюдаемой в префронтальной коре.
* PDE10A mRNA levels were determined by quantitative polymerase chain reaction (PCR) and normalised to the expression observed in the prefrontal cortex.
Экспрессия ФДЭ в полосатом теле — яркий пример клеточноспецифичной экспрессии данных ферментов. Экспрессия ФДЭ10А (как мРНК, так и собственно белка) наблюдается преимущественно в среднеразмерных шипиковых нейронах (medium-sized spiny neurons, MSNs), составляющих 90–95% всей нейрональной популяции данной структуры центральной нервной системы [30]. В этих клетках экспрессируется и ФДЭ1В. Среди других стриарных ФДЭ стоит отметить ФДЭ4, контролирующую уровень циклических нуклеотидов в дофаминовых окончаниях в полосатом теле [31], а также ФДЭ1А2, работающую в холинергических гигантских бесшипиковых нейронах [32].
MSNs играют важную роль в процессах регуляции движений и ряде других функций мозга. Выделяют два типа этих нейронов в зависимости от преимущественно экспрессируемых дофаминовых рецепторов: D1 или D2 [33]. D1-экспрессирующие MSNs являются частью «прямого» кортико-стриато-таламо-кортикального пути, и их активация приводит к усилению сигнала, передаваемого в корковые структуры. D2-содержащие нейроны, входящие в состав «непрямого» пути, выполняют противоположную функцию. Активация D1-рецепторов приводит к увеличению концентрации циклических нуклеотидов в нейронах и последующему увеличению нейрональной активности, в то время как активация D2-рецепторов обладает обратным эффектом [33][34].
При фармакологическом ингибировании ФДЭ10A повышается содержание цАМФ и цГМФ как в D1-, так и в D2-экспрессирующих MSNs, что функционально соответствует блокаде D2- и активации D1-рецепторов [33]. Подробнее данный механизм представлен на рисунке 1.
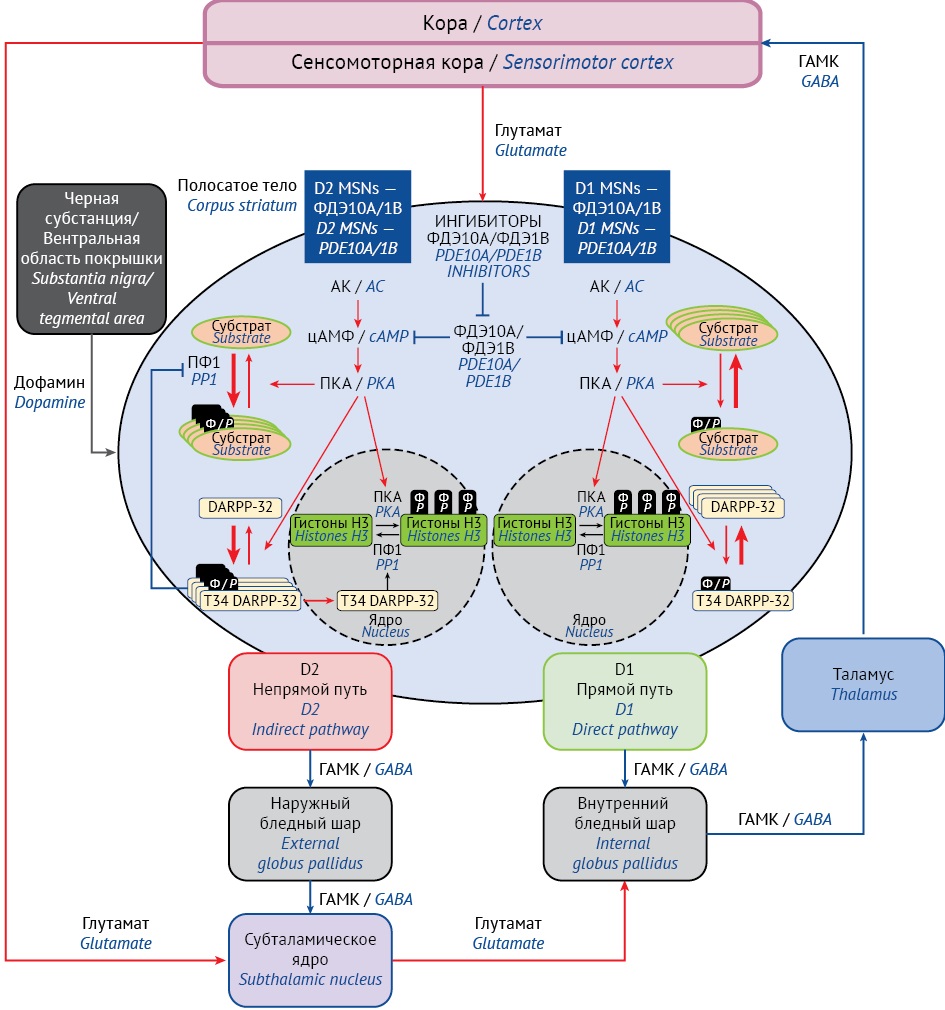
Рисунок подготовлен авторами / The figure is prepared by the authors
Рис. 1. Молекулярный механизм фармакологического ингибирования фосфодиэстеразы типа 10А (ФДЭ10А). MSNs — среднеразмерные шипиковые нейроны; AK — аденилатциклаза; цАМФ — циклический аденозин монофосфат; ПKA — протеинкиназа А; Субстрат — мишени для фосфорилирования/дефосфорилирования; ПФ1 — протеинфосфатаза 1; DARPP-32 — белок, регулируемый дофамином и цАМФ; T34 DARPP-32 — фосфорилированная форма DARPP-32; Ф — фосфатный остаток; ГАМК — гамма-аминомасляная кислота; ФДЭ1В — В-изоформа фермента фосфодиэстеразы 1; D1/D2 — нейроны, экспрессирующие дофаминовые рецепторы 1-го или 2-го типа соответственно
Fig. 1. Molecular mechanism of pharmacological inhibition of phosphodiesterase type 10A (PDE10A). MSNs, medium spiny neurons; AC, adenylate cyclase; cAMP, 3’,5’-cyclic adenosine monophosphate; PKA, protein kinase A; substrate, phosphorylation/dephosphorylation targets; PP1, protein phosphatase 1; DARPP-32, dopamine- and cAMP-regulated neuronal phosphoprotein; T34 DARPP-32, phosphorylated DARPP-32; P, phosphate residue; GABA, gamma-aminobutyric acid; PDE1B, B-isoform of phosphodiesterase 1; D1/D2, D1 or D2 receptor-expressing neurons
Таким образом, ингибиторы ФДЭ10А могут на системном уровне обладать как антипсихотическим, так и противопаркинсоническим действием [35][36]. Подобный механизм действия определяет гипотетическую возможность клинического использования ингибиторов ФДЭ10А, с одной стороны, в качестве антипсихотических препаратов со сниженным риском развития экстрапирамидных расстройств, а с другой — как противопаркинсонических средств, не вызывающих психотические эпизоды.
Еще одной потенциальной областью клинического применения ингибиторов ФДЭ10А является болезнь Гентингтона: благодаря использованию томографических методов диагностики доказано увеличение уровня экспрессии ФДЭ10А у пациентов с этим нейродегенеративным заболеванием еще до появления первых видимых симптомов [37].
Доклинические данные, полученные при исследовании ингибиторов ФДЭ10А
В научной литературе описано около двадцати ингибиторов ФДЭ10А, при этом некоторые из них фигурируют под различными названиями, что усложняет анализ доклинических и клинических данных. В таблице 3 представлены сведения об использованных для проведения доклинических исследований ингибиторах ФДЭ10А. Результаты оценки фармакодинамических свойств ингибиторов ФДЭ10A в экспериментах на лабораторных животных обобщены в таблице 4.
Таблица 3. Данные о концентрации полумаксимального ингибирования (IC50), полученные для ингибиторов фосфодиэстеразы типа 10А
Table 3. 50% inhibitory concentration (IC50) data for phosphodiesterase 10A (PDE10A) inhibitors2
МНН / Источник литературы | Альтернативные названия | Химическое название | IC50, нМ |
Мардеподект [38] | MP-10, PF-2545920 | 2-(4-(1-метил-4-пиридинил-4-ил)-1H-пиразол-3-ил)феноксиметил)хинолин | 0,37*; 1,04*; 1,34* |
– [39–41] | TP-10 | 2-{4-[ 4-пиридин-4-ил-1-(2,2,2-трифлюороэтил)-1Н-пиразол-3-ил]-феноксиметил}-хинолин | 0,3*,**; 1,0*; 1,41* |
Папаверин [39] | – | 1-[ (3,4-диметоксифенил)метил]-6,7-диметоксиизохинолин | 40* |
Балиподект [42][43] | TAK-063 | 1-(2-флюоро-4-(1H-пиразол-1-ил)фенил)-5-метокси-3-(1-фенил-1H-пиразол-5-ил)пиридазин-4(1H)-он | 0,3* |
– [44] | AMG 579 | 1-(4-(3-(4-(1Н-бензо[д]имидазол-2-карбонил)фенокси)пиразин-2-ил)пиперидин-1-ил)этанон | 0,1* |
– [63] | JNJ-42314415 | 3-(6-(2-метоксиэтил)пиридин-3-ил)-2-метил-8-морфолин-4-илимидазо(1,2-a)пиразин | – |
– [45][46] | PQ-10, A-844337 | 6,7-диметокси-4-[ 3-(хиноксалин-2-илокси)пирролидин-1-ил]хиназолин | 16*; 64* |
– [47] | PDM-042 | (E)-4-(2-(2-(5,8-диметил-[ 1,2,4]триазоло[ 1,5-a]пиразин-2-ил)винил)-6-(пирролидин-1-ил)пиримидин-4-ил)морфолин | 0,83*; 0,82** |
– [48] | FRM-6308, EVP-6308 | – | 0,0114 |
– [73] | THPP-1, DA-78439, EX-A4562 | [ 2-(6-хлорпиридин-3-ил)-4-(2-метоксиэтокси)-7,8-дигидропиридо[ 4,3-д]пиримидин-6(5H)-ил](имидазо[ 1,5-a]пиридин-1-ил)метанон | – |
– [49] | PyP-1, GLXC-26773, PD128771 | N-[ (1-метил-1h-пиразол-4-ил)метил]-5-{[ (1s,2s)-2-(пиридин-2-ил)циклопропил]метокси}пиразоло[ 1,5-A]пиримидин-7-амин | – |
– [50] | BMS-843496 | 2-((4-хлор-6-((пиридин-3-илметил)амино)пиримидин-2-ил)амино)-N-этил-4-метилтиазол-5-карбоксамид | 2,11±0,7* |
– [51][52] | SEP-39 | 2-(2-(5,8-диметил-[ 1,2,4]триазоло[ 1,5-a]пиразин-2-ил)этил)-3H-имидазо[ 4,5-f]хинолин | 1,0*; 0,001 |
– [53] | ASP9436, cоединение 38b | 1-метил-5-(1-метил-3-{[ 4-(1-метил-1h-бензимидазол-4-ил)фенокси]метил}-1h-пиразол-4-ил)пиридин-2(1h)-он | 8,0* |
– [83] | Lu AF33241 | 1-(2-хлорфенил)-4,8-диметил-[ 1,2,4]триазоло[ 4,3-а]хиноксалин | – |
– [54] | MK-8189 | 2-метил-6-((2-(5-метилпиридин-2-ил)циклопропил)метокси)-N-((5-метил-1,3,4-тиадиазол-2-ил)метил)пиримидин-4-амин | 1,6* |
– [55] | EM-221, MR1916 | N-бутил-11-[ (7R,8R,9S,13S,14S,16R,17S)-16-флюоро-3,17-дигидрокси-13-метил-6,7,8,9,11,12,14,15,16,17-декагидроциклопента[a]фенантрен-7-ил]-N-метилундеканамид | 0,022*,** |
– [55] | CPL500036 | {7-[ 5,8-диметил-(1,2,4) триазоло (1,5-а)пиразин-2-ил]-2-фенилимидазо(1,2-а) пиримидин} | 1,0* |
– [56] | RO5545965, RG7203 | 2-(4-(1-метил-4-пиридин-4-ил-1H-пиразол-3-ил)феноксиметил)хинолин | 0,37 |
Гемлаподект [24] | RO554965, NOE-105 | 2-{4-[ 4-пиридин-4-ил-1-(2,2,2-трифторэтил)-1Н-пиразол-3-ил]-феноксиметил}-хинолин | 0,3; 1,0; 1,41 |
– [57] | MT-3014 | 1-({2-(7-флюоро-3-метилхиноксалин-2-ил)-5-[ (3R)-3-флюоропирролидин-1-ил]пиразоло[ 1,5-α]пиримидин-7-ил}амино)-2-метилпропан-2-ол гидрохлорид | 0,062–0,357* |
– [58] | T-251 | 2-[ (E)-2-(7-флюоро-3-метилхиноксалин-2-ил)винил]-6-пирролидин-1-ил-N-(тетрагидро-2H-пиран-4-ил)пиримидин-4-амин гидрохлорид | 0,05* |
– [59] | T-773 | [ 1-[ 2-флюоро-4-(тетрагидро-2Н-пиран-4-ил)фенил]-5-метокси-3-(1-фенил-1Н-пиразол-5-ил)пиридазин-4(1Н)-он] | 0,77* |
– [35][59] | T-609, соединение 19e, соединение 1 | (1-[ циклопропилметил]-4-флюоро-5-[ 5-метокси-4-оксо-3-(1-фенил-1H-пиразол-5-ил)пиридазин-1(4H)-ил]-3,3-диметил-1,3-дигидро-2H-индол-2-он] | 0,08* |
– [60] | WEB 3 | 8-метокси-3-метил-4-метилсульфониламино-1-пропил-имидазо-[ 1,5-a]пиридо[ 3,2-e]пиразин | 7,28* |
– [60] | WEB 6 | 3,4-диметил-8-метокси-1-пропил-имидазо[ 1,5-а]пиридо[ 3,2-е]-пиразин | 7,16* |
– [56] | PBF-999 | 5-бром-N-(проп-2-ин-1-ил)-2-(1H-1,2,4-триазол-1-ил)пиримидин-4,6-диамин | 8,2* |
– [61] | OMS643762, OMS824 | N-(3-(4-(2-(4-(трифлюорометил)фенил)тиазол-2-ил)тиазол-4-ил)пиперидин-1-ил)пропил)-2,6-диметилпиримидин-4-амин | 0,82* |
Таблица составлена авторами / The table is prepared by the authors
Примечание. МНН — международное непатентованное наименование; «–» — нет данных.
Note. INN, international non-proprietary name; –, no data.
* Homo sapiens, ** Rattus norvegicus, *** Mus musculus.
Таблица 4. Исследования ингибиторов фосфодиэстеразы типа 10А (ФДЭ10A) на лабораторных животных
Table 4. Animal studies of phosphodiesterase 10A (PDE10A) inhibitors3
Метод | Объект исследования / Модель | Фармакологический эффект | Наименование ингибитора ФДЭ10А | Источник литературы |
Оценка массы тела | Крысы стока Wistar | – | MT-3014 | [58] |
Оценка уровня пролактина плазмы крови | Крысы стока Wistar | – | ||
Крысы стока Sprague-Dawley | – (совместное введение с галоперидолом и оланзапином) | Балиподект | [62] | |
– | JNJ-42314415, PQ-10, TP-10, Мардеподект | [63] | ||
Оценка температуры тела | Крысы стока Wistar | ⇓ температуры тела (в высоких дозах после введения JNJ-42314415) | ||
Оценка локомоторной активности | Крысы стока Wistar / пренатальная экспозиция алкоголем (модель СДВГ) | ⇓ гиперактивности (открытое поле) | Папаверин* | [64] |
Крысы стока Wistar / пренатальная экспозиция вальпроевой кислотой (модель вальпроатного фетального синдрома) | ⇓ гиперактивности (открытое поле) | [65] | ||
Крысы стока Wistar / MK-801-вызванная гиперактивность | ⇓ двигательной активности у интактных животных ⇓ гиперактивности после MK-801 (открытое поле) | MT-3014 | [66] | |
⇓ гиперактивности (локомоторные боксы) | T-251 | [58] | ||
⇓ активности | MK-8189 | [54][67] | ||
Крысы стока Wistar / скополамин-вызванная гиперактивность | ⇓ гиперактивности (локомоторные боксы) | JNJ-42314415, PQ-10, TP-10, Мардеподект | [63] | |
Крысы стока Wistar / PCP-вызванная гиперактивность | ⇓ гиперактивности (локомоторные боксы) | |||
Крысы стока Wistar / d-амфетамин-вызванная гиперактивность | ⇓ гиперактивности (локомоторные боксы) | |||
Мыши стока ICR | – (локомоторные боксы) | Балиподект | [68] | |
Мыши стока ICR / MK-801-вызванная гиперактивность | ⇓ гиперактивности (локомоторные боксы) | [43] | ||
Мыши стока NMRI / d-амфетамин-вызванная гиперактивность | ⇓ гиперактивности (открытое поле) | JNJ-42314415, PQ-10, TP-10, Мардеподект | [36] | |
Мыши стока NMRI / SCH-23390-вызванная гипоактивность | ⇓ гипоактивности после SKF-82958 (открытое поле) | |||
Мыши стока NMRI / галоперидол-вызванная гипоактивность | – (открытое поле) | |||
Мыши линии C57BL/6J / MK-801- и метамфетамин-вызванная гиперактивность | ⇓ гиперактивности (локомоторные боксы) | T-609, T-773 | [59] | |
Оценка локомоторной активности | Крысы стока Sprague-Dawley | – (локомоторные боксы) | Балиподект | [68] |
Крысы стока Sprague-Dawley / MK-801- и метамфетамин-вызванная гиперактивность | ⇓ гиперактивности (локомоторные боксы) | Балиподект | [62] | |
⇓ гиперактивности (локомоторные боксы) | Балиподект | [69] | ||
⇓ гиперактивности (локомоторные боксы) | Мардеподект | [35] | ||
⇓ гиперактивности (локомоторные боксы) | Соединение 13a | [70] | ||
Крысы стока Sprague-Dawley / фенциклидин-вызванная гиперактивность | ⇓ гиперактивности (открытое поле) | Соединение 73, Соединение 77 | [71] | |
⇓ гиперактивности (открытое поле) | SEP-39 | [51] | ||
⇓ гиперактивности (открытое поле) | AMG579 | [44] | ||
Мыши линии R6/2 Tg / модель болезни Гентингтона | ⇑ двигательной активности (открытое поле) | Балиподект | [72] | |
Крысы стока Wistar / MK-801-вызванная гиперактивность | ⇓ гиперактивности (открытое поле) | THPP-1 | [73] | |
Макаки-резус / амфетамин-вызванная гиперактивность | ⇓ гиперактивности (датчик-акселерометр) | [74] | ||
DAT-KO крысы / αMPT-вызванная гипоактивность | ⇑ двигательной активности (локомоторные боксы) | Мардеподект | [75] | |
Крысы стока Wistar / гипоактивность, вызванная тетрабеназином | Мардеподект, Гемлаподект | [76] | ||
Моделирование моторных нарушений | Макаки-крабоед / МФТП-вызванный паркинсонизм | ⇓ числа дискинезий после применения леводопы | MR1916 | [77] |
Макаки-резус | Не вызывает моторных нарушений (шкала MDS, тест Klüver Board, шкала DENS). Не влияет на удержание позы (perch тест) | FRM-6308 | [48] | |
Капуцины-фавн | Вызывает экстрапирамидные нарушения | Мардеподект | [78] | |
Тест подвешивания за хвост | Мыши линии R6/2 Tg / модель болезни Гентингтона | ⇓ числа животных с нарушением рефлекса разведения конечностей | Балиподект | [72] |
⇓ продолжительности нарушенного рефлекса разведения конечностей | TP-10 | [79] | ||
Мыши линии C57BL/6J / МФТП-индуцированный паркинсонизм | ⇑ продолжительности нахождения животного на стержне | Мардеподект | [80] | |
Мыши линии R6/2 Tg / модель болезни Гентингтона | – | Балиподект | [72] | |
Предотвращение возникновения дефицита | TP-10 | [79] | ||
Тест на шесте | Мыши линии C57BL/6J / MФТП-индуцированный паркинсонизм | ⇓ времени спуска с шеста | Мардеподект | [80] |
Оценка выраженности каталепсии | Крысы стока Wistar | Вызывает каталепсию (тест с перекладиной) | MT-3014 | [66] |
Не вызывают каталепсию (тест с перекладиной) | T-251 | [58] | ||
Не вызывают каталепсию, при сочетанном применении с D1 антагонистом наблюдается каталепсия | JNJ-42314415, PQ-10, TP-10, Мардеподект | [70] | ||
Крысы стока Sprague-Dawley | Не вызывает каталепсию (тест с перекладиной) | MR1916 | [81] | |
Не вызывает каталепсию (тест с перекладиной) | Балиподект | [62] | ||
Вызывает каталепсию (тест с перекладиной) | [43] | |||
Вызывает каталепсию (тест с перекладиной) | PDM-042 | [82] | ||
Не вызывает каталепсию (тест с решеткой) | Lu AF33241 | [83] | ||
Вызывает каталепсию (тест с перекладиной) | SEP-39 | [51] | ||
Крысы стока Sprague-Dawley | Не вызывают каталепсию (тест с решеткой) | Мардеподект | [84] | |
DAT-KO крысы / αMPT-индуцированная каталепсия | ⇓ времени в «позе лектора» | Мардеподект | [75] | |
Y-образный лабиринт Y-maze | Крысы стока Wistar / пренатальная экспозиция алкоголем (модель СДВГ) | ⇑ относительного числа спонтанных чередований рукавов | Папаверин* | [64] |
Крысы стока Wistar / пренатальная экспозиция вальпроевой кислотой (модель фетального вальпроатного синдрома) | ⇑ относительного числа спонтанных чередований рукавов | Папаверин* | [65] | |
Мыши ICR / PCP-индуцированный дефицит | ⇓ общего числа входов в рукава | Балиподект | [68] | |
Приподнятый крестообразный лабиринт | Крысы стока Wistar / пренатальная экспозиция алкоголем (модель СДВГ) | ⇑ относительного времени, проведенного в открытом рукаве, и относительного числа входов в открытый рукав | Папаверин* | [64] |
Крысы стока Wistar / пренатальная экспозиция вальпроевой кислотой (модель фетального вальпроатного синдрома) | Папаверин* | [65] | ||
Радиальный лабиринт | Крысы стока Long-Evans | ⇓ числа ошибок, вызванных введением MK-801 | Балиподект | [68] |
Преимпульсное ингибирование | Крысы стока Wistar / MK-801-индуцированный дефицит | ⇑ преимпульсного ингибирования | MT-3014 | [66] |
T-251 | [58] | |||
Мыши линии C57BL/6J | – | T-609 | [59] | |
Преимпульсное ингибирование | Мыши линии C57BL/6J | ⇑ преимпульсного ингибирования | T-773 | [59] |
Балиподект | [35] | |||
– | Мардеподект | |||
Мыши стока ICR / MK-801-индуцированный дефицит | ⇑ преимпульсного ингибирования в комбинации с субэффективными дозами антипсихотиков | Балиподект | [62] | |
Крысы стока Sprague-Dawley / Фенциклидин-индуцированный дефицит | ⇑ преимпульсного ингибирования | Соединение 73, Соединение 77 | [71] | |
Соединение 13a | [70] | |||
Крысы стока Sprague-Dawley / MK-801-индуцированный дефицит | ⇑ преимпульсного ингибирования | MK-8189 | [67] | |
Условнорефлекторная реакция активного избегания | Крысы стока Wistar | Подавляет реакцию избегания | MT-3014 | [66] |
T-251 | [58] | |||
Lu AF33241 | [83] | |||
MK-8189 | [67] | |||
Крысы стока Sprague-Dawley | Подавляет реакцию избегания | MR1916 | [81] | |
Подавляет реакцию избегания | Соединение 13a | [70] | ||
Крысы стока Wistar | THPP-1 | [73] | ||
Изучение моторных реакций, вызванных введением апоморфина | Мыши линии Swiss albino | ⇓ апоморфин-индуцированной вертикализации (обнюхивание и лазание) | Соединение 13a | [70] |
Крысы стока Wistar | ⇓ апоморфин-индуцированной ажитации | JNJ-42314415, PQ-10, TP-10, Мардеподект | [36] | |
Крысы стока Wistar | ⇓ апоморфин-индуцированной cтереотипии | [63] | ||
Реакции самовведения этанола | Крысы стока Wistar | ⇓ реакции самовведения этанола и сахарина без влияния на способность нажатия на педаль | TP-10 | [85] |
Реакция условнорефлекторного предпочтения места | Крысы стока Wistar | Предпочтение места не отмечалось | ||
Тест вынужденного плавания | Мыши стока NMRI / Увеличение времени «пассивного» плавания, вызванное введением MK-801 (модель негативных симптомов при шизофрении) | ⇑ «активного» плавания у модельных животных | Мардеподект, WEB 3, WEB 6 | [60] |
Тест распознавания новых объектов | Крысы стока Long-Evans / MK-801-индуцированный дефицит | ⇑ времени изучения нового объекта | MT-3014 | [81] |
Крысы стока Sprague-Dawley | MR1916 | [81] | ||
⇑ времени изучения нового объекта | PDM-042 | [82] | ||
Крысы стока Long-Evans | ⇑ времени изучения нового объекта | T-773 | [59] | |
Крысы стока Wistar / MK-801-индуцированный дефицит | T-251 | [58] | ||
Крысы стока Long-Evans | Балиподект | [68] | ||
SEP-39 | [51] | |||
Капюшонные крысы Листера (сток) / субхроническое введение PCP (модель когнитивных нарушений) | Lu AF33241 | [83] | ||
Крысы стока Wistar / MK-801-индуцированный дефицит (модель когнитивных нарушений) | PQ-10 | [86] | ||
Крысы стока Wistar / скополамин-индуцированный дефицит (модель когнитивных нарушений) | – | |||
Крысы стока Wistar | ⇑ времени изучения нового объекта | THPP-1, MK-8189 | [54][73] | |
Тест поиска объекта | Макаки-резус / кетамин-индуцированный дефицит (модель когнитивных нарушений) | ⇑ относительного числа успешного нахождения объекта с первого раза | THPP-1 | [73] |
MK-8189 | [67] | |||
Тест на внимание «Пять отверстий» | Крысы стока Long-Evans | ⇑ числа успешных откликов ⇑ числа пропусков ⇓ числа преждевременных нажатий | Балиподект | [68] |
Тест на переключаемость внимания | Крысы стока Sprague-Dawley | ⇑ когнитивной гибкости | Мардеподект | [87] |
Тест с горячей пластиной | Крысы стока Wistar / пренатальная экспозиция вальпроевой кислотой (модель фетального вальпроатного синдрома) | ⇓ длительности латентного периода одергивания/облизывания лапы | Папаверин* | [65] |
Оценка судорожной активности | Мыши линии R6/2 Tg / модель болезни Гентингтона | ⇓ числа судорог | Балиподект | [72] |
Таблица составлена авторами / The table is prepared by the authors
Примечание. Трактовка моделей нейропсихических расстройств дана в соответствии с мнением авторов. СДВГ — синдром дефицита внимания с гиперактивностью; αMPT — α-метил-паратирозин; DAT-KO крысы — крысы, нокаутные по гену дофаминового транспортера; PCP — фенциклидин; MФTП — 1-метил-4-фенил-1,2,3,6-тетрагидропиридин; MDS — шкала Международного общества изучения двигательных расстройств; DENS — шкала для оценки воздействия лекарственных средств на нервную систему; «–» — нет эффекта; ⇑ — увеличение эффекта; ⇓ — уменьшение эффекта.
* Папаверин — относительно селективный ингибитор ФДЭ10A, также обладающий значимой аффинностью и к другим ФДЭ.
Note. This is the authors’ own rendering of neuropsychiatric disorder models. ADHD, attention-deficit/hyperactivity disorder; áMPT, á-methyl-p-tyrosine; DAT-KO, dopamine transporter knockout rats; PCP, phencyclidine; MPTP, 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine; MDS, Movement Disorder Society; DENS, Drug Effects on the Nervous System; —, no effect; ⇑, increase; ⇑, decrease.
* Papaverine is a relatively selective PDE10A inhibitor, albeit with significant affinity to other PDEs.
Массив данных, полученных при оценке фармакодинамических ингибиторов ФДЭ10A на лабораторных животных (табл. 4), достаточно велик. Результаты большинства приведенных исследований свидетельствуют о том, что ингибиторы ФДЭ10A обладают эффектами, характерными для антипсихотиков, и способны подавлять у животного условнорефлекторную реакцию активного избегания и увеличивать преимпульсное ингибирование как при изолированном применении, так и в комбинации с субэффективными дозами антипсихотиков, а также снижать локомоторную активность при введении интактным животным и устранять гиперактивность, вызванную введением психостимуляторов (d-амфетамин, апоморфин, MK-801, фенциклидин).
Ингибиторы ФДЭ10A выгодно отличаются от существующих существующих антипсихотиков сниженным потенциалом развития типичных для них нежелательных явлений. Так, введение лабораторным животным веществ с данным механизмом действия практически не приводит к развитию каталепсии, гиперпролактинемии, а также метаболических нежелательных явлений, в первую очередь, увеличения массы тела.
Существуют данные об эффективности ингибиторов ФДЭ10A в различных моделях болезни Паркинсона. Так, сочетанное применение ингибиторов ФДЭ10A и леводопы (стандарт терапии болезни Паркинсона) у макак после введения 1-метил-4-фенил-1,2,3,6-тетрагидроперидина (МФТП) способствует снижению проявлений дискинезии, наблюдаемой при использовании леводопы, без снижения противопаркинсонических эффектов [77]. На МФТП-модели болезни Паркинсона у мышей действие ингибитора ФДЭ10A сопровождалось уменьшением выраженности моторных нарушений, в частности, увеличивалось время нахождения животного на стержне в тесте «вращающийся стержень» и снижалось время спуска в тесте на шесте [80].
На доклинических моделях болезни Гентингтона для снижения проявлений локомоторного дефицита у генетически модифицированных мышей с встроенным человеческим аномальным геном HTT (ген, кодирующий гентингтин) применяют ингибиторы ФДЭ10A, что сопровождается: увеличением двигательной активности животных в тесте «открытое поле» [72]; предотвращением развития моторных нарушений в тесте «вращающийся стержень» и тесте подвешивания за хвост [72][79]; снижением частоты развития судорог у R6/2 мышей с низким порогом развития судорожной активности (триггером к развитию судорог выступало погружение животных в воду) [72].
В ряде публикаций также описаны прокогнитивные эффекты ингибиторов ФДЭ10A, проявляющиеся увеличением времени изучения нового объекта в тесте распознавания новых объектов у интактных животных и крыс, находящихся под действием психостимуляторов [51][58][59][66][68][81–83]; увеличением шанса обнаружения объекта в тесте поиска объекта у макак после введения кетамина [73]; увеличением числа успешных ответов в тесте для оценки внимания «Пять отверстий» (5-Choice-serial-reaction time task) у крыс [68]; увеличением когнитивной гибкости в тесте на переключаемость внимания (Set shifting) у крыс [87].
Несмотря на значительный объем данных об эффективности ингибиторов ФДЭ10А на различных моделях in vivo, в ходе последующей клинической разработки предпочтение было отдано лишь ограниченному числу показаний: болезнь Гентингтона, болезнь Паркинсона и шизофрения.
Клиническая разработка ингибиторов ФДЭ10А
ФДЭ10А является перспективной терапевтической мишенью (табл. 4) для разработки новых антипсихотиков, не вызывающих экстрапирамидных нарушений и других нежелательных эффектов, характерных для психоактивных веществ данной группы [88]. Разработкой этого класса соединений занимались более пятнадцати фармацевтических компаний, а на этап КИ были выведены более десяти молекул-кандидатов. Зарегистрированные за последнее время патенты свидетельствуют о сохранении исследовательского интереса к ингибиторам ФДЭ10А (табл. 5).
Таблица 5. Патенты, относящиеся к изучению ингибиторов фосфодиэстеразы типа 10А
Table 5. Patents relevant to studying phosphodiesterase 10A (PDE10A) inhibitors4
Номер патента | Год | Патентодержатель | Описание |
WO 2024/206200 A1 | 2024 | Dinunzio James C, Harris David, Kumar Maria Sharlini, Pollitt Michael John, Radojevic Jovana, Terife Graciela | Таблетированные формы с контролируемым высвобождением 2-метил-N-((5-метил-1,3,4-тиадиазол-2-ил)метил)-6-(((1S,2S)-2-(5-метилпиридин-2-ил)циклопропил)метокси)пиримидин-4-амина (соединение А) и их применение при лечении шизофрении и других психиатрических расстройств с улучшенным профилем переносимости |
WO 2022/162193 A1 | 2022 | Garibaldi George | Cпособы лечения расстройства беглости речи у детей ингибиторами ФДЭ10A |
CN 118255747 A | 2024 | Guo Lei, Huang Hongzhe, Yuan Han, Wu Jiafei, Yang Yi, Yang Dongjing | Производное пиразола, характеризующееся более высокой селективностью и периодом полувыведения |
JP 2024112854 A | 2024 | Mahindra Makhija | Ингибитор ФДЭ10A 1-[ 2-фтор-4-(1H-пиразол-1-ил)фенил]-5-метокси-3-(1-фенил-1H-пиразол-5-ил)пиридазин-4(1H) и его соль для терапии расстройств аутистического спектра |
WO 2022/060978 A1 | 2022 | During Matthew | Лечение дискинезии, вызванной леводопой, эпизодов «выключения», связанных с болезнью Паркинсона, и психоза при болезни Паркинсона с помощью ингибитора ФДЭ10A, например, 1-[ 2-фтор-4-(1H-пиразол-1-ил)фенил]-5-метокси-3-(1-фенил-1H-пиразол-5-ил)-пиридазин-4(1H)-она |
KR 20210148533 A | 2021 | Park Se Jin, Park Hyeon Bae, Kim So Yeon, Han Sang Deok, Lee Eun Seok, Kim Kyeong Min | Соединение для профилактики, облегчения или лечения когнитивных нарушений или психических заболеваний, содержащее экстракт Dracocephalum moldavica в качестве активного компонента |
Таблица составлена авторами / The table is prepared by the authors
Несмотря на убедительные результаты доклинических исследований, попытки трансляции ингибиторов ФДЭ10А в клиническую практику пока не увенчались успехом [89]. В частности, проверка клинической эффективности MP-10 (длительность терапии — 4 недели) у пациентов с шизофренией не выявила значимых улучшений течения заболевания при сравнении с плацебо [90]. Еще одно КИ эффектов MP-10 (длительность терапии — 12 недель) было остановлено по причине малой вероятности достижения эффективности [91]. Японская фармацевтическая компания Takeda при испытании другого ингибитора ФДЭ10А, TAK-063, также не смогла достичь первичных конечных точек при оценке антипсихотического потенциала изучаемой молекулы у целевой популяции [92], а компания H. Lundbeck A/S приостановила разработку собственного соединения данного класса (Lu AF11167) по причине недостижения эффективности в коррекции негативных симптомов шизофрении у пациентов в КИ II фазы (код КИ на clinicaltrials.gov: NCT03793712).
Единственным успешным КИ на 2024 г. остается исследование, проведенное компанией Merck&Co [93]. В рандомизированном многоцентровом двойном слепом КИ IIа фазы на пациентах с острой шизофренией тестировали действие ингибитора ФДЭ10А MK-8189 (12 мг один раз в сутки). Пациенты в контрольных группах получали плацебо или антипсихотик 2-го поколения рисперидон. Установлено, что прием MK-8189 в течение четырех недель сопровождался улучшением симптоматики (общая оценка по шкале PANSS), достигавшим уровня статистической значимости при анализе выраженности отдельных позитивных симптомов. Важно отметить, что у пациентов, получавших MK-8189, не увеличивалась масса тела (в отличие от группы позитивного контроля). Также отмечена малая выраженность экстрапирамидных нарушений, которые к тому же носили временный характер.
Клинические данные эффективности ингибиторов ФДЭ10A в рамках других показаний не оправдали ожиданий. Фармацевтической компанией Pfizer было проведено исследование II фазы в отношении применения MP-10 (длительность курса — 26 недель) у пациентов с болезнью Гентингтона для снижения выраженности симптомов заболевания, в рамках которого не было получено убедительных доказательств эффективности соединения [94].
Описанная череда неудач в КИ может быть связана с недостаточной степенью изученности ряда вопросов.
- Функция стриарных ФДЭ в норме и патологии. Например, повышение экспрессии ФДЭ10А у пациентов с болезнью Гентингтона может быть не частью патогенетического процесса, а компенсаторным ответом на его развитие.
- Эффекты долговременного фармакологического ингибирования ФДЭ10А. Основные результаты доклинических исследований, на основании которых строились предположения о потенциальной активности ингибиторов ФДЭ10A, были получены в экспериментах с однократным применением соединений. Однако ко многим фармакологически активным веществам может развиваться толерантность. В соответствии с данными, полученными в ПСПбГМУ им. акад. И.П. Павлова, десятидневное введение мардеподекта и гемлаподекта сопровождается снижением их активирующего действия на двигательную активность крыс, находящихся под действием тетрабеназина [76]. Молекулярные механизмы этой толерантности пока неизвестны, но можно предположить, что они могут быть связаны с компенсаторным повышением экспрессии других изоформ ФДЭ (например, ФДЭ1В) в D1-экспрессирующих MSNs. Косвенным доказательством возможности такого механизма служат результаты изучения экспрессии различных вариантов ФДЭ в стриатуме у мышей, нокаутных по гену, кодирующему ФДЭ1В. В данном исследовании продемонстрировано повышение уровня мРНК ФДЭ10А у животных-нокаутов [95].
- Рецепторные профили MSNsи система передачи информации внутри этих нейронов. ФДЭ10А является биспецифичным ферментом и способна катализировать распад не только цАМФ, но и цГМФ. Акцент на первый циклический нуклеотид, вероятно, объясняется повышенным вниманием исследователей к дофаминовым рецепторам, работающим через цАМФ-сигнальный каскад.
- Особенности работы и взаимодействия «прямого» и «непрямого» кортико-стриато-таламо-кортикальных путей на системном уровне. Хорошей иллюстрацией может служить функциональный D1-агонизм ингибиторов ФДЭ10А, который проявляется исключительно в условиях гиподофаминергии (например, под действием тетрабеназина) или блокады D2-рецепторов к дофамину (например, под действием галоперидола).
ЗАКЛЮЧЕНИЕ
В результате проведенного анализа данных литературы о доклиническом и клиническом применении ингибиторов фосфодиэстеразы типа 10А показано, что благодаря почти селективному расположению в MSNs полосатого тела, ФДЭ10А — перспективная фармакологическая мишень для разработки новых препаратов с минимальным количеством нежелательных эффектов для лечения ряда нейропсихических патологий, включая шизофрению, болезнь Паркинсона и болезнь Гентингтона. Выявлены основные причины затруднений, которые могут возникать при переносе результатов доклинических исследований на этап клинических исследований селективных ингибиторов ФДЭ10А.
Представляется необходимым более детальное изучение механизма действия ФДЭ, активности MSNs и кортико-стриато-таламо-кортикальных путей. Заполнение имеющихся информационных лакун на всех уровнях изучения (субклеточном, клеточном и системном) создаст условия для дальнейшей разработки ингибиторов ФДЭ10А.
Дополнительная информация. Перевод таблиц 1, 3, 4, 5 на английский язык размещен на сайте журнала «Регуляторные исследования и экспертиза лекарственных средств».
https://doi.org/10.30895/1991-2919-2025-723-table
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: И.М. Суханов — концепция работы, написание текста рукописи, формулировка заключения и утверждение окончательного варианта рукописи; А.Р. Доротенко, А.А. Савченко, М.А. Тур — сбор и анализ данных литературы по доклиническим исследованиям; Г.В. Искаревский — анализ данных литературы, подготовка рисунка и таблиц; А.С. Улитина — написание разделов рукописи о молекулярных механизмах действия фосфодиэстеразы.
Благодарности. Авторы глубоко признательны д-ру хим. наук Владимиру Владимировичу Шаройко за помощь в определении химических названий соединений.
Additional information. Tables 1, 3, 4, and 5 are published on the website of Regulatory Research and Medicine Evaluation.
https://doi.org/10.30895/1991-2919-2025-723-table
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Ilya М. Sukhanov conceptualised the study, drafted the manuscript, formulated the conclusions, and approved the final version of the manuscript for publication. Аrtem R. Dorotenko, Аrtem А. Savchenko, and Margarita А. Tur searched and analysed literature on preclinical studies. Grigorii V. Iskarevskii analysed literature data and prepared the figure and tables. Anna S. Ulitina drafted the sections of the manuscript on the molecular mechanisms of phoshodiesterases.
Acknowledgements. The authors are deeply grateful to Vladimir V. Sharoyko, Dr. Sci. (Chem.), for assistance with the chemical nomenclature.
1. Перевод таблицы 1 на английский язык размещен на сайте журнала / See the English version at https://doi.org/10.30895/1991-2919-2025-723-table
2. Перевод таблицы 3 на английский язык размещен на сайте журнала / See the English version at https://doi.org/10.30895/1991-2919-2025-723-table
3. Перевод таблицы 4 на английский язык размещен на сайте журнала / See the English version at https://doi.org/10.30895/1991-2919-2025-723-table
4. Перевод таблицы 5 на английский язык размещен на сайте журнала / See the English version at https://doi.org/10.30895/1991-2919-2025-723-table
Список литературы
1. Maurice DH, Ke H, Ahmad F, Wang Y, Chung J, Manganiello VC. Advances in targeting cyclic nucleotide phosphodiesterases. Nat Rev Drug Discov. 2014;13(4):290–314. https://doi.org/10.1038/nrd4228
2. Komatsu H, Fukuchi M, Habata Y. Potential utility of biased GPCR signaling for treatment of psychiatric disorders. Int J Mol Sci. 2019;20(13):3207. https://doi.org/10.3390/IJMS20133207
3. Conti M, Beavo J. Biochemistry and physiology of cyclic nucleotide phosphodiesterases: Essential components in cyclic nucleotide signaling. Annu Rev Biochem. 2007;76:481–511. https://doi.org/10.1146/annurev.biochem.76.060305.150444
4. Omori K, Kotera J. Overview of PDEs and their regulation. Circ Res. 2007;100(3):309–27. https://doi.org/10.1161/01.RES.0000256354.95791.F1
5. Michibata H, Yanaka N, Kanoh Y, Okumura K, Omori K. Human Ca2+/calmodulin-dependent phosphodiesterase PDE1A: Novel splice variants, their specific expression, genomic organization, and chromosomal localization. Biochim Biophys Acta. 2001;1517(2):278–87. https://doi.org/10.1016/S0167-4781(00)00293-1
6. Fidock M, Miller M, Lanfear J. Isolation and differential tissue distribution of two human cDNAs encoding PDE1 splice variants. Cell Signal. 2002;14(1):53–60. https://doi.org/10.1016/S0898-6568(01)00207-8
7. Rosman GJ, Martins TJ, Sonnenburg WK, Beavo JA, Ferguson K, Loughney K. Isolation and characterization of human cDNAs encoding a cGMP-stimulated 3’,5’-cyclic nucleotide phosphodiesterase. Gene. 1997;191(1):89–95. https://doi.org/10.1016/S0378-1119(97)00046-2
8. Degerman E, Belfrage P, Manganiello VC. Structure, localization, and regulation of cGMP-inhibited phosphodiesterase (PDE3). J Biol Chem. 1997;272(11):6823–6. https://doi.org/10.1074/JBC.272.11.6823
9. Wallace DA, Johnston LA, Huston E, MacMaster D, Houslay TM, Cheung YF, et al. Identification and characterization of PDE4A11, a novel, widely expressed long isoform encoded by the human PDE4A cAMP phosphodiesterase gene. Mol Pharmacol. 2005;67(6):1920–34. https://doi.org/10.1124/MOL.104.009423
10. Lin CS, Lau A, Tu R, Lue TF. Expression of three isoforms of cGMP-binding cGMP-specific phosphodiesterase (PDE5) in human penile cavernosum. Biochem Biophys Res Commun. 2000;268(2):628–35. https://doi.org/10.1006/BBRC.2000.2187
11. Cote RH. Characteristics of photoreceptor PDE (PDE6): Similarities and differences to PDE5. Int J Impot Res. 2004;16 Suppl 1:S28–33. https://doi.org/10.1038/SJ.IJIR.3901212
12. Glavas NA, Ostenson C, Schaefer JB, Vasta V, Beavo JA. T cell activation up-regulates cyclic nucleotide phosphodiesterases 8A1 and 7A3. Proc Natl Acad Sci USA. 2001; 98(11):6319–24. https://doi.org/10.1073/PNAS.101131098
13. Fisher DA, Smith JF, Pillar JS, St. Denis SH, Cheng JB. Isolation and characterization of PDE8A, a novel human cAMP-specific phosphodiesterase. Biochem Biophys Res Commun. 1998;246(3):570–7. https://doi.org/10.1006/BBRC.1998.8684
14. Fisher DA, Smith JF, Pillar JS, St. Denis SH, Cheng JB. Isolation and characterization of PDE9A, a novel human cGMP-specific phosphodiesterase. J Biol Chem. 1998;273(25):15559–64. https://doi.org/10.1074/JBC.273.25.15559
15. Fujishige K, Kotera J, Michibata H, Yuasa K, Takebayashi SI, Okumura K, et al. Cloning and characterization of a novel human phosphodiesterase that hydrolyzes both cAMP and GMP (PDE10A). J Biol Chem. 1999;274(26):18438–45. https://doi.org/10.1074/JBC.274.26.18438
16. Yuasa K, Kanoh Y, Okumura K, Omori K. Genomic organization of the human phosphodiesterase PDE11A gene. Evolutionary relatedness with other PDEs containing GAF domains. Eur J Biochem. 2001;268(1):168–78. https://doi.org/10.1046/J.1432-1327.2001.01866.X
17. Andersson KE. PDE5 inhibitors — pharmacology and clinical applications 20 years after sildenafil discovery. Br J Pharmacol. 2018;175(13):2554–65. https://doi.org/10.1111/BPH.14205
18. Phillips JE. Inhaled phosphodiesterase 4 (PDE4) inhibitors for inflammatory respiratory diseases. Front Pharmacol. 2020;11:259. https://doi.org/10.3389/FPHAR.2020.00259
19. Calverley PM, Rabe KF, Goehring UM, Kristiansen S, Fabbri LM, Martinez FJ. Roflumilast in symptomatic chronic obstructive pulmonary disease: Two randomised clinical trials. Lancet. 2009;374(9691):685–94. https://doi.org/10.1016/S0140-6736(09)61255-1
20. Crocetti L, Floresta G, Cilibrizzi A, Giovannoni MP. An overview of PDE4 inhibitors in clinical trials: 2010 to early 2022. Molecules. 2022;27(15):4964. https://doi.org/10.3390/MOLECULES27154964
21. Beavo J, Francis S, Houslay M, eds. Cyclic nucleotide phosphodiesterases in health and disease. Boca Raton: CRC Press; 2007. https://doi.org/10.1201/9781420020847
22. Fujishige K, Kotera J, Omori K. Striatum- and testis-specific phosphodiesterase PDE10A isolation and characterization of a rat PDE10A. Eur J Biochem. 1999;266(3):1118–27. https://doi.org/10.1046/J.1432-1327.1999.00963.X
23. Kotera J, Fujishige K, Yuasa K, Omori K. Characterization and phosphorylation of PDE10A2, a novel alternative splice variant of human phosphodiesterase that hydrolyzes cAMP and cGMP. Biochem Biophys Res Commun. 1999;261(3):551–7. https://doi.org/10.1006/BBRC.1999.1013
24. Zagorska A, Partyka A, Bucki A, Gawalskax A, Czopek A, Pawlowski M. Phosphodiesterase 10 inhibitors — novel perspectives for psychiatric and neurodegenerative drug discovery. Curr Med Chem. 2018;25(29):3455–81. https://doi.org/10.2174/0929867325666180309110629
25. Macmullen CM, Vick K, Pacifico R, Fallahi-Sichani M, Davis RL. Novel, primate-specific PDE10A isoform highlights gene expression complexity in human striatum with implications on the molecular pathology of bipolar disorder. Transl Psychiatry. 2016;6(2):e742. https://doi.org/10.1038/TP.2016.3
26. MacMullen CM, Fallahi M, Davis RL. Novel PDE10A transcript diversity in the human striatum: Insights into gene complexity, conservation and regulation. Gene. 2017;606:17–24. https://doi.org/10.1016/J.GENE.2016.12.033
27. Jankowska A, Świerczek A, Wyska E, Gawalska A, Bucki A, Pawłowski M, et al. Advances in discovery of PDE10A inhibitors for CNS-related disorders. Part 1: Overview of the chemical and biological research. Curr Drug Targets. 2019;20(1):122–43. https://doi.org/10.2174/1389450119666180808105056
28. Fujishige K, Kotera J, Yuasa K, Omori K. The human phosphodiesterase PDE10A gene genomic organization and evolutionary relatedness with other PDEs containing GAF domains. Eur J Biochem. 2000;267(19):5943–51. https://doi.org/10.1046/J.1432-1327.2000.01661.X
29. Seeger TF, Bartlett B, Coskran TM, Culp JS, James LC, Krull DL, et al. Immunohistochemical localization of PDE10A in the rat brain. Brain Res. 2003;985(2):113–26. https://doi.org/10.1016/S0006-8993(03)02754-9
30. Kawaguchi Y. Neostriatal cell subtypes and their functional roles. Neurosci Res. 1997;27(1):1–8. https://doi.org/10.1016/S0168-0102(96)01134-0
31. Nishi A, Kuroiwa M, Miller DB, O’Callaghan JP, Bateup HS, Shuto T, et al. Distinct roles of PDE4 and PDE10A in the regulation of cAMP/PKA signaling in the striatum. J Neurosci. 2008;28(42):10460–71. https://doi.org/10.1523/JNEUROSCI.2518-08.2008
32. Polli JW, Kincaid RL. Expression of a calmodulin-dependent phosphodiesterase isoform (PDE1B1) correlates with brain regions having extensive dopaminergic innervation. J Neurosci. 1994;14(3 Pt 1):1251–61. https://doi.org/10.1523/JNEUROSCI.14-03-01251.1994
33. Schülke JP, Brandon NJ. Current understanding of PDE10A in the modulation of basal ganglia circuitry. Adv Neurobiol. 2017;17:15–43. https://doi.org/10.1007/978-3-319-58811-7_2
34. Calabresi P, Picconi B, Tozzi A, Ghiglieri V, Di Filippo M. Direct and indirect pathways of basal ganglia: A critical reappraisal. Nat Neurosci. 2014;17(8):1022–30. https://doi.org/10.1038/NN.3743
35. Suzuki K, Harada A, Suzuki H, Miyamoto M, Kimura H. TAK-063, a PDE10A inhibitor with balanced activation of direct and indirect pathways, provides potent antipsychotic-like effects in multiple paradigms. Neuropsychopharmacology. 2016;41(9):2252–62. https://doi.org/10.1038/npp.2016.20
36. Megens AAHP, Hendrickx HMR, Mahieu MMA, Wellens ALY, de Boer P, Vanhoof G. PDE10A inhibitors stimulate or suppress motor behavior dependent on the relative activation state of the direct and indirect striatal output pathways. Pharmacol Res Perspect. 2014;2(4):e00057. https://doi.org/10.1002/PRP2.57
37. Niccolini F, Haider S, Reis Marques T, Muhlert N, Tziortzi AC, Searle GE, et al. Altered PDE10A expression detectable early before symptomatic onset in Huntington’s disease. Brain. 2015;138(Pt 10):3016–29. https://doi.org/10.1093/BRAIN/AWV214
38. Höfgen N, Stange H, Schindler R, Lankau HJ, Grunwald C, Langen B, et al. Discovery of imidazo[1,5-a]pyrido[3,2-e]pyrazines as a new class of phosphodiesterase 10A inhibitiors. J Med Chem. 2010;53(11):4399–411. https://doi.org/10.1021/JM1002793
39. Chappie TA, Helal CJ, Hou X. Current landscape of phosphodiesterase 10A (PDE10A) inhibition. J Med Chem. 2012;55(17):7299–331. https://doi.org/10.1021/JM3004976
40. Bauer U, Giordanetto F, Bauer M, O’Mahony G, Johansson KE, Knecht W, et al. Discovery of 4-hydroxy-1,6-naphthyridine-3-carbonitrile derivatives as novel PDE10A inhibitors. Bioorg Med Chem Lett. 2012;22(5):1944–8. https://doi.org/10.1016/J.BMCL.2012.01.046
41. Das S, Harde RL, Shelke DE, Khairatkar-Joshi N, Bajpai M, Sapalya RS, et al. Design, synthesis and pharmacological evaluation of novel polycyclic heteroarene ethers as PDE10A inhibitors: Part I. Bioorg Med Chem Lett. 2014;24(9):2073–8. https://doi.org/10.1016/J.BMCL.2014.03.054
42. Kunitomo J, Yoshikawa M, Fushimi M, Kawada A, Quinn JF, Oki H, et al. Discovery of 1-[2-fluoro-4-(1H-pyrazol-1-yl)phenyl]-5-methoxy-3-(1-phenyl-1H-pyrazol-5-yl)pyridazin-4(1H)-one (TAK-063), a highly potent, selective, and orally active phosphodiesterase 10A (PDE10A) inhibitor. J Med Chem. 2014;57(22):9627–43. https://doi.org/10.1021/JM5013648
43. Suzuki K, Harada A, Shiraishi E, Kimura H. In vivo pharmacological characterization of TAK-063, a potent and selective phosphodiesterase 10A inhibitor with antipsychotic-like activity in rodents. J Pharmacol Exp Ther. 2015;352(3):471–9. https://doi.org/10.1124/JPET.114.218552
44. Hu E, Chen N, Bourbeau MP, Harrington PE, Biswas K, Kunz RK, et al. Discovery of clinical candidate 1-(4-(3-(4-(1H-benzo[d]imidazole-2-carbonyl)phenoxy)pyrazin-2-yl)piperidin-1-yl)ethanone (AMG 579), a potent, selective, and efficacious inhibitor of phosphodiesterase 10A (PDE10A). J Med Chem. 2014;57(15):6632–41. https://doi.org/10.1021/JM500713J
45. Kehler J, Ritzen A, Langgård M, Petersen SL, Farah MM, Bundgaard C, et al. Triazoloquinazolines as a novel class of phosphodiesterase 10A (PDE10A) inhibitors. Bioorg Med Chem Lett. 2011;21(12):3738–42. https://doi.org/10.1016/J.BMCL.2011.04.067
46. Wagner S, Scheunemann M, Dipper K, Egerland U, Hoefgen N, Steinbach J, et al. Development of highly potent phosphodiesterase 10A (PDE10A) inhibitors: Synthesis and in vitro evaluation of 1,8-dipyridinyl- and 1-pyridinyl-substituted imidazo[1,5-a]quinoxalines. Eur J Med Chem. 2016;107:97–108. https://doi.org/10.1016/J.EJMECH.2015.10.028
47. Arakawa K, Maehara S, Yuge N, Ishikawa M, Miyazaki Y, Naba H, et al. Pharmacological characterization of a novel potent, selective, and orally active phosphodiesterase 10A inhibitor, PDM-042 [(E)-4-(2-(2-(5,8-dimethyl-[1,2,4]triazolo[1,5-a]pyrazin-2-yl)vinyl)-6-(pyrrolidin-1-yl)pyrimidin-4-yl)morpholine] in rats: Potential for the treatment of schizophrenia. Pharmacol Res Perspect. 2016;4(4):e00241. https://doi.org/10.1002/PRP2.241
48. Masilamoni GJ, Uthayathas S, Koenig G, Leventhal L, Papa SM. Effects of a novel phosphodiesterase 10A inhibitor in non-human primates: A therapeutic approach for schizophrenia with improved side effect profile. Neuropharmacology. 2016;110(Pt A):449–57. https://doi.org/10.1016/J.NEUROPHARM.2016.08.012
49. Raheem IT, Schreier JD, Fuerst J, Gantert L, Hostetler ED, Huszar S, et al. Discovery of pyrazolopyrimidine phosphodiesterase 10A inhibitors for the treatment of schizophrenia. Bioorg Med Chem Lett. 2016;26(1):126–32. https://doi.org/10.1016/J.BMCL.2015.11.013
50. Li YW, Seager MA, Wojcik T, Heman K, Molski TF, Fernandes A, et al. Biochemical and behavioral effects of PDE10A inhibitors: Relationship to target site occupancy. Neuropharmacology. 2016;102:121–35. https://doi.org/10.1016/J.NEUROPHARM.2015.10.037
51. Jones PG, Hewitt MC, Campbell JE, Quinton MS, Engel S, Lew R, et al. Pharmacological evaluation of a novel phosphodiesterase 10A inhibitor in models of antipsychotic activity and cognition. Pharmacol Biochem Behav. 2015; 135:46–52. https://doi.org/10.1016/J.PBB.2015.04.017
52. Burdi DF, Campbell JE, Wang J, Zhao S, Zhong H, Wei J, et al. Evolution and synthesis of novel orally bioavailable inhibitors of PDE10A. Bioorg Med Chem Lett. 2015;25(9):1864–8. https://doi.org/10.1016/J.BMCL.2015.03.050
53. Hamaguchi W, Masuda N, Miyamoto S, Kikuchi S, Narazaki F, Shiina Y, et al. Addressing phototoxicity observed in a novel series of biaryl derivatives: Discovery of potent, selective and orally active phosphodiesterase 10A inhibitor ASP9436. Bioorg Med Chem. 2015;23(13):3351–67. https://doi.org/10.1016/J.BMC.2015.04.052
54. Layton ME, Kern JC, Hartingh TJ, Shipe WD, Raheem I, Kandebo M, et al. Discovery of MK-8189, a highly potent and selective PDE10A inhibitor for the treatment of schizophrenia. J Med Chem. 2023;66(2):1157–71. https://doi.org/10.1021/ACS.JMEDCHEM.2C01521
55. Matloka M, Janowska S, Pankiewicz P, Kokhanovska S, Kos T, Hołuj M, et al. A PDE10A inhibitor CPL500036 is a novel agent modulating striatal function devoid of most neuroleptic side-effects. Front Pharmacol. 2022;13:999685.https://doi.org/10.3389/FPHAR.2022.999685
56. Camacho Gomez J, Castro Palomino Laria J. Pyrimidine derivatives as phosphodiesterase 10 inhibitors (PDE-10). Patent No. US9447095B2.
57. Koizumi Y, Tanaka Y, Matsumura T, Kadoh Y, Miyoshi H, Hongu M, et al. Discovery of a pyrazolo[1,5-a]pyrimidine derivative (MT-3014) as a highly selective PDE10A inhibitor via core structure transformation from the stilbene moiety. Bioorg Med Chem. 2019;27(15):3440–50. https://doi.org/10.1016/J.BMC.2019.06.021
58. Takakuwa M, Watanabe Y, Tanaka K, Ishii T, Kagaya K, Taniguchi H, et al. Antipsychotic-like effects of a novel phosphodiesterase 10A inhibitor T-251 in rodents. Pharmacol Biochem Behav. 2019;185:172757. https://doi.org/10.1016/J.PBB.2019.172757
59. Harada A, Kaushal N, Suzuki K, Nakatani A, Bobkov K, Vekich JA, et al. Balanced activation of striatal output pathways by faster off-rate PDE10A inhibitors elicits not only antipsychotic-like effects but also procognitive effects in rodents. Int J Neuropsychopharmacol. 2020;23(2):96–107. https://doi.org/10.1093/IJNP/PYZ056
60. Langen B, Dost R, Egerland U, Stange H, Hoefgen N. Effect of PDE10A inhibitors on MK-801-induced immobility in the forced swim test. Psychopharmacology (Berl). 2012;221(2):249–59. https://doi.org/10.1007/S00213-011-2567-Y
61. Devadiga SJ, Bharate SS. Recent developments in the management of Huntington’s disease. Bioorg Chem. 2022;120:105642. https://doi.org/10.1016/J.BIOORG.2022.105642
62. Suzuki K, Harada A, Suzuki H, Capuani C, Ugolini A, Corsi M, et al. Combined treatment with a selective PDE10A inhibitor TAK-063 and either haloperidol or olanzapine at subeffective doses produces potent antipsychotic-like effects without affecting plasma prolactin levels and cataleptic responses in rodents. Pharmacol Res Perspect. 2018;6(1):e00372. https://doi.org/10.1002/PRP2.372
63. Megens AAHP, Hendrickx HMR, Hens KA, Fonteyn I, Langlois X, Lenaerts I, et al. Pharmacology of JNJ-42314415, a centrally active phosphodiesterase 10A (PDE10A) inhibitor: A comparison of PDE10A inhibitors with D2 receptor blockers as potential antipsychotic drugs. J Pharmacol Exp Ther. 2014;349(1):138–54. https://doi.org/10.1124/JPET.113.211904
64. Sharma N, Dhiman N, Golani LK, Sharma B. Papaverine ameliorates prenatal alcohol-induced experimental attention deficit hyperactivity disorder by regulating neuronal function, inflammation, and oxidative stress. Int J Dev Neurosci. 2021;81(1):71–81. https://doi.org/10.1002/JDN.10076
65. Luhach K, Kulkarni GT, Singh VP, Sharma B. Attenuation of neurobehavioural abnormalities by papaverine in prenatal valproic acid rat model of ASD. Eur J Pharmacol. 2021;890:173663. https://doi.org/10.1016/J.EJPHAR.2020.173663
66. Takakuwa M, Watanabe Y, Saijo T, Murata M, Anabuki J, Tezuka T, et al. Antipsychotic-like effects of a novel phosphodiesterase 10A inhibitor MT-3014 in rats. Pharmacol Biochem Behav. 2020;196:172972. https://doi.org/10.1016/J.PBB.2020.172972
67. Smith S, Toolan D, Kandebo M, Vardigan J, Raheem I, Layton ME, et al. Preclinical evaluation of MK-8189: A novel phosphodiesterase 10A inhibitor for the treatment of schizophrenia. J Pharmacol Exp Ther. 2025;392(1):100047. https://doi.org/10.1124/JPET.124.002347
68. Shiraishi E, Suzuki K, Harada A, Suzuki N, Kimura H. The phosphodiesterase 10A selective inhibitor TAK-063 improves cognitive functions associated with schizophrenia in rodent models. J Pharmacol Exp Ther. 2016;356(3):587–95. https://doi.org/10.1124/JPET.115.230482
69. Tomimatsu Y, Cash D, Suzuki M, Suzuki K, Bernanos M, Simmons C, et al. TAK-063, a phosphodiesterase 10A inhibitor, modulates neuronal activity in various brain regions in phMRI and EEG studies with and without ketamine challenge. Neuroscience. 2016;339:180–90. https://doi.org/10.1016/J.NEUROSCIENCE.2016.10.006
70. Das S, Shelke DE, Harde RL, Avhad VB, Khairatkar-Joshi N, Gullapalli S, et al. Design, synthesis and pharmacological evaluation of novel polycyclic heteroarene ethers as PDE10A inhibitors: Part II. Bioorg Med Chem Lett 2014;24:3238–42. https://doi.org/10.1016/J.BMCL.2014.06.028
71. Chen L, Chen D, Tang L, Ren J, Chen J, Zhen X, et al. Design and optimization of purine derivatives as in vivo active PDE10A inhibitors. Bioorg Med Chem. 2017;25(13):3315–29. https://doi.org/10.1016/J.BMC.2017.04.019
72. Harada A, Suzuki K, Kimura H. TAK-063, a novel phosphodiesterase 10A inhibitor, protects from striatal neurodegeneration and ameliorates behavioral deficits in the R6/2 mouse model of Huntington’s disease. J Pharmacol Exp Ther. 2017;360(1):75–83. https://doi.org/10.1124/JPET.116.237388
73. Smith SM, Uslaner JM, Cox CD, Huszar SL, Cannon CE, Vardigan JD, et al. The novel phosphodiesterase 10A inhibitor THPP-1 has antipsychotic-like effects in rat and improves cognition in rat and rhesus monkey. Neuropharmacology. 2013;64:215–23. https://doi.org/10.1016/j.neuropharm.2012.06.013
74. Vardigan JD, Lange HS, Tye SJ, Fox S V., Smith SM, Uslaner JM. Behavioral and qEEG effects of the PDE10A inhibitor THPP-1 in a novel rhesus model of antipsychotic activity. Psychopharmacology (Berl). 2016;233(13):2441–50. https://doi.org/10.1007/S00213-016-4290-1
75. Sukhanov I, Dorotenko A, Fesenko Z, Savchenko A, Efimova EV, Mor MS, et al. Inhibition of PDE10A in a new rat model of severe dopamine depletion suggests new approach to non-dopamine Parkinson’s disease therapy. Biomolecules. 2023;13(1):9. https://doi.org/10.3390/BIOM13010009
76. Доротенко АР, Суханов ИМ, Савченко АА, Драволина ОА, Белозерцева ИВ. Толерантность к парадоксальному увеличению двигательной активности, вызванной ингибированием фосфодиэстеразы 10А, на модели гиподофаминергии. Ученые записки Первого Санкт-Петербургского государственного медицинского университета имени академика И.П. Павлова. 2023;30(4):32–42. https://doi.org/10.24884/1607-4181-2023-30-4-32-42
77. Beck G, Maehara S, Chang PL, Papa SM. A selective phosphodiesterase 10a inhibitor reduces L-dopa-induced dyskinesias in Parkinsonian monkeys. Mov Disord. 2018;33(5):805–14. https://doi.org/10.1002/MDS.27341
78. Bleickardt CJ, Kazdoba TM, Jones NT, Hunter JC, Hodgson RA. Antagonism of the adenosine A2A receptor attenuates Akathisia-like behavior induced with MP-10 or aripiprazole in a novel non-human primate model. Pharmacol Biochem Behav. 2014;118:36–45. https://doi.org/10.1016/J.PBB.2013.10.030
79. Giampà C, Laurenti D, Anzilotti S, Bernardi G, Menniti FS, Fusco FR. Inhibition of the striatal specific phosphodiesterase PDE10A ameliorates striatal and cortical pathology in R6/2 mouse model of Huntington’s disease. PLoS One. 2010;5(10):e13417. https://doi.org/10.1371/JOURNAL.PONE.0013417
80. Kim DY, Park JS, Leem YH, Park JE, Kim HS. The potent PDE10A inhibitor MP-10 (PF-2545920) suppresses microglial activation in LPS-induced neuroinflammation and MPTP-induced Parkinson’s disease mouse models. J Neuroimmune Pharmacol. 2021;16(2):470–82. https://doi.org/10.1007/S11481-020-09943-6
81. Arakawa K, Maehara S. Combination of the phosphodiesterase 10A inhibitor, MR1916 with risperidone shows additive antipsychotic-like effects without affecting cognitive enhancement and cataleptic effects in rats. Neuropsychopharmacol Rep. 2020;40(2):190–5. https://doi.org/10.1002/NPR2.12108
82. Arakawa K, Nakao K, Maehara S. Dopamine D1 signaling involvement in the effects of the phosphodiesterase 10A inhibitor, PDM-042 on cognitive function and extrapyramidal side effect in rats. Behavioural Brain Research. 2017;317:204–9. https://doi.org/10.1016/J.BBR.2016.09.043
83. Redrobe JP, Rasmussen LK, Christoffersen CT, Bundgaard C, Jørgensen M. Characterisation of Lu AF33241: A novel, brain-penetrant, dual inhibitor of phosphodiesterase (PDE) 2A and PDE10A. Eur J Pharmacol. 2015;761:79–85. https://doi.org/10.1016/J.EJPHAR.2015.04.040
84. Gentzel RC, Toolan D, Roberts R, Koser AJ, Kandebo M, Hershey J, et al. The PDE10A inhibitor MP-10 and haloperidol produce distinct gene expression profiles in the striatum and influence cataleptic behavior in rodents. Neuropharmacology. 2015;99:256–63. https://doi.org/10.1016/J.NEUROPHARM.2015.05.024
85. Logrip ML, Vendruscolo LF, Schlosburg JE, Koob GF, Zorrilla EP. Phosphodiesterase 10A regulates alcohol and saccharin self-administration in rats. Neuropsychopharmacology. 2014;39(7):1722–31. https://doi.org/10.1038/NPP.2014.20
86. Reneerkens OAH, Rutten K, Bollen E, Hage T, Blokland A, Steinbusch HWM, et al. Inhibition of phoshodiesterase type 2 or type 10 reverses object memory deficits induced by scopolamine or MK-801. Behav Brain Res. 2013;236(1):16–22. https://doi.org/10.1016/J.BBR.2012.08.019
87. Nikiforuk A, Potasiewicz A, Rafa D, Drescher K, Bespalov A, Popik P. The effects of PDE10 inhibition on attentional set-shifting do not depend on the activation of dopamine D1 receptors. Behav Pharmacol. 2016;27(4):331–8. https://doi.org/10.1097/FBP.0000000000000201
88. Wilson L, Brandon N. Emerging biology of PDE10A. Curr Pharm Des. 2015;21(3):378–88. https://doi.org/10.2174/1381612820666140826114744
89. Geerts H, Spiros A, Roberts P. Phosphodiesterase 10 inhibitors in clinical development for CNS disorders. Expert Rev Neurother. 2017;17(6):553–60. https://doi.org/10.1080/14737175.2017.1268531
90. Walling DP, Banerjee A, Dawra V, Boyer S, Schmidt CJ, Demartinis N. Phosphodiesterase 10A inhibitor monotherapy is not an effective treatment of acute schizophrenia. J Clin Psychopharmacol. 2019;39(6):575–82. https://doi.org/10.1097/JCP.0000000000001128
91. Demartinis N, Lopez RN, Pickering EH, Schmidt CJ, Gertsik L, Walling DP, et al. A proof-of-concept study evaluating the phosphodiesterase 10A inhibitor PF-02545920 in the adjunctive treatment of suboptimally controlled symptoms of schizophrenia. J Clin Psychopharmacol. 2019;39(4):318–28. https://doi.org/10.1097/JCP.0000000000001047
92. Macek TA, McCue M, Dong X, Hanson E, Goldsmith P, Affinito J, et al. A phase 2, randomized, placebo-controlled study of the efficacy and safety of TAK-063 in subjects with an acute exacerbation of schizophrenia. Schizophr Res. 2019;204:289–94. https://doi.org/10.1016/J.SCHRES.2018.08.028
93. Mukai Y, Lupinacci R, Marder S, Snow-Adami L, Voss T, Smith SM, et al. Effects of PDE10A inhibitor MK-8189 in people with an acute episode of schizophrenia: A randomized proof-of-concept clinical trial. Schizophr Res. 2024;270:37–43. https://doi.org/10.1016/J.SCHRES.2024.05.019
94. Delnomdedieu M, Tan Y, Ogden A, Berger Z, Reilmann R. A randomized, double-blind, placebo-controlled phase II efficacy and safety study of the PDE10A inhibitor PF-02545920 in Huntington disease (AMARYLLIS). J Neurol Neurosurg Psychiatry. 2018;89:A99–100. https://doi.org/10.1136/JNNP-2018-EHDN.266
95. Hufgard JR, Williams MT, Skelton MR, Grubisha O, Ferreira FM, Sanger H, et al. Phosphodiesterase-1b (Pde1b) knockout mice are resistant to forced swim and tail suspension induced immobility and show upregulation of PDE10A. Psychopharmacology (Berl). 2017;234(12):1803–13. https://doi.org/10.1007/S00213-017-4587-8
Об авторах
А. Р. ДоротенкоРоссия
Доротенко Артем Романович
Ул. Льва Толстого, д. 6–8, Санкт-Петербург, 197022
И. М. Суханов
Россия
Суханов Илья Михайлович - д-р мед. наук.
Ул. Льва Толстого, д. 6–8, Санкт-Петербург, 197022
Г. В. Искаревский
Россия
Искаревский Григорий Вячеславович
Олимпийский просп., д. 1, Краснодарский край, федеральная территория «Сириус», 354340
А. С. Улитина
Россия
Улитина Анна Сергеевна - канд. мед. наук.
Ул. Льва Толстого, д. 6–8, Санкт-Петербург, 197022; ул. Аккуратова, д. 2, Санкт-Петербург, 197341
А. А. Савченко
Россия
Савченко Артем Алексеевич
Ул. Льва Толстого, д. 6–8, Санкт-Петербург, 197022
М. А. Тур
Россия
Тур Маргарита Алексеевна. Scopus: https://www.scopus.com/authid/detail.uri?authorId=57190949656
Ул. Льва Толстого, д. 6–8, Санкт-Петербург, 197022
Дополнительные файлы

|
1. Перевод таблиц 1, 3, 4, 5 на английский язык | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(343KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Доротенко А.Р., Суханов И.М., Искаревский Г.В., Улитина А.С., Савченко А.А., Тур М.А. Фосфодиэстераза 10А как терапевтическая мишень в нейропсихофармакологии: обзор. Регуляторные исследования и экспертиза лекарственных средств. 2025;15(2):148-167. https://doi.org/10.30895/1991-2919-2025-723
For citation:
Dorotenko A.R., Sukhanov I.M., Iskarevskii G.V., Ulitina A.S., Savchenko A.A., Tur M.А. Phosphodiesterase 10A as a Therapeutic Target in Neuropsychopharmacology: A Review. Regulatory Research and Medicine Evaluation. 2025;15(2):148-167. (In Russ.) https://doi.org/10.30895/1991-2919-2025-723



































