Перейти к:
Оценка стабильности растворов антибиотиков-цефалоспоринов по показателям «Цветность раствора» и «Примеси»
https://doi.org/10.30895/1991-2919-2025-15-1-34-43
Резюме
ВВЕДЕНИЕ. Цефалоспориновые антибиотики применяют в виде лекарственных форм для инъекций, как правило, без добавления вспомогательных веществ. Анализ по показателям «Примеси» и «Цветность раствора» позволяет оценить процессы деструкции активной фармацевтической субстанции (АФС) в таких препаратах и поэтому является важным для контроля их надлежащего качества.
ЦЕЛЬ. Оценить стабильность водных растворов цефалоспоринов по показателям «Примеси» и «Цветность раствора» и проследить взаимосвязь между этими показателями.
МАТЕРИАЛЫ И МЕТОДЫ. Объектами исследования были АФС цефазолин, цефуроксим, цефтриаксон и смесь цефтриаксона с сульбактамом (2:1). Интенсивность окраски водных растворов антибиотиков оценивали по сравнению с эталонами цветности и спектрофотометрически при 430 нм для 10% раствора цефазолина в течение 6 сут, при 450 нм для 1,2% растворов цефтриаксона и смеси цефтриаксона с сульбактамом в течение 11 и 16 сут соответственно. Одновременно методом высокоэффективной жидкостной хроматографии определяли содержание родственных примесей в растворах цефазолина (10 и 0,25%), цефтриаксона (1,2 и 0,03%), смеси цефтриаксона и сульбактама (1,2% по цефтриаксону). Примеси растворов цефтриаксона исследовали в течение 16 сут, растворов цефуроксима (10 и 0,1%) в течение 2 сут. Все экспериментальные растворы хранили при комнатной температуре и естественном освещении, исключив попадание прямых солнечных лучей.
РЕЗУЛЬТАТЫ. В процессе эксперимента все исследуемые растворы приобретали более интенсивную желтую окраску, увеличивались значения оптических плотностей и содержание родственных примесей. Деструкция в разбавленных растворах цефазолина, цефтриаксона и цефуроксима проходила интенсивнее, чем в растворах более высокой концентрации. Отмечено преимущественное увеличение содержания одной-двух примесей в течение 24–96 ч при незначительном изменении содержания других родственных соединений. Наименее стабильным в водном растворе был цефуроксим, через 24 ч содержание примеси дезкарбомоилцефуроксима превысило нормативные требования в 2,5 раза. Цветность 1,2% раствора цефтриаксона превысила нормативные требования через 24 ч хранения, содержание единичной примеси — через 72 ч.
ВЫВОДЫ. Cтабильность водных растворов цефалоспориновых антибиотиков по показателям «Цветность раствора» и «Примеси» зависит от химического строения вещества, концентрации растворов и длительности их хранения при естественном освещении. Отмечена взаимосвязь между значениями оптической плотности и увеличением количества отдельных примесей в растворах цефазолина и цефтриаксона.
Ключевые слова
Для цитирования:
Кулешова С.И., Денисова И.А., Пшеничных Т.И. Оценка стабильности растворов антибиотиков-цефалоспоринов по показателям «Цветность раствора» и «Примеси». Регуляторные исследования и экспертиза лекарственных средств. 2025;15(1):34-43. https://doi.org/10.30895/1991-2919-2025-15-1-34-43
For citation:
Kuleshova S.I., Denisova I.A., Pshenichnykh T.I. Stability of Cephalosporins in Solution in Terms of the Colour of Solution and Impurities. Regulatory Research and Medicine Evaluation. 2025;15(1):34-43. (In Russ.) https://doi.org/10.30895/1991-2919-2025-15-1-34-43
ВВЕДЕНИЕ
Цефалоспориновые антибиотики — это большая группа β-лактамных антибиотиков, производство и применение которых в медицинской практике в широких масштабах началось с 70-х годов XX века1. Для получения полусинтетических антибиотиков в общее ядро молекулы цефалоспоринов — 7-аминоцефалоспорановую кислоту (7-АЦК) (I) путем направленного химического или биокаталитического синтеза вводят функциональные группы, в основном в положения R2 и R12 [1][2]. Модификация структуры 7-АЦК приводит к изменению антибактериального спектра получаемых соединений, их фармакологических и физико-химических свойств3 [2].
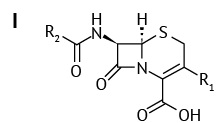
Выделяют пять поколений (генераций) антибиотиков цефалоспоринов. К первому поколению относится цефалотин, цефазолин, цефалексин, цефадроксил. Примерами 2-го поколения являются цефуроксим, цефаклор, 3-го поколения — цефотаксим, цефтриаксон. К 4-й генерации относят цефепим и цефпиром; 5-я генерация пока представлена только цефтралином. Если цефалоспорины первого поколения эффективны в основном против грамположительных бактерий, появление последующих генераций цефалоспоринов было связано с расширением спектра их действия против аэробных грамотрицательных бактерий4.
Для большинства антибиотиков, относящихся к первым трем генерациям, в Фармакопее США 2024 года, Европейской фармакопее 11.3 (Ph. Eur.) и в Государственной фармакопее Российской Федерации (ГФ РФ) XV изд. представлены монографии, регламентирующие стандарты качества соответствующих соединений в случае их использования в качестве активных фармацевтических субстанций (АФС). Обязательными показателями качества АФС, особенно если они предназначены для производства парентеральных лекарственных средств, являются «Примеси» и «Цветность раствора». Для проявления биологической активности цефалоспоринов большое значение имеет целостность β-лактамного кольца, неустойчивого в кислой и щелочной среде [3][4]. В водных растворах цефалоспорины также подвергаются деструкции с возможным расщеплением β-лактамного кольца [3–5]. Стабильность растворов цефалоспоринов зависит от температуры, рН, воздействия света. Было показано, что в течение суток цефалоспорины в водных растворах гидролизуются5. Анализ степени деструкции цефалоспоринов в водных растворах с течением времени при естественном освещении и взаимосвязь процесса постепенной деградации с изменением качества этих препаратов и их соответствием фармакопейным требованиям в литературе не описаны. При этом наблюдаемое постепенное увеличение интенсивности окрашивания растворов при работе с этими антибиотиками свидетельствует о накоплении продуктов разложения действующего вещества.
Цель работы — оценить стабильность водных растворов цефалоспоринов по показателям «Примеси» и «Цветность раствора» и проследить взаимосвязь между этими показателями.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве объектов исследования были выбраны АФС, зарегистрированные в Российской Федерации: цефазолин (II), цефуроксим (III), цефтриаксон (IV), а также смесь цефтриаксона с сульбактамом (2:1). Эти три антибиотика легко растворимы в воде и используются в форме натриевых солей для приготовления инъекционных препаратов.
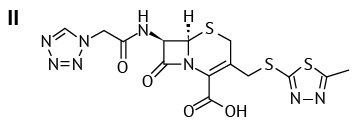
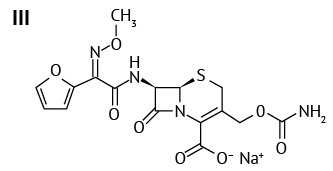
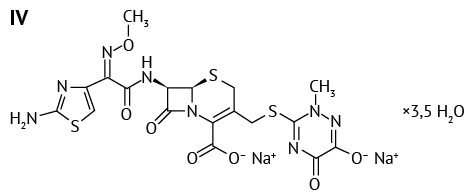
Цефазолин (6R,7R)-3-{[(5-метил-1,3,4-тиадиазол-2-ил)сульфанил]метил}-8-оксо-7-[ 2-(1H-тетразол-1-ил)ацетамидо]-5-тиа-1-азабицикло [ 4.2.0]окт-2-ен-2-карбоксилат6 относится к первому поколению соединений цефалоспоринов ряда c гетероциклическим заместителем (R2). Характеризуется как белый или почти белый порошок, очень гигроскопичен7. Цефуроксим (6R,7R)-3-[(карбамоилокси)метил]-7-[(2Z)-2-(метоксиимино)-2-(фуран-2-ил)ацетамидо]-8-оксо-5-тиа-1-азабицикло[ 4.2.0]окт-2-ен-2-карбоксилат8 — антибиотик второго поколения с негетероциклическим заместителем (R2). Белый или почти белый порошок9. Цефтриаксон (6R,7R)-7-[(Z)-2-(2-амино-4-тиазолил)-2-(метоксиимино)ацетамидо]-3-{[(2-метил-6-оксидо-5-оксо-2,5-дигидро-1,2,4-триазин-3-ил)сульфанил] метил}-8-оксо-5-тиа-1-азабицикло[ 4.2.0]окт-2-ен-2-карбоксилат динатрия гидрат (1:3,5)10 относится к третьей генерации с гетероциклическим заместителем (R2), представляет собой гидратную форму молекулы11. Белый, почти белый или желтоватый кристаллический порошок12.
Смесь цефтриаксона с сульбактамом (2:1) легко растворима в воде. Сульбактам в составе препарата13 является ингибитором пенициллиназы и также представляет собой β-лактамное соединение.
Для оценки изменения интенсивности окраски водных растворов цефалоспоринов применяли два фармакопейных метода: визуальный и спектрофотометрический. Использование инструментального метода позволяет получить количественную и более объективную оценку, чем визуальный способ.
Оптическую плотность 10% раствора цефазолина измеряли при длине волны 430 нм согласно требованиям Ph. Eur., 1,2% раствора цефтриаксона и раствора смеси цефтриаксона (1,2%) и сульбактама — в максимуме поглощения при длине волны 450 нм. Выбор концентраций испытуемых растворов соответствовал требованиям Ph. Eur. и ГФ РФ для анализа исследуемых АФС. Анализ смеси было решено проводить аналогично цефтриаксону. При анализе визуальным методом использовали фармакопейные эталоны цветности14.
Оптическую плотность растворов антибиотиков измеряли на спектрофотометре Agilent 8453, рН — на приборе Mettler Toledo тип Seven Compact, для определения содержания родственных примесей использовали хроматограф Agilent Infinity 1260. Измерения проводили через определенные промежутки времени с использованием одних и тех же растворов. Дополнительно с такой же периодичностью изучали стабильность растворов указанных антибиотиков по содержанию родственных примесей. Концентрации растворов были выбраны в соответствии с требованиями нормативных документов для анализа методом высокоэффективной жидкостной хроматографии (ВЭЖХ) — 0,25% цефазолина, 0,1% цефуроксима и 0,03% цефтриаксона. Все исследуемые растворы хранили при комнатной температуре 22–24 ºС при естественном освещении, исключив попадание прямых солнечных лучей. Антибиотики растворяли в свежеприготовленной воде очищенной и хранили в плотно укупоренных конических колбах.
Содержание примесей оценивали методом внутренней нормализации в процентах с учетом относительного времени удерживания. Единичные примеси идентифицировали, если такая возможность была предусмотрена методикой. Пики растворителей, реактивов и пики, обусловленные компонентами подвижной фазы, в расчет не принимали.
Использовали методики ВЭЖХ, описанные в монографиях Ph. Eur. на цефуроксим натрия и цефтриаксон натрия с незначительными изменениями, определение примесей в растворах цефазолина проводили согласно требованиям Фармакопеи США15. Условия хроматографирования для определения примесных продуктов:
- цефазолин — подвижная фаза (ПФ) двухкомпонентная (ПФ А — буферный раствор с рН 6,8, ПФ В — ацетонитрил), градиентное элюирование в течение 65 мин, скорость потока 1,5 мл/мин, детектирование при 254 нм и 210 нм, температура колонки 30 ºС, объем вводимой пробы 20 мкл, колонка Luna С18 250×4,6 мм, 5 мкм;
- цефуроксим — ПФ ацетонитрил и ацетатный буферный раствор с рН 3,4 в соотношении 1:99, скорость потока 1,0 мл/мин, детектирование при 273 нм, температура колонки 30 ºС, объем вводимой пробы 20 мкл, колонка Spherisorb С6 100×4,6 мм, 5 мкм.
- цефтриаксон — ПФ буферный раствор с рН 6,0 и ацетонитрил в соотношении 1:1, скорость потока 1,5 мл/мин, детектирование при 254 нм, температура колонки 30 ºС, объем вводимой пробы 20 мкл, колонка Luna С18 250×4,6 мм, 5 мкм.
Статистическую обработку результатов в данном исследовании не проводили.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В процессе работы все исследуемые растворы цефалоспоринов постепенно приобретали более интенсивную желтую окраску по сравнению с первоначальным цветом. Раствор цефтриаксона (1,2%) в начале опыта выдерживал сравнение с эталоном цветности Y5, что соответствует нормативным требованиям монографии на цефтриаксон натрия16, через 24 ч хранения на свету приобретал выраженный желтый цвет (эталон Y4), через 144 ч (6 сут) соответствовал эталону ВY3. Раствор смеси цефтриаксона с сульбактамом с той же концентрацией цефтриаксона существенно изменял окраску в течение 24 ч от Y4 до Y3 с последующим пожелтением раствора на конечном этапе эксперимента до соответствия эталону Y2. Окраска 10% раствора цефазолина первоначально не превышала эталон Y3, через 24 ч соответствовала эталону Y2, и далее в процессе наблюдений цветность раствора практически менялась.
Визуальная оценка цветности 10% раствора цефуроксима в сравнении с эталонами была затруднена, так как интенсивность окраски раствора сразу после его приготовления уже превышала эталон 1 шкалы цветности ВY.
В монографиях Ph. Eur. и ГФ РФ на исследуемые соединения только для цефтриаксона натрия предусмотрено сравнение с эталоном для оценки цветности раствора. Внешний вид растворов 10% раствор цефазолина стандартизуют по значению оптической плотности — «не более 0,15».
Для исследуемых растворов цефазолина в течение 16 сут, цефтриаксона и смеси цефтриаксона с сульбактамом в течение 11 сут наблюдали увеличение оптической плотности при хранении на свету (рис. 1). Наиболее стабильным соединением в условиях испытания по показателю «Цветность раствора» оказался цефазолин. Оптическая плотность 10% раствора цефазолина через 9 сут (216 ч) наблюдения не превышала установленное17 предельное значение 0,15.
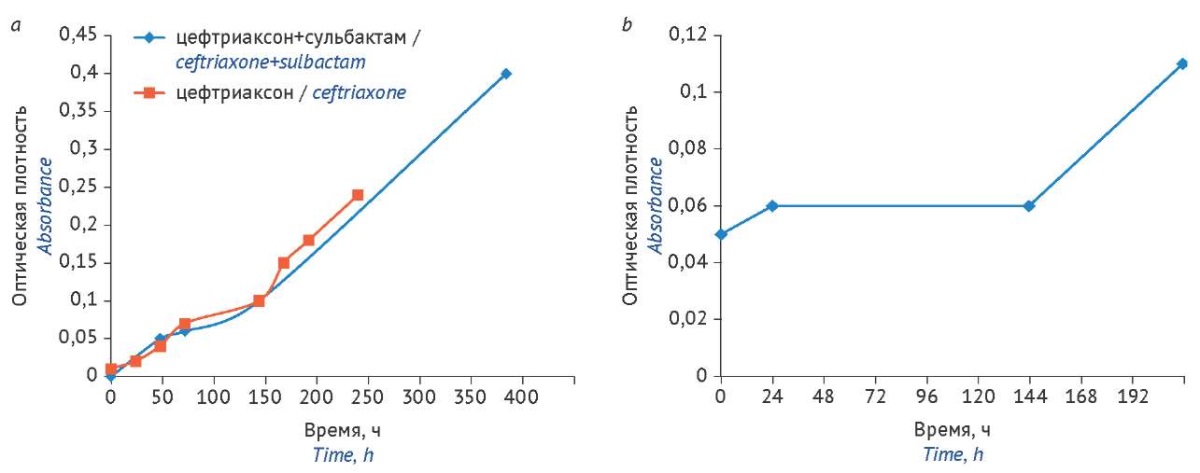
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 1. Изменение оптической плотности 1,2% раствора цефтриаксона, 1,2% раствора цефтриаксона с сульбактамом (a) и 10% раствора цефазолина (b) в процессе хранения при комнатной температуре на свету без доступа прямых солнечных лучей
Fig. 1. Changes in the absorbance of 1.2% solutions of ceftriaxone and ceftriaxone–sulbactam (a) and 10% solution of cefazolin (b) during storage at room temperature in natural light (away from direct sunlight)
Считается, что водные растворы натриевых солей цефалоспоринов обладают буферными свойствами [6]. Наблюдения за динамикой изменения рН показали, что исследуемые растворы цефтриаксона с сульбактамом и цефазолина имели слабокислую реакцию с постепенным сдвигом в щелочную. Так, рН раствора цефтриаксона с сульбактамом изменялся от 6,4 в начале эксперимента до 6,9 в конце испытаний, рН раствора цефазолина — от 6,0 до 6,8 соответственно, последнее значение превысило нормативные требования18 («от 4,0 до 6,0» для 10% раствора цефазолина натрия). Диапазон изменений рН раствора цефтриаксона был шире и составил от 6,6 до 7,5, тем не менее эти значения не превышали нормативные пределы («от 6,0 до 8,0»)19. Возможно, что в процессе хранения растворов цефалоспоринов образуются продукты деструкции, обладающие щелочными свойствами.
Оценивая полученные результаты анализа по показателю «Цветность раствора», представляется интересным проследить изменения содержания родственных примесей (продуктов деструкции) в растворах цефалоспориновых антибиотиков. При анализе результатов деструкции цефазолина в 10 и 0,25% водных растворах показано (рис. 2), что сумма примесей превышала нормативные требования (3,5%)20 через 96 ч (4 сут), а через 6 сут составила более 5%. Суммарное содержание примесей в исследуемых объектах может увеличиваться в результате образования как одной, так и одновременно нескольких примесей.
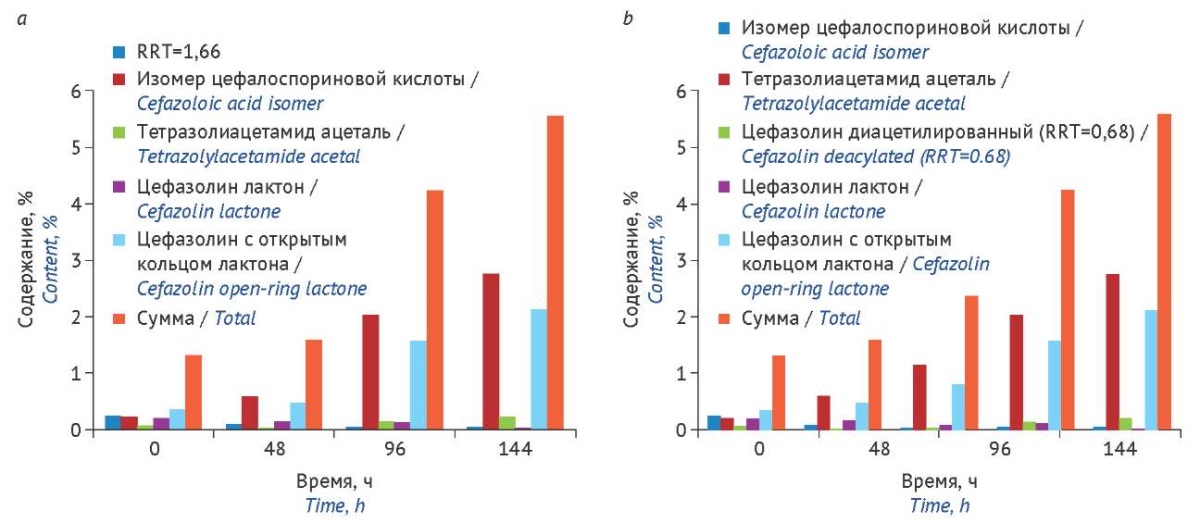
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 2. Изменение содержания примесей в 10% (a) и 0,25% (b) растворах цефазолина в процессе хранения при комнатной температуре на свету без доступа прямых солнечных лучей. RRT — относительное время удерживания соответствующей примеси
Fig. 2. Changes in the content of impurities in 10% (a) and 0.25% (b) cefazolin solutions during storage at room temperature in natural light (away from direct sunlight). RRT, relative retention time of the corresponding impurity
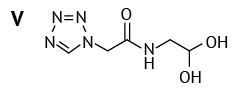
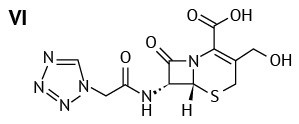
Процесс деструкции не отличался в растворах разных концентраций — увеличивалось содержание в основном двух примесей: тетразолиацетамида ацеталя (V) (N-(2,2-дигидроксиэтил)-2-(1H-тетразол-1-ил)ацетамид)21 и цефозолина с открытым лактонным кольцом или 3-гидрокси-метил цефазолина (VI) (6R,7R)-7-[ 2-(1H-тетразол-1-ил)ацетамидо]-3-(гидроксиметил)-8-оксо-5-тиа-1-азабицикло[ 4.2.0]окт-2-ен-2-карбоксикислота)22. Тогда как содержание примеси цефазолина лактона (N-{(5aR,6R)-1,7-диоксо-1,3,4,5a,6,7-гексагидроазето[ 2,1-b]фуро[ 3,4-d][ 1,3]тиазин-6-ил}-2-(1H-тетразол-1-ил)ацетамид)23 в исследуемых растворах уменьшалось. Это отчасти объясняет увеличение содержания примеси 3-гидроксиметил цефазолина, поскольку согласно данным литературы [4] цефазолин гидролизуется первоначально до цефазолина лактона, затем эта примесь распадается до цефазолина с открытым лактонным кольцом.
Диаграммы процесса деструкции цефтриаксона в растворах разных концентраций представлены на рисунке 3. Согласно требованиям Ph. Eur. предельное содержание единичной примеси в цефтриаксоне натрия должно быть не более 1,0%, суммарно — не более 4,0%. Процесс разложения цефтриаксона в разбавленном 0,03% растворе протекал интенсивнее, чем в более концентрированном. Сумма примесей (4,2%) в первом случае не соответствовала требованиям Ph. Eur. через 48 ч, во втором — через 168 ч (4,5%).
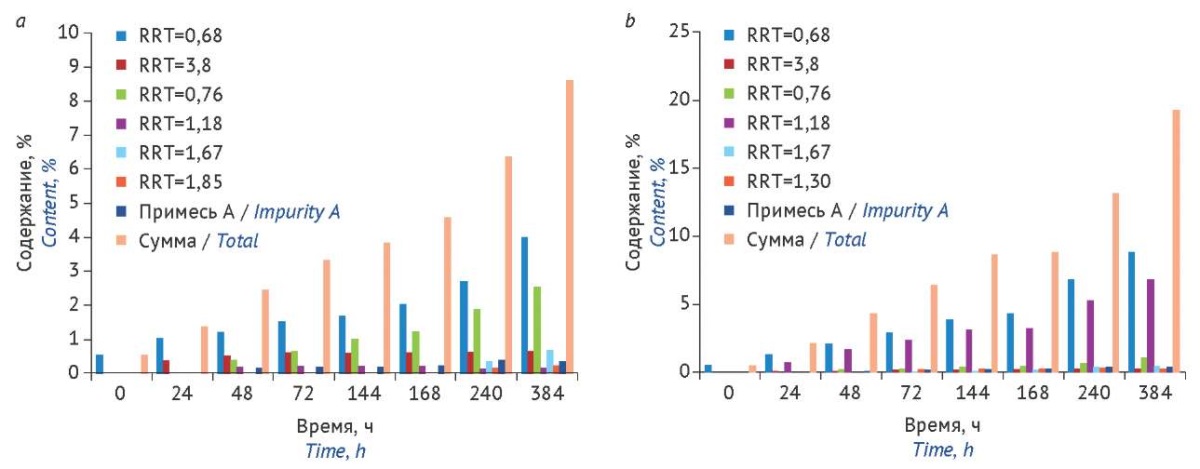
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 3. Изменение содержания примесей в 1,2% (a) и 0,03% (b) растворах цефтриаксона в процессе хранения при комнатной температуре на свету без доступа прямых солнечных лучей. RRT — относительное время удерживания соответствующей неидентифицированной примеси
Fig. 3. Changes in the content of impurities in 1.2% (a) and 0.03% (b) ceftriaxone solutions during storage at room temperature in natural light (away from direct sunlight). RRT, relative retention time of the corresponding unspecified impurity
Накопление единичных примесей цефтриаксона имело некоторые различия в растворах разных концентраций. Значительное увеличение с 0,5% в начале испытания (0 ч) до 1,5% через 72 ч и до 4,0% в конце срока хранения наблюдали для соединения с относительным временем удерживания (reference retention time, RRT) 0,68 в 1,2% растворе цефтриаксона. В разбавленном в 40 раз растворе количество этой же примеси возрастало с 0,5% (0 ч) до 2,0% через 48 ч и в конечной точке эксперимента превысило 8,0%. В то же время в разбавленном растворе наблюдали существенное увеличение примеси с RRT 1,18, которая в свежеприготовленных растворах обеих концентраций не проявлялась на хроматограммах. Количество этой примеси практически не изменилось в 1,2% растворе, но постепенно увеличилось содержание примеси с RRT 0,76. Количество остальных примесей не превышало фармакопейных норм, содержание примеси А (Е-изомер цефтриаксона)24 оставалось практически неизменным в течение всего эксперимента.
Результаты оценки стабильности растворов цефуроксима разных концентраций представлены на рисунке 4. Примесь А — основной продукт деструкции цефуроксима — нормируется отдельно от суммы других примесей (не более 1,0%)25. В свежеприготовленных растворах цефуроксима содержание примеси А (дезкарбомоилцефуроксим; (6R,7R)-7-[[ (2Z)-2-(фуран-2-ил)-2-метоксииминоацетил]амино]-3-(гидроксиметил)-8-оксо-5-тиа-1-азабицикло[ 4.2.0]окт-2-ен-2-карбоновая кислота)26 составило менее 0,4%, затем через 24 ч увеличилось до 2,5% в 10%-ном растворе цефуроксима и почти до 5,0% в разбавленном растворе. Таким образом, цефуроксим в данном исследовании проявил себя наименее стабильным соединением в водных растворах, через 24 ч содержание примеси А превысило нормативные требования в 2,5–5 раз.
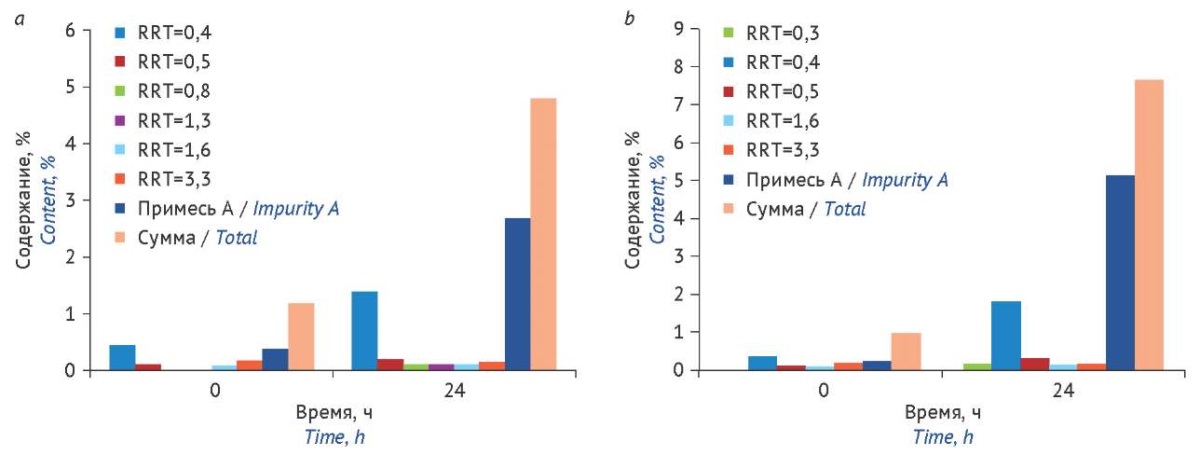
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 4. Изменение содержания примесей в 10% (a) и 0,1% (b) растворах цефуроксима в процессе хранения при комнатной температуре на свету без доступа прямых солнечных лучей. RRT — относительное время удерживания соответствующей неидентифицированной примеси
Fig. 4. Changes in the content of impurities in 10% (a) and 0.1% (b) cefuroxime solutions during storage at room temperature in natural light (away from direct sunlight). RRT, relative retention time of the corresponding unspecified impurity
Стандарт качества на смесь цефтриаксона с сульбактамом (2:1) в ведущих фармакопеях в настоящее время не представлен. В связи с этим была изучена стабильность раствора смеси цефтриаксона с сульбактамом (содержание цефтриаксона 1,2%) по отношению к стабильности сухой смеси, из которой через указанные промежутки времени отбирали навески и проводили определение примесей в свежеприготовленном (не более 2 ч хранения) растворе той же концентрации. Влияние естественного освещения на стабильность порошка смеси изучаемых веществ оказалось незначительным, сумма примесей не превысила 1,2% на 16 сут хранения (рис. 5a). Деструкция цефтриаксона с сульбактамом в водном растворе протекала интенсивно, сумма примесей на конец испытания составила около 9% (рис. 5b).
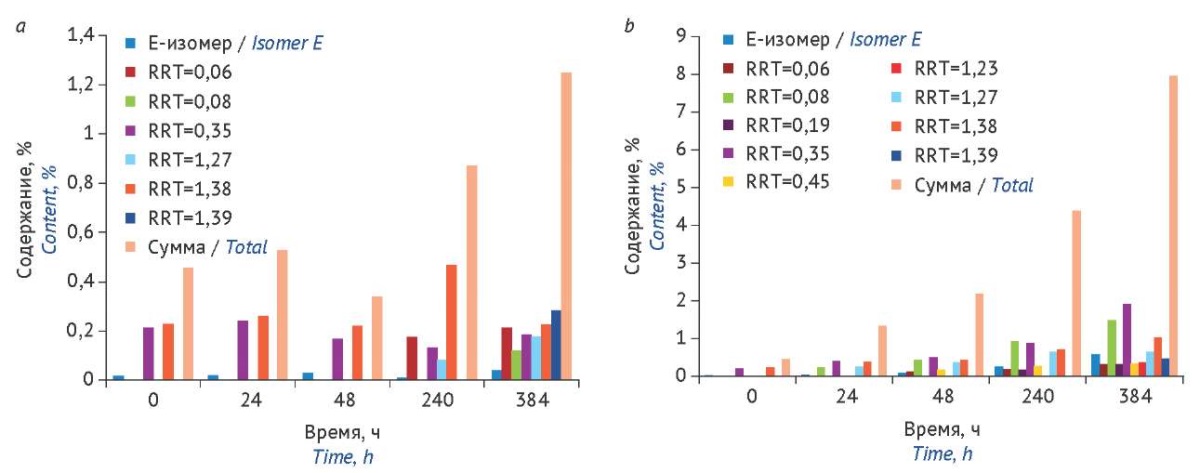
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 5. Изменение содержания примесей в сухой смеси цефтриаксона с сульбактамом (свежеприготовленный раствор) (a) и в растворе смеси (b) в процессе хранения при комнатной температуре на свету без доступа прямых солнечных лучей. RRT — относительное время удерживания соответствующей неидентифицированной примеси
Fig. 5. Changes in the content of impurities in ceftriaxone–sulbactam solution when prepared (a) and during storage at room temperature in natural light (away from direct sunlight) (b). RRT, relative retention time of the corresponding unspecified impurity
Поскольку деструкция в разбавленных растворах цефазолина (0,25%), цефтриаксона (0,03%) и цефуроксима (0,1%) проходила интенсивнее, чем в растворах более высоких концентраций (10% растворы цефазолина и цефуроксима, 1,2% раствор цефтриаксона), и наблюдали минимальное разложение β-лактамных соединений в порошке по сравнению с растворами, можно предположить, что водная среда и ее объем являются основными факторами, влияющими на накопление родственных примесей в процессе хранения. При этом в процессе деградации молекулы исследуемых антибиотиков в водных растворах разрушаются с образованием преимущественно одной-двух примесей в течение 24–96 ч, тогда как содержание остальных родственных соединений изменяется незначительно.
Визуально можно отметить увеличение оптической плотности при увеличении суммы примесей в растворах цефтриаксона и цефазолина, однако линейная функция не подтверждена статистически, что связано, скорее всего, с неравномерным вкладом примесных продуктов в общее поглощение исследуемых растворов.
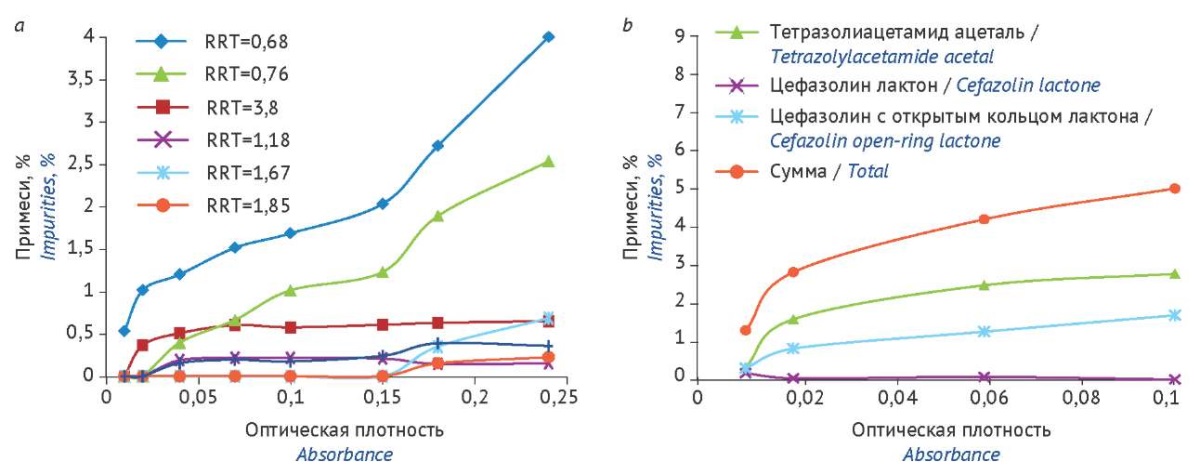
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 6. Изменение значений оптической плотности и содержания примесей в 1,2% растворе цефтриаксона (a) и 10% растворе цефазолина (b) в процессе хранения при комнатной температуре на свету без доступа прямых солнечных лучей. RRT — относительное время удерживания соответствующей неидентифицированной примеси
Fig. 6. Changes in the absorbance and impurity content in 1.2% ceftriaxone solution (a) and 10% cefazolin solution (b) during storage at room temperature in natural light (away from direct sunlight) (b). RRT, relative retention time of the corresponding unspecified impurity
Учитывая, что растворы исследуемых цефалоспоринов в процессе хранения при естественном освещении приобретали более интенсивную желтую окраску, можно предположить, что в процессе деструкции образуются родственные примеси исследуемых β-лактамных соединений, интенсивно поглощающие в диапазоне длин волн синей области видимого спектра.
ЗАКЛЮЧЕНИЕ
Стабильность водных растворов цефазолина, цефтриаксона, цефтриаксона с сульбактамом (2:1) и цефуроксима по показателям «Цветность раствора» и «Примеси» зависит от химического строения вещества, концентрации растворов и длительности хранения при естественном освещении. Между значениями оптической плотности растворов цефазолина и цефтриаксона отмечена визуально наблюдаемая взаимосвязь с увеличением количества отдельных примесей, однако четкой линейной зависимости не выявлено, что, вероятно, обусловлено неравномерным вкладом примесных продуктов в общее поглощение исследуемых растворов. Проведенные исследования могут быть полезны при разработке и оптимизации методик, необходимых для оценки качества и стабильности лекарственных средств β-лактамных соединений. На основании полученных результатов в дальнейших исследованиях предполагается оценить изменение чувствительности тест-микроорганизмов к цефалоспоринам, подвергшимся деструкции под воздействием внешних факторов.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: С.И. Кулешова — идея, общая концепция исследования, написание текста рукописи, анализ результатов; И.А. Денисова — подбор методик, проведение испытания методом ВЭЖХ, анализ результатов; Т.И. Пшеничных — выполнение испытаний спектрофотометрическим и визуальным методами, измерение рН, анализ результатов.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Svetlana I. Kuleshova conceived the study idea, conceptualised the study, drafted the manuscript, and analysed the results. Irina A. Denisova selected analytical procedures, conducted HPLC testing, and analysed the results. Tatiana I. Pshenichnykh conducted the tests using spectrophotometric and visual methods, measured the pH, and analysed the results.
1. Страчунский ЛС, Белоусов ЮБ, Козлов СН, ред. Практическое руководство по антиинфекционной химиотерапии. М.; 2007.
Яковлев ВП, Яковлев СВ, ред. Рациональная антимикробная фармакотерапия: руководство. М.: Литтерра; 2007.
2. Егоров НС. Основы учения об антибиотиках: учебник. М.: Наука; 2004.
Раменская ГВ, ред. Фармацевтическая химия: учебник. М.: Лаборатория знаний; 2021.
3. Яковлев ВП, Яковлев СВ, ред. Рациональная антимикробная фармакотерапия: руководство. М.: Литтерра; 2007.
Егоров НС. Основы учения об антибиотиках: учебник. М.: Наука; 2004.
4. Страчунский ЛС, Белоусов ЮБ, Козлов СН, ред. Практическое руководство по антиинфекционной химиотерапии. М.; 2007.
Яковлев ВП, Яковлев СВ, ред. Рациональная антимикробная фармакотерапия: руководство. М.: Литтерра; 2007.
5. Егоров НС. Основы учения об антибиотиках: учебник. М.: Наука; 2004.
6. ФС.2.1.0315 Цефазолин натрия. Государственная фармакопея Российской Федерации XV изд. Т. 2. М.; 2023.
7. 04/2019:0988 Cefazolin sodium. European Pharmacopoeia 11.6.
ФС.2.1.0315 Цефазолин натрия. Государственная фармакопея Российской Федерации XV изд. Т. 2. М.; 2023.
8. ФС.2.1.0688 Цефуроксим натрия. Государственная фармакопея Российской Федерации XV изд. Т. 2. М.; 2023.
9. 01/2008:0992 Cefuroxime sodium. European Pharmacopoeia 11.6.
ФС.2.1.0688 Цефуроксим натрия. Государственная фармакопея Российской Федерации XV изд. Т. 2. М.; 2023.
10. ФС.2.1.025 Цефтриаксон натрия. Государственная фармакопея Российской Федерации XV изд. Т. 2. М.; 2023.
1.1 Яковлев ВП, Яковлев СВ, ред. Рациональная антимикробная фармакотерапия: руководство. М.: Литература ; 2007.
Егоров НС. Основы учения об антибиотиках: учебник. М.: Наука; 2004.
Раменская ГВ, ред. Фармацевтическая химия: учебник. М.: Лаборатория знаний; 2021.
12. 01/2009:0991 Ceftriaxone sodium. European Pharmacopoeia 11.6.
ФС.2.1.025 Цефтриаксон натрия. Государственная фармакопея Российской Федерации XV изд. Т. 2. М.; 2023.
13. Государственный реестр лекарственных средств. https://grls.rosminzdrav.ru
14. ОФС.1.2.1.006 Степень окраски жидкостей. Государственная фармакопея Российской Федерации XV изд. Т. 1. М.; 2023.
15. Cefazolin sodium. United States Pharmacopeia. USP NF; 2024.
16. 01/2009:0991 Ceftriaxone sodium. European Pharmacopoeia 11.6.
17. 04/2019:0988 Cefazolin sodium. European Pharmacopoeia 11.6.
18. 04/2019:0988 Cefazolin sodium. European Pharmacopoeia 11.6.
ФС.2.1.0315 Цефазолин натрия. Государственная фармакопея Российской Федерации XV изд. Т. 2. М.; 2023.
19. 01/2008:0992 Cefuroxime sodium. European Pharmacopoeia 11.6.
20. Cefazolin sodium. United States Pharmacopeia. USP NF; 2024.
21. Там же.
22. Там же.
23. Там же.
24. 01/2009:0991 Ceftriaxone sodium. European Pharmacopoeia 11.6.
25. 01/2008:0992 Cefuroxime sodium. European Pharmacopoeia 11.6.
26. Там же.
Список литературы
1. Скляренко АВ, Грошкова ИА, Горбунов НА, Яроцкий СВ. Биокаталитический синтез новых цефалоспоринов с использованием иммобилизованной синтетазы цефалоспоринов-кислот. Биотехнология. 2022;38(2):43–56. https://doi.org/10.56304/S0234275822020089
2. Скляренко АВ, Грошкова ИА, Горбунов НА, Яроцкий СВ. Альтернативный синтез цефазолина с использованием синтетазы цефалоспоринов-кислот. Прикладная биохимия и микробиология. 2020;56(5):452–64. https://doi.org/10.31857/S055510992005013X
3. Xu QA, Trissel LA, Saenz CA, Ingram DS, Williams KY. Stability of three cephalosporin antibiotics in AutoDos Infusion System bags. J Am Pharm Assoc (Wash). 2002;42(3):428–31. https://doi.org/10.1331/108658002763316851
4. Yamana T, Tsuji A. Comparative stability of cephalosporins in aqueous solution: Kinetics and mechanisms of degradation. J Pharm Sci. 1976;65(11):1563–73. https://doi.org/10.1002/jps.2600651104
5. Серченя ТС, Горбачева ИВ, Свиридов ОВ. Прямое конъюгирование пенициллинов и цефалоспоринов с белками для рецепторного анализа бета-лактамных антибиотиков. Биоорганическая химия. 2022;48(1):63–74. https://doi.org/10.31857/S0132342322010122
6. Катаева НН, Шулепова КЕ. Сравнительный анализ физико-химических свойств водных растворов цефалоспоринов I и III поколений. В кн.: Привалова ЕГ, ред. Инновационные технологии в фармации. Иркутск; 2023. С. 36–40. EDN: IKQANP
Об авторах
С. И. КулешоваРоссия
Кулешова Светлана Ивановна, канд. биол. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
И. А. Денисова
Россия
Денисова Ирина Анатольевна
Петровский б-р, д. 8, стр. 2, Москва, 127051
Т. И. Пшеничных
Россия
Пшеничных Татьяна Ивановна
Петровский б-р, д. 8, стр. 2, Москва, 127051
Дополнительные файлы
Рецензия
Для цитирования:
Кулешова С.И., Денисова И.А., Пшеничных Т.И. Оценка стабильности растворов антибиотиков-цефалоспоринов по показателям «Цветность раствора» и «Примеси». Регуляторные исследования и экспертиза лекарственных средств. 2025;15(1):34-43. https://doi.org/10.30895/1991-2919-2025-15-1-34-43
For citation:
Kuleshova S.I., Denisova I.A., Pshenichnykh T.I. Stability of Cephalosporins in Solution in Terms of the Colour of Solution and Impurities. Regulatory Research and Medicine Evaluation. 2025;15(1):34-43. (In Russ.) https://doi.org/10.30895/1991-2919-2025-15-1-34-43



































