Перейти к:
Разработка и валидация методики определения конваллятоксина в лекарственных препаратах, содержащих сердечные гликозиды ландыша
https://doi.org/10.30895/1991-2919-2024-14-5-580-589
Резюме
ВВЕДЕНИЕ. Надлежащий контроль содержания сердечных гликозидов в лекарственных препаратах на основе ландыша необходим для обеспечения безопасности их применения. В Российской Федерации фармакопейными методами количественного анализа сердечных гликозидов ландыша являются биологический и спектрофотометрический. Необходимо использовать более точные и селективные физико-химические методы анализа сердечных гликозидов, например метод высокоэффективной жидкостной хроматографии (ВЭЖХ).
ЦЕЛЬ. Разработка и валидация методики количественного определения сердечных гликозидов (конваллятоксина) в лекарственных растительных препаратах на основе ландыша методом ВЭЖХ.
МАТЕРИАЛЫ И МЕТОДЫ. В качестве объектов исследования были использованы: «Ландыша настойка», «Зеленина капли», «Валокормид», «Карниланд®», «Экстракт ландыша — стандартный образец». Количественное определение сердечных гликозидов проводили методами ВЭЖХ и спектрофотометрии в сравнении со стандартным образцом конваллятоксина. Для пробоподготовки использовали методику, описанную в ФС.3.4.0003.18. «Ландыша травы настойка». Хроматографическое разделение смеси сердечных гликозидов проводили на колонке Luna 5µm C18(2) в градиентном режиме элюирования смесью 0,1% раствора ортофосфорной кислоты и ацетонитрила. В процессе анализа использовали автосемплер с охлаждением проб до 5 °С.
РЕЗУЛЬТАТЫ. Результаты оценки специфичности, внутрилабораторной прецизионности, линейности (коэффициент корреляции 0,99985), правильности (98–102%), повторяемости (относительное стандартное отклонение содержания конваллятоксина — 1,61%) методики соответствуют критериям приемлемости. Методика пригодна для количественного определения конваллятоксина в лекарственных препаратах на основе ландыша, так как позволяет получать достоверные и воспроизводимые результаты.
ВЫВОДЫ. Разработана высокочувствительная и селективная ВЭЖХ-методика количественного определения конваллятоксина в лекарственных растительных препаратах на основе ландыша. Содержание конваллятоксина в субстанции-жидкости «Ландыша настойка» составило от 0,012 до 0,018 мг/мл, в лекарственных препаратах «Зеленина капли» — от 0,004 до 0,013 мг/мл, «Карниланд®» и «Валокормид» — от 0,005 до 0,007 мг/мл, в экстракте ландыша — стандартном образце — 0,029 мг/мл.
Ключевые слова
Для цитирования:
Голомазова Т.А., Антонова Н.П., Cеменова Н.Е., Шефер Е.П., Прохватилова С.С. Разработка и валидация методики определения конваллятоксина в лекарственных препаратах, содержащих сердечные гликозиды ландыша. Регуляторные исследования и экспертиза лекарственных средств. 2024;14(5):580-589. https://doi.org/10.30895/1991-2919-2024-14-5-580-589
For citation:
Golomazova T.A., Antonova N.P., Semenova N.E., Shefer E.P., Prokhvatilova S.S. Development and Validation of an Analytical Procedure for Determining Convallatoxin in Medicinal Products Containing Cardiac Glycosides of Lily of the Valley. Regulatory Research and Medicine Evaluation. 2024;14(5):580-589. (In Russ.) https://doi.org/10.30895/1991-2919-2024-14-5-580-589
ВВЕДЕНИЕ
Сердечные гликозиды (СГ) представляют собой группу биологически активных веществ (БАВ), обладающих в терапевтических дозах кардиотоническим и антиаритмическим действием. Они представляют собой вторичные метаболиты растений, в частности рода Convallaria (ландыш). Из травы, листьев и цветов ландыша майского — C. majalis L., ландыша закавказского — C. transcaucasica Utkin ex Grossh. и ландыша Кейске — C. keiskei Mig. выделяют сердечный гликозид конваллятоксин1.
Механизм действия таких СГ, как конваллятоксин, основан на их способности ингибировать активность натрий-калиевой АТФ-азы, что влияет на ионообменные процессы в сердечной мышце и вызывает изменение внутримиокардиального кальциевого обмена и силы сокращения сердца. Это приводит к повышению сократительной способности сердца, регуляции сердечного ритма и улучшению гемодинамики. Препараты СГ применяются для лечения сердечной недостаточности разной этиологии [1–5]. На российском фармацевтическом рынке СГ представлены одно- и многокомпонентными препаратами.
Из травы ландыша получают настойку, которая входит в состав комплексных лекарственных растительных препаратов (ЛРП)2 в сочетании с другими компонентами природного и синтетического происхождения [6]: настойками пустырника, валерианы, белладонны, жидкими экстрактами боярышника, крапивы, нитроглицерином, ментолом, ментилизовалератом, натрия бромидом. Надлежащий контроль содержания СГ необходим для обеспечения безопасного использования препаратов на основе ландыша. Совместно присутствующие компоненты могут оказывать влияние на количественное определение СГ ландыша в комплексных ЛРП.
Согласно требованиям Государственной фармакопеи Российской Федерации (ГФ РФ)3 для количественной оценки СГ ландыша применяют два метода: биологический и спектрофотометрический. Спектрофотометрический метод основан на способности СГ образовывать хромогенный комплекс при взаимодействии с пикриновой кислотой. Методика характеризуется высокой трудоемкостью и низкой селективностью. Метод биологической стандартизации является арбитражным и основан на способности СГ в токсических дозах вызывать систолическую остановку сердца у лягушек различных видов4. Данный метод позволяет установить только силу действия СГ, а не их точное содержание. Проведение испытаний на животных связано с рядом этических проблем. В международной практике проведение научных исследований без участия животных поддерживается положением Директивы Европейского парламента и Совета Европейского союза «О защите животных, использующихся в научных целях» № 2010/63/ЕС. Кроме того, биологические методы не всегда обеспечивают желаемую воспроизводимость и точность результатов (ошибка анализа составляет от 20 до 25%) и требуют специфических навыков для выполнения экспериментов с животными.
Учитывая недостатки применяемых методов [6][7], необходимо использовать более точные и селективные физико-химические методы анализа СГ. Например, метод высокоэффективной жидкостной хроматографии (ВЭЖХ), который позволяет разделять и идентифицировать индивидуальные соединения в многокомпонентных ЛС.
Цель работы — разработка и валидация методики количественного определения сердечных гликозидов (конваллятоксина) в лекарственных растительных препаратах на основе ландыша методом ВЭЖХ.
МАТЕРИАЛЫ И МЕТОДЫ
Объекты исследования. Субстанция-жидкость «Ландыша настойка» (серии 010822 и 050423) и лекарственные препараты: «Зеленина капли» (серии 010423, 10323, 010622, 10422, 050623, 30823 и 20823), «Валокормид» (серия 30922), «Карниланд®» (серии 10224 и 10621), «Экстракт ландыша — стандартный образец» (ФС 42-2486-87), стандартный образец (СО) конваллятоксина (Sigma-Aldrich, кат. № С9140, содержание основного вещества 92,0%). Для приготовления раствора плацебо использовали субстанции-жидкости: «Боярышника настойка», «Красавки настойка», «Валерианы настойка», «Пустырника настойка».
Реактивы. Ацетонитрил (квалификация «для ВЭЖХ», Carlo Erba Reagents), хлороформ («для жидкостной хроматографии», Merck), спирт этиловый (96%, Гатчинский спиртовой завод), свинца (II) ацетат тригидрат (Merck), полиамид («для колоночной хроматографии», Sigma-Aldrich), фосфорная кислота (85,9%, Honeywell), пикриновая кислота (Sigma-Aldrich), натрия сульфат безводный (Merck), натрия гидроксид (Merck), натрия бромид («для ИК-спектроскопии», Merck), левоментол (99,6%, Sigma-Aldrich).
Оборудование. Жидкостный хроматограф Agilent 1260 Infinity II (Agilent Technologies) с диодно-матричным детектором, хроматографическая колонка Luna C18(2) 250 мм × 4,6 мм × 5 мкм (Phenomenex), электронные весы XPE205DR (Mettler Toledo), система очистки воды Milli-Q Integral 5 (Millipore), шейкер орбитальный KS 501 digital (IKA), испаритель ротационный с баней Rotavapor R-200 (BUCHI lab), спектрофотометр Cary 100 (Varian), ванна ультразвуковая (УЗ) ГРАД-95-35 (ООО «НТК Солтек»).
Пробоподготовку проводили в соответствии с ФС.3.4.0003.18. «Ландыша настойка», как указано в разделе «Количественное определение» (спектрофотометрический метод). Для приготовления испытуемого раствора 5,0 мл субстанции-жидкости «Ландыша настойка» / экстракта ландыша — стандартного образца, помещали в круглодонную колбу, прибавляли 5 мл воды очищенной и упаривали на роторном испарителе до объема около 7 мл. Объем раствора доводили водой очищенной до 10 мл, прибавляли 1 мл 10% раствора свинца ацетата и тщательно перемешивали. Раствор фильтровали в делительную воронку через смоченный водой бумажный складчатый фильтр «черная лента» (ООО «МЕЛИОР ХХI»). Фильтр промывали 5 мл воды. В делительную воронку прибавляли 30 мл смеси этиловый спирт 96% — хлороформ (2:8) и взбалтывали на орбитальном шейкере в течение 5 мин. После расслаивания нижний хлороформный слой фильтровали в колбу для отгона через бумажный фильтр с 3 г натрия сульфата безводного, смоченного 5 мл хлороформа. Операцию извлечения спирто-хлороформной смесью повторяли еще 2 раза, используя по 30 мл смеси того же состава, и фильтровали хлороформные извлечения в ту же колбу. Фильтр с натрия сульфатом безводным промывали 10 мл спирто-хлороформной смеси, промывную жидкость собирали в ту же колбу.
12,5 мл лекарственного препарата «Зеленина капли» / «Валокормид» / «Карниланд®» помещали в круглодонную колбу и упаривали до объема 5 мл на роторном испарителе. К полученному раствору добавляли 1,5 мл 10% раствора свинца ацетата. Объем раствора доводили до первоначального объема (12,5 мл) водой очищенной и фильтровали через бумажный складчатый фильтр «черная лента», смоченный водой, в делительную воронку. Фильтр промывали 5 мл воды. В делительную воронку прибавляли 30 мл смеси этиловый спирт 96% — хлороформ (2:8) и взбалтывали на орбитальном шейкере в течение 5 мин. После расслаивания нижний хлороформный слой фильтровали через бумажный фильтр с 3 г натрия сульфата безводного, смоченного 5 мл хлороформа, в колбу для отгона. Операцию извлечения спирто-хлороформной смесью повторяли еще 2 раза, используя по 30 мл смеси того же состава, и фильтровали хлороформные извлечения в ту же колбу. Фильтр с натрия сульфатом безводным промывали 10 мл спирто-хлороформной смеси, промывную жидкость собирали в ту же колбу.
Каждый из полученных фильтратов упаривали на роторном испарителе под вакуумом при температуре 45 °С досуха. Сухие остатки растворяли в 10 мл этилового спирта 25%. Растворы переносили в мерную колбу вместимостью 25 мл. Колбы для отгона промывали дважды по 5 мл тем же спиртом, растворы переносили в ту же мерную колбу. Объем растворов в мерных колбах доводили тем же спиртом до метки и перемешивали. Фильтровали полученные растворы через мембранный фильтр из регенерированной целлюлозы.
Приготовление стандартного раствора конваллятоксина. Для приготовления стандартного раствора 10 мг СО конваллятоксина помещали в мерную колбу объемом 10 мл, прибавляли 5 мл 70% этилового спирта, помещали на 5 мин на УЗ-баню при температуре не выше 20 °С, доводили объем раствора тем же растворителем до метки, перемешивали. 1,0 мл полученного раствора переносили в мерную колбу объемом 10 мл, доводили объем раствора 25% этиловым спиртом до метки, перемешивали.
Идентификацию и количественное определение конваллятоксина в лекарственных растительных препаратах на основе ландыша проводили методом ВЭЖХ в условиях градиентного элюирования (табл. 1) на обращенно-фазовой колонке Luna 5µm C18(2).
Таблица 1. Программа градиентного элюирования для количественного определения конваллятоксина в лекарственном растительном препарате
Table 1. Gradient elution programme for the quantitative determination of convallatoxin in herbal medicinal products
Время, мин Time, min | Подвижная фаза А, % Mobile phase A, % | Подвижная фаза Б, % Mobile phase B, % |
0 | 80 | 20 |
15 | 80 | 20 |
25 | 70 | 30 |
28 | 5 | 95 |
32 | 5 | 95 |
33 | 80 | 20 |
40 | 80 | 20 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. Подвижная фаза А — 0,1% раствор ортофосфорной кислоты в воде, подвижная фаза Б — ацетонитрил.
Note. Mobile phase A: 0.1% orthophosphoric acid in water; mobile phase B: acetonitrile.
Детектирование проводили при длине волны 220 нм. Скорость потока составляла 1 мл/мин, температура колонки — 25 °С, температура термостата автосемплера — 5 °С, объем вводимой пробы — 20 мкл. Время удерживания конваллятоксина в описанных условиях составило 24 мин (рис. 1). Хроматограммы испытуемых растворов препаратов «Валокормид» и «Карниланд®» были аналогичны хроматограммам испытуемого раствора препарата «Зеленина капли». Хроматограмма экстракта ландыша аналогична хроматограммам испытуемого раствора субстанции-жидкости «Ландыша настойка» (рис. 1).
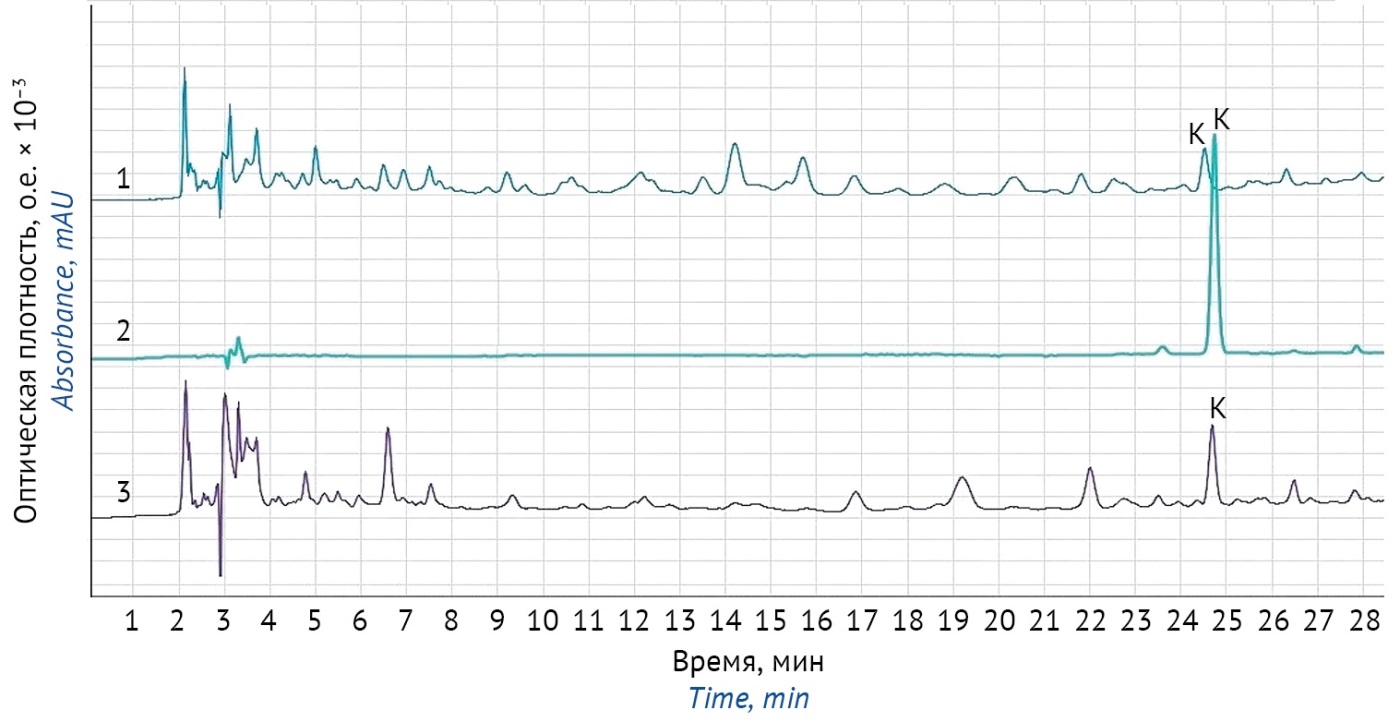
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 1. Типичные хроматограммы для количественного определения конваллятоксина в лекарственных растительных препаратах: 1 — испытуемый раствор «Зеленина капли»; 2 — стандартный образец конваллятоксина; 3 — испытуемый раствор «Ландыша настойка»; К — пик конваллятоксина. Условия анализа: колонка Luna C18(2) 250 мм × 4,6 мм × 5 мкм, градиентное элюирование смесью 0,1% раствора ортофосфорной кислоты и ацетонитрила, скорость потока — 1 мл/мин, детектирование при 220 нм
Fig. 1. Typical chromatograms for the quantitative determination of convallatoxin in herbal medicinal products: 1, Zelenin Drops test solution; 2, convallatoxin reference standard solution; 3, Lily-of-the-Valley Tincture test solution; К, peak of convallatoxin. Analytical conditions: Luna C18(2) 250 mm × 4,6 mm × 5 µm column, gradient elution with 0.1% orthophosphoric acid in water and acetonitrile, flow rate of 1 mL/min, detection at 220 nm
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для подтверждения специфичности методики была проведена оценка спектральной чистоты пиков конваллятоксина на хроматограммах растворов стандартного и испытуемого образцов; коэффициент подобия (Similarity Factor, SF) составил 999,91.
Спектры основных пиков на хроматограммах испытуемого и стандартного растворов идентичны и имеют максимум поглощения при 220 ± 2 нм (рис. 2). Времена удерживания конваллятоксина на хроматограммах раствора СО конваллятоксина и испытуемых образцов ЛРП совпадают, пик конваллятоксина на хроматограммах подвижной фазы и растворителя отсутствует. Для подтверждения специфичности методики для анализа многокомпонентных препаратов ландыша были приготовлены растворы плацебо, содержащие настойку пустырника, настойку валерианы, настойку боярышника, левоментол и натрия бромид. На хроматограммах растворов плацебо пики со временем удерживания, совпадающим со временем удерживания пика конваллятоксина, отсутствовали.
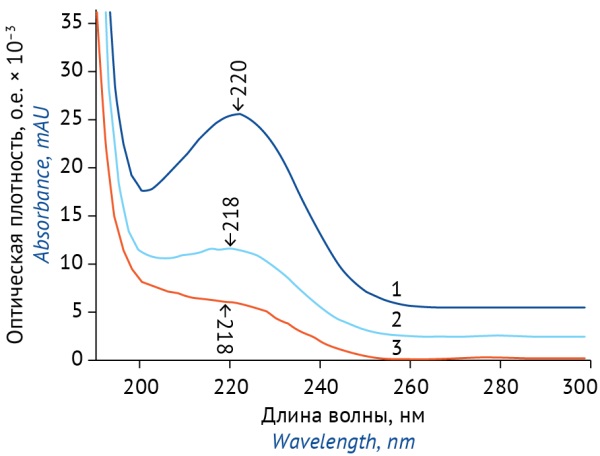
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 2. Спектры поглощения: 1 — раствор стандартного образца конваллятоксина; 2 — испытуемый раствор «Ландыша настойка»; 3 — испытуемый раствор «Зеленина капли»
Fig. 2. Absorption spectra: 1, convallatoxin reference standard solution; 2, Lily-of-the-Valley Tincture test solution; 3, Zelenin Drops test solution
В процессе исследования была проведена очистка испытуемого раствора с применением полиамида для колоночной хроматографии. Для этого 20 мл испытуемого раствора пропускали через колонку диаметром 1 см с 1,2 г полиамида. Полученные хроматограммы испытуемых растворов до и после очистки были идентичны. Таким образом, дополнительная хроматографическая очистка испытуемых растворов от сопутствующих веществ с использованием полиамида была признана нецелесообразной.
Выбор хроматографических условий количественного определения конваллятоксина был проведен на основании данных литературы [8–10]. Результаты анализа, полученные в этих условиях, представлены в таблице 2. Однако условия хроматографирования, описанные в методиках [8][10], не позволили достичь эффективного разделения веществ. Значения коэффициента разделения (Rs) составили 1,41 и 1,19 соответственно. Это привело к перекрыванию пиков на хроматограммах и затруднило корректное интегрирование и количественный анализ конваллятоксина, а также не позволило установить точное содержание конваллятоксина в многокомпонентных препаратах ландыша. Также при анализе по методикам [8–10] спектральная чистота пика конваллятоксина была во всех случаях недостаточной. SF по методике 1 составил 923,89; по методике 2 — 864,62; по методике 3 — 972,25. При значениях SF<990 различие между спектрами считается значимым [11], то есть пик не является спектрально чистым.
Таблица 2. Количественное определение конваллятоксина в субстанции-жидкости «Ландыша настойка» и экстракте ландыша — стандартном образце с использованием различных ВЭЖХ-методик
Table 2. Quantitative determination of convallatoxin in the liquid active substance Lily-of-the-Valley Tincture and in the Lily-of-the-Valley Extract Reference Standard using various HPLC-based procedures
Номер и наименование образцов Sample number and name | Результат определения конваллятоксина, мг/мл Convallatoxin quantification result, mg/mL | |||
Разработанная методика Developed analytical procedure | Методика 1 Analytical procedure 1 | Методика 2 Analytical procedure 2 | Методика 3 Analytical procedure 3 | |
1. Ландыша настойка субстанция-жидкость, серия 050423 Lily-of-the-Valley Tincture, liquid active substance, batch 050423 | 0,01824 RSD=0,18% | 0,01956 RSD=3,30% | 0,01620 RSD=2,57% | 0,01719 RSD=3,20% |
2. Ландыша настойка субстанция-жидкость, серия 010822 Lily-of-the-Valley Tincture, liquid active substance, batch 010822 | 0,01153 RSD=0,67% | 0,01307 RSD=3,22% | 0,00816 RSD=2,67% | 0,00915 RSD=4,16% |
3. Экстракт ландыша — стандартный образец Lily-of-the-Valley Extract Reference Standard | 0,02947 RSD=0,31% | 0,03816 RSD=2,98% | 0,02785 RSD=3,08% | 0,02516 RSD=3,74% |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. RSD — относительное стандартное отклонение.
Условия анализа по методике 1 приведены в источнике [8], по методике 2 — в источнике [9], по методике 3 — в источнике [10].
Note. RSD, relative standard deviation.
The testing conditions for analytical procedure 1 are specified in [8], those for analytical procedure 2 are given in [9], and those for analytical procedure 3 are described in [10].
На следующем этапе исследований были подобраны оптимальный состав и значение рН подвижной фазы, а также использован градиентный режим элюирования, позволяющий полностью разделить пики (Rs~4,40). Эти факторы помогли достичь наилучшего хроматографического разделения и повысить эффективность метода.
Далее были проведены сравнительные исследования по определению конваллятоксина в многокомпонентных препаратах ландыша методом спектрофотометрии в видимой области спектра5, включенной в большинство зарегистрированных нормативных документов, и с использованием разработанной ВЭЖХ-методики (табл. 3). Было установлено, что результаты количественного определения СГ методом спектрофотометрии с использованием значения удельного показателя поглощения конваллятоксина — 170 при длине волны 495 нм оказываются завышенными в 10–13 раз, а с использованием стандартного образца конваллятоксина — в 5–7 раз по сравнению с результатами, полученными методом ВЭЖХ. Такая разница результатов обусловлена тем, что при использовании спектрофотометрической методики рассчитывается сумма СГ в пересчете на конваллятоксин, а при использовании методики ВЭЖХ — содержание индивидуального вещества — конваллятоксина. На полученных спектрах поглощения испытуемых растворов (рис. 3) отсутствовал четко выраженный максимум поглощения. Таким образом, можно говорить о большей селективности ВЭЖХ-методики по сравнению со спектрофотометрической.
Таблица 3. Количественное определение сердечных гликозидов (СГ) в многокомпонентных препаратах ландыша методами высокоэффективной жидкостной хроматографии (ВЭЖХ; разработанная методика) и спектрофотометрии7 (СФМ)
Table 3. Quantitative determination of cardiac glycosides (CGs) in multicomponent medicinal products of lily of the valley by the developed analytical procedure based on high-performance liquid chromatography (HPLC) and by spectrophotometry7
Наименование препарата и серия образца Medicinal product name and sample batch | Результат определения, мг/мл, Result, mg/mL | Требования к количественному содержанию СГ CG content requirements | ||
ВЭЖХ (конваллятоксин) HPLC (convallatoxin) | СФМ (по удельному показателю поглощения конваллятоксина) Spectrophotometry (specific absorbance of convallatoxin) | СФМ (с использованием стандартного образца) Spectrophotometry (reference standard for convallatoxin) | ||
Зеленина капли, серия 030823 Zelenin Drops, batch 030823 | 0,00413 RSD=2,64% | 0,05398 RSD=0,88% | 0,03256 RSD=0,88% | Сумма СГ в пересчете на конваллятоксин от 0,040 до 0,060 мг/мл (метод СФМ) Total CGs expressed as convallatoxin: 0.040–0.060 mg/mL (spectrophotometry) |
Зеленина капли, серия 050623 Zelenin Drops, batch 050623 | 0,00490 RSD=0,56% | 0,05811 RSD=1,13% | 0,03506 RSD=1,13% | |
Зеленина капли, серия 10323 Zelenin Drops, batch 10323 | 0,01123 RSD=0,79% | 0,11386 RSD=1,32% | 0,06868 RSD=1,32% | |
Зеленина капли, серия 20823 Zelenin Drops, batch 20823 | 0,01028 RSD=1,42% | 0,06736 RSD=0,66% | 0,04063 RSD=0,66% | |
Зеленина капли, серия 010622 Zelenin Drops, batch 010622 | 0,01138 RSD=1,63% | 0,06531 RSD=0,44% | 0,04019 RSD=0,44% | |
Зеленина, капли, серия 010423 Zelenin Drops, batch 010423 | 0,01280 RSD=2,58% | 0,11454 RSD=1,42% | 0,06910 RSD=1,42% | |
Зеленина, капли, серия 10422 Zelenin Drops, batch 10422 | 0,00593 RSD=1,03% | 0,06554 RSD=0,67% | 0,03994 RSD=0,67% | |
Карниланд®, серия 10621 Carniland®, batch 10621 | 0,00480 RSD=1,89% | 0,04551 RSD=0,55% | 0,02745 RSD=0,55% | Содержание СГ не нормируется CG content not standardised |
Карниланд®, серия 10224 Carniland®, batch 10224 | 0,00614 RSD=0,60% | 0,04217 RSD=1,07% | 0,02544 RSD = 1,07% | |
Валокормид, серия 30922 Valocormid, batch 30922 | 0,00710 RSD=0,92% | 0,08718 RSD=2,45% | 0,05259 RSD=2,45% | Сумма СГ в пересчете на конваллятоксин от 0,034 до 0,045 мг/ мл (метод СФМ) Total CGs expressed as convallatoxin: 0.034–0.045 mg/mL (spectrophotometry) |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. RSD — относительное стандартное отклонение.
Note. RSD, relative standard deviation.
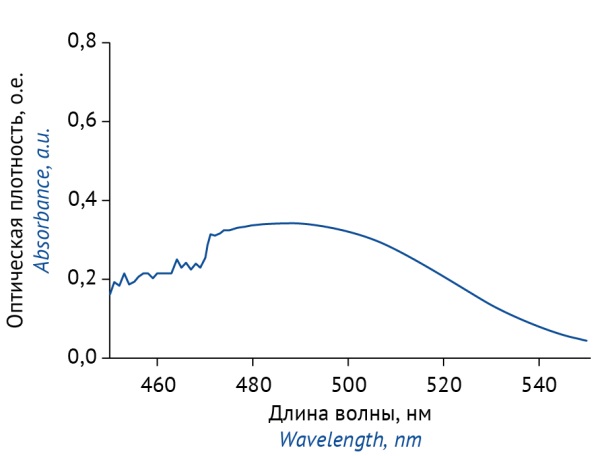
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 3. Спектр поглощения продуктов взаимодействия сердечных гликозидов ландыша с пикриновой кислотой в препаратах ландыша
Fig. 3. Absorption spectra of reaction products of cardiac glycosides and picric acid in lily-of-the-valley medicinal products
Для оценки пригодности хроматографической системы была использована хроматограмма СО конваллятоксина и вычислены:
- значение фактора асимметрии пика конваллятоксина — 1,07;
- относительное стандартное отклонение площади пика конваллятоксина для 6определений — 0,21%.
Содержание конваллятоксина (Х, мг/мл) в субстанции-жидкости «Ландыша настойка», препаратах «Зеленина капли» и «Валокормид» вычисляли по формуле:
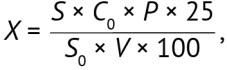 (1)
(1)
где S — площадь пика конваллятоксина на хроматограмме испытуемого раствора; S0 — площадь пика конваллятоксина на хроматограмме стандартного раствора; Р — содержание конваллятоксина в стандартном образце, %; V — объем испытуемого образца (Ландыша настойка — 5 мл, «Зеленина капли» / «Валокормид» / «Кардиланд®» — 12,5 мл); С0 — концентрация конваллятоксина в растворе стандартного образца, мг/мл.
С использованием разработанной ВЭЖХ-методики были получены следующие результаты содержания конваллятоксина: в субстанции-жидкости «Ландыша настойка» от 0,012 до 0,018 мг/мл, в лекарственных препаратах «Зеленина капли» от 0,004 до 0,013 мг/мл, «Карниланд®», «Валокормид» от 0,005 до 0,007 мг/мл, в экстракте ландыша — стандартном образце 0,029 мг/мл.
Валидация6 разработанной аналитической методики проводилась по критериям: специфичность, линейность, внутрилабораторная прецизионность, правильность, повторяемость, предел обнаружения (ПО) и предел количественного определения (ПКО).
ПО и ПКО были рассчитаны по величине стандартного отклонения сигнала и угловому коэффициенту графика линейной зависимости аналитического сигнала от концентрации определяемого вещества в анализируемой пробе по уравнениям:
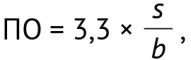 (2)
(2)
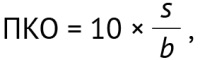 (3)
(3)
где s — стандартное отклонение аналитического сигнала; b — коэффициент чувствительности, представляющий собой отношение аналитического сигнала к определяемой величине (тангенс угла наклона калибровочной кривой). Результаты определения ПО и ПКО конваллятоксина методом ВЭЖХ представлены в таблице 4, опубликованной на сайте журнала8.
ПО и ПКО методики составили 0,018 и 0,055 мкг/мл соответственно. Результаты валидационных исследований аналитической методики количественного определения конваллятоксина в субстанции-жидкости «Ландыша настойка» представлены в таблице 5, опубликованной на сайте журнала9. Полученные данные подтверждают соответствие методики критериям приемлемости.
Разработанная методика количественного определения конваллятоксина в препаратах ландыша позволяет получать достоверные, воспроизводимые результаты.
ВЫВОДЫ
- Разработана высокочувствительная (ПКО 0,055 мкг/мл) и селективная методика количественного определения сердечного гликозида — конваллятоксина в лекарственных растительных препаратах на основе ландыша методом ВЭЖХ.
- Результаты оценки специфичности, внутрилабораторной прецизионности, линейности (коэффициент корреляции 0,99985), правильности (98–102%), повторяемости (относительное стандартное отклонение содержания конваллятоксина — 1,61%) методики соответствуют критериям приемлемости. Методика пригодна для количественного определения конваллятоксина в лекарственных препаратах на основе ландыша, так как позволяет получать достоверные и воспроизводимые результаты.
- С использованием разработанной ВЭЖХ-методики определено содержание конваллятоксина в субстанции-жидкости «Ландыша настойка» (0,012–0,018 мг/мл), в лекарственных препаратах «Зеленина капли» (0,004–0,013 мг/мл), «Карниланд®» и «Валокормид» (0,005–0,007 мг/мл), в экстракте ландыша — стандартном образце 0,029 мг/мл.
Дополнительная информация. На сайте журнала «Регуляторные исследования и экспертиза лекарственных средств» размещены таблицы 4, 5.
https://doi.org/10.30895/1991-2919-2024-14-5-580-589-table4
https://doi.org/10.30895/1991-2919-2024-14-5-580-589-table5
Additional information. Tables 4 and 5 are published on the website of Regulatory Research and Medicine Evaluation.
https://doi.org/10.30895/1991-2919-2024-14-5-580-589-table4
https://doi.org/10.30895/1991-2919-2024-14-5-580-589-table5
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Т.А. Голомазова — выполнение экспериментальной части исследований, написание текста рукописи; Н.П. Антонова — идея, планирование исследования, консультация по вопросам проведения отдельных этапов экспериментальных работ, утверждение окончательного варианта рукописи для публикации; Н.Е. Семенова — обобщение результатов исследования и интерпретация результатов; Е.П. Шефер — разработка дизайна валидационного исследования и обработка его результатов, критический пересмотр текста рукописи; С.С. Прохватилова — сбор, анализ и обобщение данных литературы.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Tatyana A. Golomazova conducted experiments and drafted the manuscript. Natalia P. Antonova conceived the study idea, designed the study, provided consultations on individual stages of the experimental work, and approved the final version of the manuscript for publication. Natalia E. Semenova summarised and interpreted the study results. Elena P. Shefer designed the validation study, analysed its results, and critically revised the manuscript. Svetlana S. Prokhvatilova collected, analysed, and summarised literature data.
1. ФС.3.4.0003.18 Ландыша травы настойка. Государственная фармакопея Российской Федерации. XIV изд. Т. 4. М.; 2018.
2. Государственный реестр лекарственных средств. https://grls.rosminzdrav.ru
3. ФС.3.4.0003.18 Ландыша травы настойка. Государственная фармакопея Российской Федерации. XIV изд. Т. 4. М.; 2018.
4. ОФС.1.2.4.0009.15 Биологические методы оценки активности лекарственного растительного сырья и лекарственных препаратов, содержащих сердечные гликозиды. Государственная фармакопея Российской Федерации. XIV изд. Т. 1. М.; 2018.
5. ФС.3.4.0003.18 Ландыша травы настойка. Государственная фармакопея Российской Федерации. XIV изд. Т. 4. М.; 2018.
6. ОФС.1.1.0012 Валидация аналитических методик. Государственная фармакопея Российской Федерации. XV изд. М.; 2023.
7. ФС.3.4.0003.18 Ландыша травы настойка. Государственная фармакопея Российской Федерации. XIV изд. Т. 4. М.; 2018.
8. https://doi.org/10.30895/1991-2919-2024-14-5-580-589-table4
9. https://doi.org/10.30895/1991-2919-2024-14-5-580-589-table5
Список литературы
1. Haviv H, Karlish SJD. P-Type pumps: Na+,K+-ATPase. Lennarz WJ, Lane MD. Encyclopedia of biological chemistry. Academic Press; 2013. https://doi.org/10.1016/B978-0-12-378630-2.00198-5
2. Wang HJ, Evans RM. Timed use of cardiac glycoside protects the heart. Nat Cardiovasc Res. 2022;1(11):973–5. https://doi.org/10.1038/s44161-022-00158-x
3. Kanji S, MacLean RD. Cardiac glycoside toxicity: more than 200 years and counting. Crit Care Clin. 2012;28(4):527–35. https://doi.org/10.1016/j.ccc.2012.07.005
4. Гуревич МА, Гаврилин АА. Сердечные гликозиды в современной клинической практике. Альманах клинической медицины. 2014;(35):101–5. https://doi.org/10.18786/2072-0505-2014-35-101-105
5. Дукельская НК, Гармашова ИВ, Давыдова МВ. Сравнительный анализ препаратов сердечных гликозидов, используемых в современной фармакотерапии. Известия Российской военномедицинской академии. 2020;39(S3–4):82–5. EDN: SNCYHH
6. Евдокимова ОВ, Бекетова АВ, Наумова ОА, Клинкова ИВ, Шемерянкина ТБ, Ладыгина ЛА, Бущик КС. Современные методы идентификации и количественного определения сердечных гликозидов. Ведомости Научного центра экспертизы средств медицинского применения. Регуляторные исследования и экспертиза лекарственных средств. 2023;13(4):567–77. https://doi.org/10.30895/1991-2919-2023-13-4-567-577
7. Круглов ДС, Кошкарева КЕ. Количественное определение конваллятоксина в растительном сырье, содержащем кардиостероиды, методом фотометрии. Сибирский медицинский вестник. 2019;(4):34–7. EDN: LHXXYU
8. Züst T, Petschenka G, Hastings AP, Agrawal AA. Toxicity of milkweed leaves and latex: chromatographic quantification versus biological activity of cardenolides in 16 Asclepias species. J Chem Ecol. 2019;45(1):50–60. https://doi.org/10.1007/s10886-018-1040-3
9. Agrawal P, Akhade M, Laddha K, Narkhede S, Mirgal A, Salunke C. Quantification of convallatoxin in Antiaris toxicaria Leusch seeds by RP-HPLC. Anal Chem Lett. 2014;4(3):172–7. https://doi.org/10.1080/22297928.2014.925821
10. Pellati F, Bruni R, Bellardi MG, Bertaccini A, Benvenuti S. Optimization and validation of a high-performance liquid chromatography method for the analysis of cardiac glycosides in Digitalis lanata. J Chromatogr A. 2009;1216(15):3260–9. https://doi.org/10.1016/j.chroma.2009.02.042
11. Эпштейн НА. Валидация хроматографических методик: контроль чистоты пиков и специфичности методик с использованием диодно-матричных детекторов (обзор). Разработка и регистрация лекарственных средств. 2020;9(3):129–36. https://doi.org/10.33380/2305-2066-2020-9-3-129-136
Об авторах
Т. А. ГоломазоваРоссия
Голомазова Татьяна Александровна.
Петровский б-р, д. 8, стр. 2, Москва, 127051
Н. П. Антонова
Россия
Антонова Наталия Петровна - канд. биол. наук.
Петровский б-р, д. 8, стр. 2, Москва, 127051
Н. Е. Cеменова
Россия
Семенова Наталья Евгеньевна.
Петровский б-р, д. 8, стр. 2, Москва, 127051
Е. П. Шефер
Россия
Шефер Елена Павловна - канд. фарм. наук.
Петровский б-р, д. 8, стр. 2, Москва, 127051
С. С. Прохватилова
Россия
Прохватилова Светлана Степановна - канд. фарм. наук.
Петровский б-р, д. 8, стр. 2, Москва, 127051
Дополнительные файлы

|
1. Таблица 4. Определение пределов обнаружения (ПО) и количественного определения (ПКО) конваллятоксина методом высокоэф фективной жидкостной хроматографии | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(881KB)
|
Метаданные ▾ | |

|
2. Таблица 5. Результаты валидационных исследований аналитической методики количественного определения конваллятоксина в субстанции-жидкости «Ландыша настойка» | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(1MB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Голомазова Т.А., Антонова Н.П., Cеменова Н.Е., Шефер Е.П., Прохватилова С.С. Разработка и валидация методики определения конваллятоксина в лекарственных препаратах, содержащих сердечные гликозиды ландыша. Регуляторные исследования и экспертиза лекарственных средств. 2024;14(5):580-589. https://doi.org/10.30895/1991-2919-2024-14-5-580-589
For citation:
Golomazova T.A., Antonova N.P., Semenova N.E., Shefer E.P., Prokhvatilova S.S. Development and Validation of an Analytical Procedure for Determining Convallatoxin in Medicinal Products Containing Cardiac Glycosides of Lily of the Valley. Regulatory Research and Medicine Evaluation. 2024;14(5):580-589. (In Russ.) https://doi.org/10.30895/1991-2919-2024-14-5-580-589



































