Перейти к:
Современные подходы к контролю неродственных технологических примесей в антибиотиках
https://doi.org/10.30895/1991-2919-2024-14-6-645-654
Резюме
ВВЕДЕНИЕ. Отдельным классом органических примесей в фармацевтических субстанциях антибиотиков являются технологические примеси, не относящиеся к родственным соединениям или органическим растворителям, в частности N,N-диметиланилин, 2-этилгексановая кислота и ее производные. Данные вещества используются в процессе производства фармацевтических субстанций антибиотиков в качестве реагентов, и контроль их остаточного содержания предусмотрен отечественной и зарубежными фармакопеями.
ЦЕЛЬ. Обосновать требования к контролю технологических неродственных примесей в фармацевтических субстанциях антибиотиков.
МАТЕРИАЛЫ И МЕТОДЫ. Проведен анализ фармакопейных статей и монографий Государственной фармакопеи Российской Федерации (ГФ РФ) и зарубежных фармакопей (Европейской фармакопеи (Ph. Eur.), Фармакопеи США (USP), Международной фармакопеи) на фармацевтические субстанции антибиотиков, а также анализ материалов регистрационных досье на фармацевтические субстанции антибиотиков российского и зарубежного производств, включенных в Государственный реестр лекарственных средств. В работе использовали методы сравнительного информационно-аналитического исследования и контент-анализа.
РЕЗУЛЬТАТЫ. В Ph. Eur. контроль содержания 2-этилгексановой кислоты предусмотрен в фармацевтических субстанциях антибиотиков (полусинтетических и полученных способом ферментации). В USP этот показатель не включен в частные монографии. Определение остаточных количеств N,N-диметиланилина введено как в частные монографии на полусинтетические антибиотики Ph. Eur., так и USP, что, вероятно, обусловлено его высокой токсичностью. Требования ГФ РФ гармонизированы с Ph. Eur. При анализе материалов регистрационных досье было показано, что производители заменяют 2-этилгексановую кислоту и N,N-диметиланилин на менее токсичные реагенты, содержание которых при необходимости контролируют в соответствии с общими требованиями к остаточным органическим растворителям.
ВЫВОДЫ. Современные технологические процессы позволяют производить фармацевтические субстанции антибиотиков без использования 2-этилгексановой кислоты и N,N-диметиланилина. Концепция их контроля должна быть основана на оценке рисков, и соответствующие указания следует включить в фармакопейные статьи, переведя показатели из статуса обязательных в статус контролируемых только при использовании 2-этилгексановой кислоты и N,N-диметиланилина в процессе производства.
Ключевые слова
Для цитирования:
Ковалева Е.Л., Архипова К.С., Алдамова И.М. Современные подходы к контролю неродственных технологических примесей в антибиотиках. Регуляторные исследования и экспертиза лекарственных средств. 2024;14(6):645-654. https://doi.org/10.30895/1991-2919-2024-14-6-645-654
For citation:
Kovaleva E.L., Arhipova K.S., Aldamova I.M. Current approaches to the control of process-related impurities in antibiotics. Regulatory Research and Medicine Evaluation. 2024;14(6):645-654. (In Russ.) https://doi.org/10.30895/1991-2919-2024-14-6-645-654
ВВЕДЕНИЕ
Общие требования к контролю органических примесей в лекарственных средствах приведены в Государственной фармакопее Российской Федерации (ГФ РФ) в общих фармакопейных статьях (ОФС)1, в Фармакопее Евразийского экономического союза (ФЕАЭС)2, в монографиях Европейской фармакопеи (Ph. Eur.) и Фармакопеи США (USP)3, руководствах Международного совета по гармонизации технических требований к лекарственным средствам для медицинского применения (International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use, ICH)4, Решении Коллегии Евразийской экономической комиссии от 04.10.2022 № 138 «Об утверждении Требований к проведению исследований (испытаний) лекарственных средств в части оценки и контроля содержания примесей».
Отдельным классом органических примесей в фармацевтических субстанциях антибиотиков являются технологические примеси, не относящиеся к родственным соединениям или к органическим растворителям. Основными представителями данного класса примесей являются N,N-диметиланилин, 2-этилгексановая кислота и ее производные. Данные вещества используются в процессе производства, и их контроль не рассматривается вышеуказанными документами. Нормы и требования к остаточному содержанию N,N-диметиланилина, 2-этилгексановой кислоты включены в частные фармакопейные статьи ГФ РФ и монографии Ph. Eur. на фармацевтические субстанции антибиотиков. В USP нормативные требования приведены только для N,N-диметиланилина в общей монографии «Dimethylaniline»5. Методики определения остаточного содержания 2-этилгексановой кислоты и N,N-диметиланилина описаны в общих фармакопейных статьях и монографиях6.
Изучение принципов и подходов к оценке примесей имеет научно-практическое значение в целях гармонизации национальных требований к стандартам качества фармацевтических субстанций с международными требованиями и обеспечения качества фармацевтических субстанций, используемых в составе лекарственных препаратов антибиотиков.
Цель работы — обоснование требований к контролю технологических неродственных примесей в фармацевтических субстанциях антибиотиков.
Задачи исследования:
- Сравнительный анализ требований ГФ РФ и ведущих зарубежных фармакопей к контролю технологических неродственных примесей в фармацевтических субстанциях антибиотиков.
- Оценка необходимости контроля технологических неродственных примесей в фармацевтических субстанциях антибиотиков российских и зарубежных производителей.
МАТЕРИАЛЫ И МЕТОДЫ
Проведен сравнительный анализ фармакопейных статей и монографий Государственной фармакопеи Российской Федерации XIV и XV изд., зарубежных фармакопей (Европейской фармакопеи 11 изд., Фармакопеи США 44 изд., Международной фармакопеи 11 изд. (Ph. Int.)), а также материалов регистрационных досье на фармацевтические субстанции антибиотиков российского и зарубежного производств, включенные в Государственный реестр лекарственных средств7. В работе использовали методы сравнительного информационно-аналитического исследования и контент-анализа.
К технологическим неродственным примесям антибиотиков относятся следующие соединения: N,N-диметиланилин, 2-этилгексановая кислота и ее производные, используемые в процессе производства фармацевтических субстанций в качестве реагентов. С целью обоснования подходов к контролю указанных примесей были выбраны фармацевтические субстанции антибиотиков трех групп (полученные ферментативным способом, полусинтетические, пептидные антибиотики).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Контроль содержания 2-этилгексановой кислоты. Спектр применения 2-этилгексановой кислоты в фармацевтическом производстве достаточно широк: используется для образования амидных связей, снятия аллильной защитной группы, для стереоселективного восстановительного аминирования и т.д. [1][2]. Важным свойством данного реагента является растворимость в неполярных органических растворителях, что позволяет использовать его для получения солей органических соединений, в том числе антибиотиков. Как правило, 2-этилгексановая кислота, применяется в процессе производства антибиотиков в виде 2-этилгексаноатов натрия или калия в качестве донора ионов натрия или калия соответственно [3].
Ниже приведена схема получения цефотаксима натрия (I). При обработке цефотаксимовой кислоты (1) в метилизобутилкетоне (MIBK) в присутствии этилацетата (EtOAc) раствором 2-этилгексаноата натрия (Na-2-EH) образуется цефотаксим натрия (2). 2-этилгексановая кислота является в данном случае побочным продуктом синтеза (производственной примесью), что обуславливает необходимость контроля ее остаточного содержания в фармацевтических субстанциях [4].
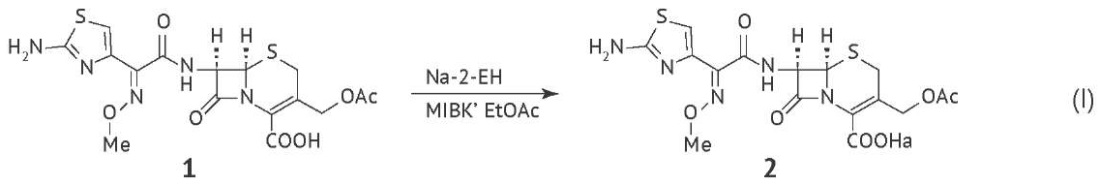
В соответствии с критериями классификации по TRGS 905 (Technische Regeln für Gefahrstoffe, технические правила использования опасных веществ)8 2-этилгексановая кислота отнесена к категории RD3 веществ, токсичных для репродуктивной функции. Контроль содержания 2-этилгексановой кислоты в фармацевтических субстанциях пептидных антибиотиков, а именно блеомицина сульфата, капреомицина сульфата, грамицидина, полимиксина В сульфата, бацитрацина, не предусмотрен ГФ РФ и зарубежными фармакопеями (USP, Ph. Eur., Ph. Int.). Требования к контролю 2-этилгексановой кислоты в частных фармакопейных статьях и монографиях на фармацевтические субстанции антибиотиков, полученные ферментативным способом и полусинтетические, приведены в таблице 1.
Таблица 1. Контроль содержания примеси 2-этилгексановой кислоты в фармацевтических субстанциях антибиотиков (%)
Table 1. Control of the 2-ethylhexanoic acid impurity in antibiotic active substances (%)
Наименование монографии Monograph | Наименование фармакопеи Pharmacopoeia | |||
ГФ РФ | Ph. Eur. | USP | Ph. Int. | |
Антибиотики, полученные методом ферментации Antibiotics produced by fermentation | ||||
Бензилпенициллин калия Benzylpenicillin potassium | ≤0,5 | – | Не описан Not described | – |
Бензилпенициллин натрия Benzylpenicillin sodium | ≤0,5 | ≤0,5 | Не описан Not described | – |
Полусинтетические антибиотики Semisynthetic antibiotics | ||||
Пенициллины Penicillins | ||||
Амоксициллин натрия Amoxicillin sodium | ≤0,8 | ≤0,8 | Не описан Not described | Не описан Not described |
Амоксициллин тригидрат Amoxicillin trihydrate | – | – | – | – |
Ампициллин Ampicillin | – | – | – | – |
Ампициллин натрия Ampicillin sodium | ≤0,8 | ≤0,8 | – | – |
Бакампициллин гидрохлорид Bacampicillin hydrochloride | Не описан Not described | – | Не описан Not described | Не описан Not described |
Диклоксациллин натрия Dicloxacillin sodium | Не описан Not described | ≤0,8 | – | Не описан Not described |
Клоксациллин натрия Cloxacillin sodium | Не описан Not described | ≤0,8 | – | – |
Оксациллин натрия моногидрат Oxacillin sodium monohydrate | ≤0,8 | ≤0,8 | – | Не описан Not described |
Пиперациллин натрия Piperacillin sodium | Не описан Not described | – | – | Не описан Not described |
Пиперациллин моногидрат Piperacillin monohydrate | Не описан Not described | – | – | Не описан Not described |
Тикарциллин натрия Ticarcillin sodium | Не описан Not described | ≤0,5 | – | Не описан Not described |
Флуклоксациллин натрия моногидрат Flucloxacillin sodium monohydrate | Не описан Not described | ≤0,8 | Не описан Not described | Не описан Not described |
Флуклоксациллин магния октагидрат Flucloxacillin magnesium octahydrate | Не описан Not described | ≤0,8 | Не описан Not described | Не описан Not described |
Цефалоспорины Cephalosporins | ||||
Цефазолин натрия Cefazolin sodium | – | – | – | Не описан Not described |
Цефалексин моногидрат Cefalexin monohydrate | Не описан Not described | – | – | Не описан Not described |
Цефалотин натрия Cefalothin sodium | Не описан Not described | ≤0,5 | – | Не описан Not described |
Цефамандола нафат Cefamandole nafate | Не описан Not described | ≤0,3 | Не описан Not described | Не описан Not described |
Цефапирин натрия Cefapirin sodium | Не описан Not described | ≤0,5 | – | Не описан Not described |
Цефотаксим натрия Cefotaxime sodium | ≤0,5 | ≤0,5 | – | Не описан Not described |
Цефтриаксон натрия Ceftriaxone sodium | ≤0,8 | ≤0,8 | – | ≤0,8 |
Цефуроксим натрия Cefuroxime sodium | ≤0,5 | ≤0,5 | – | Не описан Not described |
Таблица составлена авторами / The table is prepared by the authors
Примечание. «Не описан» — фармацевтическая субстанция не включена в фармакопею; «–» — контроль не предусмотрен.
ГФ РФ — Государственная фармакопея Российской Федерации, Ph. Eur. — Европейская фармакопея, USP — Фармакопея США, Ph. Int. — Международная фармакопея.
Note. ‘Not described’ stands for the active substances not included in the pharmacopoeia, and ‘–’ specifies the compounds not required to be controlled.
ГФ РФ, State Pharmacopoeia of the Russian Federation; Ph. Eur., European Pharmacopoeia; USP, United States Pharmacopeia; Ph. Int., The International Pharmacopoeia.
Нормы по допустимому остаточному количеству варьируют от 0,3 до 0,8%. Требования к контролю 2-этилгексановой кислоты в субстанциях антибиотиков ГФ РФ гармонизированы с требованиями Ph. Eur., тем не менее, в отличие от Ph. Eur., которая приводит требование только к натриевой соли бензилпенициллина9, ГФ РФ предусматривает контроль 2-этилгексановой кислоты и в субстанции бензилпенициллина калия10.
USP не включает контроль остаточного содержания 2-этилгексановой кислоты в субстанциях антибиотиков. Однако следует отметить, что в монографиях USP и Ph. InT. на субстанцию калия клавуланат11, структурно родственный пенициллинам, но относящийся к группе ингибиторов бета-лактамаз, введен этот показатель с описанием методики определения.
Для цефтриаксона натрия12, полусинтетического антибиотика, в Ph. InT. приведено указание, что процесс производства субстанции должен быть валидирован и содержание 2-этилгексановой кислоты не должно превышать 0,8% (в ГФ РФ и Ph. Eur. предусмотрен обязательный контроль ее остаточного содержания).
Контроль содержания N,N-диметиланилина. N,N-диметиланилин является одним из основных соединений, используемых в качестве агента, поглощающего хлороводородную кислоту при производстве ряда антибиотиков [5]. Так, например, N,N-диметиланилин используется при производстве цефтазидима на стадии обработки цефалоридина триметилхлорсиланом, а затем пентахлоридом фосфора и 1,3-бутандиолом (получение промежуточного продукта) (II) [6]. В качестве другого примера можно привести использование N,N-диметиланилина при производстве полусинтетического пенициллина — ампициллина. Ампициллин получают из 6-аминопенициллановой кислоты, при этом в качестве органического основания, поглощающего образующуюся хлороводородную кислоту, может использоваться N,N-диметиланилин. Выделяющаяся хлороводородная кислота замедляет процесс синтеза, поэтому необходимо выведение ее из зоны реакции [7].
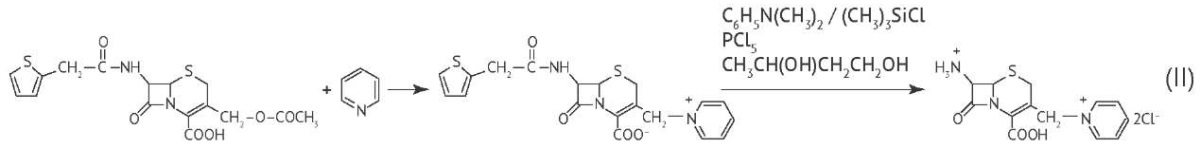
N,N-диметиланилин имеет высокую температуру кипения, вследствие чего его сложно удалить из субстанции [8]. N,N-диметиланилин является токсичным веществом (второй класс опасности), вызывает метгемоглобинобразование, обладает репротоксическим и мутагенным действием, оказывает воздействие на центральную нервную систему, дыхательную и сердечно-сосудистую систему, надпочечники, селезенку, печень и морфологический состав периферической крови13. Высокая токсичность N,N-диметиланилина обуславливает необходимость контроля его остаточного содержания в фармацевтических субстанциях.
Контроль содержания N,N-диметиланилина не предусмотрен ГФ РФ, Ph. Eur., USP, Ph. InT. в фармацевтических субстанциях пептидных антибиотиков (блеомицина сульфат, капреомицина сульфат, грамицидин, полимиксина В сульфат, бацитрацин), и антибиотиков, полученных ферментативным способом (бензилпенициллин калия и бензилпенициллин натрия). Требования к контролю N,N-диметиланилина в монографиях и фармакопейных статьях на фармацевтические субстанции полусинтетических антибиотиков приведены в таблице 2.
Таблица 2. Контроль примеси N,N-диметиланилина в фармацевтических субстанциях антибиотиков
Table 2. Control of the N,N-dimethylaniline impurity in antibiotic active substances
Наименование монографии Monograph | Наименование фармакопеи Pharmacopoeia | |||
ГФ РФ | Ph. Eur. | USP | Ph. Int. | |
Пенициллины Penicillins | ||||
Амоксициллин натрия Amoxicillin sodium | + | + | Не описан Not described | Не описан Not described |
Амоксициллин тригидрат Amoxicillin trihydrate | + | + | + | + |
Ампициллин Ampicillin | + | + | + | – |
Ампициллин натрия Ampicillin sodium | + | + | + | – |
Бакампициллин гидрохлорид Bacampicillin hydrochloride | Не описан Not described | + | Не описан Not described | Не описан Not described |
Диклоксациллин натрия Dicloxacillin sodium | Не описан Not described | + | + | Не описан Not described |
Клоксациллин натрия Cloxacillin sodium | Не описан Not described | + | + | – |
Оксациллин натрия моногидрат Oxacillin sodium monohydrate | + | + | – | Не описан Not described |
Пиперациллин натрия Piperacillin sodium | Не описан Not described | + | – | Не описан Not described |
Пиперациллин моногидрат Pipperacillin monohydrate | Не описан Not described | + | - | Не описан Not described |
Тикарциллин натрия Ticarcillin sodium | Не описан Not described | + | + | Не описан Not described |
Флуклоксациллин натрия моногидрат Flucloxacillin sodium monohydrate | Не описан Not described | + | Не описан Not described | Не описан Not described |
Флуклоксациллин магния октагидрат Flucloxacillin magnesium octahydrate | Не описан Not described | – | Не описан Not described | Не описан Not described |
Цефалоспорины Cephalosporins | ||||
Цефазолин натрия Cefazolin sodium | + | + | – | Не описан Not described |
Цефалексин моногидрат Cefalexin monohydrate | Не описан Not described | + | + | Не описан Not described |
Цефалотин натрия Cefalothin sodium | Не описан Not described | + | – | Не описан Not described |
Цефамандола нафат Cefamandole nafate | Не описан Not described | – | Не описан Not described | Не описан Not described |
Цефапирин натрия Cefapirin sodium | Не описан Not described | + | – | Не описан Not described |
Цефотаксим натрия Cefotaxime sodium | + | + | – | Не описан Not described |
Цефтриаксон натрия Ceftriaxone sodium | + | + | – | + |
Цефуроксим натрия Cefuroxime sodium | + | + | – | Не описан Not described |
Таблица составлена авторами / The table is prepared by the authors
Примечание. «Не описан» — фармацевтическая субстанция не включена в фармакопею;
«–» — контроль N,N-диметиланилина не предусмотрен;
«+» — контроль N,N-диметиланилина предусмотрен на уровне ≤ 0,002%.
ГФ РФ — Государственная фармакопея Российской Федерации, Ph. Eur. — Европейская фармакопея, USP — Фармакопея США, Ph. Int. — Международная фармакопея.
Note. ‘Not described’ stands for the active substances not included in the pharmacopoeia, ‘–’ marks the cases when the control of N,N-dimethylaniline is not required, ‘+’ shows the cases when N,N-dimethylaniline is required to be controlled at ≤ 0,002%.
ГФ РФ, State Pharmacopoeia of the Russian Federation; Ph. Eur., European Pharmacopoeia; USP, United States Pharmacopeia; Ph. Int., The International Pharmacopoeia.
В частных и общей фармакопейных статьях ГФ РФ и монографиях ведущих зарубежных фармакопей на фармацевтические субстанции антибиотиков N,N-диметиланилин нормируется на уровне ≤0,002%.
В ГФ РФ и USP для фармацевтической субстанции ампициллина14 (монография 2021 г.) указано, что определение N,N-диметиланилина необходимо только если его наличие обусловлено технологическим процессом, тогда как для ампициллина натрия15 (монография пересмотрена в 2020 г.) и других фармацевтических субстанций антибиотиков данное примечание отсутствует. Ph. Eur. подходит к этому вопросу иначе: для ампициллина натрия16 (монография 2024 г.) приводит рекомендацию проведения производителем оценки риска загрязнения N,N-диметиланилином в ходе производственного процесса (в монографии на ампициллин17 (пересмотрена в 2017 г.) такое указание отсутствует). Таким образом, Ph. Eur. также переходит от обязательного контроля показателя к гарантиям его минимального содержания или отсутствия при валидации процесса производства.
Такие же тенденции отмечаются в отношении субстанций пиперациллина натрия18 (монография 2022 г.), пиперациллина моногидрата19 (монография 2021 г.), флуклоксациллина натрия моногидрата20 (монография 2022 г.).
В Ph. InT. для фармацевтических субстанций амоксициллина тригидрата21 и цефтриаксона натрия22 указано, что процесс производства субстанции должен быть валидирован и содержание N,N-диметиланилина не должно превышать 0,002%.
Анализ материалов регистрационных досье. Наряду с проведенным сравнительным анализом требований фармакопей был осуществлен анализ материалов регистрационных досье фармацевтических субстанций амоксициллина натрия, амоксициллина тригидрата, цефтриаксона натрия (полусинтетические антибиотики) и бензилпенициллина натрия (получен ферментативным способом), включенных в Государственный реестр лекарственных средств, производства Китая, Индии, Испании, России.
Из представленных данных (табл. 3) следует, что применение 2-этилгексановой кислоты в производстве анализируемых фармацевтических субстанций не является обязательным, так как она используется в производстве лишь одной из десяти указанных субстанций. Для ионного обмена в качестве альтернативных субстратов-доноров натрия применяются натрия изооктоат, натрия гидроксид, натрия хлорид, натрия ацетат. В связи с этим большинство производителей не включают данный показатель в спецификацию либо включают только для формального соблюдения требований, указанных в частной фармакопейной статье.
Таблица 3. Данные по контролю технологических неродственных примесей в субстанциях некоторых антибиотиков
Table 3. Data on the control of process-related impurities in some antibiotic active substances
Производитель Manufacturer | Используется в производстве Used in manufacturing | Включено в спецификацию (предельное содержание) Specification limit | |
2-этилгексановая кислота 2-ethylhexanoic acid | N,N-диметиланилин N,N-dimethylaniline | ||
Амоксициллин натрия Amoxicillin sodium | |||
Производитель 1 Manufacturer 1 | Не используется Not used | Не используется (замена на триэтиламин, N,N-диметилацетамид) Not used (replaced with triethylamine, N,N-dimethylacetamide) | 2-этилгексановая кислота (≤0,8%) 2-ethylhexanoic acid (≤0.8%) |
Амоксициллина тригидрат Amoxicillin trihydrate | |||
Производитель 2 Manufacturer 2 | Не используется Not used | Не используется (замена на триэтиламин) Not used (replaced with triethylamine) | N,N-диметиланилин (≤0,002%) N,N-dimethylaniline (≤0.002%) |
Производитель 3 Manufacturer 3 | Не используется Not used | Не используется (замена на триэтиламин, N,N-диметилацетамид) Not used (replaced with triethylamine, N,N-dimethylacetamide) | – |
Производитель 4 Manufacturer 4 | Не используется Not used | Не используется (замена на триэтиламин, N,N-диметилацетамид) Not used (replaced with triethylamine, N,N-dimethylacetamide) | – |
Бензилпенициллин натрия Benzylpenicillin sodium | |||
Производитель 5 Manufacturer 5 | Не используется Not used | Не используется Not used | 2-этилгексановая кислота (≤0,5%) 2-ethylhexanoic acid (≤0.5%) |
Производитель 6 Manufacturer 6 | Не используется Not used | Не используется Not used | 2-этилгексановая кислота (≤0,5%) 2-ethylhexanoic acid (≤0.5%) |
Производитель 7 Manufacturer 7 | Не используется Not used | Не используется Not used | – |
Цефтриаксон натрия Ceftriaxone sodium | |||
Производитель 8 Manufacturer 8 | Не используется Not used | Не используется (замена на триэтиламин) Not used (replaced with triethylamine) | – |
Производитель 9 Manufacturer 9 | Используется Used | Не используется (замена на триэтиламин) Not used (replaced with triethylamine) | 2-этилгексановая кислота (≤0,8%) 2-ethylhexanoic acid (≤0.8%) |
Производитель 10 Manufacturer 10 | Не используется Not used | Не используется Not used | – |
Таблица составлена авторами / The table is prepared by the authors
Примечание. «–» — не нормируется.
Note. –, not standardised.
В настоящее время N,N-диметиланилин также не используется для производства проанализированных фармацевтических субстанций, а заменяется менее токсичными реагентами — триэтиламином (в 6 из 10 указанных субстанций), N,N-диметилацетамидом (в 3 из 10 указанных субстанций).
Необходимость определения остаточного содержания триэтиламина и N,N-диметилацетамида регламентируется ГФ РФ23, ФЕАЭС24, Решением Коллегии Евразийской экономической комиссии от 04.10.2022 № 138 «Об утверждении Требований к проведению исследований (испытаний) лекарственных средств в части оценки и контроля содержания примесей». Учитывая, что триэтиламин, согласно данным регистрационных досье анализируемых субстанций, используется на начальных стадиях производства, его контроль как органического растворителя 3 класса токсичности может отсутствовать. Однако триэтиламин является третичным амином, что увеличивает риск образования в субстанциях нитрозопримесей, и в качестве мер, направленных на обеспечение безопасности лекарственных препаратов, производители должны проводить оценку рисков25 образования примесей нитрозаминов в фармацевтических субстанциях.
Остаточное содержание N,N-диметилацетамида (2 класс токсичности), который также используется на начальных стадиях производства, может не контролироваться, если представлены результаты, полученные на 6 опытно-промышленных или 3 промышленных сериях фармацевтической субстанций или промежуточного продукта, показывающие, что его остаточное количество не превышает 10% от предельно допустимого содержания.
ЗАКЛЮЧЕНИЕ
В настоящее время сложилась противоречивая ситуация — с одной стороны, современные технологические процессы позволяют производить фармацевтические субстанции без использования токсичных реагентов, таких как 2-этилгексановая кислота и N,N-диметиланилин, с другой стороны, производители вынуждены следовать фармакопейным требованиям, в частности вводить заведомо избыточные показатели качества в спецификацию, создавая балластную лабораторную нагрузку и снижая экономическую эффективность деятельности предприятия. Необходимо при пересмотре фармакопейных стандартов критически оценить перечень нормируемых показателей и в тех случаях, когда использование того или иного реагента опционально, включать оговорку «если использование предусмотрено процессом производства».
В случае если N,N-диметиланилин, 2-этилгексановая кислота используются на каком-либо из этапов производственного процесса, включая промежуточные продукты, то спецификацией качества на фармацевтическую субстанцию должен быть предусмотрен контроль их остаточного содержания, например методом газовой хроматографии, в связи с их высокой токсичностью. Для установления соответствующих пороговых значений необходимо руководствоваться действующими фармакопейными стандартами.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Е.Л. Ковалева — идея исследования, ответственность за все аспекты работы и целостность всех частей рукописи, утверждение окончательного варианта рукописи для публикации; К.С. Архипова — систематизация и анализ нормативной документации, написание текста рукописи; И.М. Алдамова — сбор данных и участие в обсуждении материалов, материалов регистрационного досье, редактирование и переработка текста рукописи.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Elena L. Kovaleva conceived the study idea, agreed to be accountable for all aspects of the work and the academic integrity of the article, and approved the final version of the manuscript for publication. Ksenia S. Arhipova systematised and analysed regulatory standards and drafted the manuscripT. Irina M. Aldamova collected data, participated in the discussion of the study materials and registration dossiers, and revised the manuscript.
1. ОФС.1.1.0006 Фармацевтические субстанции. ОФС.1.1.0023 Родственные примеси в фармацевтических субстанциях и лекарственных препаратах. Государственная фармакопея Российской Федерации. XV изд. Т. 1. М.; 2023.
2. 2.3.18.0. Субстанции для фармацевтического применения. Фармакопея Евразийского экономического союза. Т. 1, ч. 2. М.; 2023.
3. General monograph 01/2021:2034 Substances for pharmaceutical use. European Pharmacopoeia. 10th ed. Strasburg: EDQM; 2021.
<476> Control of organic impurities in drug substances and drug products. United States Pharmacopeia. 44th ed.
4. CPMP/ICH/2737/99. ICH Topic ОЗА (R2) Note for guidance on impurities testing: impurities in new drug substances. EMA; 2006.
CPMP/ICH/2738/99. ICH Topic 03B (R2) Note for guidance on impurities in new drug products. EMA; 2006.
5. <223> N,N-Dimethylaniline. United States Pharmacopeia. 44th ed.
6. ОФС.1.2.2.2.0033 2-Этилгексановая кислота. Государственная фармакопея Российской Федерации. XV изд. Т. 1. М.; 2023.
General monograph 2.4.28 2-Ethylgexanoic acid. European Pharmacopeia. 11th ed. Strasburg: EDQM; 2022.
N,N-диметиланилин. Государственная фармакопея Российской Федерации. XV изд. Т. 1. М.; 2023.
General monograph 2.4.26 N,N-Dimethylaniline. European Pharmacopeia. 11th ed. Strasburg: EDQM; 2022.
<223> N,N-Dimethylaniline. United States Pharmacopeia. 44th ed.
7. https://grls.minzdrav.gov.ru/
8. Toxical evaluation No. 275, 2-Ethylhexanoic acid 06/00, BG Chemie. https://www.bgrci.de/fileadmin/BGRCI/Downloads/DL_Praevention/Fachwissen/Gefahrstoffe/TOXIKOLOGISCHE_BEWERTUNGEN/Bewertungen/ToxBew275-E.pdf
9. Monograph Benxylpenicillin sodium. European Pharmacopeia. 11th ed. Strasburg: EDQM; 2022.
10. ФС.2.1.0064.18 Бензилпенициллин калия. Государственная фармакопея Российской Федерации. XIV изд. Т. 3. М.; 2018.
11. Monograph Clavulanate Potassium. United States Pharmacopeia. 44th ed.
Monograph Clavulanate Potassium. International Pharmacopeia. 11th ed.
12. Monograph Ceftriaxone Sodium. International Pharmacopeia. 11th ed.
13. Федеральный регистр потенциально опасных химических и биологических веществ. Филиал РПОХБВ ФБУН «ФНЦГ им. Ф.Ф. Эрисмана» Роспотребнадзора. https://rpohv.ru/online/detail.html?id=44&ysclid=m0lg7g4wib351901776
14. ФС.2.1.0372 Ампициллин. Государственная фармакопея Российской Федерации. XV изд. Т. 1. М.; 2023.
Monograph Ampicillin. United States Pharmacopeia. 44th ed.
15. ФС.2.1.0056 Ампициллин натрия. Государственная фармакопея Российской Федерации. XV изд. Т. 1. М.; 2023.
Monograph Ampicillin sodium. United States Pharmacopeia. 44th ed.
16. Monograph Ampicillin sodium. European Pharmacopeia. 11th ed. Strasburg: EDQM; 2022.
17. Monograph Ampicillin. European Pharmacopeia. 11th ed. Strasburg: EDQM; 2022.
18. Monograph Piperacillin sodium. European Pharmacopeia. 11th ed. Strasburg: EDQM; 2022.
19. Monograph Piperacillin monohydrate. European Pharmacopeia. 11th ed. Strasburg: EDQM; 2022.
20. Monograph Fluoxacillin sodium monohydrate. European Pharmacopeia. 11th ed. Strasburg: EDQM; 2022.
21. Monograph Amoxycillin trihydrate. International Pharmacopeia. 11th ed.
22. Monograph Ceftriaxone sodium. International Pharmacopeia. 11th ed.
23. ОФС.1.1.0008 Остаточные органические растворители. Государственная фармакопея Российской Федерации. XV изд. Т. 1. М.; 2023.
24. 2.3.2.0. Остаточные органические растворители. Фармакопея Евразийского Экономического Союза. Т. 1, ч. 1. М.; 2023.
25. Рекомендация Коллегии Евразийской экономической комиссии от 06.08.2019 № 23 «О Руководстве по оценке и контролю ДНК-реактивных (мутагенных) примесей в лекарственных средствах и установлению границ потенциального канцерогенного риска».
Список литературы
1. Monguzzi R, Menaspace S, Anzaghi P. Process for the preparation of ceftriaxone. Patent of the United States of America No. US5026843A; 1991. https://patents.google.com/patent/US5026843A/en
2. Iqbal MS, Akmal MA. A simple method for simultaneous determination of some organic liquids in in-process materials and effluents produced in the manufacture of amoxicillin and ampicillin. Environ Monit Assess. 2009;151(1–4):397–400. https://doi.org/10.1007/s10661-008-0281-y
3. Кук МА, Уилкинс РБ. Способ получения и/или очистки клавулановой кислоты или ее фармацевтически приемлемых солей или эфиров, соль клавулановой кислоты с аминокислотой. Патент Российской Федерации № RU2105768; 1998.
4. Raju R, Prasad K. Synthetic applications of 2-ethylhexanoic acid derived reagents. Tetrahedron. 2012;68(5):1341–9. https://doi.org/10.1016/j.tet.2011.10.078
5. Debashish D, Vinod G, Bishwa PR. Method for manufacture of cephalosporin and intermediates thereof. Patent of the United States of America No. US5856502A; 1999. https://patents.google.com/patent/US5856502A/en
6. Vardanyan RS, Hruby VJ. Synthesis of essential drugs. Amsterdam: Elsevier; 2006. https://doi.org/10.1016/B978-0-444-52166-8.X5000-6
7. Choi JK, Park MK. Determination of N,N-dimethylaniline in penicillins by GC-MS. Arch Pharm Res. 1981;(4):85–90. https://doi.org/10.1007/BF02855750
8. Abdo KM, Jokinen MP, Hiles R. Subchronic (13-week) toxicity studies of N,N-dimethylaniline administered to Fischer 344 rats and B6C3F1 mice. J Toxicol Environ Health. 1990;29(1):77–88. https://doi.org/10.1080/15287399009531373
Об авторах
Е. Л. КовалеваРоссия
Ковалева Елена Леонардовна, д-р фарм. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051, Российская Федерация
К. С. Архипова
Россия
Архипова Ксения Сергеевна
Петровский б-р, д. 8, стр. 2, Москва, 127051, Российская Федерация
И. М. Алдамова
Россия
Алдамова Ирина Малхазовна
Петровский б-р, д. 8, стр. 2, Москва, 127051, Российская Федерация
Дополнительные файлы
Рецензия
Для цитирования:
Ковалева Е.Л., Архипова К.С., Алдамова И.М. Современные подходы к контролю неродственных технологических примесей в антибиотиках. Регуляторные исследования и экспертиза лекарственных средств. 2024;14(6):645-654. https://doi.org/10.30895/1991-2919-2024-14-6-645-654
For citation:
Kovaleva E.L., Arhipova K.S., Aldamova I.M. Current approaches to the control of process-related impurities in antibiotics. Regulatory Research and Medicine Evaluation. 2024;14(6):645-654. (In Russ.) https://doi.org/10.30895/1991-2919-2024-14-6-645-654



































