Перейти к:
Определение содержания нафтифина и продуктов его деструкции в лекарственных препаратах методом ВЭЖХ с использованием хроматографических колонок малого объема
https://doi.org/10.30895/1991-2919-2024-14-6-673-685
Резюме
ВВЕДЕНИЕ. Лекарственные препараты на основе нафтифина широко используются в медицинской практике для лечения грибковых инфекций. Одним из основных показателей качества лекарственного препарата является содержание действующего вещества. При разработке методик количественного определения для рутинного анализа лекарственных средств особое внимание уделяется сокращению временных и материальных затрат.
ЦЕЛЬ. Модернизация методики количественного определения нафтифина и его примесей в лекарственных препаратах методом ВЭЖХ с использованием колонок малого объема, позволяющих сократить время анализа и расход реактивов.
МАТЕРИАЛЫ И МЕТОДЫ. Объектами исследования были субстанция и препараты нафтифина в форме 1% спиртового раствора и крема для наружного применения. Хроматографирование растворов проводили на жидкостных хроматографах Agilent 1200 Infinity и Agilent Infinity II 1290, оснащенных диодно-матричными детекторами с использованием нескольких хроматографических колонок: XBridge Phenyl 20×4,6 мм с размерами частиц 2,5 и 3,5 мкм и Acquity BEH Phenyl 75×2,1 мм, 1,7 мкм. Для оценки специфичности методики использовали образцы N-метил-1-нафталинметиламина, коричного альдегида и растворы нафтифина после химической, термической и фотолитической деструкции.
РЕЗУЛЬТАТЫ. Подобран оптимальный нетоксичный растворитель проб — 0,1% раствор ортофосфорной кислоты и доказано, что для разных лекарственных форм могут быть применены разные растворители. Выбраны условия анализа: концентрация испытуемых растворов нафтифина — 10 мкг/мл, колонка XBridge Phenyl (20×4,6 мм; 2,5 мкм), градиентный режим элюирования смесью 0,1% раствора хлорной кислоты и ацетонитрила со скоростью 1 мл/мин. Показано, что детектирование при длине волны 254 нм обеспечивает наилучшее соотношение сигнала и шума для пика нафтифина. Воспроизводимость разработанной методики количественного определения нафтифина была подтверждена валидацией согласно требованиям Государственной фармакопеи Российской Федерации. Специфичность методики подтверждена хроматографированием растворителя, подвижной фазы и модельных растворов, содержащих основные примеси нафтифина. Линейность методики подтверждена в диапазоне 80–120% нафтифина (коэффициент корреляции составил 0,995). При проверке правильности методики открываемость составила 100,2%. Доказана устойчивость методики при незначительных изменениях хроматографических параметров. Время удерживания пика нафтифина — около 2 мин.
ВЫВОДЫ. Разработана селективная и чувствительная ВЭЖХ-методика количественного определения нафтифина в лекарственных средствах, позволяющая сократить время анализа и свести к минимуму расход используемых реагентов. Результаты валидации методики удовлетворяют критериям приемлемости, подтверждают ее пригодность и воспроизводимость.
Ключевые слова
Для цитирования:
Якупов И.Ю., Кулешова С.И., Высочанская О.Н., Симонова Е.П. Определение содержания нафтифина и продуктов его деструкции в лекарственных препаратах методом ВЭЖХ с использованием хроматографических колонок малого объема. Регуляторные исследования и экспертиза лекарственных средств. 2024;14(6):673-685. https://doi.org/10.30895/1991-2919-2024-14-6-673-685
For citation:
Yakupov I.Yu., Kuleshova S.I., Vysochanskaya O.N., Simonova E.P. Quantitative determination of naftifine and its degradation products in medicines by HPLC with small-volume columns. Regulatory Research and Medicine Evaluation. 2024;14(6):673-685. (In Russ.) https://doi.org/10.30895/1991-2919-2024-14-6-673-685
ВВЕДЕНИЕ
Нафтифин в лекарственной форме для наружного применения используется для лечения грибковых инфекций кожи и ногтей [1], относится к классу аллиламинов [2] и обладает фунгицидным и фунгистатическим действием.
Фунгицидное действие in vitro нафтифин оказывает против дерматофитных микроорганизмов Trichophyton spp., Microsporum spp. и Epidermophyton floccosum [2][3]. В исследованиях in vivo было показано, что активность нафтифина против T. rubrum и T. mentagrophytes аналогична клотримазолу [4]. Также нафтифин проявляет антибактериальную и противовоспалительную активность, что важно при лечении поверхностных дерматозов, сопровождающихся бактериальной инфекцией и воспалением.
Для количественного определения нафтифина в лекарственных средствах используют методы спектрофотометрии в ультрафиолетовом (УФ) диапазоне спектра [5] и высокоэффективной жидкостной хроматографии (ВЭЖХ) [6][7]. Однако при наличии вспомогательных веществ в составе препаратов нафтифина могут быть не выполнены требования специфичности для метода УФ-спектрофотометрии, поэтому наиболее востребованным в контроле качества является метод ВЭЖХ.
В Фармакопее США (USP)1 для анализа нафтифина гидрохлорида указана методика нормально-фазовой жидкостной хроматографии с использованием в качестве подвижной фазы смеси н-гексана, этанола, диметилформамида и муравьиной кислоты. Компоненты подвижной фазы обладают высокой токсичностью и легковоспламеняемы, а их летучесть может приводить со временем к изменению состава подвижной фазы. Методика достаточно продолжительная, при этом из-за большой скорости потока элюента (2 мл/мин) расходуется большое количество подвижной фазы. Поэтому актуален выбор условий анализа и совершенствование методики определения нафтифина в лекарственных препаратах.
Цель работы — модернизация методики количественного определения нафтифина и его примесей в лекарственных препаратах методом ВЭЖХ с использованием колонок малого объема, позволяющих сократить время анализа и расход реактивов.
Для достижения поставленной цели было необходимо решить следующие задачи:
- подобрать оптимальные условия хроматографирования нафтифина;
- выбрать условия пробоподготовки для различных лекарственных форм;
- подтвердить пригодность разработанной методики, определив ее валидационные характеристики.
МАТЕРИАЛЫ И МЕТОДЫ
Объекты исследования. Субстанция-порошок нафтифина (Olon S.p.A.), образцы лекарственных препаратов в форме 1% спиртового раствора и 1% крема для наружного применения, зарегистрированные для применения на территории Российской Федерации2, фармакопейный стандартный образец нафтифина гидрохлорида (USP).
Реактивы. Фосфорная кислота (85%, Supelco), метанол (99,9%, J.T. Baker), ацетонитрил (99,9%, CARLO ERBA Reagents), спирт этиловый абсолютизированный (Merck), хлорная кислота (70%, Sigma-Aldrich), хлороводородная кислота (37%, Merck), натрия гидроксид (99,9%, Labochem), водорода пероксид (30%, Merck).
Растворы стандартного образца. Для оценки величины аналитического сигнала, эффективности хроматографической колонки и выбора альтернативного растворителя для анализа различных лекарственных форм готовили по 5 растворов стандартного образца нафтифина (200 мкг/мл) в каждом из следующих растворителей: 0,1% растворе фосфорной кислоты (Р1), метаноле (Р2), смеси воды и этанола (50:50 об./об., Р3), этаноле (Р4), смеси 0,1% хлорной кислоты и ацетонитрила (70:30 об./об., Р5). Затем проводили второе разведение каждого раствора в том же растворителе до концентрации около 10 мкг/мл нафтифина. Все растворы после приготовления отфильтровывали через шприцевые мембранные фильтры из политетрафторэтилена с размером пор не более 0,45 мкм (Agilent Technologies).
Модельные растворы примесей. Для выбора оптимальной длины волны был приготовлен раствор, содержащий 10 мкг/мл нафтифина, 10 мкг/мл коричного альдегида (Sigma-Aldrich) и 10 мкг/мл N-метил-1-нафталинметиламина (Sigma-Aldrich) в 0,1% фосфорной кислоте. Для определения селективности при проведении валидации методики была приготовлена серия модельных растворов. Раствор, содержащий 1000 мкг/мл N-метил-1-нафталинметиламина (Sigma-Aldrich), 1000 мкг/мл коричного альдегида (Sigma-Aldrich) и 10 мкг/мл нафтифина в 0,1% фосфорной кислоте, готовили путем добавления образцов примесей при втором разведении раствора стандартного образца нафтифина. Растворы разложения нафтифина получали при втором разведении раствора стандартного образца путем добавления к нему растворов натрия гидроксида, соляной кислоты (до 0,1 М в конечном растворе) или водорода пероксида (до 10% в конечном растворе). Затем полученные растворы и раствор без добавления разлагающих реагентов термостатировали при 80 ºС в течение 8 ч. Раствор примесей нафтифина, полученных фотолитическим разложением, готовили при облучении УФ-лампой (длина волны 254 нм) раствора, содержащего 10 мкг/мл нафтифина в 0,1% фосфорной кислоте, в течение 8 ч.
Растворы для количественного определения. Для определения содержания нафтифина в лекарственных препаратах нафтифина использовали метод внешнего стандарта. Для этого готовили растворы стандартного образца нафтифина с концентрацией около 10 мкг/мл в 0,1% фосфорной кислоте в двух повторениях (стандартный раствор) и растворы лекарственных препаратов нафтифина с той же теоретической концентрацией, рассчитанной с учетом навесок, плотности и разведения препарата (испытуемый раствор). Все растворы после приготовления отфильтровали через шприцевые мембранные фильтры из политетрафторэтилена с размером пор не более 0,45 мкм (Agilent Technologies).
Оборудование. Хроматографирование приготовленных растворов проводили на жидкостных хроматографах Agilent 1200 Infinity и Agilent Infinity II 1290 (Agilent Technologies), оснащенных диодно-матричными детекторами. Хроматографические колонки, которые были использованы при проведении валидации методики и оценке возможности их замены, указаны в таблице 1.
Таблица 1. Характеристики использованных для анализа нафтифина хроматографических колонок
Table 1. Main characteristics of the columns used for naftifine determination
Колонка Column | Длина, мм Length, mm | Внутренний диаметр, мм Inner diameter, mm | Размер частиц, мкм Particle size, μm | Степень покрытия (доля углерода), % Carbon load, % | Площадь поверхности, м²/г Surface area, m²/g | Свободный объем колонки, мл Empty column volume, mL |
XBridge Phenyl | 20 | 4,6 | 2,5 | 14,5 | 185 | 0,33 |
XBridge Phenyl | 20 | 4,6 | 3,5 | 14,5 | 185 | 0,33 |
Acquity BEH Phenyl | 75 | 2,1 | 1,7 | 15 | 185 | 0,3 |
Таблица составлена авторами по данным производителя колонок (Waters Corp.) / The table is prepared by the authors using data of the column manufacturer (Waters Corp.)
Условия анализа. Объем ввода пробы 5 мкл, скорость потока подвижной фазы 1,0 мл/мин, температура колонки 30 ºС, детектирование при 254 нм, подвижная фаза А — 0,1% раствор хлорной кислоты, подвижная фаза Б — ацетонитрил, элюирование проводили в градиентном режиме (табл. 2).
Таблица 2. Программа градиентного режима элюирования
Table 2. Gradient elution programme
Время, мин Time, min | Подвижная фаза A, % Mobile phase A, % | Подвижная фаза Б, % Mobile phase B, % |
0 | 70 | 30 |
2 | 65 | 35 |
3 | 20 | 80 |
3,5 | 70 | 30 |
5,5 | 70 | 30 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
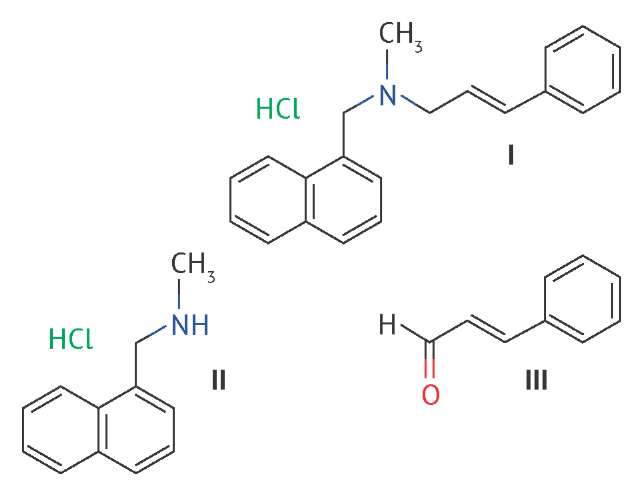
По своей структуре нафтифин (I) представляет собой третичный амин с метильным, (1-нафтил)метильным и циннамильным заместителями на атоме азота. Нафтифин не растворим в воде, растворим в этаноле, метаноле, диметилсульфоксиде и других органических растворителях, а также в водных растворах кислот.
Возможными примесями нафтифина являются N-метил-1-нафталинметиламин (II), являющийся исходным продуктом при производстве субстанции, и коричный альдегид (III), близкий по структуре к циннамилхлориду — второму компоненту синтеза субстанции.
Основными критериями для выбора условий хроматографирования были максимально возможное сокращение времени анализа и снижение расхода подвижной фазы. Это было достигнуто за счет использования колонок малого объема (свободный объем около 0,3 мл) и выбора состава подвижной фазы, не требующего длительного уравновешивания колонки.
Выбор компонентов подвижной фазы был основан на возможной эффективности разделения, сокращении времени уравновешивания колонки и данных о токсичности растворителя. Ацетонитрил выбран как обладающий большей элюирующей силой и при этом менее токсичный компонент по сравнению с метанолом и более удобный в работе, чем обладающий резким запахом тетрагидрофуран. Хлорная кислота в составе подвижной фазы выбрана как компонент, позволяющий обеспечить растворение нафтифина и при этом не требующий длительного уравновешивания колонки в отличие от солей алкилсульфоновых кислот.
Применение колонок малого объема (свободный объем около 0,3 мл) при относительно большой скорости потока подвижной фазы (1 мл/мин) позволяет использовать градиентное элюирование с быстрым изменением состава подвижной фазы и значительно сократить время уравновешивания колонки перед последующим анализом.
В качестве неподвижной фазы при хроматографировании использовали колонки с фенилгексилсилильным сорбентом (L11 по классификации USP), поскольку при применении такого сорбента основные примеси нафтифина имеют значительно отличающуюся хроматографическую подвижность.
Пригодность хроматографической системы оценивали по разделению пиков нафтифина и его примесей. При хроматографировании раствора, содержащего около 10 мкг/мл каждого из определяемых компонентов, для пиков N-метил-1-нафталинметиламина и коричного альдегида разрешение составило 4,9±0,1, а для пиков коричного альдегида и нафтифина 6,9±0,1 (рис. 1).
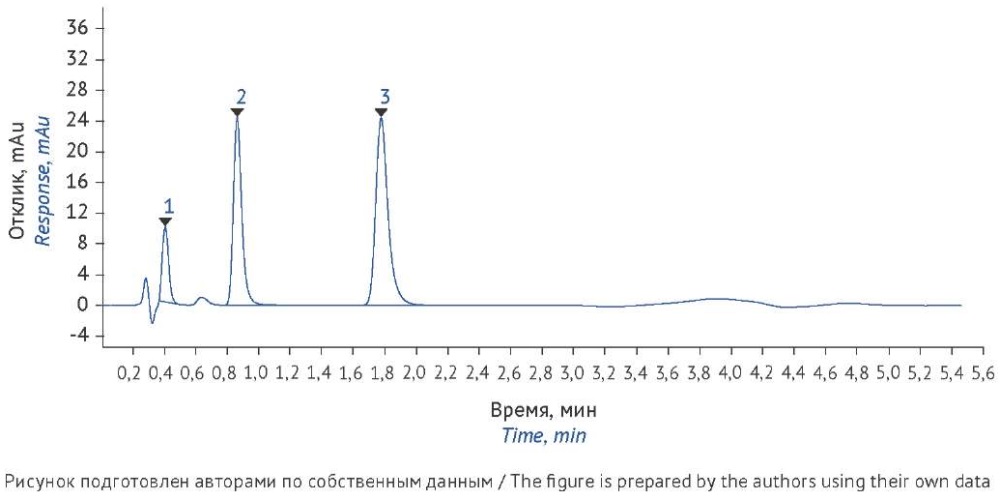
Рис. 1. Хроматограмма модельного раствора, содержащего по 10 мкг/мл нафтифина (3) RT≈1,6 мин, N-метил-1-нафталинметиламина (1) RT≈0,4 мин и коричного альдегида (2) RT≈0,8 мин. Условия анализа: колонка XBridge Phenyl (20×4,6 мм, с размером частиц 2,5 мкм), объем ввода пробы 5 мкл, скорость потока 1,0 мл/мин, температура колонки 30 ºС, детектирование при 254 нм, подвижная фаза А — 0,1% водный раствор хлорной кислоты, подвижная фаза Б — ацетонитрил, элюирование в градиентном режиме
Fig. 1. Chromatogram of a model solution with 10 μg/mL spikes of naftifine (retention time (RT)≈1.6 min) (3), N-methyl-1-naphthalenemethylamine (RT≈0.4 min) (1), and cinnamaldehyde (RT≈0.8 min) (2). Analytical conditions: XBridge Phenyl column (20×4.6 mm, particle size: 2.5 µm), injection volume of 5 µL, flow rate of 1.0 mL/min, column temperature of 30 ºC, detection at 254 nm, gradient elution with 0.1% aqueous perchloric acid (mobile phase A) and acetonitrile (mobile phase B)
Для спектров поглощения нафтифина и его примесей (рис. 2) характерны максимумы 222 и 254 нм (нафтифин), 222 и 282 нм (N-метил-1-нафталинметиламин) и 206, 222, 290 нм (коричный альдегид).
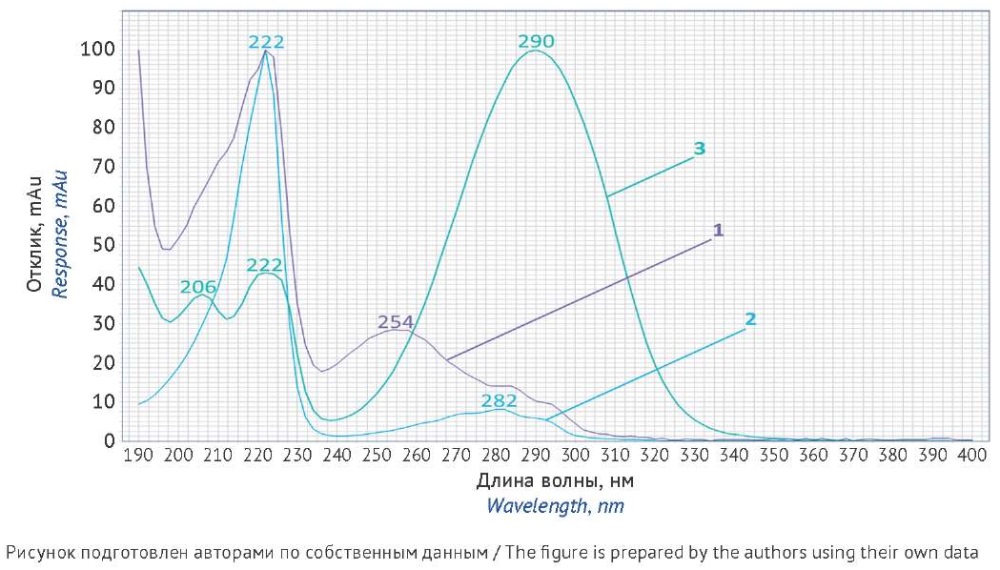
Рис. 2. УФ-спектры поглощения нафтифина (1), N-метил-1-нафталинметиламина (2) и коричного альдегида (3)
Fig. 2. UV absorption spectra of naftifine (1), N-methyl-1-naphthalenemethylamine (2), and cinnamaldehyde (3)
Основанием для выбора длины волны стала наибольшая чувствительность хроматографической системы, характеризующаяся соотношением сигнала и шума для пика определяемого компонента. Для количественного определения нафтифина выбрали длину волны 254 нм, поскольку для этого максимума поглощения нафтифина наблюдали низкий уровень шумов и дрейфа базовой линии. Для определения примесей выбрали длину волны 222 нм, при которой чувствительность хроматографической системы была выше, чем при 254 нм.
В таблице 3 представлены основные характеристики методики в зависимости от используемого растворителя и количественного содержания нафтифина в растворе стандартного образца (С, мкг/мл): средние площади пиков нафтифина (S, mAU×c), средний отклик, выраженный как отношение средней площади пика к концентрации (S/C, mAU×с×мл/мкг), относительное стандартное отклонение (RSD) полученного значения S/C для растворов 10 и 200 мкг/мл нафтифина, а также для всей выборки растворов.
Таблица 3. Изменение характеристик пика нафтифина на хроматограммах в зависимости от используемого растворителя проб
Table 3. Characteristics of the naftifine peak in chromatograms depending on the solvent
Определяемый показатель Measured parameter | Растворитель Solvent | |||||||||
10 мкг/мл нафтифина 10 µg/mL of naftifine | 200 мкг/мл нафтифина 200 µg/mL of naftifine | |||||||||
Р1 | Р2 | Р3 | Р4 | Р5 | Р1 | Р2 | Р3 | Р4 | Р5 | |
S | 177,4 | 207,5 | 197,5 | 191,4 | 180,2 | 3520,5 | 4078,6 | 3914,9 | 3863,4 | 3488,0 |
С | 10,15 | 11,75 | 11,10 | 11,00 | 10,15 | 202,90 | 235,00 | 222,00 | 220,00 | 203,00 |
S/С | 17,49 | 17,57 | 17,64 | 17,44 | 17,62 | 17,42 | 17,42 | 17,56 | 17,52 | 17,33 |
RSD, % | 0,486 | 0,522 | ||||||||
RSD всей выборки, % Total RSD, % | 0,566 | |||||||||
Время удерживания, мин Retention time, min | 2,22 | 2,20 | 2,21 | 2,19 | 2,21 | 2,12 | 2,10 | 2,10 | 2,10 | 2,11 |
Количество ТТ NTP | 2171 | 2179 | 2242 | 1983 | 2182 | 1768 | 1734 | 1722 | 1765 | 1685 |
Фактор симметрии Symmetry factor | 1,15 | 1,14 | 1,16 | 1,12 | 1,14 | 1,34 | 1,38 | 1,39 | 1,37 | 1,37 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. Р1 — 0,1% раствор фосфорной кислоты, Р2 — метанол, Р3 — смесь воды и этанола (50:50 об./об.), Р4 — этанол, Р5 — смесь 0,1% хлорной кислоты и ацетонитрила (70:30 об./об.), S — площадь пика нафтифина, С — концентрация нафтифина в растворе стандартного образца (мкг/мл), S/С — отношение средней площади пика к концентрации нафтифина в растворе, RSD — относительное стандартное отклонение, TT — теоретические тарелки.
Note. Р1, 0.1% phosphoric acid; Р2, methanol; Р3, water–ethanol mixture (50:50 v/v); Р4, ethanol; Р5, 0.1% perchloric acid–acetonitrile mixture (70:30 v/v); S, naftifine peak area; С, naftifine concentration in the reference standard solution (µg/mL); S/С, naftifine peak-to-mean concentration ratio of the corresponding solution; RSD, relative standard deviation; NTP, number of theoretical plates.
Для проверки отсутствия влияния растворителя на форму пика нафтифина, которое могло бы нарушить точность определения площадей пиков, дополнительно определяли средние значения времени удерживания, асимметрии пика и эффективности, выраженной в количестве теоретических тарелок.
RSD отношения S/C для раствора 10 мкг/мл стандартного образца нафтифина в различных растворителях составило 0,486%, что не превышает 2%, требуемых для соблюдения критериев правильности методики. Растворы 200 мкг/мл стандартного образца нафтифина использовали для проверки сходимости результатов. На хроматограммах этих растворов наблюдали увеличение асимметрии пика и уменьшение количества теоретических тарелок, что свидетельствует о слишком большом количестве аналита для данной колонки, однако RSD отношения S/C составило 0,522% (0,566% для всей выборки). На хроматограммах, полученных для растворов нафтифина в этаноле, было отмечено уменьшение числа теоретических тарелок на ≈20% и увеличение ширины пика, при этом другие параметры изменились в допустимых пределах.
В качестве растворителя проб выбрали 0,1% раствор ортофосфорной кислоты как наиболее экономичный и сделали вывод о возможности применения любого из рассмотренных растворителей для приготовления растворов стандартного образца и испытуемых растворов препаратов, для которых может потребоваться альтернативный растворитель. Хроматограммы стандартного и испытуемого растворов представлены на рисунке 3.
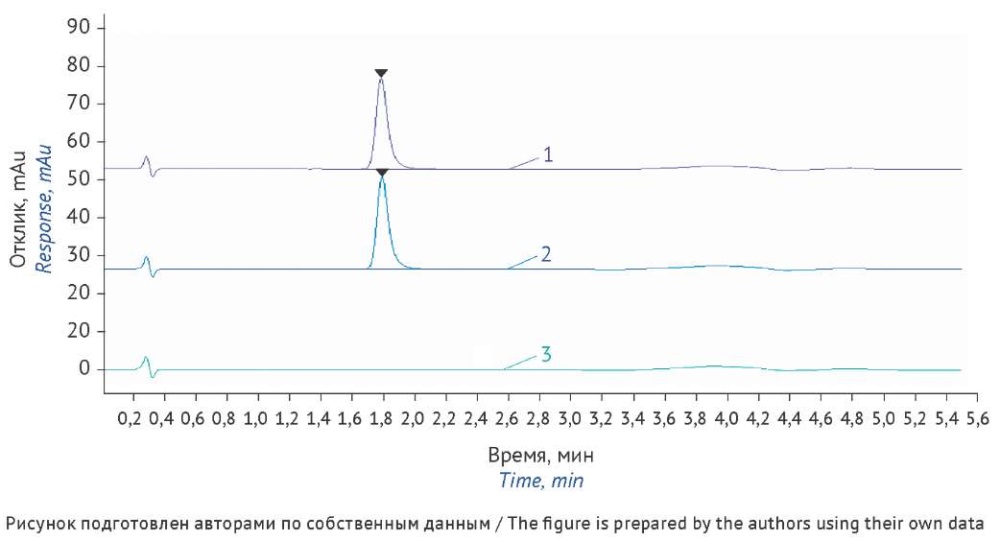
Рис. 3. Хроматограммы стандартного (1) и испытуемого (2) растворов нафтифина. Растворитель проб — 0,1% ортофосфорная кислота (3). Условия анализа: колонка XBridge Phenyl (20×4,6 мм, с размером частиц 2,5 мкм), объем ввода пробы 5 мкл, скорость потока 1,0 мл/мин, температура колонки 30 ºС, детектирование при 254 нм, подвижная фаза А — 0,1% водный раствор хлорной кислоты, подвижная фаза Б — ацетонитрил, элюирование в градиентном режиме
Fig. 3. Chromatograms of standard (1) and test (2) solutions of naftifine. Solvent: 0.1% orthophosphoric acid (3). Analytical conditions: XBridge Phenyl column (20×4.6 mm, particle size: 2.5 µm), injection volume of 5 µL, flow rate of 1.0 mL/min, column temperature of 30 ºC, detection at 254 nm, gradient elution with 0.1% aqueous perchloric acid (mobile phase A) and acetonitrile (mobile phase B)
Валидацию методики проводили согласно фармакопейным требованиям3, оценивали специфичность, аналитическую область, линейность, правильность, внутрилабораторную прецизионность, сходимость и устойчивость (робастность) методики. Для проведения валидации выбрали лекарственный препарат в форме 1% спиртового раствора нафтифина для наружного применения, поскольку входящие в его состав вспомогательные вещества не влияют на хроматографическое поведение нафтифина и растворение препарата не требуется. Для препаратов в форме крема с различным составом вспомогательных веществ могут требоваться значительные корректировки растворителя при пробоподготовке.
Специфичность. Хроматографировали растворитель (0,1% ортофосфорная кислота), подвижную фазу (смесь 0,1% хлорной кислоты и ацетонитрила в соотношении 70:30) и модельные растворы, содержащие родственные примеси нафтифина, получая не менее трех хроматограмм каждого раствора. В качестве модельных растворов использовали растворы, содержащие N-метил-1-нафталинметиламин и коричный альдегид, и растворы, подвергшиеся ускоренному разложению.
На хроматограмме модельного раствора, содержащего по 1000 мкг/мл N-метил-1-нафталинметиламина и коричного альдегида и 10 мкг/мл нафтифина, обнаружили дополнительный пик примеси коричного альдегида, элюирующейся вблизи пика нафтифина (рис. 4). Концентрация примесей в модельном растворе в 100 раз больше концентрации нафтифина, при этом площади пика нафтифина на хроматограммах модельного и стандартного растворов различаются менее чем на 10%. Таким образом, присутствие данных примесей даже в значительных количествах не оказывает существенного влияния на определение содержания нафтифина в препарате.
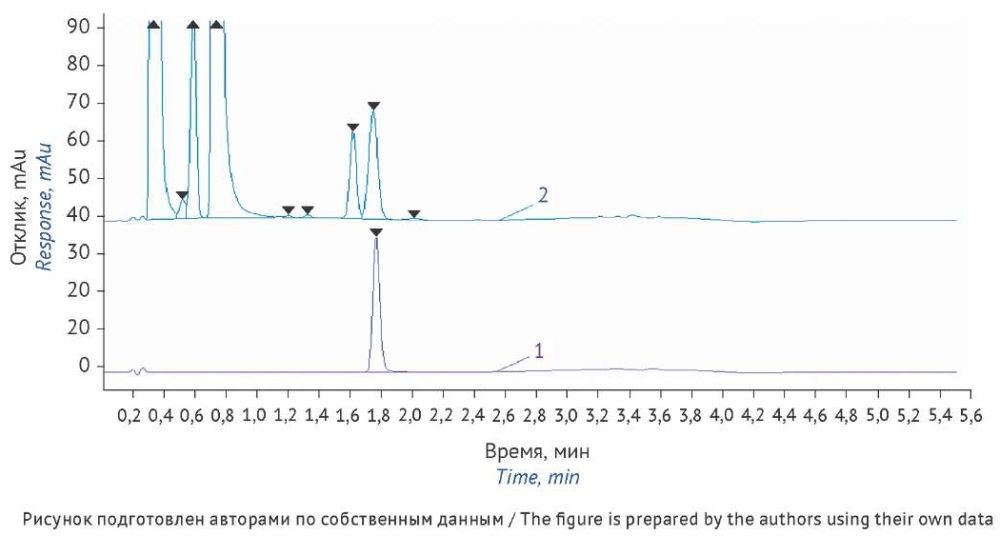
Рис. 4. Хроматограммы стандартного раствора нафтифина 10 мг/мл (1) и модельного раствора (2), содержащего 10 мкг/мл нафтифина, 1000 мкг/мл N-метил-1-нафталинметиламина и 1000 мкг/мл коричного альдегида. Условия анализа: колонка XBridge Phenyl (20×4,6 мм, с размером частиц 2,5 мкм), объем ввода пробы 5 мкл, скорость потока 1,0 мл/мин, температура колонки 30 ºС, детектирование при 254 нм, подвижная фаза А — 0,1% водный раствор хлорной кислоты, подвижная фаза Б — ацетонитрил, элюирование в градиентном режиме
Fig. 4. Chromatograms of the 10 mg/mL naftifine reference standard solution (1) and a model solution spiked with 10 μg/mL of naftifine, 1000 µg/mL of N-methyl-1-naphthalenemethylamine, and 1000 µg/mL of cinnamaldehyde (2). Analytical conditions: XBridge Phenyl column (20×4.6 mm, particle size: 2.5 µm), injection volume of 5 µL, flow rate of 1.0 mL/min, column temperature of 30 ºC, detection at 254 nm, gradient elution with 0.1% aqueous perchloric acid (mobile phase A) and acetonitrile (mobile phase B)
На хроматограммах растворов, полученных после термического, кислотного и щелочного разложения нафтифина, не обнаружили новых пиков примесей по сравнению со стандартным раствором, что свидетельствует об устойчивости нафтифина в данных условиях.
После окислительного и фотолитического разложения нафтифина на хроматограммах соответствующих растворов обнаружили новые пики примесей, а площадь пика нафтифина значительно уменьшилась. Пики примесей имеют разрешение с пиком нафтифина не менее 2,0 и не влияют на количественное определение нафтифина в растворе.
Аналитическая область методики. С учетом лекарственных форм, в которых препараты нафтифина представлены на российском фармацевтическом рынке (растворы для наружного применения и кремы для наружного применения), была определена аналитическая область методики. В диапазоне 80–120% от предлагаемой концентрации нафтифина в испытуемом растворе (10 мкг/мл) проводили определение линейности, правильности и прецизионности методики.
Линейность. Для определения зависимости величины сигнала от концентрации определяемого вещества в испытуемом растворе готовили пять растворов, содержащих 8, 9, 10, 11 и 12 мкг/мл стандартного образца нафтифина в 0,1% фосфорной кислоте, соответствующих уровням концентрации 80, 90, 100, 110 и 120%. Зависимость площади пика нафтифина на хроматограммах полученных растворов от его концентрации описывается линейным уравнением регрессии y=18,536x–1,4793. Аппроксимация линейной регрессии считается приемлемой при значениях коэффициента корреляции (R) не менее 0,99, для нафтифина в диапазоне концентраций от 80 до 120% R² составил 0,9943, что подтверждает линейность методики.
Правильность. Открываемость результатов при оценке правильности методики должна находиться в диапазоне от 98,0 до 102,0%4. Готовили два стандартных раствора нафтифина (10 мкг/мл) для расчета сходимости между ними, а также три испытуемых раствора препарата, содержащих около 8, 10 и 12 мкг/мл нафтифина (табл. 4). Концентрацию нафтифина в испытуемом растворе (Сисп) определяли методом внешнего стандарта по формуле (1):
Сисп = Sисп × Oст, (1)
где Sисп — площадь пика нафтифина на хроматограмме испытуемого раствора, Oст — среднее значение отклика пика нафтифина (Oст), рассчитанного по формуле (2) для двух последовательных хроматограмм стандартного раствора, полученных до и после хроматографирования испытуемого раствора.
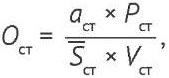 (2)
(2)
где aст, Pст, Vст — навеска, чистота и объем разведения стандартного образца нафтифина соответственно, Sст — средняя площадь пика нафтифина на хроматограммах стандартного раствора. Содержание нафтифина в препарате рассчитывали по формуле (3):
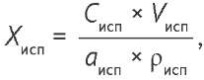 (3)
(3)
где aисп, ρисп, Vисп — навеска, плотность и объем разведения препарата нафтифина соответственно, Cисп — концентрация нафтифина в испытуемом растворе.
Таблица 4. Результаты оценки правильности методики количественного определения нафтифина
Table 4. Accuracy assessment results for the analytical procedure for the quantitative determination of naftifine
Уровень содержания, % Content level, % | Навеска препарата, мг Sample weight (medicinal product), mg | Площадь пика, mAu×c Peak area, mAu×c | Найденная концентрация нафтифина в испытуемом растворе, мкг/мл Calculated naftifine concentration (test solution), µg/mL | Найденное содержание нафтифина в препарате, мг/мл Calculated naftifine content (medicinal product), mg/mL | Открываемость, % Recovery, % |
80 | 8209,44 | 131,58 | 7,47 | 9,80 | 100,09 |
131,68 | 7,47 | 9,81 | 100,17 | ||
131,70 | 7,47 | 9,81 | 100,19 | ||
100 | 10665,80 | 171,03 | 9,71 | 9,81 | 100,17 |
171,32 | 9,72 | 9,83 | 100,34 | ||
171,13 | 9,71 | 9,81 | 100,22 | ||
120 | 13014,44 | 208,56 | 11,84 | 9,80 | 100,05 |
208,66 | 11,84 | 9,80 | 100,10 | ||
209,01 | 11,86 | 9,82 | 100,27 | ||
Среднее значение Mean | 9,81±0,01 | 100,18±0,06 | |||
RSD, % | 0,09 | ||||
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. RSD — относительное стандартное отклонение.
Note. RSD, relative standard deviation.
Для вычисления открываемости использовали известное значение содержания нафтифина в препарате 9,79±0,09 мг/мл, определенное по методике производителя. Открываемость (%) рассчитывали как отношение определенного значения содержания нафтифина в препарате к известному.
Среднее значение открываемости составило 100,18±0,06% и находилось в границах диапазона приемлемости и диапазона известного значения содержания нафтифина в препарате. Полученные результаты подтверждают правильность разработанной аналитической методики.
Внутрилабораторная прецизионность и сходимость. Анализ отдельных проб испытуемого образца, отобранных в одной и той же серии, проводили два аналитика в разные дни на разном оборудовании с применением одних и тех же реактивов. Сходимость результатов определения содержания нафтифина для каждого аналитика оценивали по значению RSD, которое не должно было превышать 2,0%. Внутрилабораторную прецизионность определяли по значению RSD для общей выборки результатов двух аналитиков, также оценивали пересечение доверительных интервалов средних значений содержания нафтифина (табл. 5). Значение RSD не должно было превышать 2,0%, а пересечение доверительных интервалов считали приемлемым, если среднее значение содержания нафтифина, полученного каждым из аналитиков, находилось в границах доверительного интервала другого аналитика.
Таблица 5. Результаты оценки прецизионности и сходимости методики количественного определения нафтифина
Table 5. Precision and repeatability assessment results for the analytical procedure for the quantitative determination of naftifine
Найденное содержание нафтифина, мг/мл Calculated naftifine content, mg/mL | Оценка сходимости Repeatability assessment | Оценка внутрилабораторной прецизионности Interlaboratory precision assessment | |||
Аналитик 1 Analyst 1 | Аналитик 2 Analyst 2 | Аналитик 1 Analyst 1 | Аналитик 2 Analyst 2 | Среднее значение Mean | RSD, % |
9,63 | 9,72 | 9,72±0,05 RSD=0,59% | 9,71±0,02 RSD=0,26% | 9,71±0,04 | 0,44 |
9,79 | 9,73 | ||||
9,70 | 9,69 | ||||
9,73 | 9,70 | ||||
9,68 | 9,69 | ||||
9,77 | 9,75 | ||||
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. RSD — относительное стандартное отклонение.
Note. RSD, relative standard deviation.
Значение RSD найденного содержания нафтифина не превышало 2,0% для каждого аналитика (0,59 и 0,26%). Для общей выборки результатов двух аналитиков RSD составило 0,44%, средние значения, полученные каждым аналитиком, находились в границах интервала другого аналитика. Полученные результаты подтверждают внутрилабораторную прецизионность и сходимость методики.
Устойчивость. Для оценки устойчивости методики количественного определения нафтифина при изменении условий проведения анализа хроматографировали стандартный раствор нафтифина концентрацией 10 мкг/мл и регистрировали влияние следующих параметров на результат:
- изменение температуры термостата колонок (от 20 до 60 °С);
- изменение скорости потока (±20%);
- изменение длины волны детектора (±2 нм от заданного значения 254 нм);
- использование альтернативных колонок (табл. 1).
Влияние изменений перечисленных параметров на результат анализа считали незначительным при соблюдении следующих характеристик пригодности системы:
- RSD площади пика нафтифина не превышает 2,0%;
- RSD времени удерживания пика нафтифина не превышает 2,0%;
- фактор симметрии пика нафтифина составляет от 0,8 до 1,5;
- число теоретических тарелок по пику нафтифина составляет не менее 2000;
- изменение площади пика нафтифина относительно полученной в стандартных условиях проведения анализа удовлетворяет критериям правильности и находится в диапазоне ±2%.
Результаты проведенных тестов, а также их соответствие критериям приемлемости приведены в таблице 6.
Таблица 6. Результаты оценки устойчивости методики количественного определения нафтифина при изменении условий анализа
Table 6. Robustness assessment results for the analytical procedure for the quantitative determination of naftifine (with changes in the analytical conditions)
Параметр системы System parameter | Значение параметра Parameter value | RSDS, % | RSDt, % | Симметрия пика Peak symmetry | Количество ТТ NTP | ∆S, % |
Температура термостата колонок, ºС Column oven temperature, ºС | 20 | 0,45 | 0,06 | 1,32 | 6206 | –0,28 |
25 | 0,72 | 0,05 | 1,13 | 3186 | –0,19 | |
28 | 0,65 | 0,05 | 1,11 | 3200 | –0,30 | |
30 | 0,65 | 0,05 | 1,12 | 3189 | – | |
32 | 0,79 | 0,05 | 1,28 | 3196 | –0,03 | |
35 | 0,81 | 0,05 | 1,42 | 3189 | –0,46 | |
40 | 0,61 | 0,09 | 1,46 | 3099 | –0,49 | |
50 | 0,61 | 0,11 | 1,41 | 2922 | –0,34 | |
60 | 0,66 | 0,10 | 1,37 | 2784 | –0,36 | |
Скорость потока, мл/мин Flow rate, mL/min | 0,8 | 0,30 | 0,26 | 1,36 | 2831 | –0,60 |
0,9 | 0,24 | 0,47 | 1,36 | 2652 | –0,46 | |
1,0 | 0,20 | 0,20 | 1,38 | 2525 | – | |
1,1 | 0,17 | 0,18 | 1,39 | 2434 | –0,09 | |
1,2 | 0,30 | 0,22 | 1,35 | 2320 | 0,35 | |
Длина волны детектора, нм Detection wavelength, nm | 252 | 0,13 | 0,07 | 1,21 | 2660 | –1,59 |
254 | 0,19 | 0,07 | 1,21 | 2660 | – | |
256 | 0,30 | 0,07 | 1,21 | 2660 | –0,38 | |
Замена колонки Column replacement | 3,5 мкм* 3.5 µm* | 0,11 | 0,02 | 1,45 | 2150 | 1,58 |
2,5 мкм* 2.5 µm* | 0,19 | 0,07 | 1,21 | 2660 | – | |
75×2,1 мм, 1,7 мкм** 75×2.1 mm, 1.7 µm** | 0,08 | 0,08 | 1,30 | 8567 | 0,16 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. RSDS — относительное стандартное отклонение площади пика, RSDt — относительное стандартное отклонение времени удерживания, TT — теоретические тарелки.
* колонка XBridge Phenyl.
** колонка Acquity BEH Phenyl.
Note. RSDS, relative standard deviation of the peak area; RSDt, relative standard deviation of the retention time; NTP, number of theoretical plates.
* XBridge Phenyl column.
** Acquity BEH Phenyl column.
При изменении температуры термостатирования хроматографической колонки в диапазоне 25–60 ºС не наблюдали значительных изменений характеристик пиков. При температуре 20 ºС обнаружили увеличение числа теоретических тарелок для пика нафтифина, что связано с увеличением времени удерживания пика и его элюированием на другой стадии градиентной программы. При таком режиме элюирования есть вероятность наложения пика нафтифина на пики примесей и получения ошибочных результатов анализа. Влияния других параметров системы на характеристики ее пригодности не обнаружили.
При изменении скорости потока учитывали, что особенностью проточного спектрофотометрического детектора является изменение времени нахождения детектируемого вещества в ячейке детектора. Поэтому в расчетах при определении влияния скорости потока на результат значение площади пика нафтифина умножали на соответствующее значение скорости потока подвижной фазы (мл/мин). На основании полученных данных подтвердили, что при учете пересчета площадей система остается устойчивой к изменениям скорости потока элюента. При проведении анализа при измененной, но постоянной в течение анализа скорости потока, значительных влияний на результаты не обнаружили.
Изменение длины волны детектора в диапазоне ±2 нм от заданного значения не оказало существенного влияния на результат анализа. При замене хроматографической колонки также не обнаружили значительных различий в результатах количественного определения нафтифина. Однако при использовании колонки Acquity BEH Phenyl бóльшей длины и с частицами меньшего размера (75×2,1 мм, 1,7 мкм) обнаружили значительное увеличение эффективности хроматографического разделения, что может улучшить определение примесей нафтифина и послужить основой для более детального анализа. За счет изменения диаметра колонки ее свободный объем отличается незначительно (табл. 1), вследствие чего не происходит изменения времени удерживания пика нафтифина. Недостатком такой замены можно считать дополнительные требования к хроматографической системе, связанные с бóльшим давлением на колонке Acquity BEH Phenyl, что требует использования хроматографа системы ультраэффективной жидкостной хроматографии (УВЭЖХ).
Полученные результаты позволили подтвердить, что внесение изменений в условия проведения анализа не приводит к значительным изменениям результатов определения содержания нафтифина.
ЗАКЛЮЧЕНИЕ
В результате проведенного исследования была разработана эффективная ВЭЖХ-методика количественного определения нафтифина в лекарственных средствах, которая позволяет сократить время анализа (время удерживания нафтифина — около 2 мин) и свести к минимуму расход используемых реагентов с сохранением критериев пригодности хроматографической системы. В ходе исследований определены оптимальные условия анализа: колонка XBridge Phenyl (20×4,6 мм, с размером частиц 2,5 мкм), температура колонки 30 ºС, подвижная фаза А — 0,1% раствор хлорной кислоты, подвижная фаза Б — ацетонитрил, элюирование в градиентном режиме с увеличением доли ацетонитрила от 30 до 80%, скорость потока подвижной фазы 1,0 мл/мин, объем ввода пробы 5 мкл, детектирование при 254 нм для количественного определения нафтифина и 222 нм для определения примесей.
Показана возможность использования разных растворителей для приготовления испытуемого раствора для препаратов различных лекарственных форм без значимых изменений хроматографических параметров.
Проведена валидация разработанной методики, подтверждены ее специфичность, аналитическая область (концентрация растворов от 8 до 12 мг/мл), линейность (R² составил 0,9943), правильность (RSD составило 0,09%), сходимость (RSD составило 0,59%), внутрилабораторная прецизионность (RSD составило 0,44%) и робастность. Полученные результаты валидации соответствуют требованиям Государственной фармакопеи Российской Федерации и свидетельствуют о пригодности и воспроизводимости разработанной методики.
Выбраны предварительные условия анализа для определения содержания примесей нафтифина. Установлена возможность их разделения и предварительно определена длина волны детектирования (222 нм).
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: И.Ю. Якупов — идея, написание и графическое оформление текста рукописи, разработка хроматографических условий и проведение испытаний, выполнение валидации методики, интерпретация полученных результатов; С.И. Кулешова — разработка концепции исследования, критический пересмотр текста рукописи, анализ результатов; О.Н. Высочанская — проведение валидации, написание и графическое оформление текста рукописи; Е.П. Симонова — разработка условий проведения испытания, выполнение валидации методики.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Ilya Yu. Yakupov conceived the study idea, drafted the manuscript, designed the graphical material, developed the chromatographic conditions, conducted testing, validated the analytical procedure, and interpreted the results obtained. Svetlana I. Kuleshova conceptualised the study, critically revised the manuscript, and analysed the study results. Olga N. Vysochanskaya conducted validation, drafted the manuscript, and designed the graphical materiaL. Elena P. Simonova developed the testing conditions and validated the analytical procedure.
1. Naftifine Hydrocloride. USP-NF. Rockville, MD; 2023.
2. https://grls.rosminzdrav.ru
3. ОФС.1.1.0012 Валидация аналитических методик. Государственная фармакопея Российской Федерации. XV изд. Т. 1. М.; 2023.
4. Там же.
Список литературы
1. Gupta AK, Ryder JE, Cooper EA. Naftifine: a review. J Cutan Med Surg. 2008;12(2):51–8. https://doi.org/10.2310/7750.2008.06009
2. Trailokya AA, Shirsat AB, Madhu R, Shah B. Naftifine: a topical allylamine for superficial dermatophytosis. J Assoc Physicians India. 2023;71(5):11–2. https://doi.org/10.5005/japi-11001-0241
3. Mühlbacher JM. Naftifine: a topical allylamine antifungal agent. Clin Dermatol. 1991;9(4):479–85. https://doi.org/10.1016/0738-081x(91)90076-w
4. Šveikauskaitė I, Briedis V. Potential of naftifine application for transungual delivery. Molecules. 2020;25(13):3043. https://doi.org/10.3390/molecules25133043
5. Косенкова СИ, Краснюк ИИ, Краснюк (мл.) ИИ, Беляцкая АВ, Степанова ОИ, Нарышкин СР. Оценка возможности использования метода УФ-спектрофотометрии для разработки количественного определения нафтифина гидрохлорида в его растворе с комбинацией ПЭГ для лечения грибковых инфекций. Разработка и регистрация лекарственных средств. 2020;9(1):35–8. https://doi.org/10.33380/2305-2066-2020-9-1-35-38
6. de Oliveira CH, Barrientos-Astigarraga RE, de Moraes MO, Bezerra FA, de Moraes ME, de Nucci G. Terbinafine quantification in human plasma by high-performance liquid chromatography coupled to electrospray tandem mass spectrometry: application to a bioequivalence study. Ther Drug Monit. 2001;23(6):709–16. https://doi.org/10.1097/00007691-200112000-00019
7. Gurule S, Khuroo A, Monif T, Goswami D, Saha A. Rational design for variability minimization in bioanalytical method validation: illustration with LC-MS/MS assay method for terbinafine estimation in human plasma. Biomed Chromatogr. 2010;24(11):1168–78. https://doi.org/10.1002/bmc.1423
Об авторах
И. Ю. ЯкуповРоссия
Якупов Илья Юрьевич
Петровский б-р, д. 8, стр. 2, Москва, 127051
С. И. Кулешова
Россия
Кулешова Светлана Ивановна, канд. биол. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
О. Н. Высочанская
Россия
Высочанская Ольга Николаевна
Петровский б-р, д. 8, стр. 2, Москва, 127051
Е. П. Симонова
Россия
Симонова Елена Павловна
Петровский б-р, д. 8, стр. 2, Москва, 127051
Дополнительные файлы
Рецензия
Для цитирования:
Якупов И.Ю., Кулешова С.И., Высочанская О.Н., Симонова Е.П. Определение содержания нафтифина и продуктов его деструкции в лекарственных препаратах методом ВЭЖХ с использованием хроматографических колонок малого объема. Регуляторные исследования и экспертиза лекарственных средств. 2024;14(6):673-685. https://doi.org/10.30895/1991-2919-2024-14-6-673-685
For citation:
Yakupov I.Yu., Kuleshova S.I., Vysochanskaya O.N., Simonova E.P. Quantitative determination of naftifine and its degradation products in medicines by HPLC with small-volume columns. Regulatory Research and Medicine Evaluation. 2024;14(6):673-685. (In Russ.) https://doi.org/10.30895/1991-2919-2024-14-6-673-685



































