Перейти к:
Разработка и валидация ВЭЖХ-методики определения кофейной кислоты в траве нонеи русской
https://doi.org/10.30895/1991-2919-2025-680
Резюме
ВВЕДЕНИЕ. Спиртовой экстракт Nonea rossica Steven согласно данным литературы проявляет антикоагулянтную, противомикробную и противогрибковую активность, что может быть связано с наличием в составе растения кофейной кислоты и ее дериватов. Для стандартизации сырья необходима разработка методики количественного определения кофейной кислоты. Наиболее перспективным методом такого определения является высокоэффективная жидкостная хроматография (ВЭЖХ).
ЦЕЛЬ. Разработка и валидация методики определения кофейной кислоты в траве нонеи русской с использованием ВЭЖХ.
МАТЕРИАЛЫ И МЕТОДЫ. Объектом исследования служила надземная часть нонеи русской, заготовленная в Новосибирской области на остепненном луге в период цветения. Исследование проводили на жидкостном хроматографе Agilent 1100 с колонкой Zorbax SB-C18 (150 мм × 2,1 мм × 3,5 мкм) и детектированием при 330 нм.
РЕЗУЛЬТАТЫ. Хроматографические условия подобраны таким образом, чтобы обеспечить получение пика кофейной кислоты, соответствующего одной молекулярной форме, а также достичь приемлемого разрешения пиков компонентов экстракта при максимальной интенсивности пика аналита. Разработаны условия градиентного элюирования с использованием двухкомпонентной подвижной фазы: метанола (растворитель Б) и 0,01 М KH2PO4 водного раствора, рН 2,70 (растворитель А) при скорости потока 0,25 мл/мин. В этих условиях кофейная кислота элюировалась через 13,5 мин при общем времени анализа 60 мин. Методика валидирована по критериям: специфичность, аналитическая область, пределы обнаружения и количественного определения, правильность, повторяемость и внутрилабораторная прецизионность.
ВЫВОДЫ. Разработана и валидирована методика количественного определения кофейной кислоты в траве нонеи русской методом ВЭЖХ. Относительное стандартное отклонение результатов анализа не превышало 5,0%. Методика может применяться при стандартизации лекарственного растительного сырья «Нонеи русской трава» для его последующего использования в медицинской практике.
Ключевые слова
Для цитирования:
Величко В.В., Ластовка А.В., Карташова М.Е., Гайдук А.А., Круглов Д.С. Разработка и валидация ВЭЖХ-методики определения кофейной кислоты в траве нонеи русской. Регуляторные исследования и экспертиза лекарственных средств. 2025;15(2):222-228. https://doi.org/10.30895/1991-2919-2025-680
For citation:
Velichko V.V., Lastovka A.V., Kartashova M.E., Gaiduk A.A., Kruglov D.S. Development and Validation of an Analytical Procedure for the Determination of Caffeic Acid in Nonea rossica Herb by HPLC. Regulatory Research and Medicine Evaluation. 2025;15(2):222-228. (In Russ.) https://doi.org/10.30895/1991-2919-2025-680
ВВЕДЕНИЕ
В ранее проведенных нами исследованиях была показана антикоагулянтная, а также противомикробная (в отношении Staphylococcus aureus и Bacillus cereus) и противогрибковая (в отношении Candida albicans) активность спиртового (70%) экстракта из надземной части нонеи русской (Nonea rossica Steven) семейства Boraginaceae [1][2]. В соответствии с данными литературы установлено, что такие виды активности могут быть обусловлены присутствием в экстракте веществ фенольной природы [3][4].
Проведенные исследования химического состава надземной части нонеи русской показали преобладание фенольных продуктов вторичного метаболизма растения [5]: флавонолов (производных кверцетина и кемпферола) и гидроксициннаматов (дериватов кофейной кислоты). Следует заметить, что впервые выделенное соединение — нонеазид — (кверцетин-3-О-(2´´-О-кофеил-6´´-О-ацетил)-β-D-глюкопиранозид) является источником кофейной кислоты [5], которая будет образовываться в результате гидролиза нонеазида при его пероральном поступлении в желудочно-кишечный тракт. С кофейной кислотой может быть связана установленная бактериостатическая активность в отношении исследованных культур [6][7]. Кемпферол обладает способностью уменьшать или предотвращать тромботические осложнения за счет различных биохимических каскадов [3][8].
Для эффективного терапевтического применения лекарственных препаратов, в том числе растительных, необходимо для их получения использовать сырье с известным химическим составом и установленными пределами содержания активных компонентов. В этой связи существует необходимость стандартизации лекарственного растительного сырья (ЛРС) «Нонеи русской трава». В качестве показателя для определения доброкачественности сырья целесообразно нормировать количественное содержание кофейной кислоты в ЛРС исследуемого вида. Следует отметить, что согласно принятым нормам1 кофейная кислота как гидроксикоричная кислота с доказанной эссенциальностью [6][7] относится к категории «Минорные биологически активные вещества пищи — природные вещества с установленными химической структурой и физиологическим действием, присутствующие в пище в малых количествах (миллиграммах или микрограммах) и играющие доказанную роль в поддержании здоровья, выполняющие функции экзогенных регуляторов метаболизма», для которых конкретные величины необходимого уровня потребления не установлены. Поэтому определение количественного содержания в ЛРС требует точной и высокочувствительной методики измерений.
В российской фармацевтической практике для оценки количественного содержания оксикоричных кислот в ЛРС используют спектрофотометрический метод анализа [9], отличающийся достаточной простотой выполнения, доступностью оборудования, высокой воспроизводимостью, отсутствием трудоемких операций и небольшим количеством используемых реактивов. Однако растительное сырье характеризуется многокомпонентным составом оптически активных соединений, которые также могут поглощать в аналитической области спектра, характерной для оксикоричных кислот. Согласно закону Бугера–Ламберта–Бера поглощение излучения обладает свойством аддитивности, и результирующая оптическая плотность будет равна сумме оптических плотностей всех веществ, имеющих близкие спектральные характеристики. Поэтому методом прямой спектрофотометрии могут быть получены завышенные результаты, не соответствующие истинному содержанию оксикоричных кислот [10].
Более информативным является метод высокоэффективной жидкостной хроматографии (ВЭЖХ) с диодно-матричным детектированием [11][12], позволяющий установить качественный состав и количественное содержание отдельных компонентов и характеризующийся высокой точностью и воспроизводимостью.
На данный момент метод ВЭЖХ для стандартизации ЛРС по содержанию оксикоричных кислот используется довольно редко, о применении данного метода имеются лишь отдельные сообщения [13–15]. Проанализировав требования Государственной фармакопеи Российской Федерации (ГФ РФ), установили, что для количественного определения оксикоричных кислот данный метод не используется, а для определения качественного состава — только для сырья родиолы розовой2.
В зарубежной практике метод ВЭЖХ используют в исследовательской работе для определения оксикоричных кислот (хинной, цикориевой, розмариновой, кофейной) [16][17]. Применяют также метод высокоэффективной тонкослойной хроматографии (ВЭТСХ), позволяющий одновременно определять несколько десятков соединений [18]. Однако ВЭТСХ-метод требует дорогостоящего оборудования и ограничен в применении из-за нестабильности соединений на воздухе и различий в результатах количественного анализа от пластины к пластине [19].
Таким образом, использование селективного и чувствительного метода ВЭЖХ для количественного определения кофейной кислоты при исследовании и стандартизации ЛРС на примере травы нонеи русской является актуальной задачей.
Цель работы — разработка и валидация методики определения кофейной кислоты в траве нонеи русской с использованием высокоэффективной жидкостной хроматографии.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве объекта исследования использовали надземную часть нонеи русской, заготовленной в окрестностях д. Воробьево Колыванского р-она Новосибирской обл. (с.ш. 55°31´, в.д. 82°57´) на остепненном луге в период цветения в 2023 г. Собранное сырье доводили до воздушно-сухого состояния и измельчали до размера частиц, проходящих сквозь сито № 3 (ТУ 3618-001-39436682-98) с размером отверстий 3 мм. Влажность сырья определяли по стандартной методике в сушильном шкафу СНОЛ-3,5.5.3,5/5-И2 (ООО «НПФ ТермИКС»). Для экстракции из сырья целевой группы биологически активных соединений были взяты девять точных навесок измельченной травы нонеи русской массой 1,4–2,6 г, взвешенных на аналитических весах SQP-F Quintix 215D-10RU (Sartorius Lab Instruments GmbH). Экстракцию проводили в отработанных ранее условиях [20]: размер частиц сырья 0,2–3 мм, экстрагент — спирт этиловый 70%, соотношение сырье–экстрагент 1:20, время экстракции — 60 мин при настаивании на водяной бане, количество повторов — 2.
Полученные экстракты охлаждали, затем фильтровали в колбу ротационного испарителя Rotavapor R-200 (BUCHI Labortechnik AG) и удаляли растворитель при температуре 60 °С. К полученному сухому остатку добавляли 2 мл метанола («для ВЭЖХ», J.T. Baker) и помещали в ультразвуковую ванну УЗВ-2,8 (ООО «Сапфир») на 3 мин. Далее извлечения фильтровали через шприцевой фильтр из политетрафторэтилена с диаметром пор 0,45 мкм (ANPEL Laboratory Technologies Inc.) в виалы для хроматографии.
Точную навеску кофейной кислоты (≥98,0, Sigma-Aldrich) массой 5,0 мг растворяли в 5 мл метанола, перемешивали, фильтровали через шприцевой фильтр с диаметром пор 0,45 мкм. Полученный раствор сравнения (1 мг/мл кофейной кислоты) использовали для приготовления серии рабочих градуировочных растворов, содержащих 0,1, 0,25, 0,5, 1, 5, 10, 100, 500 мкг/мл кофейной кислоты в метаноле.
Анализ экстрактов выполняли на жидкостном хроматографе Agilent 1100 (Agilent Technologies) с диодно-матричным детектором при длине волны 330 нм. Для хроматографирования использовали колонку Zorbax SB 150×2,1 мм (Agilent Technologies), заполненную сорбентом C18 с зернением 3,5 мкм. Состав подвижной фазы: 0,01 М раствор калия дигидрофосфата (ч., «РусХим») рН 2,70 (А) и метанол (Б). Режим элюирования градиентный: 10–100% (Б) 0–60 мин, 100% (Б) 60–65 мин со скоростью 0,25 мл/мин. Температура колонки — 30 °С, объем вводимой пробы — 2 мкл.
Валидация разработанной методики была выполнена по показателям: специфичность, аналитическая область, пределы обнаружения и количественного определения, правильность, повторяемость, внутрилабораторная прецизионность в соответствии с требованиями ОФС.1.1.00123. Для статистической обработки данных использовали принятые методики4 и программное обеспечение Microsoft Office Excel.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Хроматографические условия были подобраны таким образом, чтобы обеспечить получение пика кофейной кислоты, соответствующего одной молекулярной форме вещества, а также достичь приемлемого разрешения между пиками компонентов экстракта при максимальной интенсивности пика кофейной кислоты.
Кофейная кислота имеет хорошую растворимость как в ацетонитриле, так и в метаноле, однако использование ацетонитрила в качестве органического компонента подвижной фазы, а также добавление трифторуксусной или муравьиной кислот не позволили улучшить хроматографическое разделение компонентов экстракта. Зависимость формы и интенсивности пика кофейной кислоты от рН водного компонента подвижной фазы представлена на рисунке 1.
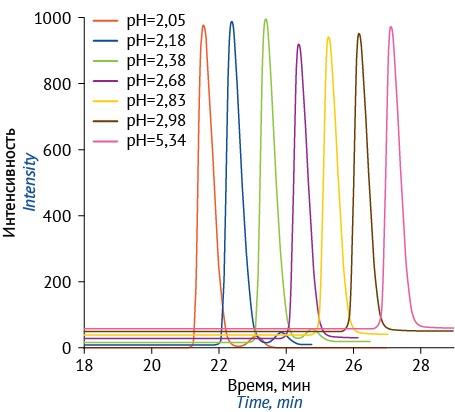
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 1. Хроматографическое пики кофейной кислоты в зависимости от pH подвижной фазы
Fig. 1. Chromatographic peaks of caffeic acid depending on the mobile phase pH
При значениях рН ниже 2,68 наблюдалось образование второго пика, соответствующего протонированной форме кофейной кислоты. Для получения пика кофейной кислоты, соответствующего одной молекулярной форме, и его отделения от компонентов матрицы экстракта с разрешением не менее 1,55 были разработаны условия градиентного элюирования, в которых время удерживания кофейной кислоты составило 13,5 мин при общем времени анализа 60 мин.
Специфичность методики была доказана получением хроматограмм раствора «холостого» образца (100% растворитель), раствора сравнения и раствора экстракта травы нонеи русской при длине волны 330 нм. На хроматограмме чистого растворителя (рис. 2)6 отсутствовали пики с временами удерживания определяемых компонентов, таким образом, подтверждено отсутствие мешающего влияния посторонних пиков на аналитический сигнал.
Градуировочный график в аналитической области определения кофейной кислоты, построенный в диапазоне концентраций от 0,25 до 1000 мкг/мл, имел форму линейной зависимости, описываемой уравнением: Y=33,54X+46,61 с коэффициентом корреляции 0,9998, где Х — концентрация кофейной кислоты (мкг/мл), Y — площадь пика кофейной кислоты (табл. 1)7.
Для проверки правильности ВЭЖХ-методики определения кофейной кислоты использовали метод добавок. Для трех диапазонов концентраций были приготовлены растворы спиртового извлечения из растительного сырья с добавкой раствора кофейной кислоты известной концентрации в метаноле. Результаты анализа полученных растворов в условиях разработанной ВЭЖХ-методики представлены в таблице 2. Правильность определения кофейной кислоты составила от 0,15 до 5,2%.
Повторяемость методики оценивали по результатам определения кофейной кислоты в образцах с добавками в одинаковых условиях проведения анализа с использованием одних и тех же реактивов и оборудования в одной и той же лаборатории в течение одного дня. Значение повторяемости (относительного стандартного отклонения) изменялось в интервале от 1,5 до 4,6 и не превышало 5% (табл. 2). Данное значение можно принять за допустимую норму при определении содержания кофейной кислоты методом ВЭЖХ в образцах растительного сырья «Нонеи русской трава».
Внутрилабораторная прецизионность исследовалась для получения характеристики вариабельности результатов анализа в одной лаборатории на одном и том же оборудовании в разные дни разными исполнителями и не превышала 5% (табл. 3).
Результаты валидации разработанной методики, установленные пределы обнаружения и количественного определения кофейной кислоты, линейность, аналитическая область методики, специфичность, прецизионность на уровне сходимости (внутрилабораторной и межлабораторной) представлены в таблице 4.
Проведена метрологическая оценка разработанной методики. Установлено, что относительная погрешность единичного определения с доверительной вероятностью 95% составляет 3,74% (табл. 5).
ЗАКЛЮЧЕНИЕ
Разработана методика определения количественного содержания кофейной кислоты в надземной части нонеи русской на основе высокоэффективной жидкостной хроматографии с диодно-матричным детектированием при 330 нм и колонкой Zorbax SB-C18 (150 мм × 2,1 мм × 3,5 мкм). Выбран оптимальный состав подвижной фазы: 0,01 М водный раствор калия дигидрофосфата, рН 2,70 (элюент А) и метанол (элюент Б). Элюирование предложено проводить в градиентном режиме: от 10 до 100% элюента Б за первые 60 мин анализа, затем еще 5 мин — 100% элюента Б со скоростью 0,25 мл/мин. В этих условиях время удерживания кофейной кислоты составляло 13,5 мин.
Методика валидирована по критериям: специфичность, аналитическая область, пределы обнаружения и количественного определения, правильность, повторяемость и внутрилабораторная прецизионность. Специфичность методики была доказана по отсутствию мешающих пиков, совпадающих по времени удерживания с пиком кофейной кислоты. Аналитическая область методики находится в диапазоне концентраций от 80 до 120 мкг/мл кофейной кислоты. Предел обнаружения составил 0,1 мкг/мл, предел количественного определения — 0,25 мкг/мл. Диапазон вариаций открываемости составил от 0,15 до 5,2%. Относительное стандартное отклонение при оценке повторяемости и внутрилабораторной прецизионности методики не превышало 5,0%. При изменении скорости потока подвижной фазы время удерживания кофейной кислоты изменялось соответственно.
Разработанная методика может применяться для стандартизации лекарственного растительного сырья «Нонеи русской трава».
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: В.В. Величко — работа с источниками литературы, концепция и дизайн исследования, написание текста рукописи, формулировка выводов, окончательное утверждение текста рукописи для публикации; А.В. Ластовка — получение, анализ данных, их интерпретация, написание текста рукописи; М.Е. Карташова и А.А. Гайдук — пробоподготовка, получение экспериментальных данных; Д.С. Круглов — работа с источниками литературы, критический пересмотр и доработка текста рукописи.
Дополнительная информация. На сайте журнала «Регуляторные исследования и экспертиза лекарственных средств» размещены таблицы 1–5, рис. 2.
https://doi.org/10.30895/1991-2919-2025-680-fig2
https://doi.org/10.30895/1991-2919-2025-680-tables
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Viktoriya V. Velichko worked with literature sources, conceptualised and designed the study, drafted the manuscript, formulated the conclusions, approved the final version of the manuscript for publication. Anastasiya V. Lastovka obtained, analysed, and interpreted data and drafted the manuscript. Anastasiya E. Kartashova and Anastasiya A. Gaiduk prepared samples and obtained experimental data. Dmitriy S. Kruglov worked with literature sources, critically revised the manuscript, and finalised the manuscript.
Additional information. Tables 1–5, and Figure 2 are published on the website of Regulatory Research and Medicine Evaluation.
https://doi.org/10.30895/1991-2919-2025-680-fig2
https://doi.org/10.30895/1991-2919-2025-680-tables
1. МР 2.3.1.0253-21. 2.3.1. Гигиена питания. Рациональное питание. Нормы физиологических потребностей в энергии и пищевых веществах для различных групп населения Российской Федерации. М.: Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека; 2021.
2. ФС.2.5.0036.15 Родиолы розовой корневища и корни. Государственная фармакопея Российской Федерации. XIV изд. М.; 2018.
3. ОФС.1.1.0012 Валидация аналитических методик. Государственная фармакопея Российской Федерации. XV изд. М.; 2023.
4. ОФС.1.1.0013 Статистическая обработка результатов физических, физико-химических и химических испытаний. Государственная фармакопея Российской Федерации. XV изд. М.; 2023.
Никитин ВИ. Первичная статистическая обработка экспериментальных данных. Самара: Самарский государственный технический университет; 2017.
5. ОФС.1.2.1.2.0001 Хроматография. Государственная фармакопея Российской Федерации. XV изд. М.; 2023.
6. Рисунок 2 размещен на сайте журнала. https://doi.org/10.30895/1991-2919-2025-680-fig2
7. Таблицы 1–5 размещены на сайте журнала. https://doi.org/10.30895/1991-2919-2025-680-tables
Список литературы
1. Долганова ОМ, Величко ВВ, Карташова МЕ, Ершов КИ, Круглов ДС. Антикоагулянтная активность травы нонеи русской (Nonea rossica Steven). Journal of Siberian Medical Sciences. 2023;7(4):68–76. https://doi.org/10.31549/2542-1174-2023-7-4-68-76
2. Величко ВВ, Карташова МЕ, Кучерова СД, Круглов ДС, Бурова ЛГ, Евстропов АН. Фитохимическая характеристика и антимикробные свойства экстрактов Nonea rossica (Boraginaceae). Растительные ресурсы. 2023;59(3):297–305. https://doi.org/10.31857/S0033994623030068
3. Чиряпкин АС, Золотых ДС, Поздняков ДИ. Обзор биологической активности флавоноидов: кверцетина и кемпферола. Juvenis Scientia. 2023;9(2):5–20. https://doi.org/10.32415/jscientia_2023_9_2_5-20
4. Бояринцев ДИ, Калинин ЕП, Ральченко ИВ, Рудзевич ЕЛ. Природные соединения с антикоагулянтным действием (обзор). Вопросы биологической, медицинской и фармацевтической химии. 2019;22(2):3−10. https://doi.org/10.29296/25877313-2019-02-01
5. Olennikov DN, Kartashova ME, Velichko VV, Kruglov DS. New flavonoids from Nonea rossica and Tournefortia sibirica. Chem Nat Compd. 2022;58(6):1021–5. https://doi.org/10.1007/s10600-022-03858-9
6. Khan F, Bamunuarachchi NI, Tabassum N, Kim YM. Caffeic acid and its derivatives: Antimicrobial drugs toward microbial pathogens. J Agric Food Chem. 2021;69(10):2979–3004. https://doi.org/10.1021/acs.jafc.0c07579
7. Лужанин ВГ, Уэйли АК, Понкратова АО, Новикова ВВ, Безверхняя ЕА. Противомикробная активность соединений полифенольной природы. Разработка и регистрация лекарственных средств. 2022;11(2):65–72. https://doi.org/10.33380/2305-2066-2022-11-2-65-72
8. Choi J-H, Park S-E, Kim S-J, Kim S. Kaempferol inhibits thrombosis and platelet activation. Biochimie. 2015;115:177–86. https://doi.org/10.1016/j.biochi.2015.06.001
9. Belay A. Spectrophotometric method for the determination of caffeic acid complexation and thermodynamic properties. Int J Biophys. 2012;2(2):12–7. https://doi.org/10.5923/j.biophysics.20120202.01
10. Компанцева ЕВ, Айрапетова АЮ, Саушкина АС. Определение гидроксикоричных кислот в растительном сырье спектрофотометрическим методом. Часть 1. Прямая спектрофотометрия (обзор). Ведомости Научного центра экспертизы средств медицинского применения. Регуляторные исследования и экспертиза лекарственных средств. 2024;14(2):181–95. https://doi.org/10.30895/1991-2919-2024-14-2-181-195
11. Awwad S, Issa R, Alnsour L, Albals D, Al-Momani I. Quantification of caffeine and chlorogenic acid in green and roasted coffee samples using HPLC-DAD and evaluation of the effect of degree of roasting on their levels. Molecules. 2021;26(24):7502. https://doi.org/10.3390/molecules26247502
12. Gerasimova V, Kaloyanov N, Karsheva M, Peycheva MF, Stoilova NA. HPLC-DAD method for simultaneous determination of natural polyphenols. Open J Anal Bioanal Chem. 2019;3(1):39–43. https://doi.org/10.17352/ojabc.000009
13. Коломиец НЭ, Калинкина ГИ, Сапронова НН. Стандартизация листьев крапивы двудомной. Фармация. 2011;(6):22–4. EDN: OEELAL
14. Zhang Z, Zhang W, Tu J, Li Y, Xu G, Zhang Y. Simultaneous detection of protocatechuic acid, chlorogenic acid and caffeic acid in honey by HPLC with ultraviolet and electrochemical detectors. Int J Electrochem Sci. 2018;13(7):6655–65. https://doi.org/10.20964/2018.07.44
15. Нестерова НВ, Самылина ИА, Бобкова НВ, Кузьменко АН, Краснюк ИИ, Евграфов АА. Количественное определение гидроксикоричных кислот и анализ динамики их накопления в листьях яблони лесной. Вестник Московского университета. Серия 2: Химия. 2019;60(1):60–4. EDN: YTIALB
16. Lee H-D, Paje LA, Lee S, Kang KS, Hong K, Kwon H, Lee S. Optimization of an analytical HPLC-DAD method for detecting hydroxycinnamic acid derivatives from mixtures of Saussurea grandifolia and Taraxacum coreanum. Appl Biol Chem. 2021;64:49. https://doi.org/10.1186/s13765-021-00622-5
17. Wang H, Provan GJ, Helliwell K. Determination of rosmarinic acid and caffeic acid in aromatic herbs by HPLC. Food Chem. 2004;87(2):307–11. https://doi.org/10.1016/j.foodchem.2003.12.029
18. Ishwarya M, Narendhirakannan RT. HPTLC method for quantitative determination of hydroxycinnamic acid derivatives in Solanum lycopersicum. Bangladesh J Pharmacol. 2018;13(2):137–41. https://doi.org/10.3329/bjp.v13i2.34461
19. Morlock GE. High-performance thin-layer chromatography combined with effect directed assays and high-resolution mass spectrometry as an emerging hyphenated technology: A tutorial review. Anal Chim Acta. 2021;1180:338644. https://doi.org/10.1016/j.aca.2021.338644
20. Карташова МЕ, Величко ВВ, Круглов ДС. Товароведческие показатели лекарственного растительного сырья «Нонеи русской трава». В кн.: Лужанин ВГ, ред. Кромеровские чтения 2024. Пермь; 2024.
Об авторах
В. В. ВеличкоРоссия
Величко Виктория Владимировна - канд. фарм. наук, доцент.
Красный пр-т, д. 52, Новосибирск, 630091
А. В. Ластовка
Россия
Величко Виктория Владимировна - канд. фарм. наук, доцент.
Академика Лаврентьева пр-т, д. 9, Новосибирск, 630090; ул. Пирогова, д. 1, Новосибирск, 63009
М. Е. Карташова
Россия
Карташова Марина Елвардовна
Красный пр-т, д. 52, Новосибирск, 630091
А. А. Гайдук
Россия
Гайдук Анастасия Андреевна
Академика Лаврентьева пр-т, д. 9, Новосибирск, 630090; ул. Пирогова, д. 1, Новосибирск, 630090
Д. С. Круглов
Россия
Круглов Дмитрий Семенович - канд. техн. наук, доцент.
Красный пр-т, д. 52, Новосибирск, 630091
Дополнительные файлы

|
1. Таблицы 1–5 | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(1MB)
|
Метаданные ▾ | |

|
2. Рис. 2. Хроматограммы чистого растворителя (красный), раствора кофейной кислоты (синий) и экстракта, полученного из образца травы нонеи русской (зеленый). Условия анализа: колонка Zorbax SB-C18 150 мм × 2,1 мм × 3,5 мкм, элюирование 0,01 МKH₂PO₄ рН 2,70 (А) и метанол (Б) в градиентном режиме 10–100% (Б) 0–60 мин, 100% (Б) 60–65 мин со скоростью 0,25 мл/мин, температура колонки — 30 °С, объем вводимой пробы — 2 мкл, длина волны детектора — 330 нм | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(1MB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Величко В.В., Ластовка А.В., Карташова М.Е., Гайдук А.А., Круглов Д.С. Разработка и валидация ВЭЖХ-методики определения кофейной кислоты в траве нонеи русской. Регуляторные исследования и экспертиза лекарственных средств. 2025;15(2):222-228. https://doi.org/10.30895/1991-2919-2025-680
For citation:
Velichko V.V., Lastovka A.V., Kartashova M.E., Gaiduk A.A., Kruglov D.S. Development and Validation of an Analytical Procedure for the Determination of Caffeic Acid in Nonea rossica Herb by HPLC. Regulatory Research and Medicine Evaluation. 2025;15(2):222-228. (In Russ.) https://doi.org/10.30895/1991-2919-2025-680



































