Перейти к:
Календулы цветки (Calendulae officinalis flos): методы выделения фракций биологически активных веществ
https://doi.org/10.30895/1991-2919-2024-634
Резюме
ВВЕДЕНИЕ. Актуальной задачей фармацевтической отрасли является разработка ресурсосберегающих технологий производства лекарственных средств (ЛРС). Один из способов эффективного использования лекарственного растительного сырья — технологии, позволяющие получать продукты с различным фармакологическим действием в одном технологическом цикле. В настоящее время отсутствует регламентированный способ обработки данного вида сырья, который бы позволил разрабатывать лекарственные препараты на основе календулы цветков с заданным фармакологическим действием. В странах Евразийского экономического союза (ЕАЭС) для переработки сырья календулы используются методы экстракции, направленные на получение в одном технологическом цикле только одной фракции БАВ (только флавоноидов или только каротиноидов).
ЦЕЛЬ. Оценка возможности получения фракций биологически активных веществ разной полярности (каротиноиды, флавоноиды и полисахариды) из календулы цветков путем использования поэтапной обработки лекарственного растительного сырья в одном технологическом цикле.
МАТЕРИАЛЫ И МЕТОДЫ. Экстракцию каротиноидов календулы цветков проводили гексаном. Дополнительно для предварительной обработки сырья использовали термическое воздействие. Количественное определение каротиноидов и флавоноидов выполняли спектрофотометрическим методом, полисахаридных фракций — гравиметрическим. После отгонки гексана был получен твердый маслянистый остаток, который растворяли при механическом перемешивании в масле для получения масляного экстракта. Выполняли трехэтапную обработку: экстракция гексаном (экстракция слабополярным органическим растворителем каротиноидов), экстракция смесью вода/ацетон в отношении 30/70 по объему (выделение флавоноидов) и экстракция водой (осаждение полисахаридов).
РЕЗУЛЬТАТЫ. Максимальное количество каротиноидов (~4%) содержится в липофильных вытяжках, полученных при однократной экстракции гексаном и ее комбинации с термообработкой, при водно-органической экстракции их содержание меньше в десять раз. Масляные экстракты были получены из твердого маслянистого остатка после отгонки гексана при температуре его кипения, содержание биологически активных веществ в них сопоставимо с исходным. Предварительная экстракция гексаном увеличивает выход флавоноидов на 68,5% при водно-органической экстракции и снижает его в 1,7 раза при водной экстракции по сравнению с нативным сырьем, что сопровождается уменьшением их содержания во фракции водорастворимых полисахаридов практически в 10 раз. С введением новых этапов обработки суммарное содержание и содержание отдельных полисахаридных фракций снижается с повышением степени их чистоты. Соотношение полисахаридных фракций не изменяется при использовании всех примененных способов обработки.
ВЫВОДЫ. Поэтапная обработка сырья календулы цветков позволяет в одном технологическом цикле выделить три фракции, содержащие повышенное количество каротиноидов (в 3,3 раза), флавоноидов (на 44,8%) и полисахаридов (на 41,3%) соответственно в сравнении с нативным сырьем. Полученный продукт характеризуется более высокой степенью чистоты, чем продукт, полученный при предобработке с применением двукратной экстракции гексаном, или из нативного сырья. Метод рекомендовано использовать для получения лекарственных средств, обогащенных конкретной группой БАВ, или с меньшим содержанием примесей.
Ключевые слова
Для цитирования:
Лукашов Р.И., Гурина Н.С. Календулы цветки (Calendulae officinalis flos): методы выделения фракций биологически активных веществ. Регуляторные исследования и экспертиза лекарственных средств. 2024;14(6):707-719. https://doi.org/10.30895/1991-2919-2024-634
For citation:
Lukashou R.I., Gurina N.S. Calendula Flowers (Calendulae officinalis flos): Methods to Obtain Fractions of Biologically Active Substances. Regulatory Research and Medicine Evaluation. 2024;14(6):707-719. (In Russ.) https://doi.org/10.30895/1991-2919-2024-634
ВВЕДЕНИЕ
Комплексная переработка лекарственного растительного сырья (ЛРС) является одной из перспективных технологий, применяемых в промышленной фармации стран СНГ. Целью такой технологии является максимально полное использование растительного сырья, в том числе всех частей растения; шрота после экстракции целевых биологически активных веществ (БАВ); одного вида ЛРС для получения разных продуктов в одном технологическом процессе; вторичного сырья пищевых производств и извлечение разных групп БАВ из одного и того же ЛРС [1][2].
Значимость внедрения комплексной переработки календулы обусловлена широким применением лекарственных средств на ее основе. На фармацевтическом рынке Республики Беларусь представлены следующие лекарственные препараты на основе календулы цветков1.
Календулы настойка 1:10 (содержит не менее 65% этанола) относится к коду по АТХ «R02AA — препараты для лечения заболеваний горла. Антисептики». В форме полосканий после добавления к теплой воде применяют для комплексной терапии воспалительных заболеваний рта (стоматит, гингивит, пародонтит) и горла (тонзиллит), легких воспалительных процессов кожи и небольших поверхностных ран.
Ноготков (календулы) цветки — сырье растительное в картонных пачках и фильтр-пакетах. Применяют в форме водных извлечений по тем же показаниям, что и настойку.
Мазь для наружного применения «Календула» относится к коду АТХ «D03AX — прочие ЛС, способствующие заживлению ран». Оказывает местное противовоспалительное и антисептическое действие. Применяют в терапии ожогов первой степени, небольших поверхностных ран.
На основе календулы цветков получают также жидкие экстракты в составе комбинированных лекарственных средств противовоспалительного, ранозаживляющего, репаративного и антимикробного действия. Календула входит в состав биологически активных добавок к пище (сырье растительное, таблетки), косметических средств (гель, крем, бальзам), зубных паст, ополаскивателей и др.
В технологию комплексной переработки календулы лекарственной могут быть включены следующие процессы: заготовка надземной части [3]2, экстракция из шрота после извлечения 70% этиловым спиртом органических кислот, полисахаридов, флавоноидов, аминокислот, дубильных веществ, тритерпеновых сапонинов, аскорбиновой кислоты3 [4]. В работе И.В. Бурцевой шрот календулы, оставшийся после получения настойки, был использован для получения масляного экстракта, содержащего каротиноиды, и водного экстракта, в котором были определены флавоноиды и полисахариды4. В той же работе установлена противоязвенная активность масляного экстракта и иммунокорректирующая — водного. Противоязвенная активность связана с обогащением экстрактов каротиноидами и флавоноидами [5–7], а иммунокорректирующая — полисахаридами5 [8]. Как элемент комплексной переработки календулы может быть предложено получение липофильных фракций с использованием сжиженных газов. Полученный липофильный экстракт содержит жирные кислоты, летучие вещества эфирных масел, фитостерины, витамины6.
В рамках концепции ресурсосбережения и максимально эффективного использования ЛРС актуальной является разработка такой технологии поэтапной обработки, при которой на каждом последующем этапе повышается выход БАВ или чистота полученного продукта. В рамках такого подхода разные по полярности фракции БАВ могут быть получены в три этапа: извлечение липофильных веществ из ЛРС путем экстракции слабополярным растворителем, извлечение фракций фенольных соединений из обезжиренного сырья путем водно-органической экстракции и выделение из полученного шрота полисахаридных фракций путем водной экстракции. При такой обработке могут быть получены продукты, обогащенные конкретной группой БАВ, что позволит разработать лекарственные препараты с заданным фармакологическим действием.
Существующие в настоящее время в странах ЕАЭС технологии переработки сырья календулы заключаются в использовании методов экстракции, направленных на получение в одном технологическом цикле только одной фракции БАВ, хотя фармакологическим действием обладает весь комплекс БАВ. Это создает предпосылки для разработки новых методик получения в одном технологическом процессе ряда фракций, обогащенных конкретной группой БАВ, для которой выражен тот или иной фармакологический эффект.
Цель работы — оценка возможности получения фракций биологически активных веществ разной полярности (каротиноиды, флавоноиды и полисахариды) из календулы цветков путем использования поэтапной обработки лекарственного растительного сырья в одном технологическом цикле.
Задачи исследования:
1) определить содержание липофильных веществ (каротиноидов) в сырье при экстракции гексаном, твердом маслянистом остатке и масляных экстрактах, водно-органических вытяжках;
2) выявить влияние предварительной экстракции гексаном на содержание каротиноидов, флавоноидов, полисахаридов при водно-органической и водной экстракции;
3) установить зависимость содержания отдельных полисахаридных фракций и их суммы от используемых этапов обработки;
4) предложить методику поэтапной обработки календулы с получением фракций каротиноидов, флавоноидов и полисахаридов.
МАТЕРИАЛЫ И МЕТОДЫ
Объектами исследования являлись промышленные серии ЛРС календулы цветков производства ООО «НПК Биотест» (Республика Беларусь).
Этапы обработки сырья. Первым этапом обработки являлась экстракция гексаном (х.ч., ОДО «ХимХром») (обезжиривание) календулы цветков в условиях, подобранных ранее7. В полученных после экстракции гексаном извлечениях определяли содержание суммы каротиноидов. Для оценки возможности использования этих извлечений как источников указанной группы БАВ провели удаление гексана путем отгонки при температуре его кипения (69 ºС) в роторном испарителе RV 3 eco с баней HB eco (IKA) и повторное определение каротиноидов, также установили их содержание в твердом маслянистом остатке (экстракте) — плотной массе желто-оранжевого цвета с каплями жирного масла.
Для оценки возможности получения из данного остатка масляных экстрактов использовали в качестве растворителя масло подсолнечное в объеме, эквивалентном первоначальному объему вытяжки, и контролировали полноту растворения визуально и путем определения содержания каротиноидов. Процесс растворения проводили при комнатной температуре в течение 1 ч при механическом перемешивании на орбитальном шейкере KS 130 basic Package (IKA) при 240 об./мин.
Дополнительно до и после отгонки гексана проводили определение каротиноидов ЛРС после различной предобработки: а) обезжиривание с последующей термообработкой; б) термообработка с последующим обезжириванием; в) только термообработка. Термическую обработку проводили при помощи стерилизатора воздушного «Витязь ГП 10-3» (ОАО «Витязь», Республика Беларусь) при следующих условиях: температура в алюминиевой упаковке — 140 ºС; продолжительность обработки — 1,5 ч; толщина слоя обрабатываемого порошка сырья — до 1 см. Определяли содержание каротиноидов при повторной (двукратной) экстракции для оценки полноты их извлечения.
Вторым этапом обработки являлась водно-органическая экстракция (смесь вода/ацетон в соотношении 30/70 по объему) флавоноидов из обезжиренного гексаном сырья при подобранных ранее условиях экстракции [9][10] (далее — этап «удаление флавоноидов»). Условия экстракции: температура экстракции — 60 ºС; продолжительность экстракции — 1,5 ч; соотношение сырья и экстрагента — 1:5 (г:мл); кратность экстракции — однократная; степень измельчения сырья — 500 мкм. Сырье оставляли для естественного улетучивания экстрагента до 5 сут под вытяжной системой при комнатной температуре. Высохшее сырье использовали для последующей водной экстракции.
На третьем этапе выполняли водную экстракцию в режиме отвара8.
Определение БАВ. В водно-органическом извлечении из ЛРС без предварительной обработки и предварительно обезжиренного (экстракция гексаном) определяли содержание флавоноидов и каротиноидов. В водном извлечении определяли содержание водорастворимых полисахаридов (ВПС), флавоноидов и каротиноидов. В шроте, оставшемся после определения ВПС, устанавливали содержание других полисахаридных фракций (пектиновые вещества (ПВ) и гемицеллюлозы (ГЦ) А и Б) для предварительно необработанного ЛРС, для ЛРС после удаления флавоноидов и после предварительной экстракции гексаном с последующим удалением флавоноидов.
Определение содержания суммы каротиноидов выполняли методом прямой спектрофотометрии при длине волны 442 нм [11] на спектрофотометре Solar PB2201 (ЗАО «Солар», Республика Беларусь). Исследуемый образец разбавляли гексаном или экстрагентом до значений оптической плотности 0,2–0,8 (испытуемый раствор), в качестве компенсационного раствора использовали гексан или экстрагент без добавок.
Содержание суммы каротиноидов в пересчете на β-каротин рассчитывали по формуле (1):
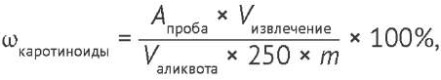 (1)
(1)
где ωкаротиноиды — массовая доля каротиноидов, %; Апроба — оптическая плотность испытуемого раствора; Vизвлечение — объем полученного извлечения, мл; Vаликвота — объем аликвоты, взятой для разведения; 250 — удельный показатель поглощения β-каротина; m — масса навески испытуемого сырья, г.
Определение содержания флавоноидов проводили по схеме: к 5,0 мл извлечения добавляли 8,0 мл раствора 50 г/л алюминия хлорида в 70% этиловом спирте, выдерживали на водяной бане в течение 4 мин, быстро (в течение 30 с) в сосуде со льдом охлаждали до комнатной температуры, добавляли 5,0 мл буферного раствора и доводили 70% этиловым спиртом до объема 25 мл. Получали таким образом испытуемый раствор. Измерение оптической плотности испытуемого раствора производили при 409 нм с использованием компенсационного раствора соответственно.
Для приготовления буферного раствора к 10 мл 1 М раствора натрия гидроксида прибавляли 25 мл раствора 60 г/л кислоты уксусной ледяной и доводили водой до объема 100 мл.
Компенсационный раствор готовили без добавления алюминия хлорида: 5,0 мл извлечения выдерживали на водяной бане в течение 4 мин, быстро (в течение 30 с) охлаждали в сосуде со льдом до комнатной температуры, добавляли 5,0 мл буферного раствора и доводили 70% этиловым спиртом до объема 25 мл.
Пересчет суммарного содержания флавоноидов проводили методом одного стандарта на рутин (Sigma-Aldrich, кат. № 1606503). Готовили стандартный раствор: к 5,0 мл раствора 2 г/л рутина добавляли 8,0 мл раствора 50 г/л алюминия хлорида в 70% этиловом спирте, выдерживали на водяной бане в течение 4 мин, быстро (в течение 30 с) охлаждали в сосуде со льдом до комнатной температуры, добавляли 5,0 мл буферного раствора и доводили 70% этиловым спиртом до объема 25 мл.
Компенсационный раствор готовили без добавления алюминия хлорида: 5,0 мл раствора 2 г/л рутина выдерживали на водяной бане в течение 4 мин, быстро (в течение 30 с) охлаждали в сосуде со льдом до комнатной температуры, добавляли 5,0 мл буферного раствора и доводили 70% этиловым спиртом до объема 25 мл.
Идентификацию флавоноидов проводили методом высокоэффективной жидкостной хроматографии, условия хроматографирования приведены в [12], времена удержания и форму спектров поглощения сравнивали с данными, полученными на стандартных образцах Sigma-Aldrich: тифанеозид (кат. № 0002045); мангаслин (кат. № 0003918); рутин (кат. № 1606503); изокверцитрин (кат. № 0105405); нарциссин (кат. № 5481663); изорамнетина 3-глюкозид (кат. № 0016733).
Определение содержания полисахаридных фракций проводили гравиметрически [13–15]. Для определения ВПС из каждого водного извлечения отбирали по три пробы объемом по 25 мл в центрифужные пробирки, прибавляли трехкратный объем 96% этилового спирта и подогревали на водяной бане при 60 ºС 5 мин. Через 30 мин центрифугировали при 5000 об./мин в течение 30 мин на центрифуге Sigma 3-16L (Sigma-Aldrich). Надосадочную жидкость фильтровали через предварительно высушенный до постоянной массы при температуре 100–105 ºС стеклянный фильтр ПОР 16 диаметром 40 мм, затем в отфильтрованной жидкости проводили количественное определение флавоноидов и каротиноидов (при их обнаружении в водном извлечении).
Осадок количественно переносили на предварительно взвешенное часовое стекло, промывали последовательно смесью 96% этилового спирта и воды (3:1, по объему), ацетоном и этилацетатом, высушивали сначала на воздухе, затем при температуре 100–105 ºС до постоянной массы и рассчитывали содержание определяемых веществ (ω) (ВПС, ПВ, сумма ГЦ А и В) по формуле (2).
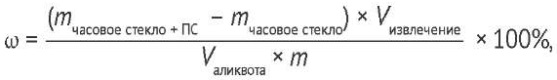 (2)
(2)
где mчасовое стекло + ПС — масса часового стекла с высохшей на нем ПС фракцией, г; mчасовое стекло — масса часового стекла, г; Vизвлечение — объем извлечения, полученного в ходе водной экстракции, мл; Vаликвота — объем аликвоты, из которой проводилось осаждение ПС фракции, мл; m — масса навески испытуемого сырья, г.
Конечная масса ВПС определена путем вычитания из массы ВПС, рассчитанной по формуле (2), массы флавоноидов, содержащихся в растворе ВПС, который получали из осадков ВПС после их растворения в 25 мл воды.
Для определения содержания пектиновых ве-ществ к полученному после извлечения ВПС шроту (высушивание в вытяжной системе в течение 3 сут) добавляли смесь растворов 5 г/л аммония оксалата и 5 г/л кислоты щавелевой (1:1, по объему) при соотношении сырья по массе и экстрагента по объему 1:20 (г:мл). Помещали на водяную баню WB-4 («Белаквилон», Республика Беларусь) при температуре 85 ºС на 2 ч. После остывания до комнатной температуры пробы фильтровали через ватный тампон, сырье и фильтр отжимали. Фильтр с остатками ЛРС прибавляли к оставшемуся шроту и использовали для дальнейшего извлечения суммы ГЦ А и Б после высушивания в вытяжной системе в течение 3 сут. Осаждение и расчет массовой доли ПВ проводили аналогично ВПС по формуле (2).
При определении содержания суммы гемицеллюлоз А и Б к полученному после извлечения ПВ шроту добавляли раствор 100 г/л натрия гидроксида при соотношении сырья по массе и экстрагента по объему 1:10 (г:мл). Экстракцию проводили в течение 12 ч при комнатной температуре, после чего фильтровали через ватный тампон, сырье и фильтр отжимали.
Из профильтрованных извлечений отбирали по три пробы объемом 10 мл в центрифужные пробирки, к каждой пробе добавляли 10 мл кислоты уксусной ледяной и осаждали полисахаридную фракцию трехкратным объемом 96% этилового спирта [16][17]. Центрифугировали при 5000 об./мин в течение 30 мин. Надосадочную жидкость фильтровали через стеклянный фильтр, к полученному осадку прибавляли 20 мл воды, 1,0 мл кислоты уксусной ледяной и 60 мл 96% этилового спирта. Повторно центрифугировали и фильтровали надосадочную жидкость. С осадком поступали аналогично тому, как описано в случае ВПС. Массовую долю суммы ГЦ А и Б определяли по формуле (2).
Статистическую обработку проводили при помощи компьютерной программы Microsoft Office Exсel 2016 (пакет «Анализ данных). Каждое испытание проводили три раза (n = 3). Результаты представляли в виде X ± ∆X, где X — среднее значение выборки; ∆X — полуширина доверительного интервала средней величины. Значения статистически значимо различались при p-значении (р) < 0,05. Сравнение вели с сырьем, не подвергавшемся предварительной обработке.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В таблице 1 представлены результаты определения содержания каротиноидов, флавоноидов и полисахаридных фракций календулы цветков на различных этапах предобработки. Содержание флавоноидов больше для ЛРС, прошедшего предварительную обработку путем экстракции гексаном, на 44,8% (отн.) (р = 0,0084) по сравнению с нативным ЛРС (табл. 1), что подтверждается спектрами поглощения, записанными в УФ- и видимой областях (рис. 1). Флавоноиды присутствовали во всех водных извлечениях, полученных как из нативного, так и предварительно обработанного сырья (рис. 2a).
Таблица 1. Содержание каротиноидов, флавоноидов и полисахаридных фракций календулы цветков при поэтапной предварительной обработке
Table 1. Content of carotenoids, flavonoids, and polysaccharide fractions in calendula flowers observed during stepwise pretreatment
Исследуемый объект Study object | Каротиноиды, % Carotenoids, % | Флавоноиды, % Flavonoids, % | Водорастворимые полисахариды, % Water-soluble polysaccharides (WSPs), % | Пектиновые вещества, % Pectic substances,% | Сумма гемицеллюлоз А и Б, % Sum of hemicelluloses A and B, % |
Нативное лекарственное растительное сырье Intact herbal drug | |||||
Водное извлечение Aqueous extract | Не обнаружено not detected | 3,59±0,12 | 14,10±0,13 | 17,36±0,18 | 12,37±0,20 |
Надосадочная жидкость Supernatant fluid | – | 1,86±0,53 | – | – | – |
Раствор водорастворимых полисахаридов WSP solution | – | 1,47±0,17 | – | – | – |
Лекарственное растительное сырье после удаления флавоноидов Herbal drug after removal of flavonoids | |||||
Водно-органическое извлечение Extract obtained using a water–organic solvent system | 0,40±0,015 | 4,42±0,62 | – | – | – |
Водное извлечение Aqueous extract | Не обнаружено not detected | 2,13±0,10 | 12,49±0,12 | 14,91±0,11 | 10,25±0,083 |
Надосадочная жидкость Supernatant fluid | – | 0,85±0,090 | – | – | – |
Раствор водорастворимых полисахаридов WSP solution | – | 0,15±0,0070 | – | – | – |
Лекарственное растительное сырье после предварительной экстракции гексаном и удаления флавоноидов Herbal drug after pre-extraction with hexane and removal of flavonoids | |||||
Водно-органическое извлечение Extract obtained using a water–organic solvent system | 0,20±0,028 | 6,39±0,31 | – | – | – |
Водное извлечение Aqueous extract | Не обнаружено not detected | 0,92±0,013 | 9,83±0,80 | 14,17±0,17 | 6,81±0,21 |
Надосадочная жидкость Supernatant fluid | – | 0,20±0,028 | – | – | – |
Раствор водорастворимых полисахаридов WSP solution | – | 0,11±0,01 | – | – | – |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. «–» — количественное определение для этих проб не проводили.
Note. –, no quantitative determination was performed for these samples.
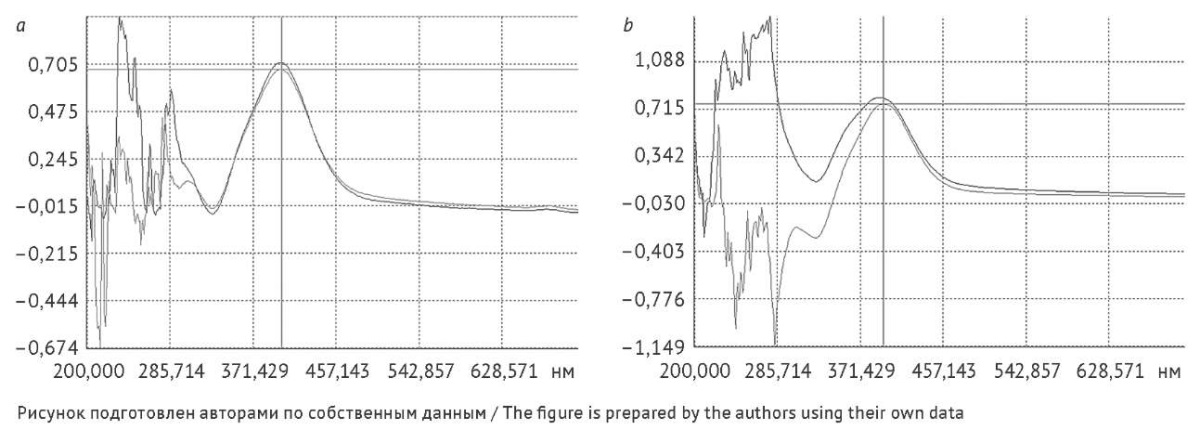
Рис. 1. Спектры поглощения, записанные при количественном определении флавоноидов в водно-органическом извлечении из календулы цветков. a — нативное сырье; b — сырье после предварительной экстракции гексаном
Fig. 1. Absorption spectra recorded during the quantification of flavonoids in extract of calendula flowers obtained using a water–organic solvent system: a, intact herbal drug; b, herbal after pre-extraction with hexane
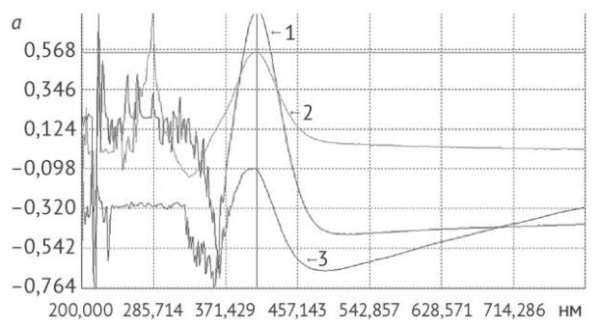
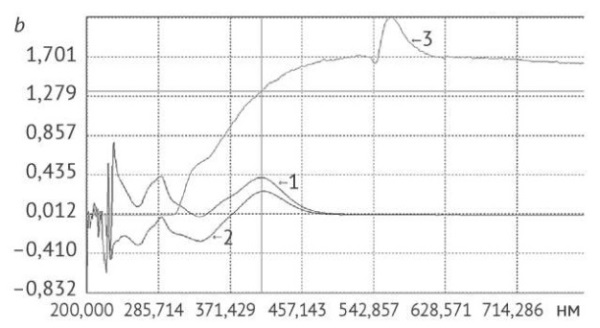
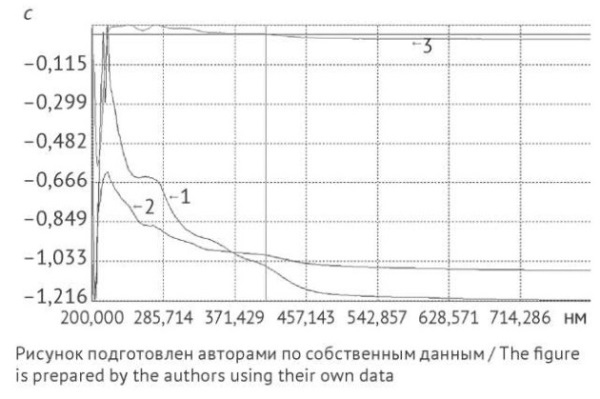
Рис. 2. Спектры поглощения, записанные при количественном определении флавоноидов в сырье календулы цветков: а — водное извлечение; b — надосадочная жидкость; с — раствор водорастворимых полисахаридов. 1 — без предварительной обработки; 2 — после удаления флавоноидов; 3 — после экстракции гексаном и удаления флавоноидов
Fig. 2. Absorption spectra recorded during the quantification of flavonoids in calendula flower herbal drug: a, aqueous extract; b, supernatant fluid; c, water-soluble polysaccharide solution. 1, without pretreatment; 2, after removal of flavonoids; 3, after pre-extraction with hexane and removal of flavonoids
Наиболее богато флавоноидами водное извлечение, полученное из нативного сырья; после предварительного удаления флавоноидов водно-органической экстракцией и ее сочетании с экстракцией гексаном содержание этих соединений снижалось на 68,5% (отн.) (р = 0,0053) и в два раза соответственно. Также флавоноиды присутствовали в надосадочной жидкости, которая получена после осаждения ВПС 96% этиловым спиртом и их отделении центрифугированием (рис. 2b).
Максимум поглощения при длине волны 409 нм, характерный для продукта химической реакции флавоноидов календулы с алюминия хлоридом, отсутствовал только в надосадочной жидкости после предварительного обезжиривания и удаления флавоноидов (рис. 2b). Содержание флавоноидов в надосадочной жидкости снижалось в ряду «сырье без предварительной обработки» –> «после удаления флавоноидов» –> «после предварительной экстракции гексаном с последующим удалением флавоноидов», при этом содержание в двух последних случаях уменьшалось в 2 и 9 раз соответственно по сравнению с нативным сырьем.
Осадки ВПС также содержали флавоноиды, что подтверждено их обнаружением в растворах ВПС (рис. 2c).
Больше всего флавоноидов обнаружено в растворе ВПС из ЛРС без предварительной обработки, что в 10 и 13 раз больше в сравнении с раствором «после удаления флавоноидов» и раствором, полученном при сочетании этого метода предобработки с экстракцией гексаном соответственно. Длина волны максимума поглощения раствора ВПС (325 нм) отличается от длины волны максимума поглощения рутина (365 нм) (рис. 3), что свидетельствует об удалении флавоноидов из осадка ВПС во время предварительной обработки сырья — экстракции гексаном и путем водно-органической экстракции, однако не исключает абсорбцию ВПС других веществ, поглощающих в УФ-области спектра (белки, простые фенолы и др.).
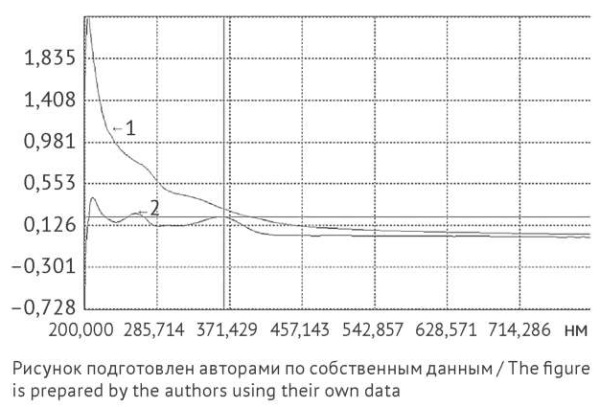
Рис. 3. Спектры поглощения: 1 — раствор водорастворимых полисахаридов из сырья после экстракции гексаном и удаления флавоноидов; 2 — раствор рутина
Fig. 3. Absorption spectra: 1, solutions of water-soluble polysaccharides from calendula flowers after extraction with hexane and removal of flavonoids; 2, rutin solution
При проведении дополнительных процедур предварительной обработки содержание флавоноидов увеличивалось при водно-органической экстракции и снижалось при водной экстракции в надосадочной жидкости и растворе ВПС, что указывало на повышение степени чистоты выделяемых ВПС. Это подтверждается тем, что при введении каждого дополнительного этапа предобработки ЛРС масса ВПС снижалась по сравнению с массой ВПС, полученных из нативного сырья, на 12,9% (отн.) (р = 0,083) и 43,4% (отн.) (р = 0,0072) при удалении флавоноидов и сочетании этого метода предобработки с экстракцией гексаном соответственно, то есть снижение массы ВПС происходило за счет удаления флавоноидов при предобработке и уменьшении их массы в осадке ВПС на 15,4% (отн.) (р = 0,065) и 49,6% (отн.) (р = 0,027) соответственно.
Согласно данным В.И. Дейнеки и соавт. [18], основными каротиноидами календулы являются лютео-, флаво- и рубиксантин (максимумы поглощения при 399, 422 и 448 нм), лютеин (446 и 474 нм), изомеры ликопина (463–472 нм), β-каротина (458–462 нм). Аналогичные максимумы поглощения отмечены на спектрах липофильных извлечений, полученных при экстракции гексаном (рис. 4). Спектры, приведенные на рисунке 4, совпадают со спектрами, полученными для гексановых вытяжек из календулы9 [19][20].
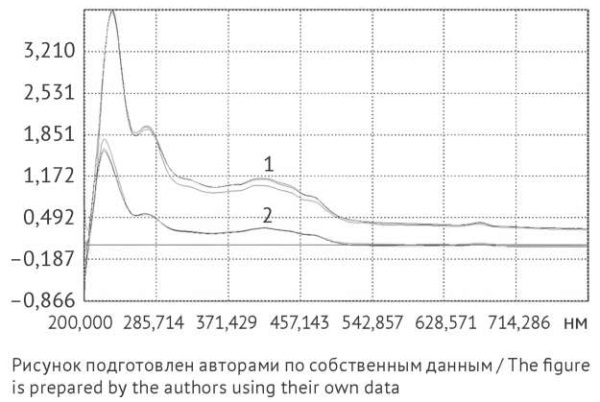
Рис. 4. Спектры поглощения липофильных извлечений из календулы цветков после экстракции гексаном: 1 — однократной; 2 — двукратной
Fig. 4. Absorption spectra of lipophilic extracts from calendula flowers: 1, after single hexane extraction; 2, after double hexane extraction
Каротиноиды определены только в липофильных вытяжках и водно-органических извлечениях (рис. 4) и не обнаружены в водных извлечениях вне зависимости от типа предварительной обработки. Предварительная экстракция гексаном снижала содержание каротиноидов при последующей водно-органической экстракции в два раза.
Из образцов, предварительно обработанных гексаном с/без последующей термической обработкой, удалялось в 5–7 раз больше каротиноидов, чем из образцов, обработанных термически с/без последующей экстракцией гексаном. Удаление гексана (отгонка) не влияло на содержание каротиноидов в образце, полученном при экстракции гексаном с/без последующей термической обработкой (р = 0,29), при термической обработке с/без экстракцией гексаном содержание каротиноидов снижалось (р = 0,037), что, предположительно, связано с двойным воздействием температуры: на этапах предобработки и отгонки гексана. Двукратная экстракция гексаном при всех примененных вариантах предобработки приводит к меньшему извлечению каротиноидов на 37,5–250% (отн.) (рис. 5а), чем однократная.
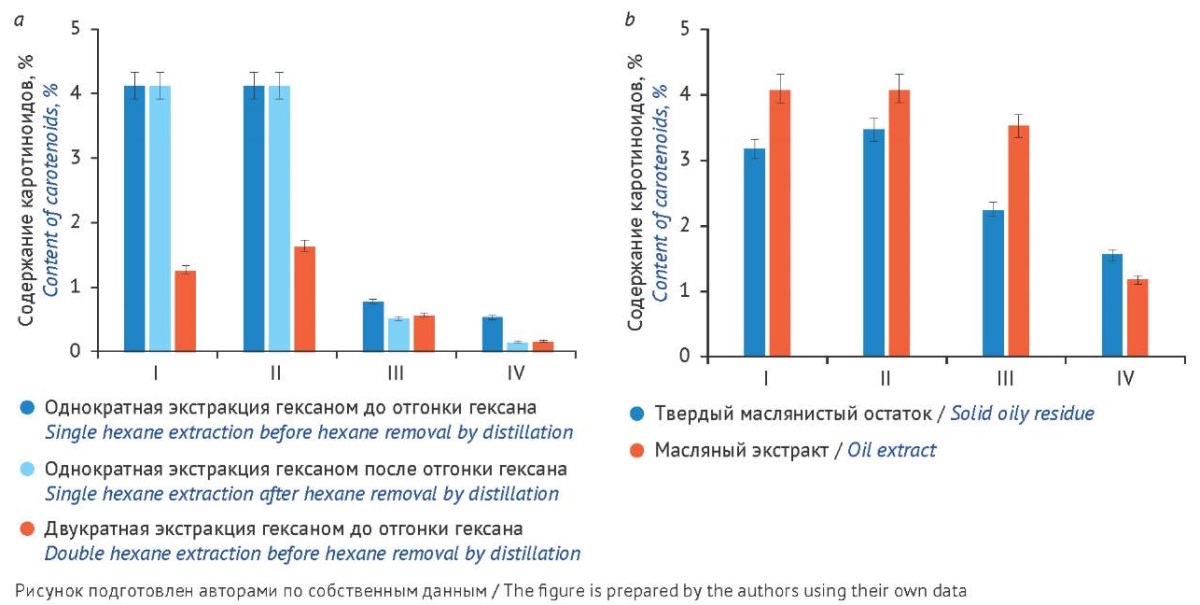
Рис. 5. Содержание каротиноидов в: а — гексановом извлечении, b — твердых маслянистых остатках и масляных экстрактах. Предварительная обработка сырья: I — экстракция гексаном; II — экстракция гексаном, затем термическая обработка; III — термическая обработка, затем экстракция гексаном; IV — термическая обработка
Fig. 5. Content of carotenoids: a, in hexane extracts; b, in solid oily residues and oil extracts. Herbal drug pretreatment: I, hexane extraction; II, hexane extraction followed by heating; III, heating followed by hexane extraction; IV, heating
Наибольшее содержание каротиноидов в твердом маслянистом остатке и масляном экстракте отмечено в случае образца, полученного при экстракции гексаном с/без последующей термической обработкой (р = 0,28 и 0,30 соответственно). Значимое на 41,2–250% снижение отмечено при термической обработке и ее комбинации с экстракцией гексаном (рис. 5b) по сравнению с образцами, полученными только с использованием экстракции гексаном.
Полисахариды календулы относятся к трем группам: водорастворимые полисахариды (31,25%), пектиновые вещества (9,67%), сумма гемоцеллюлоз А и Б (5,92% от массы ЛРС). В составе ВПС 31,25% сахаров восстанавливающего типа и 25,77% кислых сахаров. Моносахаридная фракция содержит глюкозу, арабинозу, галактозу, рамнозу, ксилозу и галактуроновую кислоту [21–23].
Для ВПС, полученных из нативного ЛРС, характерно темно-оранжевое окрашивание, более светлые оттенки характерны для ВПС после удаления флавоноидов с/без экстракцией гексаном (рис. 6a). Содержание ВПС снижалось при удалении флавоноидов и его комбинировании с экстракцией гексаном на 12,9% (р = 0,067) и 43,4% (р = 0,0048) по сравнению с нативным сырьем.
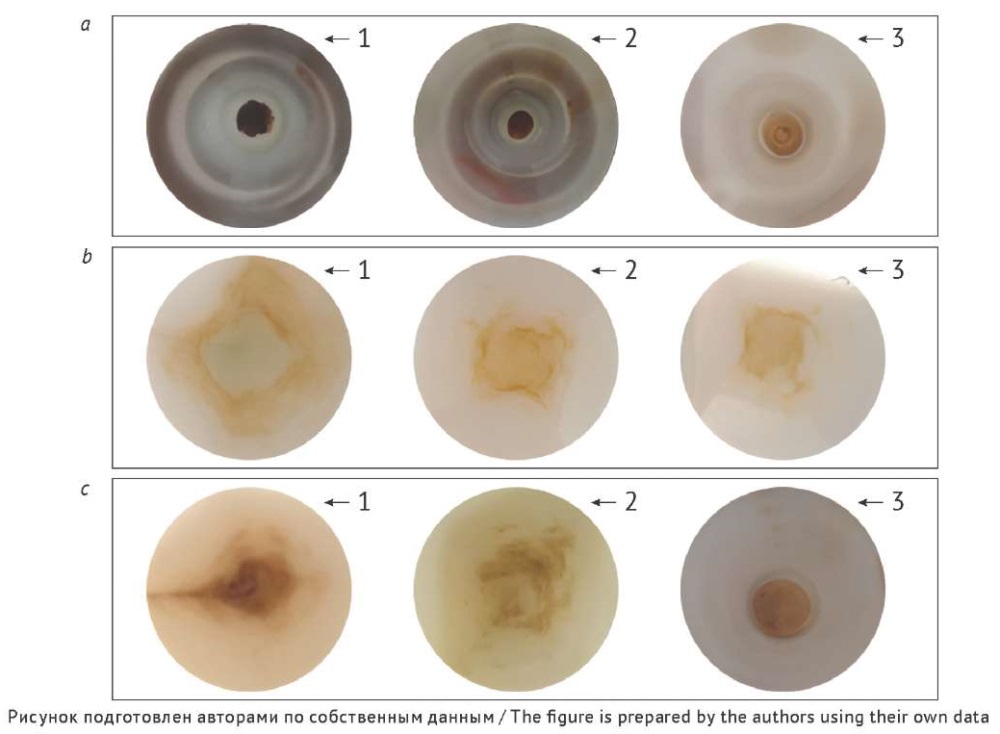
Рис. 6. Внешний вид образцов из сырья календулы цветков на часовом стекле: а — водорастворимые полисахариды; b — пектиновые вещества; c — гемицеллюлозы А и Б. 1 — без предварительной обработки; 2 — после удаления флавоноидов; 3 — после экстракции гексаном и удаления флавоноидов
Fig. 6. Appearance of samples obtained from calendula flowers: a, water-soluble polysaccharides; b, pectic substances; c, hemicelluloses A and B. 1, without pretreatment; 2, after removal of flavonoids; 3, after pre-extraction with hexane and removal of flavonoids
Окрашивание пектиновых веществ (светло-оранжевое) не зависело от способа предобработки (рис. 6b). В спектре поглощения растворов ПВ отмечены два максимума при длинах волн 285 и 325 нм (рис. 7), аналогичные максимумы отмечены в спектрах поглощения растворов ВПС (рис. 3). При предобработке содержание ПВ снижалось по сравнению с нативным сырьем на 16,4% (р = 0,047) в образцах после удаления флавоноидов и на 22,5% (р = 0,044) при дополнительной экстракции гексаном.
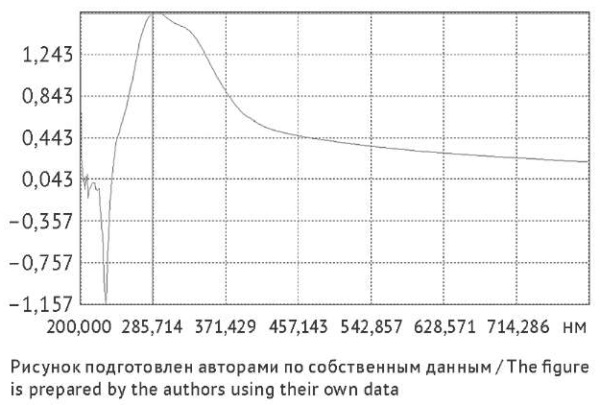
Рис. 7. Спектр поглощения пектиновых веществ из календулы цветков после экстракции гексаном и удаления флавоноидов
Fig. 7. Absorption spectrum of pectic substances from calendula flowers after pre-extraction with hexane and removal of flavonoids
Окрашивание образцов, содержащих гемицеллюлозу, было оранжевым независимо от способа предобработки (рис. 6с). Содержание суммы ГЦ А и Б ПВ снижалось по сравнению с нативным сырьем на 20,7% (р = 0,045) при введении этапа удаления флавоноидов и на 81,6% (р = 0,0031) при его комбинировании с экстракцией гексаном. При этом снижение содержания ГЦ А и Б происходило более резко, чем в случае ВПС.
Соотношение полисахаридных фракций по массе (ВПС:ПВ:сумма ГЦ А и Б) следующее:
- нативное ЛРС — 1,00:1,30:0,90 (суммарное содержание ПС фракций — 43,40±0,53%);
- ЛРС после удаления флавоноидов — 1,00:1,21:0,83 (суммарное содержание ПС фракций — 37,50±0,33%);
- ЛРС после предварительной экстракции гексаном с последующим удалением флавоноидов — 1,00:1,46:0,70 (суммарное содержание ПС фракций — 30,70±1,18%).
Соотношение ПС фракций имеет схожий профиль при разных способах предварительной обработки (р = 0,16), наименьшее количество при любом способе характерно для фракции ГЦ, наибольшее — для фракции ПВ. В меньшей степени снижалось содержание ПВ при увеличении циклов предобработки.
Суммарное содержание полисахаридных фракций снижалось при удалении флавоноидов с/без экстракцией гексаном на 15,7% (р = 0,046) и 41,3% (р = 0,024) соответственно по сравнению с нативным сырьем. Снижение массы ВПС, ПВ и ГЦ А и Б при увеличении циклов предобработки ЛРС может свидетельствовать о повышении степени чистоты выделяемых полисахаридных фракций за счет удаления флавоноидов, которые могут адсорбироваться на осадках полисахаридов.
Качественный состав флавоноидов при использовании всех рассматриваемых способов предобработки не изменялся (рис. 8. «Хроматограммы водно-органического извлечения из нативных (a), проэкстрагированных гексаном (b), термообработанных (c), проэкстрагированных гексаном, затем термообработанных (d) и термообработанных, затем проэкстрагированных гексаном (e) календулы цветков», опубликован на сайте журнала10).
ЗАКЛЮЧЕНИЕ
Разработан способ поэтапной обработки ЛРС «календулы цветки», позволяющий получить продукты, обогащенные конкретной группой БАВ. Предварительная экстракция (обезжиривание) слабополярным агентом (гексаном) позволяет по сравнению с нативным сырьем повысить выход флавоноидов на 68,5% при водно-органической экстракции, снижает их содержание при водной экстракции в надосадочной жидкости в два раза и растворе водорастворимых полисахаридов практически в десять раз, повышает чистоту выделенных полисахаридных фракций: водорастворимых полисахаридов на 43,4%, пектиновых веществ на 22,5% и гемицеллюлозы на 81,6%. Липофильные вытяжки могут быть использованы для получения сухих и масляных экстрактов, в которых содержание каротиноидов сопоставимо с их содержанием в самом сырье. Соотношение полисахаридных фракций не меняется при всех примененных способах обработки.
Таким образом, для повышения эффективности использования ЛРС и получения нескольких продуктов с разными фармакологическими свойствами можно предложить следующий способ поэтапной обработки календулы цветков: экстракция сырья гексаном с получением липофильных вытяжек, обогащенных каротиноидами; водно-органическая экстракция с получением извлечений, обогащенных флавоноидами, и водная экстракция, дающая возможность получить полисахариды высокой степени чистоты, что выгодно отличает предложенный способ от существующих в странах ЕАЭС одноэтапных способов получения фракций биологически активных веществ.
Дополнительная информация. На сайте журнала «Регуляторные исследования и экспертиза лекарственных средств» размещен рисунок 8.
https://doi.org/10.30895/1991-2919-2024-634-fig8
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Р.И. Лукашов — выполнение экспериментальных работ, оформление результатов, написание текста рукописи; Н.С. Гурина — постановка цели работы, методическое руководство выполнением экспериментальной работы, обсуждение результатов.
Additional information. Figure 8 is available on the website of Regulatory Research and Medicine Evaluation.
https://doi.org/10.30895/1991-2919-2024-634-fig8
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Raman I. Lukashou conducted experiments, presented the results, and drafted the manuscripT. Natalia S. Gurina set the aim for the work, provided methodological guidance for the experiments, and participated in discussions of the results.
1. Государственный реестр лекарственных средств. https://rceth.by/Refbank/reestr_lekarstvennih_sredstv
2. Кащенко НИ. Фитохимическое исследование и совершенствование методов стандартизации цветков и травы календулы лекарственной (Calendula officinalis L.): автореф. дис. ... канд. фарм. наук. Улан-Удэ; 2014.
3. Дзаурова ММ. Получение и исследование водного экстракта в условиях малоотходной технологии переработки цветков ноготков и его лекарственных форм: автореф. дис. ... канд. фарм. наук. Курск; 2007.
4. Бурцева ИВ. Фармакогностическое изучение шрота цветков ноготков после получения настойки: автореф. дис. ... канд. фарм. наук. Пермь; 2004.
5. WHO monographs on selected medicinal plants. V. 2. Malta; 2002.
6. Дёмин МС. Разработка технологии получения и изучение состава липофильных метаболитов плодов Calendula officinalis (L.) и Echinacea purpurea (L.): автореф. дис. ... канд. фарм. наук. М.; 2010.
7. Assessment report for the development of community herbal monographs and for inclusion of herbal substance(s), preparation(s) or combinations thereof in the community lisT. https://www.ema.europa.eu/docs/en_GB/document_library/Herbal_HMPC_assessment_report/2009/12/12/WC500018122.pdf
8. Фармакопейная статья 01/2013:РБ0002. Настои, отвары и чаи. Государственная фармакопея Республики Беларусь. 2-е изд. Т. 1. 2012.
9. Афанасьева ПВ. Комплексное фармакогностическое исследование календулы лекарственной (Calendula officinalis L.): автореф. дис. ... канд. фарм. наук. Самара; 2017.
10. https://doi.org/10.30895/1991-2919-2024-634-fig8
Список литературы
1. Сайбель ОЛ. Принцип комплексного использования растительного сырья как инструмент ресурсосберегающих технологий получения лечебных и профилактических средств. Вопросы биологической, медицинской и фармацевтической химии. 2021;24(12):3–10. https://doi.org/10.29296/25877313-2021-12-01
2. Куркин ВА, Запесочная ГГ, Авдеева ЕВ, Правдивцева ОЕ, Браславский ВБ, Куркина АВ и др. Создание ресурсосберегающих технологий переработки лекарственного растительного сырья. Известия Самарского научного центра Российской академии наук. 2010;12(1–3):737–40. EDN: NDXVAJ
3. Афанасьева ПВ, Куркина АВ. Перспективы комплексного использования сырья календулы лекарственной (Calendula officinalis L.). Известия Самарского научного центра Российской академии наук. 2014;16(5):980–2. EDN: RPEGPO
4. Бурцева ИВ, Левинова ВФ, Саладовникова ВН. Органические кислоты шрота цветков ноготков. Вестник Пермской государственной фармацевтической академии. 2007;(2):220–3.
5. Palmieri B, Vadala’ M, Laurino C. New vaginal gel for female genital wellness and disease prevention: rationale of a multi-herbal derived treatment on a high-tech pharmaceutical perspective. AJPCT. 2016;4(1):1–18.
6. Chandra P, Kishore K, Ghosh AK. Evaluation of antacid capacity and antiulcer activity of Calendula officinalis L. in experimental rats. Orient Pharm Exp Med. 2015;15:277–85. https://doi.org/10.1007/s13596-015-0195-5
7. Воскресенская МЛ, Плеханов АН, Мондодоев АГ, Цыремпилов СВ. Фармакотерапевтическая эффективность календулы лекарственной. Вестник Бурятского государственного университета. Медицина и фармация. 2017;(1):73–8. EDN: VKTTXY
8. Лукашов РИ. Обезжиривание календулы цветков как способ повышения экстракции флавоноидов. Вестник фармации. 2022;(1):48–56. EDN: LVPKJW
9. Лукашов РИ. Влияние природы и концентрации органических экстрагентов на извлечение флавоноидов из календулы цветков. Вестник Витебского государственного медицинского университета. 2018;17(5):109–23. https://doi.org/10.22263/2312-4156.2018.5.109
10. Лукашов РИ, Гурина НС. Уточнение объемной доли органических растворителей, используемых для экстракции флавоноидов из календулы цветков. В кн.: Инновационные технологии в фармации. Иркутск; 2022. С. 86–90 (In Russ.). EDN: RPMFWT
11. Тринеева ОВ, Сливкин АИ, Сафонова ЕФ. Определение гидроксикоричных кислот, каротиноидов и хлорофилла в листьях крапивы двудомной (Urtica dioica L.). Химия растительного сырья. 2015;(3):105–10. EDN: VEJQGX
12. Моисеев ДВ, Шелюто ВЛ, Бузук ГН. Идентификация флавоноидов в растениях методом ВЭЖХ. Химико-фармацевтический журнал. 2011;45(1):35–8. https://doi.org/10.30906/0023-1134-2011-45-1-35-38
13. Бубенчиков РА. Фенольные соединения и полисахариды фиалки собачьей. Вестник ВГУ. Серия: Химия. Биология. Фармация. 2004;(1):156–9. EDN: OITHVF
14. Bueno da Silva DP, Ferreira Florentino I, da Silva Moreira L, Ferreira Brito A, Vale Carvalho V, Ferreira Rodrigues M. Chemical characterization and pharmacological assessment of polysaccharide free, standardized cashew gum extract (Anacardium occidentale L.). J Ethnopharmacol. 2018;213:395–402. https://doi.org/10.1016/j.jep.2017.11.021
15. Makio M. Polysaccharides of soybean seeds: Part I. Polysaccharide constituents of “hot-water-extract” fraction of soybean seeds and an arabinogalactan as its major component. Agric Biol Chem. 1965;29(6):564–73. https://doi.org/10.1080/00021369.1965.10858424
16. Ананьина НА, Андреева ОА, Оганисян ЭТ. Полисахариды клубней георгины простой (Dahlia single L.). Химия растительного сырья. 2008;(2):135–6. EDN: JSIRCP
17. Bian J, Peng F, Peng P, Xu F, Sun R-C. Isolation and fractionation of hemicelluloses by graded ethanol precipitation from Caragana korshinskii. Carbohydr Res. 2010;345(6):802–9. https://doi.org/10.1016/j.carres.2010.01.014
18. Дейнека ВИ, Гостищев ИА, Третьяков МЮ, Индина ИВ. Каротиноиды лепестков цветков календулы. Научные ведомости Белгородского государственного университета. Серия: Естественные науки. 2011;(15–2):277–85. EDN: RYLTDP
19. Афанасьева ПВ, Куркин ВА, Куркина АВ. Оптимизация подходов к стандартизации фитопрепаратов на основе календулы лекарственной. Известия Самарского научного центра Российской академии наук. 2015;17(5–3):930–4. EDN: WFCBEF
20. Смирнова АН, Швыдкий ВО, Шишкина ЛН. Физико-химические свойства и состав липидов цветков календулы и плодов облепихи. Химическая физика. 2021;40(7):43–8. https://doi.org/10.31857/S0207401X21070104
21. Корж АП, Гурьев АМ, Белоусов МВ, Юсубов МС, Белянин МЛ. Состав водорастворимых полисахаридов из цветков Calendula officinalis L. 2012;12(4):23–5. EDN: TMRBFF
22. Сычев ИА, Кокина ДГ, Ванина ДС. Влияние полисахарида календулы на изменение состава белой крови крыс и структуру лимфоидных органов в норме и при анемии. Достижения науки и образования. 2024;(1):10–6. EDN: ZTENCX
23. Сироткина ДС, Сычев ИА, Черданцева ТМ, Колосова ТЮ. Действие полисахарида цветков календулы на кровь и кроветворение. Современная наука: актуальные проблемы теории и практики. Серия: Естественные и технические науки. 2022;(3):212–7. EDN: RDVKSK
Об авторах
Р. И. ЛукашовБеларусь
Лукашов Роман Игоревич, канд. фарм. наук, доцент
пр-т Дзержинского, 83, Минск, 220083, Республика Беларусь
Н. С. Гурина
Беларусь
Гурина Наталия Сергеевна, д-р биол. наук, профессор
пр-т Дзержинского, 83, Минск, 220083, Республика Беларусь
Дополнительные файлы

|
1. Рис. 8. Хроматограммы водно-органического извлечения из сырья календулы цветков, подвергнутого предобработке: а — без предобработки (нативные); b — экстракция гексаном; с — термообработка; d — экстракция гексаном с последующей термообработкой; e — термообработка с последующей экстракцией гексаном. 1 — тифанеозид; 2 — мангаслин; 3 — рутин; 4 — изокверцитрин; 5 — нарциссин; 6 — изорамнетина 3-глюкозид | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(2MB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Лукашов Р.И., Гурина Н.С. Календулы цветки (Calendulae officinalis flos): методы выделения фракций биологически активных веществ. Регуляторные исследования и экспертиза лекарственных средств. 2024;14(6):707-719. https://doi.org/10.30895/1991-2919-2024-634
For citation:
Lukashou R.I., Gurina N.S. Calendula Flowers (Calendulae officinalis flos): Methods to Obtain Fractions of Biologically Active Substances. Regulatory Research and Medicine Evaluation. 2024;14(6):707-719. (In Russ.) https://doi.org/10.30895/1991-2919-2024-634



































