Перейти к:
Пирролизидиновые алкалоиды растений семейства Boraginaceae и оценка безопасности их применения по критерию острой токсичности
https://doi.org/10.30895/1991-2919-2025-15-6-701-711
Резюме
ВВЕДЕНИЕ. Растения семейства бурачниковые (Boraginaceae) Pulmonaria mollis, Nonea rossica, Onosma simplicissima и Cynoglossum officinale широко распространены на территории Российской Федерации и могут являться источниками лекарственных средств, обладающих противомикробными, противоанемическими, антикоагулянтными свойствами. В настоящее время данные растения не являются официнальными, что
может быть связано с содержанием в них пирролизидиновых алкалоидов, способных вызывать гепатотоксические эффекты.
ЦЕЛЬ. Оценка безопасности применения растений семейства Boraginaceae по критерию острой токсичности и содержанию пирролизидиновых алкалоидов.
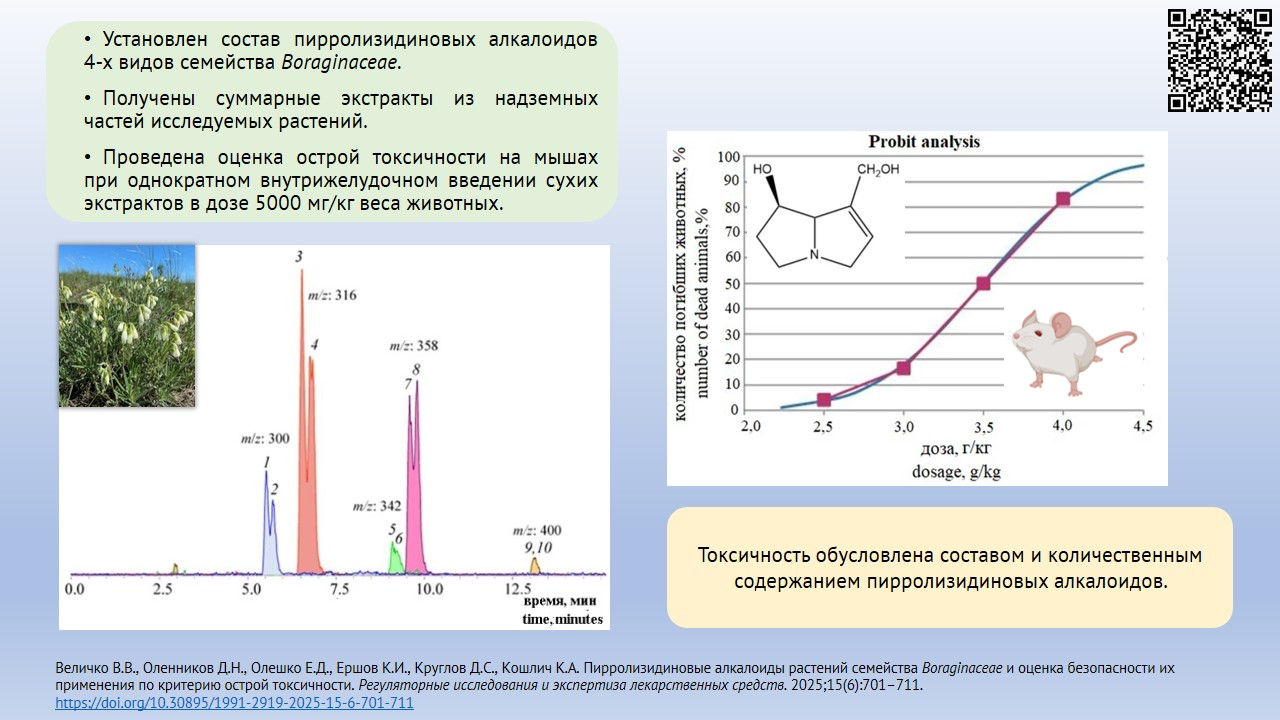
МАТЕРИАЛЫ И МЕТОДЫ. В качестве объектов исследования использовали высушенные надземные части растений Pulmonaria mollis, Nonea rossica, Onosma simplicissima и Cynoglossum officinale, заготовленные в период цветения. Состав и содержание алкалоидов в спиртовых извлечениях определяли методом высокоэффективной жидкостной хроматографии с диодно-матричным и масс-спектрометрическим детектированием с ионизацией электрораспылением. Определение острой токсичности проводили на 102 половозрелых мышах обоего пола стока CD-1 весом 24,0±2,0 г в возрасте 12 нед., полученных из ЦКП «Виварий конвенциональных животных» ФГБНУ ФИЦ ИЦиГ СО РАН. Животным однократно внутрижелудочно вводили сухие экстракты изучаемых видов сырья, растворенные в дистиллированной воде, в дозе 5 г/кг.
РЕЗУЛЬТАТЫ. Установлено отсутствие пирролизидиновых алкалоидов в траве P. mollis, наличие их следовых количеств (0,01 мкг/г) в листьях P. mollis. В других изученных видах растений обнаружены пирролизидиновые алкалоиды — энантиомеры интермедина и ликопсамина и их производные: в траве O. simplicissima — 1,07±0,03 мкг/г, в траве N. rossica — 8,25±0,08 мкг/г, в траве C. officinale — 676,3±7,4 мкг/г. По результатам оценки острой токсичности сухие экстракты из травы и листьев P. mollis, травы N. rossica и травы O. simplicissima отнесены к 5 классу токсичности, экстракт из травы C. officinale — к 4 классу токсичности.
ВЫВОДЫ. Извлечения из травы и листьев P. mollis в исследуемых дозах являются нетоксичными, для извлечений из травы O. simplicissima и N. rossica необходимо проведение дальнейших исследований для определения токсичности при длительном применении. Извлечения из травы C. officinale токсичны и не могут использоваться для внутреннего применения.
Ключевые слова
Для цитирования:
Величко В.В., Оленников Д.Н., Олешко Е.Д., Ершов К.И., Круглов Д.С., Кошлич К.А. Пирролизидиновые алкалоиды растений семейства Boraginaceae и оценка безопасности их применения по критерию острой токсичности. Регуляторные исследования и экспертиза лекарственных средств. 2025;15(6):701-711. https://doi.org/10.30895/1991-2919-2025-15-6-701-711
For citation:
Velichko V.V., Olennikov D.N., Oleshko E.D., Yershov K.I., Kruglov D.S., Koshlich K.A. Pyrrolizidine Alkaloids of Boraginaceae Family and Safety Assessment of Acute Toxicity. Regulatory Research and Medicine Evaluation. 2025;15(6):701-711. (In Russ.) https://doi.org/10.30895/1991-2919-2025-15-6-701-711
ВВЕДЕНИЕ
Семейство бурачниковые (Boraginaceae), по данным Angiosperm Phylogeny Group IV (APG IV) (цит. по [1]), объединяет 90 родов и насчитывает около 1700 видов растений, произрастающих по всему миру, в основном в Европе и Азии. Растения данного семейства содержат нафтохиноны, флавоноиды, терпеноиды, фенилпропаноиды и другие биологически активные соединения [1–3], обладающие различными видами фармакологической активности, в том числе противомикробной, противовирусной, противовоспалительной, антиагрегантной [4][5]. Изучение растений семейства Boraginaceae является актуальным с точки зрения возможности их применения в фармакологии и косметологии.
На территории Западной Сибири встречаются представители нескольких триб семейства Boraginaceae, которые имеют обеспеченную сырьевую базу [6]. Из представителей трибы Boragineae широкое распространение имеют медуница мягкая (Pulmonaria mollis Wulf. ex Hornem.) и нонея русская (Nonea rossica Steven), из трибы Lithospermeae — оносма простейшая (Onosma simplicissima L.), из трибы Cynoglossinae — чернокорень лекарственный (Cynoglossum officinale L.) [7][8]. Растения рода Pulmonaria используют в народной и доказательной медицине ряда стран в качестве противовоспалительных и отхаркивающих средств [9]. Представители рода Nonea оказывают антикоагулянтное [10], противовоспалительное, противомикробное, противогрибковое действие, ингибируют ацетилхолинэстеразу [11]. Растения рода Onosma применяют в качестве противовоспалительных, противомикробных и антиоксидантных средств [12]. C. officinale также используют в народной медицине: извлечения из корней — чаще наружно в качестве кровоостанавливающего, антибактериального, обезболивающего и противовоспалительного средства, настой травы или спиртовую настойку принимают внутрь при заболеваниях желудочно-кишечного тракта, кашле, кровохаркании, гнойных инфекциях и мышечных судорогах. В гомеопатии используется извлечение из свежего цветущего растения при диарее, судорогах и суставных болях [10][13].
Для растений семейства бурачниковые характерно накопление пирролизидиновых алкалоидов (ПА), потенциально оказывающих токсическое действие на организм [10]. По химической природе ПА делят на 4 группы: ретронецин (I), гелиотридин (II), отонецин (III) и платинецин (IV). Структура и количественное содержание алкалоидов у разных представителей семейства Boraginaceae варьирует в широком диапазоне [14], что, в свою очередь, определяет степень выраженности токсических проявлений или их отсутствие.

Наличие алкалоидов в C. officinale является основанием запрета использовать все части растения в составе биологически активных добавок к пище1. Известны случаи гибели сельскохозяйственных животных при поедании C. officinale [15], что связано с высоким содержанием в различных частях растения ПА подгруппы гелиотридина [10][16–18]. В то же время траву бурачника лекарственного (Borago officinalis L.) в некоторых странах выращивают как овощную культуру и широко используют в пищу [19].
В настоящее время P. mollis, N. rossica, O. simplicissima и C. officinale в Российской Федерации не являются официнальными видами. Тем не менее для этих и некоторых других представителей семейства бурачниковые проведены фитохимические исследования, определены различные метаболиты [4][20], представляющие интерес как биологически активные соединения, установлены их фармакологические свойства [5]. Выбранные для изучения растения по данным скрининговых исследований [21] представляют интерес для разработки новых фитопрепаратов. Вместе с тем наличие характерных для этого семейства ПА, которые могут оказывать гепатотоксическое действие [22], свидетельствует о необходимости предварительной оценки токсикологических исследований.
Цель работы — оценка безопасности применения растений семейства Boraginaceae по критерию острой токсичности и содержанию пирролизидиновых алкалоидов.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы
Лекарственное растительное сырье. В качестве объектов исследования (табл. 1) были выбраны высушенные надземные части P. mollis, N. rossica, O. simplicissima и C. officinale, заготовленные в период цветения и вегетации производящих растений на территории Новосибирской области в 2023–2024 гг.
Таблица 1. Характеристика источников лекарственного растительного сырья
Table 1. Herbal raw material sources
|
Наименование сырья Herb raw material |
Дата сбора, фенофаза Date of collection, phenophase |
Место произрастания Place of growth |
||
|
Описание Description |
Координаты Coordinates |
|||
|
Широта Latitude |
Долгота Longitude |
|||
|
Медуницы мягкой трава Pulmonarie mollis herba |
15.05.2024 цветение flowering |
Под пологом березового колка в окрестностях д. Козловка Венгеровского р‑на Новосибирской обл. Novosibirsk region, Vengerovo district, surroundings of Kozlovka village, birch grove |
55°60' |
76°94' |
|
Медуницы мягкой листья Pulmonarie mollis folia |
20.07.2024 вегетация vegetation |
Под пологом березового колка в окрестностях д. Козловка Венгеровского р‑на Новосибирской обл. Novosibirsk region, Vengerovo district, surroundings of Kozlovka village, birch grove |
55°60' |
76°94' |
|
Нонеи русской трава Noneae rossicae herba |
18.07.2023 цветение flowering |
Остепненный луг в окрестностях с. Воробьево Колыванского р‑на Новосибирской обл. Novosibirsk region, Kolyvan district, surroundings of Vorobyevo village, steppe meadow |
55°31' |
82°57' |
|
Оносмы простейшей трава Onosmae simplicissimae herba |
28.06.2023 цветение flowering |
Каменистый склон реки Шипуниха в 1,5 км на восток от ж/д станции Ложок Искитимского р‑на Новосибирской обл. Novosibirsk region, Iskitim district, 1.5 km to the east of Lozhok railway station, rocky slope of the Shipunikha river |
54°34' |
83°21' |
|
Чернокорня трава Cynoglossi officinali herba |
28.06.2023 цветение flowering |
Обочина проселочной дороги в 1,5 км на восток от ж/д станции Ложок Искитимского р‑на Новосибирской обл. Novosibirsk region, Iskitim district, 1.5 km to the east of Lozhok railway station, country roadside |
54°34' |
83°21' |
Таблица составлена авторами по собственным данным / The table was prepared by the authors using their own data
Приготовление экстракта. Сухие экстракты получали в соответствии с подобранными ранее технологическими параметрами [23][24]: сырье измельчали до частиц размера 3 мм, помещали в колбу и заливали 70% спиртом этиловым в соотношении 1:20 (г:мл). Колбу с присоединенным обратным холодильником выдерживали на водяной бане при температуре 55 °С 60 мин, охлаждали при непрерывном перемешивании в течение 60 мин. После охлаждения экстракт фильтровали, удаляли экстрагент конвективной сушкой при температуре 30–40 °С.
Стандартные образцы. Реактивы производства BioCrick Co., Ltd. (Китай): 7-ацетилликопсамин (кат. № BCN2000, ≥98%), N-оксид 7-О-ацетилликопсамина (кат. № BCN8935, ≥98%); реактивы по каталогу Sigma-Aldrich: ликопсамин (кат. № PHL89726, ≥95%), N-оксид ликопсамина (кат. № PHL83447, ≥90%); реактивы производства MedChemExpress (США): интермедин (кат. № HY-113845, ≥99,0%), интермедин N-оксид (кат. № HY-W707957, ≥99,0%); реактивы производства ChemFaces (Китай): N-оксид виридифлорина (кат. № CFN00337, ≥98,0%), 7’-ацетил-интермедин (кат. № CFN00286, ≥98,0%), 7’-ацетил-интермедин N-оксид (кат. № CFN00518, ≥98,0%).
Лабораторные животные. Определение острой токсичности проводили на 102 половозрелых мышах стока CD-1: самцах весом 25±2 г и самках весом 23±2 г в возрасте 12 нед., полученных из ЦКП «Виварий конвенциональных животных» ФГБНУ ФИЦ Институт цитологии и генетики (ИЦиГ) СО РАН (г. Новосибирск).
Животные находились в стандартных условиях вивария на обычном пищевом рационе и свободном доступе к воде и корму. Условия содержания и манипуляции с животными соответствовали стандартам, установленным в нормативных документах, регламентирующих работу с лабораторными животными2. Протокол исследования (№ 162 от 28.11.2024) согласован комитетом по этике ФГБОУ ВО «Новосибирский государственный медицинский университет» (НГМУ) Минздрава России.
Методы
Хроматографическое исследование. Состав и количественное содержание алкалоидов в экстрактах определяли методом высокоэффективной жидкостной хроматографии с масс-спектрометрической детекцией-ионизацией электрораспылением (ВЭЖХ-ИЭР-МС). Анализ осуществляли на хроматомасс-спектрометре, оснащенном ВЭЖХ системой LC-20 Prominence (Shimadzu, США), масс-спектрометрическим детектором с тройным квадрупольным масс-анализатором LCMS-8050 (Shimadzu, США; ИЭР-МС) и колонкой ReproSil-Pur 120 C18-AQ (250×4,6×5 мм; Dr. Maisch GmbH, Германия).
Условия ВЭЖХ: подвижная фаза, элюент A — вода, элюент В — ацетонитрил; программа градиента — 0–20 мин 2–80% B, 20–30 мин 80–100% B, 30–35 мин 100% B, 35–40 мин 100–2% B; инжектируемый объем — 1 мкл; скорость потока — 1 мл/мин, температура колонки — 30°C. Условия ИЭР-МС: режим ионизации — электрораспыление, положительная ионизация; температура интерфейса — 300°C; температура линии десольватации — 250°C; температура нагревательного блока — 400°C; скорость газа-распылителя (азот) — 3 л/мин; скорость газа-нагревателя (воздух) — 10 л/мин; давление газа (Ar), используемого для диссоциации, индуцируемой соударением — 270 кПa; скорость Ar — 0,3 мл/мин; напряжение на капилляре — 3 кВ; диапазон сканирования масс (m/z) 100–1900.
Количественный анализ индивидуальных соединений проводили, как описано ранее [25], для этого серию растворов (1–100 мкг/мл) веществ сравнения (ликопсамин, ликопсамин N-оксид, 7'-ацетил-ликопсамин, 7'-ацетил-ликопсамин N-оксид, интермедин, интермедин N-оксид, 7'-ацетил-интермедин, 7'-ацетил-интермедин N-оксид, виридифлорин N-оксид) хроматографировали в описанных выше условиях трижды для каждой концентрации вещества.
Градуировочные графики строили в координатах «концентрация соединения, мкг/мл — площадь масс-спектрометрического пика соединения в режиме регистрации выделенного иона (соответствует величине m/z протонированного иона [M+H]+, см. табл. 2), усл. ед.». с применением пакета программ Advanced Grapher v.2.2 (Alentum Software, Inc., США). Данные были представлены в виде среднего значения в серии из пяти определений.
Таблица 2. Количественный состав пирролизидиновых алкалоидов в надземных частях некоторых растений
Table 2. Quantitative composition of pyrrolizidine alkaloids in herbs of certain plants
|
Соединения Compounds |
[M+H]+ |
Уровень идентификации* Identification level |
Содержание пирролизидиновых алкалоидов, мкг/г воздушно-сухого сырья (M±SD) Content of pyrrolizidine alkaloids, mg/g of air-dried raw material (M±SD) |
||||
|
Pulmonaria mollis |
Onosma simplicissima трава herb |
Nonea rossica трава herb |
Cynoglossum officinale трава herb |
||||
|
трава herb |
листья leaves |
||||||
|
Интермедин Intermedine |
300 |
1 |
– |
– |
– |
0,34±0,01 |
35,64±0,70 |
|
Ликопсамин Lycopsamine |
300 |
1 |
– |
– |
0,25±0,01 |
0,19±0,01 |
22,83±0,44 |
|
Виридифлорин N-оксид Viridiflorine N-oxide |
302 |
1 |
– |
– |
0,07±0,01 |
– |
3,29±0,07 |
|
Интермедин N-оксид Intermedine N-oxide |
316 |
1 |
– |
– |
– |
2,52±0,05 |
206,04±4,33 |
|
Ликопсамин N-оксид Lycopsamine N-oxide |
316 |
1 |
– |
0,01±0,01 |
0,74±0,02 |
2,20±0,04 |
285,39±5,73 |
|
7'-Ацетил-интермедин 7'-Acetyl-intermedine |
342 |
1 |
– |
– |
– |
0,04±0,01 |
1,67±0,03 |
|
7'-Ацетил-ликопсамин 7'-Acetyl-lycopsamine |
342 |
1 |
– |
– |
0,01±0,01 |
0,03±0,01 |
8,22±0,17 |
|
7'-Ацетил-интермедин N-оксид 7'-Acetyl-intermedine N-oxide |
358 |
1 |
– |
– |
– |
1,48±0,03 |
54,67±1,08 |
|
7'-Ацетил-ликопсамин N-оксид 7'-Acetyl-lycopsamine N-oxide |
358 |
1 |
– |
– |
– |
1,45±0,03 |
55,28±1,14 |
|
3,7'-Диацетил-интермедин N-оксид 3,7'-Diacetyl-intermedine N-oxide |
400 |
2 |
– |
– |
– |
<0,01 |
2,32±0,04 |
|
3,7'-Диацетил-ликопсамин N-оксид 3,7'-Diacetyl-lycopsamine N-oxide |
400 |
2 |
– |
– |
– |
<0,01 |
0,93±0,02 |
|
Суммарное содержание Total content |
– |
0,01±0,01 |
1,07±0,03 |
8,25±0,08 |
676,3±7,4 |
||
Таблица составлена авторами по собственным данным / The table was prepared by the authors using their own data
Примечание. «–» — не обнаружено.
* 1 — идентифицированное соединение после анализа данных УФ-, масс-спектрометрии в сравнении со спектрами стандартного образца полученного в тех же условиях соединения; 2 — соединения, идентифицированные путем сравнения данных УФ- и масс-спектров с данными справочной литературы.
Notes. –, not found.
* level of identification: (1) compound identified after UV analysis and mass spectrometry in comparison with the reference compound spectra registered in the same conditions; (2) compound identified by comparison of UV and mass spectra with the reference database.
Количественный анализ 3,7'-диацетил-интермедин N-оксида и 3,7'-диацетил-ликопсамин N-оксида проводили с использованием внешних веществ сравнения — 7'-ацетил-интермедин N-оксида и 7'-ацетил-ликопсамин N-оксида соответственно. Расчет содержания 3,7'-диацетил-интермедин N-оксида и 3,7'-диацетил-ликопсамин N-оксида осуществляли с использованием поправочного коэффициента (k = 1,117), учитывающего разницу в молекулярных массах ди- и моноацетатов ПА.
Изучение острой токсичности. Объектами исследования при определении острой токсичности служили сухие экстракты из травы и листьев P. mollis, травы N. rossica, O. simplicissima и C. officinale.
Лабораторных животных разделяли на 10 групп по 6 животных с учетом пола, возраста, массы тела и принципа рандомизации; для проведения пробит-анализа формировали 7 групп по 6 животных в каждой. Дозирование экстрактов проводили в мг/кг массы тела экспериментальных животных. Введение сухого экстракта осуществляли однократно внутрижелудочно в максимально возможной общей дозе 5 г на 1 кг массы тела животных. Сухой экстракт растворяли в дистиллированной воде для получения раствора с концентрацией 0,6 г/мл, объем введения составил 0,17 мл на 20 г массы животного.
При оценке острой токсичности сухих экстрактов из травы и листьев P. mollis, травы N. rossica, O. simplicissima и C. officinale учитывали общее состояние мышей (поведение, внешний вид, двигательная активность, потребление пищи и воды, реакция на внешние раздражители, масса тела), характер клинических проявлений интоксикации, возможный летальный исход3. Время непрерывного наблюдения для выявления первых признаков острой токсичности составляло 8 ч сразу после введения экстрактов. Затем наблюдение продолжалось в течение 14 сут регулярно в дневное время, принимая во внимание нормальный циркадный ритм животного. В качестве параметров острой токсичности рассматривали изменение общего состояния и внешнего вида животных, массы тела на 14 сут после введения препарата, число павших и выживших животных, продолжительность жизни.
В случае гибели животных проводили дополнительные исследования c помощью пробит-анализа по методу В.Б. Прозоровского в компьютерной программе StatPlus с определением основных летальных доз (ЛД): ЛД10, ЛД50, ЛД90 [26] и морфологическое исследование внутренних органов.
Гистологическое исследование препаратов печени павших животных проводили с использованием микроскопа Nikon Eclipse 200 (Япония), камеры Levenhuk 1400M (США) при увеличении в 10–40 раз. Окраску препаратов проводили стандартным методом окраски гематоксилином и эозином.
Статистические методы. Описательная статистика (среднее арифметическое, стандартное отклонение (M±SD)) выполнена с помощью программного обеспечения «Statsoft Statistica 10.0.1011». Проверку нормальности распределения количественных признаков проводили с использованием критерия Шапиро–Уилка.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В результате хроматографического разделения этанольных экстрактов из травы N. rossica, O. simplicissima и C. officinale были обнаружены и идентифицированы ПА (табл. 2). Их качественный состав и количественное содержание сильно варьировали в зависимости от объекта исследования. В генеративных побегах P. mollis алкалоиды не обнаружены, а из листьев они извлекались в следовых количествах.
Наибольшим разнообразием по качественному составу алкалоидов отличалась N. rossica, трава которой накапливает их в количестве до 8,25±0,8 мкг/г воздушно-сухого сырья. В целом в составе надземной части N. rossica преобладали алкалоиды-энантиомеры интермедина и ликопсамина, а также их дериваты. В составе надземной части O. simplicissima, помимо производных ликопсамина, обнаружен виридифлорин N-оксид, суммарное содержание ПА в сырье составило 1,07±0,03 мкг/г. Наибольшее количественное содержание ПА выявлено в траве C. officinale: 676,3±7,4 мкг/г. Результаты хроматографического исследования соединений приведены в таблице 2.
Ликопсамин проявляет противоопухолевую активность в отношении рака легких, его антипролиферативные эффекты связаны со способностями к аутофагии, апоптозу и ингибированию экспрессии интерлейкина-2 [27]. Учитывая значительное содержание производных ликопсамина в траве C. officinale, перспективно выделение данного соединения и проведение скрининга в отношении антипролиферативных свойств.
Генеративные побеги P. mollis не накапливают ПА, а ее листья содержат минимальное количество — менее 0,01 мкг на 1 г воздушно-сухого сырья, что косвенно свидетельствует о безопасности этих видов сырья. Для подтверждения этого предположения на следующем этапе проводили определение острой токсичности всех исследуемых видов сырья в эксперименте in vivo.
Гепатотоксическое действие большинства ПА развивается при хроническом применении, а при введении высоких доз — при остром отравлении [28][29]. В эксперименте животным вводили внутрижелудочно извлечения в высоких дозах — 5000 мг/кг. При этом отсутствовала летальность у животных, получавших сухие экстракты из травы и листьев P. mollis, травы O. simplicissima и N. rossica (табл. 3. Масса тела мышей после однократного внутрижелудочного введения экстрактов из надземной части некоторых растений в дозе 5000 мг/кг. Опубликована на сайте журнала4), что не позволило установить параметры острой токсичности методом пробит-анализа (ЛД10, ЛД50, ЛД90). Полученные данные свидетельствуют о безопасности извлечений из данных видов сырья в указанных дозах.
Из-за отсутствия летальных случаев при максимально возможной дозировке ЛД50 для сухих экстрактов из травы и листьев P. mollis, травы O. simplicissima и N. rossica при внутрижелудочном введении мышам ЛД50 должна составлять 5 г/кг, что позволяет отнести изучаемые объекты к 5 классу токсичности (малотоксичные вещества) согласно действующей нормативной документации5. Необходимы дальнейшие исследования субхронической токсичности, что позволит выявить возможные функциональные нарушения при введении экстракта.
При внутрижелудочном введении экстракта из травы C. officinale все животные из группы погибли в течение первых трех суток наблюдения, после чего были произведены вскрытие животных и забор материала для гистологического исследования.
При исследовании морфологии внутренних органов наблюдали изменения в желудочно-кишечном тракте: желудок растянут (вздут); поджелудочная железа имела признаки острой воспалительной реакции, цвет темно-коричневый с редкими мелкими фокусами стеатоза, некроза; печень увеличена незначительно, цвет неравномерный — крупные фокусы светло-коричневого и темно-коричневого цвета, границы между ними нечеткие; остальные органы выраженных изменений не имели.
При гистологическом исследовании печени (рис. 2) выявлены признаки повреждения: центролобулярное полнокровие и обширные кровоизлияния; синусоиды расширены, полнокровны. Морфологические изменения в печени представлены жировой дистрофией гепатоцитов (рис. 2а) и мононуклеарной (воспалительной) инфильтрацией в портальных трактах (рис. 2b). Строение печени в норме представлено на рисунке 2c.
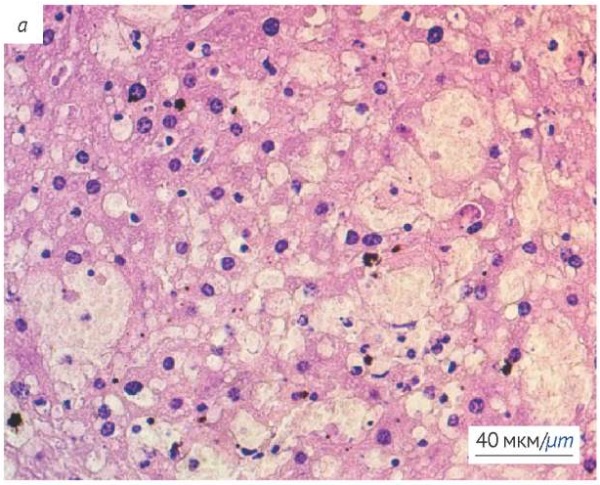
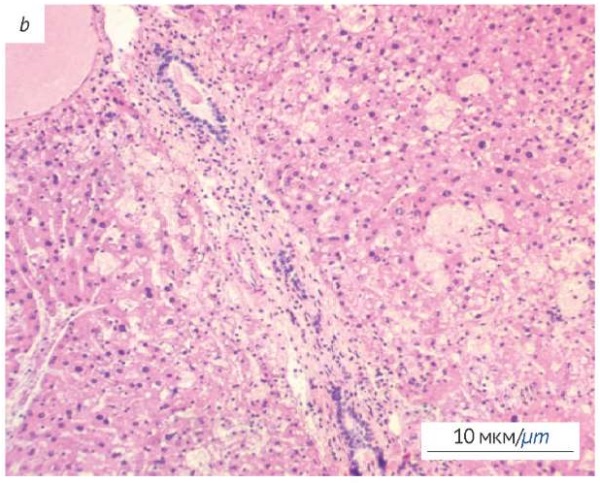
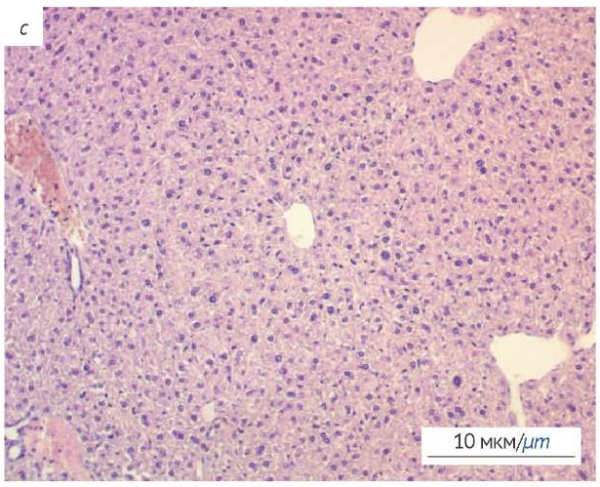
Фотографии выполнены авторами / The photographs were taken by the authors
Рис. 2. Гистологическое исследование печени мышей после однократного внутрижелудочного введения экстракта C. officinale. Окраска гематоксилином и эозином. a — жировая дистрофия гепатоцитов; b — портальный тракт печени с признаками воспаления; c — печень интактного животного (контроль)
Fig. 2. Histological examination of the murine liver after a single intragastric administration of C. officinale extract. a, degeneration of hepatocytes; b, portal triad of the liver with inflammation; c, liver of intact animals (control)
Определен диапазон доз экстракта C. оfficinale, при введении которых наблюдали переход от отсутствия гибели животных до 100% летальности: от 2,75 до 4,25 г/кг. В данном диапазоне с шагом 0,25 мг/г животным вводили исследуемые экстракты для установления количества смертей при каждой дозе (табл. 4. Летальность животных после внутрижелудочного введения экстракта травы C. officinale. Опубликована на сайте журнала6).
С применением пробит-анализа по методу В.Б. Прозоровского для спиртового извлечения (70%) из травы C. officinale были рассчитаны ЛД различных уровней и определено, что ЛД50 составила 3,51±0,13 г/кг. Выявленные значения позволяют отнести экстракт из травы C. officinale к 4 классу токсичности согласно действующей нормативной документации.
Токсичность экстракта из травы C. officinale, вероятно, обусловлена метаболизмом ПА и их производных в соответствующие пирролы [30], обладающие высокой реакционной способностью и прерывающие репликацию ДНК, в результате которой возникают мутации, приводящие к раку печени [31][32].
В некоторых странах ведется мониторинг и нормирование содержания ПА в пищевых продуктах и фитопрепаратах в связи с риском возрастания уровня хронических заболеваний печени [33]. При норме допустимого потребления алкалоидов 1 мкг/кг [34] максимально допустимая доза ПА составит 70 мкг/сут.
Таким образом, результаты проведенного исследования показывают, что извлечения из травы и листьев P. mollis в исследуемых дозах при пероральном применении являются нетоксичными, для извлечений из травы O. simplicissima и N. rossica необходимо проведение дальнейших исследований для определения токсичности при длительном применении, а извлечения из травы C. officinale — токсичны и не могут использоваться для внутреннего применения.
ЗАКЛЮЧЕНИЕ
Методом ВЭЖХ установлено отсутствие ПА в траве P. mollis, наличие их следовых количеств (0,01 мкг/г) в листьях P. mollis. Трава и листья P. mollis не обладают гепатотоксическим действием при внутрижелудочном введении мышам в дозе 5 г/кг.
В траве O. simplicissima содержание ПА составило 1,07±0,03 мкг/г, в траве N. rossica — 8,25±0,08 мкг/г, в траве C. officinale выявлено высокое содержание ПА — 676,3±7,4 мкг/г.
Различия в компонентном составе и количественном содержании ПА явились причиной развития токсического эффекта при однократном внутрижелудочном введении исследуемых экстрактов мышам. Экстракты из травы и листьев P. mollis, травы N. rossica и травы O. simplicissima относятся к 5 классу токсичности (малотоксичные вещества), экстракт из травы C. officinale — к 4 классу токсичности7.
Таким образом, исследуемые растения семейства Boraginaceae содержат разное количество ПА и в связи с этим имеют различные перспективы медицинского применения. Так, трава и листья P. mollis не вызывают признаков проявления острой токсичности при однократном внутрижелудочном введении лабораторным животным; применение препаратов на основе травы N. rossica и O. simplicissima требует проведения дальнейших исследований для определения токсичности при длительном пероральном применении, а лекарственные формы на основе травы C. officinale токсичны, и их использование для внутреннего применения исключено.
Дополнительная информация. Таблицы 3, 4 размещены на сайте журнала «Регуляторные исследования и экспертиза лекарственных средств».
https://doi.org/10.30895/1991-2919-2025-15-6-701-711-table
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Вклад авторов распределен следующим образом: В.В. Величко — концепция и дизайн исследования, написание текста рукописи, формулировка выводов, утверждение окончательной версии статьи для публикации; Д.Н. Оленников — получение, анализ данных химического состава, их интерпретация, редактирование текста рукописи; Е.Д. Олешко — пробоподготовка, получение экспериментальных данных; К.И. Ершов — проведение экспериментов с животными, статистическая обработка и интерпретация экспериментальных данных; Д.С. Круглов — статистическая обработка экспериментальных данных, работа с источниками литературы, критический пересмотр и доработка текста рукописи; К.А. Кошлич — морфологическое и гистохимическое исследование, интерпретация данных.
Соответствие принципам этики. Исследование было одобрено на заседании Комитета по этике Новосибирского государственного медицинского университета (протокол № 162 от 28.11.2024).
Additional information. Tables 3, 4 are published on the website of Regulatory Research and Medicine Evaluation.
https://doi.org/10.30895/1991-2919-2025-15-6-701-711-table
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Viktoriya V. Velichko developed research concept and design, wrote the manuscript, formulated conclusions, and finally approved the manuscript for publication. Daniil N. Olennikov obtained and analysed chemical composition, interpreted them and corrected the manuscript. Egor D. Oleshko prepared the samples and obtained experimental data. Konstantin I. Ershov conducted animal experiments, processed and interpreted statistical data. Dmitriy S. Kruglov statistically processed experimental data, worked with literature sources, and critically revised the manuscript. Ksenia A. Koshlich performed morphological and histochemical study and interpreted the data.
Ethics approval. The research was approved at a meeting of Ethics Committee, Novosibirsk State Medical University (Meeting Minutes No. 162 of 11 November 2024).
1. Технический регламент Таможенного союза ТР ТС 021/2011 «О безопасности пищевой продукции», Приложение № 7 «Перечень растений и продуктов их переработки, объектов животного происхождения, микроорганизмов, грибов и биологически активных веществ, запрещенных для использования в составе биологически активных добавок к пище в связи с содержанием психотропных, наркотических, сильнодействующих или ядовитых веществ».
2. Рекомендация Коллегии ЕЭК от 14.11.2023 № 33 «О Руководстве по работе с лабораторными (экспериментальными) животными при проведении доклинических (неклинических) исследований»; Решение Совета ЕЭК от 03.11.2016 № 81 «Об утверждении Правил надлежащей лабораторной практики Евразийского экономического союза в сфере обращения лекарственных средств»; Хельсинкская декларация Всемирной медицинской ассоциации о гуманном обращении с животными, 1996.
3. Миронов АН, ред. Руководство по проведению доклинических исследований лекарственных средств. М.: Гриф и К; 2012.
4. https://doi.org/10.30895/1991-2919-2025-15-6-701-711-table
5. ГОСТ 32644-2014. Методы испытания по воздействию химической продукции на организм человека. Острая пероральная токсичность — метод определения класса острой токсичности.
6. https://doi.org/10.30895/1991-2919-2025-15-6-701-711-table
7. ГОСТ 32644-2014. Методы испытания по воздействию химической продукции на организм человека. Острая пероральная токсичность — метод определения класса острой токсичности.
Список литературы
1. Тамахина АЯ. Микроморфологические особенности эпидермы листьев и вторичные метаболиты перспективного лекарственного растения чернокорня лекарственного (Cynoglossum officinale L.) флоры Кабардино-Балкарии. Известия Горского государственного аграрного университета. 2023;60(2):118–28. EDN: NLKUMW
2. Dresler S, Szymczak G, Wójcik M. Comparison of some secondary metabolite content in the seventeen species of the Boraginaceae family. Pharm Biol. 2017;55(1):691–5. https://doi.org/10.1080/13880209.2016.1265986
3. Chrzanowska E, Denisow B, Ekiert H, Pietrzyk Ł. Metabolites obtained from Boraginaceae plants as potential cosmetic ingredients — A review. Molecules. 2024;29(21):5088. https://doi.org/10.3390/molecules29215088
4. Yan Y, Wei X, Qiu B, et al. Exploring pharmaphylogeny from multiple perspectives: A case study on Lithospermeae. Sci Rep. 2023;13(1):7636. https://doi.org/10.1038/s41598-023-34830-4
5. Kararenk AC, Sönmez HR, Asgarli T, et al. Comprehensive analysis of elemental and metabolite composition in Boraginaceae species from Türkiye. Chem Biodivers. 2025;22(5):e202402331. https://doi.org/10.1002/cbdv.202402331
6. Величко ВВ, Круглов ДС, Турышев АЮ, Белоногова ВД. Определение запасов сырья Pulmonaria mollis и P. obscura (Boraginaceae). Растительные ресурсы. 2025;61(3):52–9.
7. Chacón J, Luebert F, Hilger HH, et al. The borage family (Boraginaceae s.str.): a revised infrafamilial classification based on new phylogenetic evidence, with emphasis on the placement of some enigmatic genera. Taxon. 2016;65(3):523–46. https://doi.org/10.12705/653.6
8. Vasile M-A, Böhnert T, Jeiter J, et al. An updated phylogeny of Boraginales based on the Angiosperms353 probe set: a roadmap for understanding morphological evolution. Ann Bot. 2025;136(1):77–97. https://doi.org/10.1093/aob/mcaf061
9. Grünwald J, Jänicke Ch. Grüne Apotheke: Das moderne Standardwerk zur Pflanzenheilkunde. Berlin: Gräfe und unzer Verlag GmbH; 2015.
10. Николаев НА, Ливазан МА, Скирденко ЮП, Мартынов АИ. Биологически активные растения и грибы Сибири в клинической медицине. М.: Академия Естествознания; 2019. EDN: PCKISJ
11. Mohammed HH, Abdullah FO. Microwave-assisted extraction and phytochemical profile of Nonea pulmonarioides and its antifungal, antibacterial, and antioxidant activities. J Food Qual. 2022;2022(1):1–12. https://doi.org/10.1155/2022/5135880
12. Jabbar АА, Abdullah FО, Hassan AO, et al. Ethnobotanical, phytochemistry, and pharmacological activity of Onosma (Boraginaceae) an updated review. Molecules. 2022;27(24):8687. https://doi.org/10.3390/molecules27248687
13. Барагунова МА. Разработка и обоснование экстракта жидкого чернокорня лекарственного, применяемого при язвенной болезни желудка и двенадцатиперстной кишки. Научный лидер. 2022;(7):85–91. EDN: UGTPCT
14. These A, Bodi D, Ronczka S, et al. Structural screening by multiple reaction monitoring as a new approach for tandem mass spectrometry: presented for the determination of pyrrolizidine alkaloids in plants. Anal Bioanal Chem. 2013;405(29): 9375–83. https://doi.org/10.1007/s00216-013-7365-4
15. Яковлева ЕГ. Диагностика, лечение и профилактика отравлений животных растениями, содержащими пирролизидиновые алкалоиды. Вестник Курской государственной сельскохозяйственной академии. 2008;(4):30–3. EDN: KZVGFR
16. Van Dam Nicole M, Witte L, Theuring C, et al. Distribution, biosynthesis and turnover of pyrrolizidine alkaloids in Cynoglossum officinale. Phytochemistry. 1995;39(2):287–92. https://doi.org/10.1016/0031-9422(94)00944-O
17. Pfister JA, Molyneux RJ, Baker DC. Pyrrolizidine alkaloid content of houndstongue (Cynoglossum officinale L). J Range Manag. 1992:45(3):254–6. https://doi.org/10.2307/4002973
18. El-Shazly A, Sarg T, Ateya A, et al. Pyrrolizidine alkaloids of Cynoglossum officinale and Cynoglossum amabile (family Boraginaceae). Biochem Syst Ecol. 1996:24(5):415–21. https://doi.org/10.1016/0305-1978(96)00035-X
19. Montaner C, Zufiaurre R, Movila M, Mallor C. Evaluation of borage (Borago officinalis L.) genotypes for nutraceutical value based on leaves fatty acids composition. Foods. 2021;11(1):16. https://doi.org/10.3390/foods11010016
20. Величко ВВ, Ластовка АВ, Карташова МЕ и др. Разработка и валидация ВЭЖХ-методики определения кофейной кислоты в траве нонеи русской. Регуляторные исследования и экспертиза лекарственных средств. 2025;15(2):222–8. https://doi.org/10.30895/1991-2919-2025-680
21. Величко ВВ. Фармакогностическое исследование наиболее распространенных представителей трибы Boragineae. В кн.: Сборник материалов Международной конференции «Достижения и перспективы создания новых лекарственных растительных препаратов». М.; 2024. С. 106–10. EDN: OLWRSN
22. Jayawickreme K, Świstak D, Ozimek E, et al. Pyrrolizidine alkaloids-pros and cons for pharmaceutical and medical applications. Int J Mol Sci. 2023;24(23):16972. https://doi.org/10.3390/ijms242316972
23. Карташова МЕ, Величко ВВ, Круглов ДС. Товароведческие показатели лекарственного растительного сырья «Нонеи русской трава». В кн.: Всероссийская научно-практическая конференция с международным участием «Кромеровские чтения 2024». Пермь; 2024. EDN: NILHDN
24. Олешко ЕД, Круглов ДС. Оптимальные условия извлечения фенольных соединений из травы оносмы простейшей. В кн.: Сборник материалов международной научно-практической конференции «Достижения и перспективы создания новых лекарственных растительных препаратов». М.; 2025. С. 444–7. EDN: MRKHMR
25. Kashchenko NI, Olennikov DN, Chirikova NK. Phenolic compounds and pyrrolizidine alkaloids of two north bluebells: Mertensia stylosa and Mertensia serrulate. Appl Sci. 2023;13(5):3266. https://doi.org/10.3390/app13053266
26. Прозоровский ВБ. Табличный экспресс-метод определения средних эффективных мер воздействия на биологические объекты. Токсикологический вестник. 1998;(1):28–32.
27. Wei X, Ruan W, Vrieling K. Current knowledge and perspectives of pyrrolizidine alkaloids in pharmacological applications: A mini-review. Molecules. 2021;26(7):1970. https://doi.org/10.3390/molecules26071970
28. Lu Y-S, Qiu J, Mu X-Y, Qian Y-Z, Chen L. Levels, toxic effects, and risk assessment of pyrrolizidine alkaloids in foods: a review. Foods. 2024;13(4):536. https://doi.org/10.3390/foods13040536
29. Fu PP, Xia Q, Lin G, Chou MW. Pyrrolizidine alkaloids — genotoxicity, metabolism, enzymes, metabolic activation, and mechanisms. Drug Metab Rev. 2004;36(1):1–55. https://doi.org/10.1081/dmr-120028426
30. El-Shazly A, Wink M. Diversity of pyrrolizidine alkaloids in the Boraginaceae structures, distribution, and biological properties. Diversity. 2014;6(2):188–282. https://doi.org/10.3390/d6020188
31. Cooper RA, Huxtable RJ. The relationship between reactivity of metabolites of pyrrolizidine alkaloids and extrahepatic toxicity. Proc West Pharmacol Soc. 1999; 42:13–6.
32. Wang Z, Han H, Wang C, et al. Hepatotoxicity of pyrrolizidine alkaloid compound intermedine: comparison with other pyrrolizidine alkaloids and its toxicological mechanism. Toxins. 2021;13(12):849. https://doi.org/10.3390/toxins13120849
33. Wang Z, Qiao L, Zheng Q, et al. Combined hepatotoxicity and toxicity mechanism of intermedine and lycopsamine. Toxins. 2022;14(9):633. https://doi.org/10.3390/toxins14090633
34. Casado N, Morante-Zarcero S, Sierra I. The concerning food safety issue of pyrrolizidine alkaloids. An overview. Trends Food Sci Technol. 2022;120:123–39.
Об авторах
В. В. ВеличкоРоссия
Величко Виктория Владимировна, канд. фарм. наук, доцент
Красный пр-т, д. 52, г. Новосибирск
Д. Н. Оленников
Россия
Оленников Даниил Николаевич, д-р. фарм. наук, профессор
ул. Сахьяновой, д. 6, г. Улан-Удэ, 670047
Е. Д. Олешко
Россия
Олешко Егор Данилович
Красный пр-т, д. 52, г. Новосибирск, 630091
К. И. Ершов
Россия
Ершов Константин Игоревич, канд. биол. наук, доцент
Красный пр-т, д. 52, г. Новосибирск, 630091
ул. Сахьяновой, д. 6, г. Улан-Удэ, 670047
Д. С. Круглов
Россия
Круглов Дмитрий Семенович, канд. техн. наук, доцент
Красный пр-т, д. 52, г. Новосибирск, 630091
К. А. Кошлич
Россия
Кошлич Ксения Александровна, канд. мед. наук
Красный пр-т, д. 52, г. Новосибирск, 630091
Дополнительные файлы

|
1. Таблицы 3, 4 | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(877KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Величко В.В., Оленников Д.Н., Олешко Е.Д., Ершов К.И., Круглов Д.С., Кошлич К.А. Пирролизидиновые алкалоиды растений семейства Boraginaceae и оценка безопасности их применения по критерию острой токсичности. Регуляторные исследования и экспертиза лекарственных средств. 2025;15(6):701-711. https://doi.org/10.30895/1991-2919-2025-15-6-701-711
For citation:
Velichko V.V., Olennikov D.N., Oleshko E.D., Yershov K.I., Kruglov D.S., Koshlich K.A. Pyrrolizidine Alkaloids of Boraginaceae Family and Safety Assessment of Acute Toxicity. Regulatory Research and Medicine Evaluation. 2025;15(6):701-711. (In Russ.) https://doi.org/10.30895/1991-2919-2025-15-6-701-711
JATS XML