Перейти к:
Определение методом масс-спектрометрии с индуктивно-связанной плазмой содержания элементных примесей в российских радиофармацевтических лекарственных препаратах
https://doi.org/10.30895/1991-2919-2025-15-4-434-443
Резюме
ВВЕДЕНИЕ. Оценка производителями радиофармацевтических лекарственных препаратов (РФЛП) рисков негативного воздействия элементных примесей на качество своей продукции должна основываться на реальной информации об уровне элементной контаминации РФЛП. Накопление знаний о лекарственном препарате и процессе производства должно происходить начиная со стадии разработки и продолжаться на этапе его реализации вплоть до момента снятия лекарственного препарата с производства.
ЦЕЛЬ. Мониторинг содержания элементных примесей в РФЛП отечественных производителей методом масс-спектрометрии с индуктивно-связанной плазмой.
МАТЕРИАЛЫ И МЕТОДЫ. В качестве объектов исследования использовали 127 образцов различных РФЛП российских производителей, полученных ФГБУ «Научный центр экспертизы средств медицинского применения» в ходе уставной деятельности: флудезоксиглюкоза (18F), ПСМА-1007 (18F), натрия йодид (131I), натрия йодогиппурат (131I), йобенгуан (123I), натрия пертехнетат (99mTc). Содержание элементов Ag, Al, As, Au, Ba, Be, Bi, Cd, Co, Cr, Cu, Fe, Ga, Ge, Hg, Ir, Li, Mn, Nb, Ni, Os, Pb, Pd, Pt, Rh, Ru, Sb, Se, Mo, Sn, Tl, V, W, Zn определяли на масс-спектрометре Agilent 7900 по методике МУК 4.1.1483-03.
РЕЗУЛЬТАТЫ. Элементные примеси Ag, As, Au, Bi, Be, Cd, Co, Cr, Ga, Ge, Hg, Ir, Mo, Nb, Ni, Os, Pb, Pd, Pt, Rh, Ru, Sb, Se, Sn, Tl, V, W не обнаружены ни в одном из анализируемых РФЛП. Практически во всех проанализированных РФЛП максимальный уровень в элементную контаминацию вносят Al, Zn, Cu. В РФЛП для однофотонной эмиссионной компьютерной томографии (ОФЭКТ) содержится значительно меньше элементных примесей по сравнению с РФЛП для позитронно-эмиссионной томографии (ПЭТ).
ВЫВОДЫ. Элементы, вносящие максимальный вклад в контаминацию отечественных РФЛП (Al, Zn, Cu), являются нетоксичными или малотоксичными. Контроль над ними необходим в том случае, если они оказывают негативное влияние на качество РФЛП. Во флудезоксиглюкозе (18F) уровень элементной контаминации существенно зависит от используемого буферного раствора. Для точного понимания источников элементной контаминации исследованных РФЛП необходимо проведение дополнительного анализа элементных примесей исходных материалов, реактивов и полупродуктов на всех стадиях технологического процесса.
Ключевые слова
Для цитирования:
Швецова Ю.Н., Ерина А.А., Щукин В.М., Кузьмина Н.Е., Рузиев Р.Д., Припадчев Д.А., Кузнецов М.А. Определение методом масс-спектрометрии с индуктивно-связанной плазмой содержания элементных примесей в российских радиофармацевтических лекарственных препаратах. Регуляторные исследования и экспертиза лекарственных средств. 2025;15(4):434-443. https://doi.org/10.30895/1991-2919-2025-15-4-434-443
For citation:
Shvetsova Yu.N., Erina A.A., Shchukin V.M., Kuz'mina N.E., Ruziev R.D., Pripadchev D.A., Kuznetsov M.A. Detecting Elemental Impurities by Inductively Coupled Plasma Mass Spectrometry in Russian Radiopharmaceuticals. Regulatory Research and Medicine Evaluation. 2025;15(4):434-443. (In Russ.) https://doi.org/10.30895/1991-2919-2025-15-4-434-443
ВВЕДЕНИЕ
Одним из показателей качества радиофармацевтических лекарственных препаратов (РФЛП) является содержание в них элементных примесей, негативно влияющих на качественные характеристики готовой продукции (удельную активность, радиохимическую чистоту, стабильность) [1]. Основными источниками элементных примесей в РФЛП являются исходное сырье, оборудование (материал мишеней, в которых нарабатывается радионуклид, генераторных колонок, препаративных или очистных колонок и контейнеров и т.д.), а также используемые в технологическом процессе катализаторы, реагенты и вспомогательные вещества1.
Согласно фармакопейным требованиям производители РФЛП должны сами оценивать риски негативного воздействия элементных примесей на качество своей продукции и устанавливать перечень нормируемых элементов и пределы их содержания2. Оценка рисков, как правило, основана на реальной информации об уровне элементной контаминации РФЛП. Накопление знаний о лекарственном препарате и процессе производства должно происходить начиная со стадии разработки и продолжаться на этапе его реализации вплоть до момента снятия лекарственного препарата с производства3. В литературе отсутствует информация об уровне загрязнения российских РФЛП элементными примесями, поэтому крайне актуально проведение экспериментальных исследований, позволяющих производителям РФЛП понять, какие элементные примеси нужно контролировать при производстве своей продукции.
Цель работы — мониторинг содержания элементных примесей в РФЛП российских производителей, поступивших в гражданский оборот, методом масс-спектрометрии с индуктивно-связанной плазмой (ИСП-МС). Метод ИСП-МС характеризуется максимальной чувствительностью среди спектральных методов элементного анализа и рекомендован для определения элементных примесей в лекарственных препаратах4.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве объектов исследования использовали образцы с истекшим сроком годности, имеющие значения активности ниже минимально значимой удельной активности. Образцы готовой продукции были предоставлены производителями в невскрытой первичной упаковке. Анализировали образцы двух типов:
- РФЛП для позитронно-эмиссионной томографии (ПЭТ): флудезоксиглюкоза (18F) (18F-ФДГ), раствор для инъекций (54 образца различных серий от 4 различных производителей), фторпростатспецифический мембранный антиген — 18F-ПСМА-1007 (35 образцов различных серий с одной производственной площадки);
- РФЛП для однофотонной эмиссионной компьютерной томографии (ОФЭКТ): натрия йодид (131I), изотонический раствор (17 образцов различных серий двух производителей), натрия йодогиппурат (131I), раствор для внутривенного введения (3 образца различных серий с одной производственной площадки), йобенгуан [ 123I] (МИБГ, 123I), раствор для инъекций (12 образцов различных серий с одной производственной площадки), натрия пертехнетат (99mTc), раствор для инъекций (19 образцов различных серий, полученных одним производителем, но с использованием генераторов различных серий). Важно отметить, что производители ОФЭКТ-РФЛП использовали различные источники сырья. Серии ОФЭКТ-РФЛП были произведены в течение трех месяцев. Планово-предупредительные ремонтные работы (ППР) реактора проводились в летний период, а поставка сырья производителям осуществлялась в последнем квартале года. Препарат производился в течение полугода после ППР.
Определяли содержание элементов, подлежащих учету при оценке рисков в соответствии с ОФС «Элементные примеси» ГФ РФ XV (Cd, Pb, As, Hg, Co, V, Ni, Tl, Au, Pd, Ir, Os, Rh, Ru, Se, Ag, Pt, Li, Sb, Ba, Mo, Cu, Sn, Cr), и элементов, рекомендованных к контролю в РФЛП ГФ РФ XI5 (Al, Mn, Fe, Zn, Bi), а также Bi, Be, Ga, Ge, Nb, W.
В ходе исследования были использованы следующие реактивы: одноэлементные стандартные образцы с аттестованным значением 1000 мг/дм3 (СО1000) лития, бериллия, алюминия, ванадия, кобальта, никеля, меди, галлия, мышьяка, молибдена, кадмия, бария, иридия, золота, ртути, висмута (Inorganic Ventures, CША), хрома, железа, германия, селена, палладия, серебра, олова, сурьмы, вольфрама, платины, таллия, свинца (Central Drug House (p) Ltd, Индия), цинка (кат. номер 1.70369), ниобия (кат. номер 1.70369 67913) (оба — Sigma-Aldrich, CША), марганца, рутения (PerkinElmer, CША), родия (High-Purity Standarts, CША), осмия (кат. номер 1.70338) (Merck, CША), концентрированная азотная кислота (кат. номер 6001091, tracemetal grade, 69%, Fisher Chemical), вода деионизованная, очищенная на установке Milli-Q — Integral 3 (Millipore, Франция), аргон (выс. ч., ООО «НИИ КМ»).
Содержание 34 элементов в испытуемых образцах определяли методом масс-спектрометрии с индуктивно-связанной плазмой на приборе Agilent 7900 (Agilent, США) с использованием стандартной методики6. Испытуемые образцы анализировали неразбавленными. Фиксировали интенсивность сигналов следующих изотопов (а.е.м.): 7Li, 9Be, 27Al, 51V, 52Cr, 55Mn, 57Fe, 59Co, 60Ni, 65Cu, 66Zn, 71Ga, 72Ge, 75As, 77Se, 93Nb, 95Mo, 101Ru, 103Rh, 105Pd, 107Ag, 111Cd, 118Sn, 121Sb, 137Ba, 182W, 189Os, 193Ir, 195Pt, 197Au, 202Hg, 205Tl, 208Pb, 209Bi. Параметры эксперимента: мощность плазмы — 1500 Вт; поток плазменного газа (аргон) — 15,0 л/мин, поток газа-носителя (аргон) — 1,05 л/мин, поток вспомогательного газа (аргон) — 0,9 л/мин, температура распылительной камеры Скотта — 2 °С, скорость подачи образца — 0,1 об./с. Значения предела обнаружения (ПО, LOD), предела количественного определения (ПКО, LOQ) и коэффициента корреляции для определяемых элементов, установленные на модельных смесях с использованием стандартных образцов, представлены в таблице 1. Для расчета концентраций элементов применяли метод калибровочной кривой.
Для каждого из образцов за результат измерения брали усредненное значение, полученное от трех параллельных проб. Статистическая обработка результатов была произведена в программе Microsoft Office Excel 2007 с установленным пакетом «Анализ данных».
Таблица 1. Характеристики методики определения элементных примесей в радиофармацевтических препаратах методом масс-спектрометрии с индуктивно-связанной плазмой
Table 1. Parameters of identification method for elemental impurities in radiopharmaceuticals using inductively coupled plasma mass spectrometry
|
Элемент Element |
Коэффициент корреляции (r) Correlation coefficient (r) |
Предел обнаружения, ppb Limit of detection, ppb |
Предел количественного определения, ppb Limit of quantitation, ppb |
|
7Li |
0,9995 |
0,687 |
2,061 |
|
9Be |
0,9999 |
0,004 |
0,012 |
|
27Al |
0,9999 |
0,093 |
0,280 |
|
51V |
0,9990 |
0,024 |
0,073 |
|
52Cr |
0,9900 |
0,409 |
1,228 |
|
55Mn |
0,9961 |
0,117 |
0,351 |
|
57Fe |
0,9983 |
75,99 |
227,9 |
|
59Co |
0,9955 |
0,010 |
0,031 |
|
60Ni |
0,9994 |
0,051 |
0,154 |
|
65Cu |
0,9998 |
0,417 |
1,251 |
|
66Zn |
0,9999 |
1,345 |
4,035 |
|
71Ga |
0,9917 |
0,043 |
0,130 |
|
72Ge |
0,9997 |
0,117 |
0,350 |
|
75As |
0,9999 |
0,081 |
0,244 |
|
77Se |
0,9999 |
0,369 |
1,108 |
|
93Nb |
0,9995 |
0,000 |
0,001 |
|
95Mo |
0,9989 |
0,022 |
0,065 |
|
103Rh |
0,9998 |
0,001 |
0,002 |
|
105Pd |
0,9997 |
0,004 |
0,011 |
|
107Ag |
0,9959 |
0,036 |
0,108 |
|
111Cd |
0,9893 |
0,002 |
0,005 |
|
118Sn |
0,9949 |
0,349 |
1,047 |
|
121Sb |
0,9978 |
0,029 |
0,086 |
|
137Ba |
0,9997 |
0,014 |
0,042 |
|
182W |
0,9987 |
0,001 |
0,002 |
|
189Os |
0,9999 |
0,010 |
0,029 |
|
193Ir |
0,9999 |
0,002 |
0,006 |
|
195Pt |
0,9998 |
0,013 |
0,039 |
|
197Au |
0,9998 |
0,005 |
0,015 |
|
202Hg |
0,9923 |
0,024 |
0,072 |
|
205Tl |
0,9972 |
0,016 |
0,049 |
|
208Pb |
0,9923 |
0,014 |
0,042 |
|
209Bi |
0,9897 |
0,002 |
0,006 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Таблица 2. Уровни элементной контаминации образцов флудезоксиглюкозы [ 18F]
Table 2. Elemental contamination, fluorodeoxyglucose [ 18F] samples
|
Элемент Element |
Cmin, ppm |
Cmed, ppm |
Cmax, ppm |
|
Цитратный буфер Citrate buffer |
|||
|
Al |
1,65 |
4,15 |
10,2 |
|
Cu |
0,026 |
0,439 |
0,822 |
|
Zn |
0,084 |
4,42 |
23,4 |
|
Ba |
0,002 |
0,013 |
0,218 |
|
Li |
0,005 |
0,031 |
0,095 |
|
Фосфатный буфер Phosphate buffer |
|||
|
Al |
0,006 |
0,007 |
0,059 |
|
Cu |
0,322 |
0,419 |
0,554 |
|
Zn |
2,39 |
3,04 |
4,34 |
|
Ba |
ниже предела количественного обнаружения / ≤ Limit of quantitation |
||
|
Li |
ниже предела количественного обнаружения / ≤ Limit of quantitation |
||
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. Cmin — минимальная обнаруженная концентрация, Cmed — медиана обнаруженных концентраций, Cmax — максимальная обнаруженная концентрация.
Note. Cmin, minimum detectable concentration, Cmed, median detectable concentration, Cmax, maximum detectable concentration.
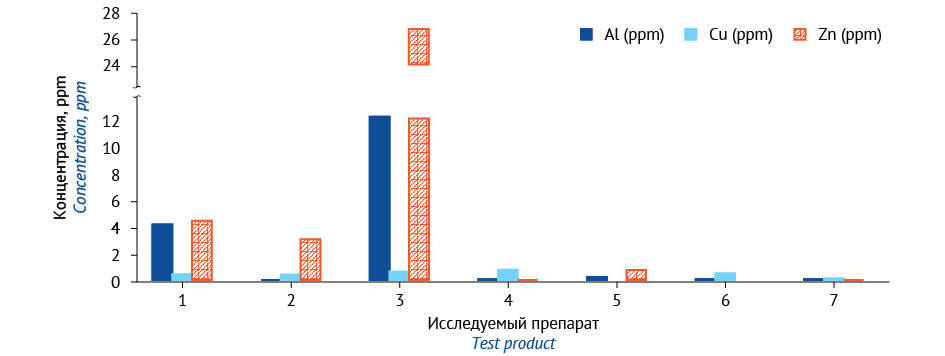
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 1. Медианные уровни контаминации элементами Al, Cu, Zn радиофармацевтических препаратов: 1 — 18F- флудезоксиглюкоза (цитратный буфер), 2 — 18F- флудезоксиглюкоза (фосфатный буфер), 3 — 18F- простатспецифический мембранный антиген, 4 — натрия йодид 131I, 5 — натрия йодогиппурат 131I, 6 — йобенгуан [ 123I], 7 — натрия пертехнетат (99mTc)
Fig. 1. Median contamination of Al, Cu, and Zn in analysed radiopharmaceuticals. 1, 18F Fluorodeoxyglucose (18F) (citric buffer); 2, 18F Fluorodeoxyglucose (18F) (phosphate buffer); 3, 18F- prostate-specific membrane antigen; 4, sodium iodide 131I; 5, sodium iodohippurate 131I; 6, iobenguane 123I (123I); 7, sodium pertechnetate 99mTc
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Флудезоксиглюкоза (18F-ФДГ) является неспецифическим туморотропным ПЭТ-РФЛП и накапливается в повышенных количествах в клетках злокачественных опухолей и метастазах, что связано с присущим им гипергликолизом. Степень накопления 18F-ФДГ в клетках злокачественных опухолей коррелирует с распространенностью неопластического процесса [2], а также позволяет оценить эффект от проведенного лечения, так как при эффективном лечении процент накопления препарата в опухолях снижается, а при неэффективном — не изменяется или возрастает [3]. Препараты на основе 18F-ФДГ включены во многие фармакопеи, однако содержание элементных примесей нормируется только в Японской фармакопее7. В отечественной нормативной документации до недавнего времени вообще отсутствовали какие-либо требования к элементной контаминации ПЭТ-РФЛП.
54 исследуемых образца 18F-ФДГ представлены с четырех производственных площадок, получены с использованием различных реактивов: на последнем этапе технологического процесса для стабилизации РФЛП применялся либо цитратный (51 образец), либо фосфатный буферный раствор (3 образца) [4]. Кроме того, степень разбавления полупродукта физиологическим раствором, зависящая от требуемой объемной активности, различна [5]. На основе результатов измерения содержания определяемых элементов в выборке из препаратов 18F-ФДГ определен диапазон элементной контаминации этих препаратов, который мы охарактеризовали тремя уровнями концентраций: минимальным (Cmin), медианным (Cmed) и максимальным (Cmax) (табл. 2). В таблицу 2 не включены элементы, содержание которых в анализируемых образцах ниже ПКО.
Максимальный вклад в контаминацию 18F-ФДГ отечественного производства вносят Zn, Al и Cu (табл. 2). Их содержание при использовании цитратного буферного раствора выше, чем фосфатного. Следует отметить, что эти же элементные примеси выявлены и в импортных 18F-ФДГ. Согласно данным литературы, содержание Zn в отдельных образцах составляет 0,072±0,011 [6], 0,25±0,05 [7], 0,121±0,005 ppm [8]; Al — 0,27±0,014 ppm [6]; Cu — 0,052±0,002 ppm [8]. Содержание этих примесей в импортных образцах ниже, чем минимальный уровень их концентраций в российских аналогах. Однако в импортных образцах обнаружены Cr (0,027±0,002 [7]; 0,054±0,007 ppm [8]) и Ni (0,187±0,006 ppm [8]), которые отсутствуют в российских препаратах.
Основным источником контаминации данного препарата алюминием являются алюмооксидные сорбенты, использующиеся для выделения и очистки радионуклида [9][10]. Источником контаминации 18F-ФДГ цинком, по нашему предположению, является материал мишени, так как данный элемент обнаружен в картриджах после прохождения через них водных смывов с тела и окна мишени [11]. Кроме того, потенциальными источниками элементных примесей являются применяемые при производстве реагенты, не обладающие достаточной чистотой [7].
18F-ПСМА-1007 — трансмембранный белок, используется в качестве радиоактивно-меченного индикатора в ПЭТ, нацеленного на специфический мембранный антиген простаты (PSMA). Благодаря метке 18F и высокой фармакокинетической активности этот ПЭТ-индикатор является мощным инструментом для визуализации новообразований простаты [12]. Кроме того, ПСМА-1007 может быть использован в качестве транспортного средства для переноса цитотоксических препаратов, направленных именно на раковые клетки простаты, с минимальным повреждением соседних здоровых клеток [13]. Монография на данный препарат приведена только в Европейской фармакопее8, при этом перечень нормируемых элементных примесей с соответствующими пределами их содержания в ней отсутствует.
По результатам наших исследований, максимальный вклад в контаминацию данного препарата вносят Zn (Сmin=7,05; Сmed=26,7; Сmax=46,5 ppm) и Al (Сmin=0,622; Сmed=12,2; Сmax=24,4 ppm). В заметных количествах присутствуют Cu (Сmin=0,079; Сmed=0,638; Сmax=1,10 ppm), Fe (Сmin=0,003; Сmed=0,459; Сmax=1,05 ppm) и Li (Сmin=0,022; Сmed=0,322; Сmax=0,698 ppm). Концентрация остальных определяемых элементов находится ниже пределов обнаружения. Высокое содержание Zn в данном РФЛП объясняется тем, что исходное сырье (ПСМА-1007) является цинксодержащим металлоферментом [14], в котором Zn2+ бидентатно связан с активными сайтами мембранного гликопротеина [15]. Основным источником примеси Al в 18F-ПСМА-1007, аналогично 18F-ФДГ, являются алюмооксидные сорбенты, используемые для выделения и очистки данного радионуклида [9][10]. Для понимания источников контаминации 18F-ПСМА-1007 элементами Cu, Li и Fe необходимо провести дополнительный элементный анализ набора реагентов и расходных материалов. Данные литературы об элементном анализе 18F-ПСМА-1007 нами не обнаружены.
Натрия йодид (131I) изотонический раствор. Избирательное накопление 131I в щитовидной железе позволяет использовать данный РФЛП для лечения гипертиреоза, эутиреоидного многоузлового зоба [16], а также рака щитовидной железы [17]. Монографии на данный препарат содержатся в ГФ РФ, Фармакопее США, Европейской, Китайской, Японской, Корейской и Индийской фармакопеях. ГФ РФ нормирует остаточное содержание в нем иодида, но ни одна из фармакопей не нормирует содержание примесей металлов.
В исследованных нами образцах данного препарата обнаружено заметное количество меди (Сmin=0,0; Сmed=0,760; Сmax=1,18 ppm), цинка (Сmin=0,0; Сmed=0,002; Сmax=0,951 ppm), алюминия (Сmin=0,009; Сmed=0,057; Сmax=0,564 ppm). Примесь бария присутствует в меньших количествах (Сmin=0,0; Сmed=0,005; Сmax=0,167 ppm). Концентрация остальных определяемых элементов находится ниже пределов обнаружения.
Натрия о-йодгиппурат (131I) используют для диагностики функционального состояния почек у взрослых9. Уже более 50 лет он считается золотым стандартом для оценки эффективного почечного плазменного потока [18]. По данным скорости выведения препарата из организма, величинам и временным характеристикам накопления и выведения препарата почками определяют их функциональное состояние [19]. Монографии на натрия о-йодгиппурат (131I) содержатся в ГФ РФ, Европейской, Китайской, Японской и Корейской фармакопеях. Ни в одной из них содержание элементных примесей не нормируется.
В данном препарате отечественного производства нами обнаружено незначительное количество примесей следующих элементов: алюминия (Сmin=0,212; Сmed=0,219; Сmax=0,238 ppm), бария (Сmin=0,013; Сmed=0,014; Сmax=0,018 ppm) и цинка (Сmin=0,651; Сmed=0,745; Сmax=0,877 ppm). Содержание остальных элементов находится на уровне ниже предела обнаружения.
Йобенгуан [123I] (123I-МИБГ) широко используется для диагностики сердечно-сосудистых, онкологических и нейродегенеративных заболеваний [20][21]. Монографии на данный препарат приведены в ГФ РФ, Европейской, Японской фармакопеях и фармакопее США. Следует отметить, что в ГФ РФ и Европейской фармакопеях прямо указано, что в препарате может содержаться остаточное количество меди из катализатора, однако нормы предельного содержания этого элемента не приведены. Остаточное содержание этого элемента в 123I-МИБГ не влияет на его производство и применение, напротив, использование катализатора на основе меди обеспечивает полноту протекания реакции радиойодирования без образования других побочных продуктов [22].
Исследуемые образцы 123I-МИБГ получены реакцией каталитического изотопного обмена стабильного йода на радионуклид. Уровень содержания элементных примесей в данном препарате низок. Обнаружено незначительное содержание алюминия (Сmin=0,033; Сmed=0,095; Сmax=0,212 ppm), меди (Сmin=0,326; Сmed=0,506; Сmax=0,624 ppm), бария (Сmin=0,023; Сmed=0,037; Сmax=0,038 ppm) и лития (Сmin=0,028; Сmed=0,032; Сmax=0,038 ppm. Содержание остальных элементов находится на уровне ниже предела обнаружения.
Натрия пертехнетат (99mTc) применяется для сцинтиграфии щитовидной и слюнных желез. Накапливаясь в щитовидной железе, он, в отличие от натрия йодида (131I), не участвует в синтезе тиреоидных гормонов [23]. Это обстоятельство позволяет использовать натрия пертехнетат (99mTc) для сцинтиграфических исследований щитовидной железы на фоне применения антитиреоидных препаратов, блокирующих захват йода щитовидной железой [24]. Кроме того, физические характеристики этого радионуклида хорошо подходят для ОФЭКТ-исследований, а его небольшой период полураспада приводит к минимальной лучевой нагрузке на пациента [25].
Испытуемые образцы натрия пертехнетата (99mTc) были получены через 12 ч после первого элюирования генератора 99mTc cо сроком эксплуатации не более 3 сут. Максимальный вклад в контаминацию натрия пертехнетата (99mTc) вносят Al (Сmin=0,015; Сmed=0,045; Сmax=0,802 ppm) и Zn (Сmin=0,054; Сmed=0,135; Сmax=0,264 ppm), Cu (Сmin=0,0; Сmed=0,033; Сmax=0,042 ppm) и Mn (Сmin=0,007; Сmed=0,261; Сmax=1,83 ppm). Содержание остальных элементов находится на уровне ниже предела обнаружения.
Алюминий — химическая примесь, о которой чаще всего сообщается при производстве натрия пертехнетата (99mTc) с помощью генератора на основе 99Mo. Катионы алюминия образуются при адсорбции 99Mo, когда сорбционная колонка, наполненная оксидом алюминия, подвергается воздействию сильнокислой среды [26][27]. Хотя последующая промывка генератора удаляет почти все ионы Al+3, полная очистка препарата от этой примеси практически невозможна [26]. При концентрациях ≥10 ppm Al образует с анионным пертехнетатом (99mTc) комплексы, которые накапливаются преимущественно в печени [28], что изменяет биораспределение данного РФЛП и негативно сказывается на эффективности диагностики патологических процессов щитовидной железы. В связи с этим требования к контролю остаточного содержания алюминия в натрия пертехнетате (99mTc) приведены практически во всех мировых фармакопеях [1]. Содержание алюминия во всех исследованных образцах натрия пертехнетата (99mTc) соответствует фармакопейным требованиям ГФ РФ XV изд. (≤5,0 мкг/мл)10.
Следует отметить, что в производстве исследованных образцов «Натрия пертехнетат (99mTc) раствор для инъекций» используют отечественные генераторы ГТ-4К, содержащие сорбционные колонки с сорбентом, упакованным слоями. Один из слоев содержит оксид алюминия в кислой форме, другой — силикагель, модифицированный оксидом марганца (IV) [29]. Такой сорбент является дополнительным источником контаминации РФЛП марганцем.
Обращает на себя внимание наличие примесей Al, Zn, Cu в большинстве проанализированных РФЛП (рис. 1). Наибольшие значения медианных уровней содержания примесей меди характерны для препаратов 18F-ФДГ, 18F-ПСМА-1007, натрия йодид (131I) и МИБГ (123I). Эти уровни близки между собой (среднее значение медианы 0,55±0,18 ppm). В препарате натрия йодогиппурат (131I) данный элемент отсутствует. По уровню контаминации алюминием и цинком резко выделяется препарат 18F-ПСМА-1007, на втором месте по загрязненности этими элементами находится 18F-ФДГ, полученный с использованием цитратного буфера. Наименее загрязненным по показателю «элементные примеси» является натрия пертехнетат (99mTc).
Необходимо подчеркнуть, что Al и Zn относятся к элементам с неустановленными значениями допустимого суточного воздействия вследствие их низкой токсичности, а Cu — к третьему классу токсичности11. Однако контроль над содержанием элементных примесей в РФЛП основывается не на оценке рисков их токсичного воздействия на организм человека, а на оценке рисков их негативного влияния на качественные характеристики препарата [1]. Принято считать, что если целью является излечение от онкологического заболевания, то даже значительные побочные эффекты, связанные с токсичностью примесей, являются приемлемыми [30].
ЗАКЛЮЧЕНИЕ
На основе проведенных экспериментальных исследований установлено, что элементные примеси Ag, As, Au, Bi, Be, Cd, Co, Cr, Ga, Ge, Hg, Ir, Mo, Nb, Ni, Os, Pb, Pd, Pt, Rh, Ru, Sb, Se, Sn, Tl, V, W не обнаружены ни в одном из анализируемых РФЛП. Практически во всех анализируемых РФЛП максимальный уровень в элементную контаминацию вносят элементы Al, Zn, Cu, которые относятся к категории нетоксичных или малотоксичных. Контроль над ними необходим в том случае, если они оказывают негативное влияние на качество РФЛП. В ОФЭКТ-РФЛП содержится значительно меньше элементных примесей по сравнению с ПЭТ-РФЛП. Во флудезоксиглюкозе (18F) уровень элементной контаминации во многом зависит от используемого буферного раствора. Для точного понимания источников элементной контаминации исследованных РФЛП необходимо проведение дополнительного анализа элементных примесей исходных материалов, реактивов и полупродуктов на всех стадиях технологического процесса. Кроме того, планируется разработка и валидация конкретных методик определения содержания, выявленных на этапе предварительного мониторинга элементных примесей, дающих максимальный вклад в контаминацию каждого из проанализированных РФЛП.
1 ОФС.1.11.0001 Радиофармацевтические лекарственные препараты. Государственная фармакопея Российской Федерации. XV изд. М.; 2023.
2 General monograph 04/2025:0125 Radiopharmaceutical preparations. European Pharmacopoeia. 11.8 ed. Strasbourg: EDQM; 2021.
3 Решение Коллегии ЕЭК от 04.10.2022 № 138 «Об утверждении Требований к проведению исследований (испытаний) лекарственных средств в части оценки и контроля содержания примесей».
4 ОФС.1.1.0040 Элементные примеси. Государственная фармакопея Российской Федерации. XV изд. М.; 2023.
5 Определение примесей элементов в радиофармацевтических препаратах. Государственная фармакопея СССР. XI изд. Вып. 1. М.: Медицина; 1987.
6 МУК 4.1.1483-03. Определение химических элементов в биологических средах и препаратах методами атомно-эмиссионной спектрометрии с индуктивно связанной плазмой и масс-спектрометрии с индуктивно связанной плазмой. М.: Федеральный центр госсанэпиднадзора Минздрава России; 2003.
7 Minimum requirements for radiopharmaceuticals. Japan Radiopharmaceuticals Association, Minister of Health, Labour and Welfare Ministerial Notification No. 83 (March 30, 2013).
8 04/2024:3116 PSMA-1007 (18F) Injection. European Pharmacopoeia. 11.8 ed. Strasbourg; EDQM: 2025.
9 https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=5dc19fce-78f0-4fda-b308-083ca3113607
10 ФС.3.5.0011 Натрия пертехнетат (99mTc), раствор для инъекций. Государственная фармакопея Российской Федерации. XV изд. М.; 2023.
11 ОФС.1.1.0040 Элементные примеси. Государственная фармакопея Российской Федерации. XV изд. М.; 2023.
Список литературы
1. Щукин ВМ, Кузьмина НЕ, Рузиев РД и др. Фармакопейные требования к содержанию элементных примесей в радиофармацевтических лекарственных препаратах (обзор). Регуляторные исследования и экспертиза лекарственных средств. 2025;15(4):421–33. https://doi.org/10.30895/1991-2919-2025-751
2. Нуркенов СА, Баратова АА, Турикбаев К. Исследование онкозаболеваний на основе 18F (FDG) и 99mTc. Вестник Казахского национального женского педагогического университета. 2019;(4):53–60. EDN: KAYSNM
3. Субботин АС, Пронин АИ, Оджарова АА, Комарова МА. Особенности накопления 18F-фтордезоксиглюкозы в опухолевой ткани при множественной миеломе. Онкогематология. 2021;16(3):40–9. https://doi.org/10.17650/1818-8346-2021-1 6-3-40-49
4. Long JZ, Jacobson MS, Hung JC. Comparison of FASTlab 18F-FDG production using phosphate and citrate buffer cassettes. J Nucl Med Technol. 2013;41(1):32–4. https://doi.org/10.2967/jnmt.112.112649
5. Lodi F, Boschi S. Quality control of PET radiopharmaceuticals. In: Khalil M, ed. Basic Science of PET Imaging. Springer Cham; 2016. P. 105–26. https://doi.org/10.1007/978-3-319-40070-9_5
6. Tavares AT, Martins PDA, Fukumori NTO, et al. Multielemental determination of trace elements in radiopharmaceuticals produced at the radiopharmacy center using ICP-OES technique. International Nuclear Atlantic Conference (INAC 2013). Recife, PE (Brazil); 2013.
7. Kilian K, Chabecki B, Kiec J, et al. Synthesis, quality control and determination of metallic impurities in 18F-fludeoxyglucose production process. Rep Pract Oncol Radiother. 2014;19(1):22–31. https://doi.org/10.1016/j.rpor.2014.03.001
8. Kilian K, Pęgier M, Pękal A, Pyrzyńska K. Distribution and separation of metallic and radionuclidic impurities in the production of 18F-fluorodeoxyglucose. J Radioanal Nucl Chem. 2016;307:1037–43. https://doi.org/10.1007/s10967-015-4328-6
9. Chochevska M, Velichkovska M, Lazareva MA, et al. Evaluation of factors with potential influence on [18F]FDG radiochemical synthesis yield. Appl Radiat Isot. 2023;199:110900. https://doi.org/10.1016/j.apradiso.2023.110900
10. Kumar R, Kumar A, Kumar A, et al. Significance of cartridges and resins used in a purification column during 18F-fluorodeoxyglucose synthesis. Indian J Nucl Med. 2022; 37(4):318–22. https://doi.org/10.4103/ijnm.ijnm_14_22
11. Бринкевич ДИ, Бринкевич СД, Барановский ОА и др. Долгоживущие радионуклиды в производстве 2-[18F] фтордезоксиглюкозы. Медицинская физика. 2018;(1):80–8. EDN: XMGXJR
12. Тер-Ованесов МД, Ягудаев ДМ, Аниканова ЕВ, Медведев КИ. Олигометастатический рак предстательной железы: локальное лечение и метастазнаправленная терапия. Онкоурология. 2024;20(1):146–52. https://doi.org/10.17650/1726-9776-2024-20-1-146-152
13. Okarvi SM. Recent developments of prostate-specific membrane antigen (PSMA)-specific radiopharmaceuticals for precise imaging and therapy of prostate cancer: an overview. Clin Transl Imaging. 2019;(7):189–208. https://doi.org/10.1007/s40336-019-00326-3
14. Леонтьев АВ, Рубцова НА, Халимон АИ и др. Применение радиомеченых лигандов к простатспецифическому мембранному антигену для определения локализации биохимического рецидива рака предстательной железы методом ПЭТ/КТ (обзор литературы). Медицинская визуализация. 2018;(3):81–97. https://doi.org/10.24835/1607-0763-2018-3-81-97
15. Pastorino S, Riondato M, Uccelli L, et al. Toward the discovery and development of PSMA targeted inhibitors for nuclear medicine applications. Curr Radiopharm. 2020;13(1):63–79. https://doi.org/10.2174/1874471012666190729151540
16. Giovanella L, Avram AM, Ovčariček PP, Clerc J. Thyroid functional and molecular imaging. Presse Med. 2022;51(2):104116. https://doi.org/110.1016/j.lpm.2022.104116
17. Happel C, Kranert WT, Bockisch B, et al. The influence of thyroid hormone medication on intra-therapeutic half-life of 131I during radioiodine therapy of solitary toxic thyroid nodules. Sci Rep. 2022;12(1):3925. https://doi.org/10.1038/s41598-022-18170-3
18. Pathuri G, Hedrick AF, Awasthi V, et al. Synthesis and in vivo evaluation of ortho-[124I] iodohippurate for PET renography in healthy rats. Appl Radiat Isot. 2016;(115):251–5. https://doi.org/10.1016/j.apradiso.2016.07.002
19. Taylor AT. Nuclear medicine imaging techniques of the kidney. In: Ahmadzadehfar H, Biersack HJ, Freeman L, Zuckier L, eds. Clinical nuclear medicine. Springer Cham; 2020. Р. 323–55. https://doi.org/10.1007/978-3-030-39457-8_8
20. Chang MC, Peng CL, Chen CT, et al. Iodine-123 Metaiodobenzylguanidine (I-123 MIBG) in clinical applications: A comprehensive review. Pharmaceuticals (Basel). 2024;17(12):1563. https://doi.org/10.3390/ph17121563
21. Monzio Compagnoni G, Appollonio I, Ferrarese C. The role of 123I-MIBG cardiac scintigraphy in the differential diagnosis between dementia with Lewy bodies and Alzheimer’s disease. Neurol Sci. 2024;45(8):3599–609. https://doi.org/10.1007/s10072-024-07476-x
22. McErlain H, Andrews MJ, Watson AJ, et al. Ligand-enabled copper-mediated radioiodination of arenes. Org Lett. 2024;26(7):1528–32. https://doi.org/10.1021/acs.orglett.4c00356
23. Lv X, Yin L, Wu W, et al. Quantitative scintigraphy evaluated the relationship between 131I therapy and salivary glands function in DTC patients: A retrospective analysis. J Healthc Eng. 2022;7640405. https://doi.org/10.1155/2022/7640405
24. Chen YC, Chen HY, Hsu CH. Recent advances in salivary scintigraphic evaluation of salivary gland function. Diagnostics (Basel). 2021;11(7):1173. https://doi.org/10.3390/diagnostics11071173
25. MacPherson DS, Fung K, Cook BE, et al. A brief overview of metal complexes as nuclear imaging agents. Dalton Trans. 2019;48(39):14547–65. https://doi.org/10.1039/c9dt03039e
26. Ahmad M, Pervez S, Hussain S, et al. Evaluation of Pakgen 99mTc generators loaded with indigenous fission 99Mo. Radiochimica Acta. 2012;100(10):793–801. https://doi.org/10.1524/ract.2012.1945
27. Vallabhajosula S, Killeen RP, Osborne JR. Altered biodistribution of radiopharmaceuticals: role of radiochemical/pharmaceutical purity, physiological, and pharmacologic factors. Semin Nucl Med. 2010;40(4):220–41. https://doi.org/10.1053/j.semnuclmed.2010.02.004
28. Shukla SK. Effect of aluminium impurities in the generator-produced pertechnetate-99m ion on thyroid scintigrams. Eur J Nucl Med. 1977;2(3):137–41. https://doi.org/10.1007/bf00257269
29. Дуфлот ВР, Китаева НК, Ильичева НС. Генератор технеция-99m с сульфо-карбоксилированным катионнообменным защитным слоем и способ его получения Патент Российской Федерации № 2443030 C2; 2012. EDN: GEUXQE
30. Трякин АА, Бесова НС, Волков НМ и др. Общие принципы проведения противоопухолевой лекарственной терапии. Злокачественные опухоли. 2023;13(3s2–1):28–41. https://doi.org/10.18027/2224-5057-2023-1 3-3s2-1-28-41
Об авторах
Ю. Н. ШвецоваРоссия
Швецова Юлия Николаевна.
Петровский б-р, д. 8, стр. 2, Москва, 127051
А. А. Ерина
Россия
Ерина Алина Андреевна.
Петровский б-р, д. 8, стр. 2, Москва, 127051
В. М. Щукин
Россия
Щукин Виктор Михайлович - канд. фарм. наук.
Петровский б-р, д. 8, стр. 2, Москва, 127051
Н. Е. Кузьмина
Россия
Кузьмина Наталия Евгеньевна - д-р хим. наук.
Петровский б-р, д. 8, стр. 2, Москва, 127051
Р. Д. Рузиев
Россия
Рузиев Рамзес Джауланович - канд. хим. наук.
Петровский б-р, д. 8, стр. 2, Москва, 127051
Д. А. Припадчев
Россия
Припадчев Дмитрий Анатольевич - канд. хим. наук.
Петровский б-р, д. 8, стр. 2, Москва, 127051
М. А. Кузнецов
Россия
Кузнецов Михаил Анатольевич.
Петровский б-р, д. 8, стр. 2, Москва, 127051
Дополнительные файлы
Рецензия
Для цитирования:
Швецова Ю.Н., Ерина А.А., Щукин В.М., Кузьмина Н.Е., Рузиев Р.Д., Припадчев Д.А., Кузнецов М.А. Определение методом масс-спектрометрии с индуктивно-связанной плазмой содержания элементных примесей в российских радиофармацевтических лекарственных препаратах. Регуляторные исследования и экспертиза лекарственных средств. 2025;15(4):434-443. https://doi.org/10.30895/1991-2919-2025-15-4-434-443
For citation:
Shvetsova Yu.N., Erina A.A., Shchukin V.M., Kuz'mina N.E., Ruziev R.D., Pripadchev D.A., Kuznetsov M.A. Detecting Elemental Impurities by Inductively Coupled Plasma Mass Spectrometry in Russian Radiopharmaceuticals. Regulatory Research and Medicine Evaluation. 2025;15(4):434-443. (In Russ.) https://doi.org/10.30895/1991-2919-2025-15-4-434-443



































