Перейти к:
Сравнение условий выделения микроорганизмов-контаминантов при микробиологическом мониторинге
https://doi.org/10.30895/1991-2919-2024-14-4-483-492
Резюме
ВВЕДЕНИЕ. Программы микробиологического мониторинга состояния помещений для фармацевтического производства, включенные в нормативные документы разного уровня, различаются. В частности, это касается условий проведения эксперимента: используемых питательных сред, температуры и времени инкубации. Для унификации процедур контроля качества необходимо разработать единую стратегию обработки проб микробиологического анализа.
ЦЕЛЬ. Определение оптимальных условий инкубации посевов при микробиологическом мониторинге «чистых» помещений.
МАТЕРИАЛЫ И МЕТОДЫ. Проведено сравнение условий культивирования тест-штаммов Bacillus subtilis ATCC 6633, Staphylococcus aureus ATCC 6538, Pseudomonas aeruginosa ATCC 9027, Candida albicans ATCC 10231, Aspergillus brasiliensis ATCC 16404, Aspergillus fumigatus ВКПМ F-62, Aspergillus terreus ВКПМ F-1269, Penicillium chrysogenum ВКПМ F-3, а также изолятов из окружающей среды Staphylococcus epidermidis, Kocuria rosea, Micrococcus luteus, Bacillus spp., Sphingomonas paucimobilis. Питательные среды: триптиказо-соевый агар (TSA), агар Сабуро с декстрозой и хлорамфениколом (SDCA), агар Ризонера (R2A). Режимы инкубации: 2 сут при 30–35 ºС, затем 3 сут при 20–25 ºС; 3 сут при 20–25 ºС, затем 2 сут при 30–35 ºС; 48–72 ч при 30–35 ºС (культивирование аэробных бактерий); 5–7 сут при 20–25 ºС (культивирование дрожжевых и плесневых грибов).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ. При культивации бактерий в среде TSA и R2A статистически значимых различий результатов, полученных при разных температурных условиях, выявлено не было. Коэффициент прорастания изолятов из окружающей среды был существенно ниже (на 19–37%) в случае их выращивания на TSA при двухтемпературной схеме инкубации (первоначальное выдерживание посевов при более низкой температуре). Выявлены группы микроорганизмов (бактерии с угнетенными физиологическими функциями и замедленным ростом, а также плесневые грибы), требующие при микробиологическом мониторинге подбора условий культивирования.
ВЫВОДЫ. Установлена необходимость стандартизации выполнения микробиологического анализа при мониторинге и его регламентация в установленном порядке в виде общей фармакопейной статьи. Показана возможность использования при микробиологическом мониторинге в качестве питательной среды как триптиказо-соевого агара, так и агара Ризонера. Применение двухтемпературной схемы инкубации с использованием одной неселективной питательной среды требует валидации в каждом конкретном случае. При культивировании тест-штаммов последовательность изменения температуры не оказывает влияния на коэффициент их прорастания, однако в случае бактерий, выделенных из окружающей среды, предпочтительным следует считать режим инкубации с более высокой температурой (30–35 ºС) на начальном этапе инкубации.
Ключевые слова
Для цитирования:
Гунар О.В., Сахно Н.Г., Тынчерова О.С. Сравнение условий выделения микроорганизмов-контаминантов при микробиологическом мониторинге. Регуляторные исследования и экспертиза лекарственных средств. 2024;14(4):483-492. https://doi.org/10.30895/1991-2919-2024-14-4-483-492
For citation:
Gunar O.V., Sakhno N.G., Tyncherova O.S. Comparison of Incubation Conditions for Microbial Contaminant Isolation in Microbiological Environmental Monitoring. Regulatory Research and Medicine Evaluation. 2024;14(4):483-492. (In Russ.) https://doi.org/10.30895/1991-2919-2024-14-4-483-492
ВВЕДЕНИЕ
Микробная контаминация лекарственных средств (ЛС), снижающая их эффективность и безопасность применения, может возникнуть на любой стадии производственного процесса. Ключевым инструментом обнаружения и снижения потенциальных производственных рисков контаминации является микробиологический мониторинг, представляющий собой комплекс мероприятий, направленных на обеспечение контроля состояния критически важных параметров окружающей среды и систем фармацевтического предприятия (персонала, воздуха, поверхностей, систем подготовки сжатого воздуха и воды и др.). Необходимость разработки единой научно обоснованной программы микробиологического мониторинга подчеркивается в нескольких отраслевых руководствах1, однако имеющиеся в различных национальных и международных нормативных документах практические рекомендации по процедуре проведения исследований различаются. Единая стратегия обработки проб, исследуемых в рамках микробиологического мониторинга, в настоящее время отсутствует.
Наиболее значимыми источниками микробного загрязнения являются персонал, рабочие поверхности, воздух, вода [1–4]. Для каждого из них можно определить характерный видовой состав микрофлоры. Так, более 50% всех изолятов представляют собой аборигенные для человека виды грамположительных кокков (например, Micrococcus spp., Staphylococcus spp., Propionibacterium spp., Kocuria spp.) [1]. Источником грамотрицательных бактерий, таких как Pseudomonas spp., Burkholderia cepacia, Ralstonia pickettii и др., как правило, является вода [5]. Bacillus spp., Corynebacterium spp., дрожжевые грибы Saccharomyces spp., Rhodotorula rubra, а также плесневые грибы Aspergillus spp. и Penicillium spp. наиболее часто обнаруживаются в образцах воздуха и на поверхностях [4–6]. Очевидно, оптимальные условия жизнедеятельности каждого из этих микроорганизмов различаются, и учесть их при микробиологическом мониторинге довольно сложно.
Цель работы — определение оптимальных условий инкубации посевов при микробиологическом мониторинге «чистых» помещений.
МАТЕРИАЛЫ И МЕТОДЫ
При планировании эксперимента было проведено изучение отечественной и зарубежной нормативной документации, регламентирующей асептические процессы в фармацевтическом производстве2, а также процедуру микробиологического мониторинга производственных «чистых» помещений3.
В работе использовали тест-штаммы бактерий, дрожжевых и плесневых грибов, депонированные в официальных коллекциях: Bacillus subtilis ATCC 6633, Staphylococcus aureus ATCC 6538, Pseudomonas aeruginosa ATCC 9027, Candida albicans ATCC 10231, Aspergillus brasiliensis ATCC 16404, Aspergillus fumigatus ВКПМ F-62, Aspergillus terreus ВКПМ F-1269, Penicillium chrysogenum ВКПМ F-3. Помимо этого использовали бактерии, выделенные из окружающей среды и идентифицированные с помощью анализатора бактериологического Vitek2Compact30 (Biomerieux): Staphylococcus epidermidis, Kocuria rosea, Micrococcus luteus, Bacillus spp., Sphingomonas paucimobilis.
Все работы производили в контролируемых условиях шкафа ламинарного Purifier Logic A2 (Labconco corp.).
Культуры, выращенные на скошенной агаризованной среде в течение 24 ч, смывали с помощью стерильного раствора натрия хлорида 0,9%, стандартизовали с использованием оптического стандарта мутности ВОЗ 10 ЕД и доводили до требуемой концентрации методом серийных разведений. Посев производили поверхностным чашечным агаровым методом на готовые к применению питательные среды: триптиказо-соевый агар (TSA) (Biomerieux, кат. № 41466), агар Сабуро с декстрозой и хлорамфениколом (SDCA) (Biomerieux, кат. № 42620), а также агар Ризонера (R2A), приготовленный в лаборатории из сухой питательной среды (Liofilchem S.r.l, кат. № 610129) в трехкратной повторности.
Инкубацию посевов проводили в инкубаторах BD-240 и КB-115 (Binder) в следующих условиях:
- режим «33→23ºС» — 2 сут при 30–35 ºС, затем 3 сут при 20–25 ºС;
- режим «23→33ºС» — 3 сут при 20–25 ºС, затем 2 сут при 30–35 ºС;
- режим «33ºС» — 48–72 ч при 30–35 ºС (культивирование аэробных бактерий);
- режим «23ºС» 5–7 сут при 20–25 ºС (культивирование дрожжевых и плесневых грибов).
Для получения статистически значимых результатов эксперименты выполняли многократно (n≥6) в условиях внутрилабораторной прецизионности: при сравнении питательных сред TSA и R2A для каждого температурного режима было выполнено 8 определений; коэффициент прорастания микроорганизмов (Кпр,%) на триптиказо-соевом агаре при разных режимах инкубирования рассчитывали по результатам 8 определений; изучение динамики роста бактерий K. rosea выполняли в ходе 6 определений; выявление оптимальных условий культивирования плесневых грибов проводили с использованием массива данных нескольких определений, содержащих не менее 35 единичных значений для каждого режима инкубации.
Посевы просматривали ежедневно, по окончании срока инкубации выполняли подсчет колоний с помощью счетчика Scan 100 (Interscience).
Перед статистической обработкой результатов проводили оценку их нормальности с помощью теста Шапиро–Уилка (α=0,05) и на основании полученных данных выбирали инструмент для выполнения дисперсионного анализа (P=95%): односторонний ANOVA или тест Краскела–Уоллиса. При обнаружении статистически значимых различий между группами проводили попарные сравнения с использованием апостериорных критериев Тьюки–Крамера или Данна соответственно.
Коэффициент прорастания Кпр микроорганизмов рассчитывали по формуле (1).
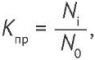 (1)
(1)
где Ni — количество колоний, выросших при двухтемпературной схеме инкубации, N0 — количество колоний, выросших в условиях инкубации при постоянной температуре, выбранной с учетом вида микроорганизма.
Удельную скорость роста штамма (μ, ч-1) определяли по формуле (2), время удвоения концентрации микробных клеток (Td, ч) — по формуле (3).
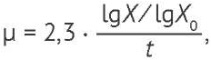 (2)
(2)
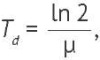 (3)
(3)
где Х0 и Х — начальная и конечная концентрации клеток (КОЕ/см3); t — время культивирования микроорганизмов (ч).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Изучение нормативной документации. Представленные в нормативных документах требования, регламентирующие условия проведения микробиологического мониторинга, в том числе питательные среды, температуру и длительность инкубации посевов, существенно различаются (табл. 1).
Таблица 1. Питательные среды и режимы инкубации посевов
образцов микробиологического мониторинга
Table 1. Culture media and incubation regimes for microbiological monitoring samples
|
Нормативный документ Regulatory document |
Питательные среды* Culture media* |
Условия инкубации Incubation conditions |
|
Рекомендация Коллегии ЕЭК от 01.03.2021 № 6a Recommendation No. 6 of the EEC Board dated 03/01/2021 |
Неселективные фармакопейные или эквивалентные им готовые питательные среды Non-selective pharmacopoeial or equivalent ready-to-use culture media |
30–35 ºС, 48–72 ч (выделение аэробных бактерий)**; 20–25 ºС, 5–7 сут (выделение дрожжевых и плесневых грибов) 30–35 ºС, 48–72 h (isolation of aerobic bacteria)**; 20–25 ºС, 5–7 days (isolation of yeasts and moulds) |
|
ГОСТ ИСО 14698-1-2005b GOST ISO 14698-1-2005 |
Неселективные питательные среды Non-selective culture media |
2–5 сут (выделение бактерий); 5–7 сут (выделение грибов) 2–5 days (isolation of bacteria); 5–7 days (isolation of yeasts and moulds) |
|
МУК 4.2.734-99c MUK 4.2.734-99 |
Среда № 1 (выделение бактерий); среда № 2 (агар Сабуро) — выделение грибов Culture medium 1 (isolation of bacteria); Culture medium 2 (Sabouraud’s agar) (isolation of fungi) |
30–35 ºС, 48 ч 20–25 ºС, 72 ч 30–35 ºС, 48 h 20–25 ºС, 72 h |
|
USP <1116>d |
Соево-казеиновая питательная среда; агар Сабуро, модифицированный агар Сабуро или агар, ингибирующий рост плесневых грибов; селективная питательная среда Soybean–casein digest medium (SCDM); Sabouraud’s agar, modified Sabouraud’s agar, or inhibitory mould agar; selective media |
20–35 ºС, не менее 72 ч (аэробные и/или анаэробные условия)***; двухтемпературная схема инкубации, сначала при более высокой температуре; требования технической документации селективной питательной среды 20–35 ºС, ≥72 h (aerobic and/or anoxic conditions)***; two-tiered incubation scheme, starting at a higher temperature; technical requirements for selective culture media |
|
PDA Technical report No. 13e |
Соево-казеиновая питательная среда или триптиказо-соевый агар; агар Сабуро или модифицированный агар Сабуро; триптиказо-соевый бульон (для тампонных проб при мониторинге в помещениях класса А) Soybean–casein digest medium (SCDM) or trypticase soy agar (TSA) Sabouraud’s agar or modified Sabouraud’s agar; Tryptic soy broth (for swabs performed in Grade A clean rooms) |
30–35 ºС, 48–72 ч (аэробные и/или анаэробные условия)***; 20–25 ºС, 5–7 сут*** 1) двухтемпературная схема инкубации, сначала при низкой температуре; 2) несколько схем инкубации 30–35 ºС, 48–72 h (aerobic and/or anoxic conditions)***; 20–25 ºС, 5–7 days*** 1) two-tiered incubation scheme, starting at a lower temperature; 2) multiple incubation schemes |
Таблица составлена авторами / The table is prepared by the authors
a Рекомендация Коллегии Евразийской экономической комиссии от 01.03.2021 № 6 «О Руководстве по асептическим процессам в фармацевтическом производстве».
Recommendation No. 6 of the Board of the Eurasian Economic Commission (EEC) dated 03/01/2021 On the Guidelines for aseptic processes in pharmaceutical production.
b ГОСТ ИСО 14698-1-2005 Чистые помещения и связанные с ними контролируемые среды. Контроль биозагрязнений. Часть 1. Общие принципы и методы.
Russian State Standard GOST ISO 14698-1-2005 Clean rooms and associated controlled environments. Biocontamination control. Part 1. General principles and methods.
c МУК 4.2.734-99. 4. Методы контроля. Микробиологический мониторинг производственной среды. Методические указания.
Russian Methodological Guidelines MUK 4.2.734-99 Control methods. Microbiological environmental monitoring. Methodological guidelines.
d USP <1116> Microbiological control and monitoring of aseptic processing environments.
e PDA Technical Report No. 13 Revised 2022 (TR 13) Fundamentals of an Environmental Monitoring Program.
Примечание. * — могут содержать нейтрализаторы; ** — срок инкубации может быть обоснованно сокращен или увеличен; *** — срок инкубации может быть увеличен для выделения медленнорастущих видов.
Note. * may contain neutralisers; ** may be reasonably shortened or extended; *** may be extended to isolate slow-growing species.
Влияние питательной среды и температуры инкубирования на выделение бактерий. Как показывают некоторые исследования, наиболее эффективной питательной средой для выделения широкого спектра бактерий и грибов из окружающей среды фармацевтического производства является триптиказо-соевый агар (TSA) [7–9]. В отдельных работах подчеркивается возможность применения агара Ризонера (R2A) для оценки загрязнения воздуха [10][11]. Данная питательная среда была создана для стимулирования роста медленнорастущих гетеротрофных бактерий и нашла широкое применение при анализе воды [12–14].
В настоящей работе выполнено экспериментальное сравнение питательных сред TSA и R2A для выделения микроорганизмов (тест-штаммов бактерий, дрожжевых и плесневых грибов, а также изолятов из окружающей среды), в ходе которого не было выявлено статистически значимых различий полученных результатов (рассчитанное значение критерия Фишера Fc=1,28 не превышало табличное Ft(0,05;52;52)=1,59). Однако объективная оценка влияния состава питательной среды невозможна без учета температурных условий инкубации.
В настоящее время в практику фармацевтических микробиологов вводится использование двухтемпературной схемы инкубации [15], несмотря на то что при низкой температуре, поддерживаемой на первом этапе инкубации, может подавляться рост грамположительных кокков4. Следует отметить, что в настоящем исследовании подавления роста бактерий не наблюдалось (табл. 2).
Таблица 2. Результаты инкубирования бактериальных культур в различных условиях
Table 2. Effects of different incubation conditions on bacterial cultures
|
Параметр Parameter |
Условия культивирования Culture conditions |
|||||
|
Триптиказо-соевый агар (TSA) Trypticase soy agar |
Агар Ризонера (R2A) Reasoner’s 2A agar |
|||||
|
33 ºC |
33→23 ºС |
23→33 ºC |
33 ºC |
33→23 ºC |
23→33 ºC |
|
|
Нормальность Normality |
0,65 |
0,58 |
0,98 |
0,13 |
0,06 |
0,67 |
|
Среднее (n=8), КОЕ Mean (n=8), CFU |
38,63 |
35,50 |
33,63 |
36,13 |
32,00 |
37,50 |
|
Стандартное отклонение (S) Standard deviation (S) |
10,08 |
15,03 |
9,71 |
15,55 |
26,75 |
10,99 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. В эксперименте использовали тест-штаммы Bacillus subtilis ATCC 6633, Staphylococcus aureus ATCC 6538, Pseudomonas aeruginosa ATCC 9027; изоляты Bacillus spp., Sphingomonas paucimobilis; n — размер выборки
Note. The experiment used Bacillus subtilis ATCC 6633, Staphylococcus aureus ATCC 6538, and Pseudomonas aeruginosa test strains and Bacillus spp. and Sphingomonas paucimobilis environmental isolates. n, sample size
Проведенное сравнение показало отсутствие статистически значимых различий между выборочными средними значениями всех групп полученных результатов (рассчитанное значение критерия Фишера (Fc=0,19) меньше табличного Ft=2,44) (табл. 2). Ни температурный режим инкубации, ни используемая питательная среда не оказывали влияние на выделение (рост) изучаемых в настоящей работе бактерий. Сравнение количества бактерий, выросших на TSA при разных режимах инкубации, выявило, что коэффициент прорастания бактерий, выделенных из окружающей среды, существенно различался (на 19–37%) в зависимости от температурных условий (табл. 3). В качестве критерия приемлемости при интерпретации полученных данных (табл. 3) использовали значение «не менее 70%»5. Обнаружено, что лишь в случае бактерий K. rosea установленное требование не выполнялось.
Таблица 3. Коэффициент прорастания микроорганизмов на триптиказо-соевом агаре
при разных режимах инкубирования (размер выборки, n=6)
Table 3. Germination rates of microorganisms on trypticase soy agar
under different incubation regimes (sample size, n=6)
|
Микроорганизм Microorganism |
Коэффициент прорастания микроорганизмов Microorganism germination rate Кпр, % |
|
|
Режим инкубации посевов Culture incubation regime |
||
|
33→23 ºC |
23→33 ºC |
|
|
Bacillus subtilis ATCC 6633 |
106 |
106 |
|
Staphylococcus aureus ATCC 6538 |
96 |
92 |
|
Pseudomonas aeruginosa ATCC 9027 |
97 |
93 |
|
Staphylococcus epidermidis |
98 |
161 |
|
Kocuria rosea |
42 |
5 |
|
Micrococcus luteus |
102 |
75 |
|
Bacillus spp. |
111 |
86 |
|
Sphingomonas paucimobilis |
132 |
113 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Динамика роста бактерий K. rosea, выделенных из окружающей лабораторной среды. Микроорганизмы, присутствующие в окружающей среде фармацевтического производства, находятся под воздействием различных физических, химических или биологических факторов. Влияние стрессовых условий приводит к запуску адаптационных механизмов и вызывает краткосрочные или долгосрочные изменения физиологии микробных клеток [16–19]. Одним из примеров служит более продолжительная лаг-фаза у выделенных микроорганизмов по сравнению с музейными штаммами [20]. Как следствие, для роста производственных изолятов требуется немного более длительный период культивирования (на 2–4 сут) [20].
Температура является важным фактором регулирования роста микроорганизмов, поскольку она напрямую влияет на различные клеточные компоненты и метаболические процессы. Некоторые внутриклеточные биомолекулы, такие как ДНК, РНК, липиды и белки, могут служить бактериям в качестве термосенсоров, позволяющих детектировать изменение температуры окружающей среды [23–25]. Патогенные микроорганизмы (например, E. coli, S. aureus, P. aeruginosa, Salmonella spp. и др.) используют такие механизмы восприятия температуры для запуска экспрессии генов вирулентности, контроля подвижности и развития биопленок [24–26]. Среди механизмов адаптации выделяют индукцию белков теплового (холодового) шока, которая, в свою очередь, приводит к модификациям клеточной мембраны, изменению ферментативной активности и транспорта питательных веществ, а также к снижению скорости роста [8][17–20].
В настоящей работе был использован выделенный из окружающей лабораторной среды штамм K. rosea, характеризующийся замедленным ростом.
Микроорганизмы K. rosea способны расти при 10–45 ºC, оптимальным температурным диапазоном является 20–30 ºC [21][22]. В этих условиях наблюдается максимальная удельная скорость роста, а также выработка молекулярных факторов устойчивости к неблагоприятным условиям окружающей среды [22]. Полученные в настоящем исследовании данные свидетельствуют о том, что наиболее подходящими условиями культивирования микроорганизмов с угнетенными физиологическими функциями и замедленным ростом, к которым можно отнести изучаемый изолят K. rosea, является инкубация на питательной среде TSA при одной температуре 30–35 ºC не менее 5 сут, что подтверждается динамикой роста (табл. 4, рис. 1).
Таблица 4. Кинетика роста Kocuria rosea на триптиказо-соевом агаре
при разных режимах инкубации
Table 4. Time course of Kocuria rosea growth on trypticase soy agar
under different incubation regimes
|
Параметр Parameter |
Условия инкубации Incubation conditions |
||
|
33 ºC |
33→23 ºC |
23→33 ºC |
|
|
Удельная скорость роста (μ, ч-1) Specific growth rate (μ, h-1) |
0,058 |
0,056 |
0,049 |
|
Время удвоения концентрации (Td , ч) Concentration doubling time (Td , h) |
11,95 |
12,38 |
14,15 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
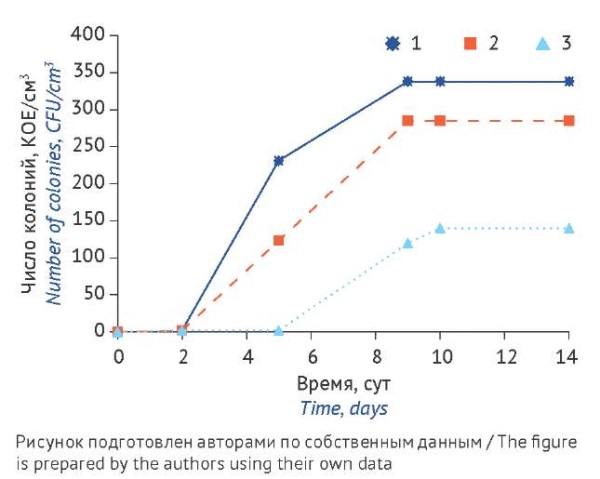
Рис. 1. Динамика роста Kocuria rosea при различных температурных режимах:
1 — постоянная температура 33 ºC,
2 — уменьшение температуры 33→23 ºC,
3 — увеличение температуры 23→33 ºC
Fig. 1. Time course of Kocuria rosea growth under different incubation regimes:
1, constant temperature (33 ºC);
2, decrease of temperature (33→23 ºC);
3, increase of temperature (23→33 ºC)
Определение оптимальных условий роста плесневых грибов. Одним из показателей качества воздуха производственной (лабораторной) среды является содержание плесневых грибов в пробах микробиологического мониторинга [27–29]. Для выделения грибов, как правило, используют рекомендованные рядом нормативных документов специальные микологические среды, такие как агар с экстрактом солода и агар Сабуро (с добавлением антибиотиков или без них) (табл. 1). Для большинства грибов-изолятов окружающей среды «чистых» помещений (например, Alternaria spp., Cladosporium spp., Trichophyton spp., Penicillium spp.), а также некоторых комменсалов кожи человека (Malassezia spp.) температурный оптимум роста (Topt) находится в диапазоне 20–25 ºС [15]. Другие виды, например Aspergillus spp., демонстрируют лучшие показатели роста при 30 ºС и выше [29].
По данным I. Symonds et al. [7] оптимальной температурой роста мезофильных неспорообразующих бактерий является 30–35 ºC, тогда как наилучшее восстановление дрожжевых и плесневых грибов и спорообразующих бактерий происходит при 20–25 ºC. Использование двухтемпературной инкубации (при 20–25 ºC в течение 3 сут с последующей инкубацией при 30–35 ºC в течение 2 сут) приводило к снижению количества выделяемых бактерий и грибов. Эти результаты согласуются с данными, полученными О. Gordon et al. [9], которые показали, что восстановление микроорганизмов при однотемпературных режимах инкубации происходит гораздо лучше, чем при двухтемпературной инкубации с первоначальной температурой 20–25 ºС. Помимо этого, авторами было продемонстрировано, что восстановление грибов и дрожжей происходит более эффективно при температуре 20–25 ºC.
Экспериментальное сравнение различных условий инкубации (табл. 5) выявило статистически значимое различие результатов количественного определения плесневых грибов: рассчитанное значение критерия Краскела–Уоллиса Hc=14,24 превышает его табличное значение Ht=9,49; p=0,007. Апостериорное попарное сравнение, выполненное с помощью критерия Данна (скорректированное с помощью поправки Бонферрони значение α=0,005), показало, что средние ранги существенно отличаются в группах 1 и 3, а также в группах 3 и 5. Это свидетельствует о том, что инкубация в условиях однотемпературного режима при температуре 33 ºC на питательной среде TSA не позволяет объективно оценить количественное содержание плесневых грибов. При этом наибольшее медианное количество колоний наблюдалось при использовании агара Сабуро.
Таблица 5. Сравнение условий инкубации посевов плесневых грибов
Table 5. Comparison of incubation conditions for mould cultures
|
Параметр Parameter |
Условия культивирования Culture conditions |
||||
|
Триптиказо-соевый агар Trypticase soy agar |
Агар Сабуро Sabouraud’s agar |
||||
|
1 |
2 |
3 |
4 |
5 |
|
|
33→23 ºС |
23→33 ºC |
33 ºC |
23 ºC |
23 ºC |
|
|
Медиана, КОЕ Median, CFU |
36 |
32 |
26 |
30 |
37 |
|
Размер выборки (n) Sample size (n) |
38 |
39 |
35 |
35 |
41 |
|
Средний ранг Mean rank score |
104,14 |
85,35 |
60,57 |
89,96 |
102,93 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
ВЫВОДЫ
- На основании анализа нормативно-правовой документации, устанавливающей для микробиологического мониторинга различные температурные режимы инкубации посевов на различных питательных средах, установлена необходимость стандартизации рассматриваемого процесса и его регламентация в установленном порядке в виде общей фармакопейной статьи.
- Показана возможность использования при микробиологическом мониторинге в качестве питательной среды как триптиказо-соевого агара, так и агара Ризонера.
- Применение двухтемпературной схемы инкубации с использованием одной неселективной питательной среды (например, TSA или R2A) в настоящее время документально не закреплено и требует валидации в каждом конкретном случае. В рамках выполненного исследования показано, что при культивировании тест-штаммов последовательность изменения температуры не оказывает влияния на коэффициент их прорастания (92–106%). Однако в случае бактерий, выделенных из окружающей среды, предпочтительным следует считать режим инкубации с более высокой температурой (30–35ºС) на начальном этапе инкубации.
Вклад авторов. Авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Н.Г. Сахно — подбор и анализ материалов литературы, выполнение эксперимента, написание текста рукописи; О.С. Тынчерова — выполнение эксперимента; О.В. Гунар — идея исследования, редактирование и критический пересмотр текста рукописи.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Nadezhda G. Sakhno selected and analysed literature, performed the experiments, and drafted the manuscript. Olga S. Tyncherova performed the experiments. Olga V. Gunar conceived the idea of research, edited the manuscript, and critically reviewed it.
1. Решение Совета Евразийской экономической комиссии от 03.11.2016 № 77 «Об утверждении Правил надлежащей производственной практики Евразийского экономического союза».
Приказ Минпромторга России от 14.06.2013 № 916 «Об утверждении Правил надлежащей производственной практики».
Рекомендация Коллегии Евразийской экономической комиссии от 01.03.2021 № 6 «О Руководстве по асептическим процессам в фармацевтическом производстве».
МУК 4.2.734-99. 4. Методы контроля. Микробиологический мониторинг производственной среды. Методические указания.
2. Рекомендация Коллегии Евразийской экономической комиссии от 01.03.2021 № 6 «О Руководстве по асептическим процессам в фармацевтическом производстве»
3. МУК 4.2.734-99. 4. Методы контроля. Микробиологический мониторинг производственной среды. Методические указания.
4. USP <1116> Microbiological control and monitoring of aseptic processing environments.
5. ОФС.1.1.0021.18 Валидация микробиологических методик. Государственная фармакопея Российской Федерации. XIV изд. М.; 2018.
Список литературы
1. Sandle T. A review of cleanroom microflora: types, trends, and patterns. PDA J Pharm Sci Technol. 2011;65(4):392–403. https://doi.org/10.5731/pdajpst.2011.00765
2. Jimenez L. Microbial contamination control in the pharmaceutical industry. Taylor & Francis; 2004. https://doi.org/10.1201/9780203026267
3. Jimenez L. Analysis of FDA enforcement reports (2012– 2019) to determine the microbial diversity in contaminated non-sterile and sterile drugs. Am Pharm Rev. 2019;21:48–73.
4. Griffith C. Surface sampling and the detection of contamination. In: Handbook of Hygiene Control in the Food Industry. 2016. P. 673–96. https://doi.org/10.1016/B978-0-08-100155-4.00044-3
5. Jimenez L. Microbial diversity in pharmaceutical product recalls and environments. PDA J Pharm Sci Technol. 2007;61(5):383–99. PMID: 18047177
6. Obuekwe CO, Obuekwe IF, Rafiq M. Surface microbial contamination in some commonly available tablet dosage forms. Med Princ Pract. 2001;9(4):290–9. https://doi.org/10.1159/000054256
7. Symonds I, Martin D, Davies M. Facility-based case study: a comparison of the recovery of naturally occurring species of bacteria and fungi on semi-solid media when incubated under standard and dual temperature conditions and its impact on microbial environmental monitoring approach. Eur J Parenter Pharm Sci. 2016;21(1): 7–15.
8. Weissfeld AS, Joseph RA, Le TV, Trevino EA, Schaeffer MF, Vance PH. Optimal media for use in air sampling to detect cultivable bacteria and fungi in the pharmacy. J Clin Microbiol. 2013;51(10):3172–5. https://doi.org/10.1128/JCM.00944-13
9. Gordon O, Berchtold M, Staerk A, Roesti D. Comparison of different incubation conditions for microbiological environmental monitoring. PDA J Pharm Sci Technol. 2014;68(5):394–406. https://doi.org/10.5731/pdajpst.2014.00994
10. Dziurzynski M, Ciuchcinski K, Dyda M, Szych A, Drabik P, Laudy A, et al. Assessment of bacterial contamination of air at the Museum of King John III’s Palace at Wilanow (Warsaw, Poland): selection of an optimal growth medium for analyzing airborne bacteria diversity. Appl Sci. 2020;10(20):7128. https://doi.org/10.3390/app10207128
11. Hyvärinen AM., Martikainen PJ, Nevalainen AI. Suitability of poor medium in counting total viable airborne bacteria. Grana. 1991;30(2):414–17. https://doi.org/10.1080/00173139109432000
12. Cao X, Xiong H, Fan Y, Xiong L. Comparing the effects of two culture methods to determine the total heterotrophic bacterial colony count in hospital purified water. J Epidemiol Glob Health. 2024;14(1):184–92. https://doi.org/10.1007/s44197-023-00186-1
13. Bugno A, Almodóvar AAB, Pereira TC. Enumeration of heterotrophic bacteria in water for dialysis: Comparison of the efficiency of Reasoner’2 agar and plate count agar. Braz J Microbiol. 2010;41(1):15–8. https://doi.org/10.1590/S1517-83822010000100003
14. Ćirić S, Olga P, Milenković D. Low-nutrient R2A medium in monitoring microbiological quality of drinking water. Chem Ind Chem Eng Q. 2010;16(1):39–45 https://doi.org/10.2298/CICEQ090603004C
15. Sandle T. Examination of the order of incubation for the recovery of bacteria and fungi from pharmaceutical-grade cleanrooms. Int J Pharm Compd. 2014;18(3):242–7. PMID: 25306772.
16. Tan YS, Zhang RK, Liu ZH, Li BZ, Yuan YJ. Microbial adaptation to enhance stress tolerance. Front Microbiol. 2022;13:888746. https://doi.org/10.3389/fmicb.2022.888746
17. Schumann W. Function and regulation of temperature-inducible bacterial proteins on the cellular metabolism. Adv Biochem Eng Biotechnol. 2000;67:1–33. https://doi.org/10.1007/3-540-47865-5_1
18. Dasila H, Maithani D, Suyal DC, Debbarma P. Cold-adapted microorganisms: survival strategies and biotechnological significance. In: Goel R., Soni R., Suyal DC, Khan M, eds. Survival strategies in cold-adapted microorganisms. Singapore: Springer; 2020. https://doi.org/10.1007/978-981-16-2625-8_16
19. Sagini JPN, Ligabue-Braun R. Fungal heat shock proteins: molecular phylogenetic insights into the host takeover. Sci Nat. 2024;111(2):16. https://doi.org/10.1007/s00114-024-01903-x
20. Sandle T. Examination of the growth rates of environmental isolates compared with compendial strains. EJPPS Eur J Parenter Pharm Sci. 2022:272. https://doi.org/10.37521/ejpps.27201
21. Nudelman BG, Ouellette T, Nguyen KQ, Schmaus WH, Chokshi RR. Kocuria rosea bacteremia in a sickle cell patient: a case report. Cureus. 14(9):e28870. https://doi.org/10.7759/cureus.28870
22. Timkina E, Drábová L, Palyzová A, Řezanka T, Maťátková O, Kolouchová I. Kocuria strains from unique radon spring water from Jachymov spa. Fermentation. 2022;8(1):35. https://doi.org/10.3390/fermentation8010035
23. Samtani H, Unni G, Khurana P. Microbial mechanisms of heat sensing. Indian J Microbiol. 2022;62(2):175–86. https://doi.org/10.1007/s12088-022-01009-w
24. Almblad H, Randall TE, Liu F, Leblanc K, Groves RA, Kittichotirat W, et al. Bacterial cyclic diguanylate signaling networks sense temperature. Nat Commun. 2021;12(1):1986. https://doi.org/10.1038/s41467-021-22176-2
25. Moon S, Ham S, Jeong J, Ku H, Kim H, Lee C. Temperature matters: bacterial response to temperature change. J Microbiol. 2023;61(3):343–57. https://doi.org/10.1007/s12275-023-00031-x
26. Solar Venero EC, Galeano MB, Luqman A, Ricardi MM, Serral F, Fernandez Do Porto D, et al. Fever-like temperature impacts on Staphylococcus aureus and Pseudomonas aeruginosa interaction, physiology, and virulence both in vitro and in vivo. BMC Biol. 2024;22:27. https://doi.org/10.1186/s12915-024-01830-3
27. Masia MD, Dettori M, Deriu GM, Soddu S, Deriu M, Arghittu A, et al. Microbial monitoring as a tool for prevent ing infectious risk in the operating room: results of 10 years of activity. Atmosphere. 2021;12(1):19. https://doi.org/10.3390/atmos12010019
28. Tomazin R, Matos T. Mycological methods for routine air sampling and interpretation of results in operating theaters. Diagnostics. 2024;14(3):288. https://doi.org/10.3390/diagnostics14030288
29. Vijayakumar R, Sandle T, Manoharan C. A review of fungal contamination in pharmaceutical products and phenotypic identification of contaminants by conventional methods. EJPPS Eur J Parenter Pharm Sci. 2012;17(1): 4–19.
Об авторах
О. В. ГунарРоссия
Гунар Ольга Викторовна, д-р фарм. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
Н. Г. Сахно
Россия
Сахно Надежда Геннадьевна, канд. фарм. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
О. С. Тынчерова
Россия
Тынчерова Ольга Сергеевна
Петровский б-р, д. 8, стр. 2, Москва, 127051
Дополнительные файлы
Рецензия
Для цитирования:
Гунар О.В., Сахно Н.Г., Тынчерова О.С. Сравнение условий выделения микроорганизмов-контаминантов при микробиологическом мониторинге. Регуляторные исследования и экспертиза лекарственных средств. 2024;14(4):483-492. https://doi.org/10.30895/1991-2919-2024-14-4-483-492
For citation:
Gunar O.V., Sakhno N.G., Tyncherova O.S. Comparison of Incubation Conditions for Microbial Contaminant Isolation in Microbiological Environmental Monitoring. Regulatory Research and Medicine Evaluation. 2024;14(4):483-492. (In Russ.) https://doi.org/10.30895/1991-2919-2024-14-4-483-492



































