Перейти к:
Практические аспекты функциональной оценки токсических поражений периферической нервной системы в доклинических исследованиях на грызунах: обзор
https://doi.org/10.30895/1991-2919-2024-14-3-265-282
Резюме
ВВЕДЕНИЕ. В практике доклинических исследований безопасности фармакологически активных веществ стандартные процедуры оценки нейротоксичности в основном нацелены на диагностику расстройств высшей нервной деятельности и поведения. Однако именно структуры периферической нервной системы ввиду большей уязвимости представляют собой доступную мишень, что обусловливает высокую распространенность нейротоксичных побочных эффектов лекарственных средств. Указанные обстоятельства определяют актуальность уточнения методических подходов к оценке токсических поражений периферической нервной системы.
ЦЕЛЬ. Анализ современного методического уровня клинико-функциональных тестов для оценки токсического действия фармакологически активных веществ на структуры периферической нервной системы и формулирование практических рекомендаций по их применению при проведении доклинических исследований на грызунах.
ОБСУЖДЕНИЕ. Оптимальной тест-системой для доклинических исследований фармакологически активных веществ считаются грызуны, однако используя этих животных невозможно воспроизвести весь объем неврологического осмотра, применяемого для выявления клинических эквивалентов нейротоксичности. В работе представлено описание системного подхода к использованию доступных диагностических тестов для повышения транслируемости данных. Дана краткая характеристика неврологического дефицита, вызванного побочными действиями лекарственных средств у людей, и описаны основные токсиндромы, которые также могут быть выявлены у животных. На основании обзора литературы и собственного опыта в соответствующих разделах представлены практические рекомендации по выполнению основных тестов, позволяющих исследовать силу и тонус мышц, состояние физиологических рефлексов, координацию движений и разные виды чувствительности у грызунов. Приведены краткие сведения о возможностях электрофизиологической диагностики искомых поражений. В качестве минимального перечня методик первичного скрининга нейротоксических побочных эффектов рекомендованы следующие тесты: оценка позы животного в покое и при ходьбе «Сужающаяся дорожка», «Подтягивание на горизонтальной перекладине», шкала отведения пальцев, «Тест отдергивания хвоста», рефлекс Прейера.
ВЫВОДЫ. Анализ результатов комплексной оценки неврологического дефицита в экспериментах на грызунах рекомендовано проводить клинически релевантным способом, то есть с позиций топической диагностики и общности звеньев патологического процесса. Целесообразно выполнять верификацию патологического процесса на уровне периферической нервной системы при помощи комплекса электрофизиологических методик.
Ключевые слова
Для цитирования:
Ильинский Н.С., Тюнин М.А., Чепур С.В., Пугач В.А., Мясников В.А. Практические аспекты функциональной оценки токсических поражений периферической нервной системы в доклинических исследованиях на грызунах: обзор. Регуляторные исследования и экспертиза лекарственных средств. 2024;14(3):265-282. https://doi.org/10.30895/1991-2919-2024-14-3-265-282
For citation:
Ilinskii N.S., Tyunin M.A., Chepur S.V., Pugach V.A., Myasnikov V.A. Practical Aspects of Assessing Toxic Lesions of the Peripheral Nervous System in Preclinical Studies in Rodents: A Review. Regulatory Research and Medicine Evaluation. 2024;14(3):265-282. (In Russ.) https://doi.org/10.30895/1991-2919-2024-14-3-265-282
ВВЕДЕНИЕ
Нейротоксичность — способность химических веществ, действуя на организм немеханическим путем, вызывать напрямую или опосредованно нарушение структуры и (или) функций нервной системы [1]. Порог чувствительности компонентов нервной системы к функциональному или структурному воздействию нейротоксичных веществ в ряде случаев существенно ниже, чем у других органов и систем организма. Вместе с тем наличие гематоэнцефалического, гематоликворного, а также периневрального барьеров налагает токсикодинамический запрет на реализацию нейротоксических эффектов множества соединений, для которых свойства нейротоксичности были прослежены в культурах клеток и тканей.
Необходимость скрининговой оценки нейротоксичности фармакологически активных веществ (ФАВ) в рамках доклинических исследований продиктована рядом российских и международных руководящих документов1 и составляет значительную часть всего объема исследований безопасности. В современной практике доклинические исследования безопасности ФАВ в первую очередь включают оценку расстройств интегральных функций нервной системы и не учитывают важность выявления изолированных нейротоксических эффектов на уровне центральной (ЦНС) или периферической (ПНС) нервной системы [2][3]. Вместе с тем в ряде случаев именно структуры ПНС подвержены изолированным, иногда отсроченным по мере формирования патологического процесса повреждениям в результате токсических эффектов ФАВ [4][5]. В ПНС к основным мишеням нейротоксического действия ФАВ относят тела двигательных и чувствительных нейронов, нейриты и их миелиновую оболочку, структуры эндо- и периневрия периферических нервов, а также нервно-мышечные синапсы (НМС). Следствием нейротоксичности ФАВ на уровне ПНС являются блоки проведения с разрушением дуг соматических или вегетативных рефлексов, диагностируемых в том числе по функциональным или органическим повреждениям скелетных мышц [6].
На данный момент нейротоксические эффекты на уровне ПНС описаны для широкого перечня лекарственных средств, в том числе из групп антибактериальных, противовирусных, антиаритмических, противоопухолевых препаратов, кортикостероидов, витаминов и статинов [6–10]. Согласно опубликованным данным, выявление нежелательных эффектов со стороны нервной системы обусловливает до 30% случаев прекращения исследований лекарственных препаратов на этапах клинических испытаний, что указывает на несовершенство методических подходов к оценке нейротоксичности при проведении доклинических исследований [11][12]. В настоящее время большинство доклинических исследований выполняют на грызунах, которые с учетом анатомо-физиологических особенностей строения нервной системы и относительно низкой стоимости исследований признаны оптимальными тест-объектами для скрининговой оценки нейротоксичности2 [13–15].
Доклинические исследования нейротропных ФАВ сопряжены с рядом проблем, связанных с недостаточным пониманием биологических основ заболеваний и неудовлетворительными прогностическими возможностями экспериментальных моделей3. По данной причине результаты оценки неврологического дефицита у грызунов зачастую представляют собой значения суррогатных характеристик, которые сложно интерпретировать и затруднительно транслировать в клиническую практику [13][16][17]. Следует признать, что присутствует вариативность выполнения широко известных диагностических методик, способная существенно повлиять на конечный результат оценки, а подробные стандартизированные методические руководства отсутствуют. Рядом авторов признана необходимость повышения точности доклинической оценки новых ФАВ в контексте определения нейротоксичности [12][17].
Токсические поражения ПНС представляют собой сочетание различных патологических процессов. Их прогрессия может быть реализована в виде проявлений расстройств движений (мышечная слабость или утомляемость), чувствительности (онемение, парестезии, гипералгезия/аллодиния, боль) и вегетативных функций, а также их сочетанием. Такое разнообразие нарушений вызвано тем, что моторные, сенсорные и вегетативные нейроны обладают различной чувствительностью к повреждающему воздействию ксенобиотиков [18]. Специалистам в области доклинических исследований важно помнить, что поражения ПНС не ограничены часто ожидаемой кумулятивной токсичностью. Нередко нейротоксические эффекты манифестируют мультимодальными проявлениями и возникают в поздние сроки, а также с дополнительным усилением непрямых отдаленных эффектов [17]. Эти механизмы в значительной степени зависят от токсических свойств ФАВ, а формы их проявления — от дозы и длительности введения.
Поэтому полноценная и всесторонняя оценка нарушений функций нервной системы в эксперименте должна иметь целью выявление пораженных структур по аналогии с принципами топической диагностики, используемой в клинической практике. В то же время у лабораторных животных невозможно полностью воспроизвести весь объем неврологического осмотра, необходимый для выявления клинических эквивалентов патологии человека, что подчеркивает необходимость системного подхода к использованию доступных диагностических тестов для повышения транслируемости данных. Именно этим определена актуальность настоящей работы.
Цель работы — анализ современного методического уровня клинико-функциональных тестов для оценки токсического действия фармакологически активных веществ на структуры периферической нервной системы и формулирование практических рекомендаций по их применению при проведении доклинических исследований на грызунах.
Поиск источников литературы осуществляли в базах данных PubMed, Google Scholar, eLIBRARY.RU по ключевым словам: нейротоксичность, грызуны, фармакологическая безопасность, клинико-функциональные тесты, полинейропатия, миастенический синдром. Глубина поиска источников — 30 лет.
ОСНОВНАЯ ЧАСТЬ
Токсические поражения периферической нервной системы
Рассматривая основные типы неврологического дефицита (табл. 1), традиционно оцениваемого в клинической практике, следует отметить, что в случаях токсических поражений ПНС наиболее показательны периферические расстройства двигательных и вегетативных функций, а также чувствительности. Расстройства сознания и других высших функций мозга в меньшей степени свойственны нейротоксикантам периферического действия либо возникают при их воздействии в крайне высоких дозах4 [6].
Таблица 1. Основные типы неврологического дефицита,
оцениваемые в клинической практике
Table 1. Main types of neurological deficits measured in clinical practice
|
Типы неврологического дефицита Neurological deficit types |
Подтипы неврологического дефицита (расстройств) Neurological deficit (disorder) subtypes |
Синдромы/симптомы Syndromes/symptoms |
|
Расстройства чувствительности Sensory disorders |
Общая чувствительность General senses |
Простая чувствительность: 1) поверхностная — болевая, температурная, тактильная 2) глубокая — вибрационная, мышечно-суставная Simple sensation: 1) superficial: pain, temperature, touch 2) deep: vibration, muscle and joint position (proprioception) |
|
Сложная чувствительность: локализация, стереогноз, дискриминационная чувствительность Complex sensation: touch localisation, stereognosis, two-point discrimination |
||
|
Специальная чувствительность Special senses |
Зрительная, слуховая, вкусовая Vision, hearing, taste |
|
|
Расстройства движений Movement disorders |
Непроизвольные движения Involuntary movements |
Рефлексы: поверхностные, глубокие, патологические Reflexes: superficial, deep, pathological |
|
Синкинезии: физиологические, патологические Synkineses: physiological, pathological |
||
|
Произвольные движения Voluntary movements |
Снижение мышечной силы, патологическая утомляемость Muscle weakness, pathological fatigue |
|
|
Координация движений Motor coordination |
Статическая: стояния, ходьбы, асинергии Static coordination: astasia, abasia, dyssynergia |
|
|
Динамическая: интенционный тремор, дисметрия, нистагм Dynamic coordination: intention tremor, dysmetria, nystagmus |
||
|
Экстрапирамидные расстройства Extrapyramidal symptoms |
Гипокинезия: гипомимия, мышечная ригидность, тремор покоя Hypokinesia: hypomimia, rigidity, rest tremor |
|
|
Гиперкинезы: хорея, атетоз, гемибаллизм и др. Hyperkinesia: chorea, athetosis, haemiballismus, etc. |
||
|
Расстройства сознания Disorders of consciousness |
Качественные Qualitative disorders |
Делирий, онейроид, аменция Delirium, oneiroid syndrome, amentia |
|
Количественные Quantitative disorders |
Оглушение, сопор, кома I–IV ст. Somnolentia, sopor, coma (grade I–IV) |
|
|
Расстройства высших мозговых (когнитивных) функций Disorders of higher brain functions (cognitive disorders) |
Агнозии Agnosia |
Астереогноз, зрительная, слуховая Astereognosis, visual agnosia, auditory agnosia |
|
Апраксии Apraxia |
Идеомоторная, глазодвигательная, концептуальная Ideomotor apraxia, oculomotor apraxia, conceptual apraxia |
|
|
Афазии Aphasia |
Моторная, сенсорная, эфферентная Motor aphasia, receptive aphasia, kinetic aphasia |
|
|
Расстройства вегетативных функций Vegetative function disorders |
Зрачковые реакции Pupillary responses |
|
|
Ортостатическая гипотензия, вариабельность ритма сердца, глазосердечный рефлекс Orthostatic hypotension, heart rate variability, oculocardiac reflex |
||
|
Дермографизм, потоотделение, терморегуляция Dermatographia, sweating, thermoregulation |
||
|
Нарушения функций тазовых органов Pelvic organ dysfunction |
||
Таблица составлена авторами / The table is prepared by the authors
Наиболее часто лекарственные токсические поражения ПНС манифестируют в форме симметричных дистальных аксональных (реже демиелинизирующих) полинейропатий (ПНП), скорость прогрессирования которых зависит от механизма действия, дозы и длительности приема ФАВ [10]. Признаки очаговых поражений нервов выявляют гораздо реже. К особенностям токсических ПНП относят вовлечение всех трех типов волокон, что сопровождается комбинированной сенсорно-моторно-вегетативной симптоматикой, однако выраженность этих компонентов может значительно отличаться для разных веществ [19]. Преимущественное поражение моторных (двигательных) волокон ПНС манифестирует проявлениями нарастающего пареза вплоть до тетрапареза, а избирательное поражение толстых миелинизированных чувствительных волокон опосредует расстройства глубокой чувствительности5. Для аксонопатий характерна быстрая прогрессия денервационной атрофии мышц, что предположительно связывают с прекращением аксоплазматического тока6. Демиелинизирующим ПНП менее свойственна атрофия мышц, которая возникает лишь при длительном течении патологического процесса [19]. Чувствительность аксонов к токсическим поражениям прямо пропорциональна их длине, поэтому признаки ПНП в первую очередь выявляют в дистальных участках самых протяженных нервов7. Значительно реже подвержены поражению черепные нервы: зрительный, глазодвигательный, лицевой, преддверно-улитковый [20][21]. В силу реализации компенсационных механизмов симптомы токсических поражений нервных сплетений редки, за исключением случаев локального воздействия местных анестетиков. Описано влияние на вегетативную систему всего нескольких лекарственных средств, в частности алкалоидов барвинка и статинов [10].
К основным клиническим проявлениям токсических ПНП относят онемение, парестезии, нейропатическую боль, снижение мышечного тонуса и вялые (периферические) парезы (мышечную слабость), которые распределены дистально по типу «перчаток и носков» [10]. Существует мнение, что при токсических ПНП нарушения чувствительности преобладают над двигательными расстройствами, однако такое действие свойственно далеко не всем веществам [19][22]. На фоне снижения глубокой чувствительности (в основном за счет мышечно-суставной и вибрационной) возникает сенситивная атаксия, снижаются или исчезают физиологические рефлексы. При выявлении симптоматики в проксимальных отделах конечностей следует предположить вовлечение спинномозговых корешков, описываемое термином «полирадикулоневропатия».
В случае токсических поражений пре- или постсинаптических структур НМС говорят о миастеническом синдроме (МС). При этом ведущим симптомом считают мышечную слабость (так же, как и при ПНП) или патологическую мышечную утомляемость, которые принято рассматривать как парез не неврогенной природы [19][22]. К признакам, отличающим МС от ПНП, относят сохранность физиологических рефлексов, отсутствие расстройств чувствительности, нарушений функций тазовых органов и амиотрофий [18][19].
В аспекте дифференциальной диагностики обращают внимание на важность оценки мышечной силы, физиологических рефлексов и тонуса мышц при подозрении на поражение ПНС. Однако такие методики недостаточно широко внедрены в рутинную экспериментальную практику, также нередко допускают ошибочное толкование указанных терминов. Вместе с этим следует понимать, что выраженные сенсорные и (или) моторные нарушения при ПНП или МС способны изменять поведенческие реакции животных в таких тестах, как открытое поле, реакции избегания, лабиринт Морриса и др., которые предназначены в первую очередь для исследования неврологических расстройств центрального генеза. В подобных случаях исследователями могут быть неверно интерпретированы результаты тестирования, если не выполнена оценка состояния функций на уровне ПНС.
Токсические расстройства движений разделяют на: 1) снижение силы или утомляемость (слабость); 2) тремор; 3) нарушения координации; 4) спазмы, миоклонию или аномальные движения (гипокинезию, гиперкинезы, патологические синкинезии) [23]. Обычно при токсических поражениях ПНС в клинической практике выявляют снижение силы или патологическую мышечную утомляемость (слабость). По нашему мнению, именно методы оценки расстройств движений и чувствительности в экспериментах на грызунах в силу объективности методического аппарата наиболее приемлемы для изучения нейротоксичности ФАВ и последующей трансляции данных в клиническую практику.
Характеристика нейротоксических эффектов некоторых лекарственных средств различных групп представлена в таблице 2.
Таблица 2. Некоторые лекарственные средства,
вызывающие токсические поражения периферической нервной системы
Table 2. Some medicines that cause toxic lesions of the peripheral nervous system
|
Лекарственные средства Medicines |
Токсиндром Toxidrome |
Механизм нейротоксического действия Neurotoxicity mechanism |
Источник Source |
|
Фторхинолоны Макролиды Аминогликозиды Fluoroquinolones Macrolides Aminoglycosides |
Миастенический синдром, ухудшение течения миастении Myasthenic syndrome (MS), deterioration of MS |
Прямые нарушения нервно-мышечной передачи на пре- и постсинаптическом уровне Direct impairment of neuromuscular transmission at pre- and postsynaptic levels |
[6][10] |
|
Статины Statins |
Миастенический синдром, ухудшение течения миастении, сенсорная полинейропатия MS, deterioration of MS, sensory polyneuropathy (PNP) |
Сдвиг поляризации Т-лимфоцитов, миопатия, повреждение митохондрий нейронов Shift in T-cell polarisation, myopathy, neuronal mitochondrial damage |
[6][7][10] |
|
Прокаинамид Препараты лития Procainamide Lithium products |
Миастенический синдром, ухудшение течения миастении MS, deterioration of MS |
Уменьшение образования и выделения ацетилхолина в нервных окончаниях, уменьшение числа постсинаптических Н-холинорецепторов Reduction of acetylcholine production in and release from nerve endings, decrease in the number of postsynaptic N-cholinergic receptors |
[6] |
|
Амиодарон Amiodarone |
Моторно-сенсорная полинейропатия Sensorimotor PNP |
Демиелинизация, потеря крупных аксонов с лизосомальными включениями; окислительный стресс и нарушение лизосомальной деградации Demyelination, loss of large axons with lysosomal inclusions; oxidative stress and impaired lysosomal degradation |
[7][8][10] |
|
Таксаны Taxanes |
Преимущественно сенсорная, в тяжелых случаях сенсомоторная полинейропатия Predominantly sensory PNP, with sensorimotor PNP in severe cases |
Нарушение метаболического кальциевого сигналинга, полимеризации тубулина Interference into metabolic calcium signaling, disruption of tubulin depolymerisation in axonal transport |
[7][9] |
|
Алкалоиды барвинка Vinca alkaloids |
Преимущественно сенсорная полинейропатия Predominantly sensory PNP |
Клеточная и аксональная транспортная дисфункция, опосредованная микротрубочками Dysfunction of cellular and axonal transport mediated by microtubules |
[7–9] |
|
Бортезомиб Талидомид Bortezomib Thalidomide |
Сенсорная полинейропатия тонких волокон, связанная со жгучей болью Small-fibre sensory PNP accompanied by burning pain |
Митохондриальная дисфункция в аксонах; высвобождение кальция митохондриями, приводящее к активации апоптотического каскада Mitochondrial dysfunction in axons, mitochondrial calcium release leading to apoptotic cascade activation |
[7–10] |
Таблица составлена авторами / The table is prepared by the authors
Оценка токсических поражений периферической нервной системы
В современной экспериментальной практике принято, что при оценке наиболее опасных побочных эффектов ФАВ должны быть реализованы максимальные интенсивность и глубина тестирования. Стратегии тестирования должны обеспечивать баланс между глубиной и широтой исследования ради получения основных исходных данных для оценки безопасности ФАВ. В случае необходимости должны быть проведены отдельные целевые исследования (например, электрофизиологические, морфологические, исследования in vitro / ex vivo) по уточнению механизмов вызываемых ФАВ нейротоксических эффектов [17][23]. Такой многоуровневый подход к тестированию может быть основан на качественном первичном неврологическом осмотре, который позволил бы адекватно и быстро выявить основные виды нарушений у животных [17][24]. С учетом этого ниже представлен анализ методологических особенностей выполнения некоторых клинико-функциональных тестов (КФТ) для выявления расстройств движений и чувствительности у грызунов.
К общим рекомендациям при проведении КФТ следует отнести необходимость предварительного отбора и обучения животных. Важно формировать у животных устойчивый навык выполнения методики при однотипных условиях. Не следует обогащать среду обитания в домашней клетке, поскольку регулярное перемещение животных по разным предметам может создать эффект «тренированности» и исказить результаты тестирования [24][25]. Желательно, чтобы неврологический осмотр одновременно выполняли два сотрудника в строгом соответствии со стандартной операционной процедурой. Несмотря на простоту выполнения КФТ, межисследовательская вариабельность оценки результатов представляет проблему при динамической регистрации неврологического дефицита и должна быть сведена к минимуму [24].
Следует избегать использования большого числа тестов, которые измеряют один и тот же параметр, например мелкую моторику передних конечностей или мышечную силу, поскольку каждый тест может увеличить выраженность стресса у животных. С целью уменьшения влияния систематических ошибок необходимо организовывать исследование в соответствии с устоявшимися принципами доказательной медицины (рандомизация, ослепление, контроль хода эксперимента, обоснованная статистическая обработка результатов), которые подробно описаны в работах [16][17].
Использование порядковых (ранговых) оценочных шкал представляет своего рода проблему, поскольку двукратное увеличение баллов не означает, что состояние одного животного в два раза лучше другого, поскольку отдельные части соответствующих тестов измеряют разные функции, но итоговые показатели интегрируют в единую оценку [23]. На наш взгляд, следует избегать совокупной балльной характеристики неврологического дефицита путем суммирования различных признаков, заменив это комплексным анализом полученных данных с позиций топической диагностики и общности звеньев патологического процесса.
Большинство из упомянутых в статье КФТ апробированы на моделях поражений ЦНС (черепно-мозговые травмы, острые нарушения мозгового кровообращения, болезнь Паркинсона и др.), однако все они также могут быть применены для оценки токсических поражений ПНС. При этом важным практическим аспектом остается необходимость внимательной совокупной интерпретации всех данных неврологического осмотра и нейрофизиологических исследований с целью топической диагностики.
Оценка силы мышц
Известно множество КФТ для оценки силы мышц у грызунов (в основном мышей и крыс), каждый из которых достаточен для установления факта двигательных расстройств, однако не позволяет достоверно определить уровень поражения ЦНС и (или) ПНС. Наиболее широкое распространение в доклинических исследованиях получил тест «Удержание на перевернутой горизонтальной сетке», который модифицируют расположением сетки над емкостью с водой, а результат оценивают по времени удержания. Этот тест вместе с тем не позволяет объективно оценить силу мышц, что может быть реализовано в тесте «Подтягивание на горизонтальной перекладине» [26–28]. Внимательный анализ результатов выполнения теста позволяет выявить у животного целый ряд функциональных расстройств:
1) неспособность схватывать перекладину (то есть снижение или полное угнетение хватательного рефлекса);
2) неспособность выполнить сложный двигательный акт «подтягивание, схватывание тазовой конечностью, движение в сторону по перекладине», то есть тест позволяет выявить апраксию;
3) в случаях, когда животное длительно зависает на перекладине (порядка 15–20 с) без выполнения подтягивания, с наибольшей вероятностью имеет место:
- нарушение навыка, но не снижение силы;
- снижение силы мышц проксимальных отделов грудных конечностей с сохранением силы мышц дистальных отделов;
4) в случаях сохранности позы животного в покое отрицательный тест подтягивания способен указать на слабость мышц дистальных отделов конечностей.
Совокупный анализ результатов теста и осмотра животного в покое пригоден для исследования функций центрального двигательного контроля, состояния хватательного рефлекса, силы разных групп мышц грудных конечностей и, в меньшей степени, для оценки тонуса мышц, что находит подтверждение в иностранной литературе [26][29].
В экспериментах на мышах установлено, что способность к захвату перекладины обратно пропорциональна ее диаметру, а оптимальным следует считать диаметр 2 мм [26]. Такая же закономерность прослежена для крыс, в работе с которыми следует использовать перекладину диаметром 2–4 мм. С другой стороны, использование более толстых перекладин усложняет для животного выполнение теста, но повышает его чувствительность. Важным практическим моментом следует считать необходимость правильного расположения животного на перекладине в исходном положении виса на вытянутых (полностью выпрямленных) передних (грудных) конечностях. В противном случае высока вероятность захвата перекладины задней (тазовой) конечностью, что учитывают как ложноположительный результат.
С целью количественной оценки силы мышц грудных и тазовых конечностей часто используют аппаратное измерение силы схватывания. Показано, что вертикальное расположение прибора и животного следует считать оптимальным вариантом теста по причине обеспечения наилучшего уравновешивания воздействующих сил и повышенной мотивацией животных к удерживанию штанги устройства (рис. 1). Доказательством этому служили меньшая вариабельность значений измерений и большая чувствительность к изменениям силы по сравнению с традиционным способом выполнения методики. Для анализа данных теста предпочтительнее использовать показатель абсолютной силы захвата, нежели нормализованной по массе тела, поскольку в последнем случае часто регистрируют противоречивые результаты. Тест пригоден для динамического наблюдения и позволяет оценивать функциональное состояние мышц на фоне развития МС [30].

Рис. 1. Распределение воздействующих на животное сил
при выполнении теста «Сила схватывания» (адаптировано из [30]):
a — обычный тест; b — модифицированный тест
Fig. 1. Distribution of forces acting on the animal
in the forelimb grip strength test (adapted from [30]):
a, conventional test; b, modified test
Наиболее достоверным инструментом для исследования силы мышц у всех видов грызунов считают метод электронейромиостимуляционной механографии. Используя различные протоколы стимуляции, регистрируют параметры отклика мышц на электрическое раздражение в виде единичного супрамаксимального стимула или высокочастотной тетанизации и получают расчетные параметры, характеризующие силу мышцы и ее функциональное состояние (рис. 2) [31][32]. Данный метод позволяет топически определять уровень поражения структур ПНС путем сравнения силы сокращения мышц в ответ на стимуляцию либо двигательного нерва на разных уровнях, либо напрямую мышц, а также дифференцировать парезы, вызванные развитием ПНП и (или) МС. Однако этот метод достаточно сложен, требует специального оборудования, общей анестезии и соответствующей квалификации сотрудников, а само исследование трудоемко в связи с необходимостью подбора оптимальных и однотипных условий.
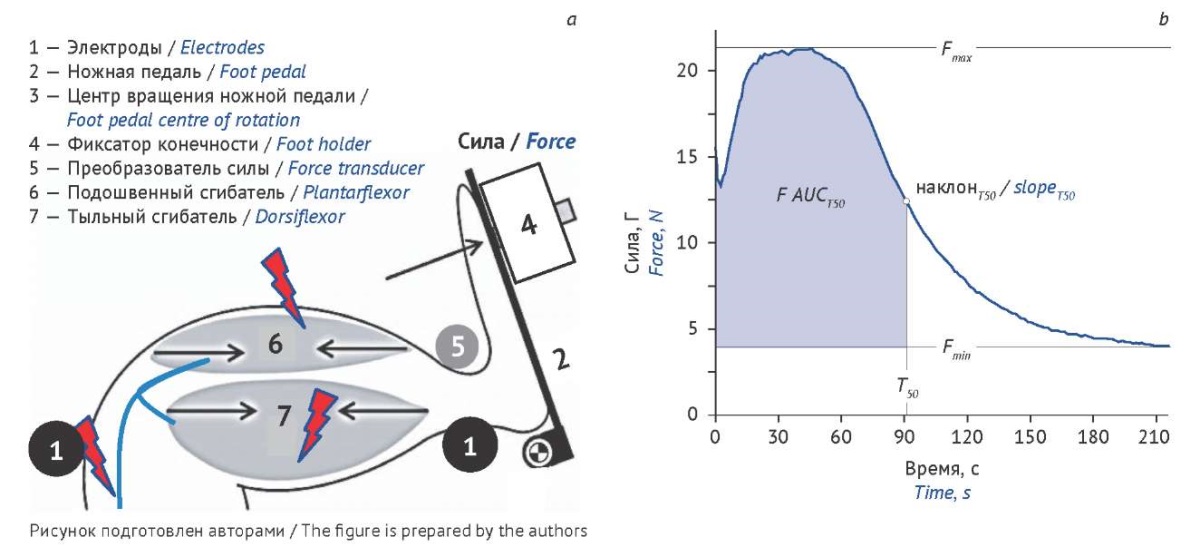
Рис. 2. Исследование силы мышечных сокращений
в ответ на электронейромиостимуляцию (адаптировано из [31, 32]).
a — принципиальная схема устройства; b — типичный график утомления мышцы.
Регистрируемые параметры: максимальное усилие (Fmax ), минимальное усилие (Fmin ),
время полуутомления (T50 ), наклон кривой в точке T50
и индекс утомления мышечной силы (F AUCT50 )
Fig. 2. Investigation of the strength of muscle contractions
in response to electric nerve stimulation (adapted from [31, 32]).
a, schematic diagram of the apparatus; b, typical muscle fatigue envelope.
Recorded parameters: maximum force (Fmax ), minimum force (Fmin ),
half-fatigue time (T50 ), slope at T50 (slopeT50 ),
fatigable muscle force index (F AUCT50 )
Оценка координации движений
В соответствии с «Руководством по проведению доклинических исследований лекарственных средств»8 для оценки координации движений у грызунов в качестве основного теста рекомендована методика «Ротарод». Данная методика позволяет выявить у всех видов грызунов нарушения, причинами которых могут быть патологические процессы на уровне мозжечка, слабость мышц конечностей вследствие ПНП, патологическая мышечная утомляемость при МС, грубые расстройства глубокой и (или) поверхностной чувствительности. Тест позволяет различить центральные и периферические поражения нервной системы. Считают, что животные с центральными (мозжечковыми) нарушениями координации падают на старте или вскоре после начала теста, в то время как у тех, кто смог удерживать равновесие на стержне более 1–2 мин, тест скорее отражает выносливость или указывает на мышечную слабость (патологическую утомляемость), а не дискоординацию движений как таковую [26]. При этом модификация теста со ступенчатым увеличением скорости вращения стержня не повышает информативности, а лишь укорачивает время на его проведение [29]. Важным условием объективности данного метода признано первичное фенотипирование и предварительное обучение животных. По нашим данным 20–30% белых беспородных крыс проявляют отказ от ходьбы по стержню и падают на подстилающий материал, другие же могут цепляться за стержень и вращаться вместе с ним, а не падать. Таких особей, несомненно, следует исключать из выборки, а с целью устранения захватывания стержня его стоит обернуть материалом, за который животные не могли бы ухватиться (например, грубой резиной). Для качественного обучения животным обычно необходимо не менее 9 тренировочных тестов, выполненных в течение 3 последовательных дней. Важно учитывать массу тела животных при формировании групп и сравнении полученных результатов, поскольку более тяжелые особи выполняют тест хуже.
В комплексе с предыдущей методикой часто используют тест «Сужающаяся дорожка», который предназначен для оценки моторного дефицита тазовых конечностей. Дополнительно при помощи бокового зеркала проводят визуальную оценку походки животного [24]. Этот тест требует минимального оборудования, применим ко всем видам грызунов и может быть проведен быстро, учитывая, что одна пробежка не должна превышать 60 с [29].
Для оценки координации движений у грызунов предложены специализированные шкалы. D.M. Basso и соавт. была разработана крайне подробная 21-балльная оценочная шкала Basso–Beattie–Bresnahan для крыс и 9-балльная модификация Basso Mouse Scale для мышей. Эти методики ранжируют целый ряд нарушений движений у грызунов, а именно: объем движений в суставах, позицию и положение конечностей, координацию и синхронность движения грудных и тазовых конечностей, способность стабильно удерживать положение тела, характер распределения веса животного. Для использования шкал необходимо проводить исследование двумя сотрудниками с использованием установки «Открытое поле». К недостаткам указанных методик относят необходимость длительного обучения персонала, трудоемкость, высокую вероятность ошибок детекции вследствие субъективной визуальной оценки нарушений локомоторной активности у животных, что не позволяет достоверно оценить степень выраженности неврологического дефицита, если эксперимент проводят несколько исследователей [24].
Детальное исследование двигательной активности у всех видов грызунов с оценкой их координации и походки, в том числе при необходимости динамического наблюдения, позволяют выполнять современные программно-аппаратные комплексы: CatWalk XT (Noldus Information Technology, Нидерланды), DigiGait (Mouse Specifics Inc, США), MotoRater (TSE Systems Inc, Германия). Специализированная компьютерная программа комплекса CatWalk XT обрабатывает видеозапись передвижения животного в установке, автоматически распознает следы, определяя степень нажима на поверхность в каждой точке пространства, на основании чего дает развернутую характеристику параметров двигательной активности. Схожим потенциалом в отношении исследований походки у грызунов обладает система TreadScan (Clever Sys Inc., США). Основным недостатком этой системы является невозможность оценить степень нажима конечности животного на опору, что не позволяет всесторонне охарактеризовать тяжесть неврологического дефицита [33].
Оценка тонуса мышц и физиологических рефлексов
Для оценки тонуса мышц у всех видов грызунов наиболее объективным методом считают механографию, совмещенную с электромиографией. Однако этот метод достаточно сложен и редко используется в практике доклинических исследований [34].
В проведенном нами исследовании была доказана высокая информативность адаптированной шкалы отведения пальцев в качестве метода оценки состояния физиологического двигательного рефлекса у крыс при моделировании генерализованной токсической полинейромиопатии [35]. Ранее K.R. Aoki в оригинальном исследовании с помощью данного теста оценивал выраженность неврологических нарушений у мышей при имитации падения с высоты на фоне развития местного миорелаксантного эффекта при введении препарата на основе ботулинического нейротоксина [36]. В последующем данный тест был применен с аналогичной целью у крыс (рис. 3) [37]. Нами было показано, что тестирование при помощи данной шкалы отражает динамику нарастания пареза на фоне системного введения блокаторов нейрональных натриевых каналов в широком диапазоне доз. Причем раннюю реакцию в виде первоначального разведения пальцев стопы на несколько секунд с последующим прижатием 1 или 2 пальцев друг к другу, по нашему мнению, следует рассматривать как эквивалент клинического признака «снижение физиологических рефлексов» (гипорефлексия).
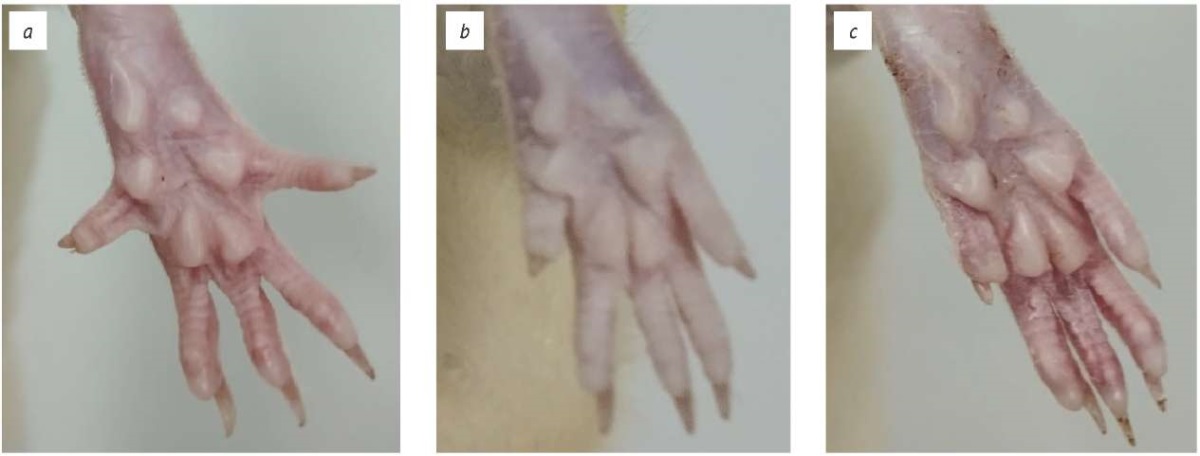
Рис. 3. Сравнение паттернов отведения пальцев стоп у мышей и крыс,
оцениваемых с помощью шкалы отведения пальцев (адаптировано по [37]).
a — норма (0 баллов); b — 2 балла; c — 4 балла
Fig. 3. Comparison of toe abduction patterns in mice and rats,
evaluated using the digit abduction score (adapted from [37]).
a, norm (0 points); b, 2 points; c, 4 points
Японскими учеными предложено оценивать состояние глубоких сухожильных рефлексов у крыс путем воспроизведения методики исследования ахиллова рефлекса у человека, используя вместо неврологического молоточка карандаш [38]. Данный подход имеет высокую клиническую релевантность, однако требует применения общей анестезии у животных, что может оказывать влияние на неврологический статус и определяет потребность в дополнительных исследованиях.
Оценка расстройств чувствительности
Токсические поражения в виде ПНП у грызунов манифестируют и в виде расстройств различных видов чувствительности (поверхностной, глубокой, интерорецептивной, специальной) [24]. Большинство тестов доступны к выполнению у всех видов грызунов.
Оценка поверхностной чувствительности. При исследовании болевой чувствительности у лабораторных животных обычно оценивают перцептуальный и эмоциональный компоненты ноцицепции. Перцептуальный компонент (собственно ощущение боли) возникает вследствие возбуждения механо/хемоноцицепторов. Оценку перцептуального компонента проводят при действии механических, термических и химических стимулов [39][40].
Механические болевые стимулы используют в следующих тестах: механическая компрессия конечности (тест Рэндалла–Селитто) и дозированное механическое раздражение основания хвоста крыс с помощью зажима (метод Гаффнера). Широко используют тест Рэндалла–Селитто, в котором аппаратным способом оказывают давление на конечность животного до появления у него поведенческих реакций, после чего считывают величину давления при помощи специальной шкалы [40]. Эти методы достаточно просты и могут быть выполнены без использования дорогостоящего оборудования, однако они обладают низкой информативностью и обеспечивают регистрацию лишь выраженных расстройств чувствительности. Воздействие при помощи электронного эстезиометра фон Фрея позволяет более точно объективизировать нарушения чувствительности (гипалгезию, гипералгезию и аллодинию), но при условии неоднократного фонового обследования и определения референтного интервала для конкретной выборки животных [41].
Термические болевые раздражения используют в тестах «Горячая пластина», «Горячая/холодная пластина», «Тест отдергивания хвоста». Кроме этого, существует аппаратный плантарный тест (по методу Харгривза), позволяющий оценивать ноцицептивный порог при воздействии теплового стимула. Особенностью этого теста служит то, что животные имеют возможность свободного передвижения в зоне исследования [42]. Использование более простых подходов (например, исследование реакции животного в ответ на опускание хвоста в воду различной температуры) не рекомендовано из-за низкой повторяемости результатов вследствие невозможности проведения эксперимента в одинаковых условиях.
В качестве химических болевых стимулов обычно используют интраплантарное введение формалина, капсаицина или каррагинана [40][43]. Однако такой подход может значительно изменить течение основного патологического процесса и исказить картину токсического поражения, вызываемого тестируемым ФАВ.
Оценка реакции на температурные раздражители (холод, тепло) часто сопряжена с определением болевой чувствительности, что позволяет провести комплексное исследование поверхностной чувствительности при смешанном термоалгическом воздействии. Существуют подходы к преимущественной оценке температурной чувствительности, в том числе при помощи теста с тепловым градиентом. Тест позволяет определить температурные предпочтения и порог теплового комфорта у лабораторных животных, а также выявить возникновение тепловой аллодинии и гипералгезии [40]. Формирование холодовой аллодинии у животных можно определить, помимо использования теста «Холодовая пластина», в тесте испарения ацетона после его нанесении на кожу стопы животного. Однако воспроизводимость данного теста сомнительна ввиду необходимости визуальной оценки полученных результатов, которые, как правило, неоднозначны у животных разного возраста и пола [44].
Вместе с оценкой болевой чувствительности часто проводят исследование тактильной чувствительности. Преимущественно тактильную чувствительность можно оценить мануально при помощи калиброванных монофиламентов фон Фрея, а также автоматическим методом с использованием динамического подошвенного анестезиометра. Оба метода основаны на механической стимуляции вентральной поверхности кистей и стоп животного. Кроме этого, существуют различные калибры монофиламентов фон Фрея, предназначенные для проведения исследований на конкретных областях тела животного (стопа, кисть, губа, щека и др.) [39]. Следует отметить, что интерпретация полученных результатов затруднена вследствие того, что, по сути, оценивают только одну реакцию животного в виде отдергивания конечности.
Оценка глубокой чувствительности. Проприорецептивную (глубокую) чувствительность в основном определяют в виде мышечно-суставного чувства и чувства давления/веса. Существуют специализированные системы измерения приложенного давления (Pressure application measurement, P.A.M.), позволяющие провести количественную оценку порога боли при изучении гиперчувствительности суставов у грызунов [45]. Системы P.A.M. представляют собой достаточно редкое оборудование, которое используют в основном при экспериментальном моделировании у грызунов остеоартритов различной этиологии.
Оценка интерорецептивной чувствительности. Для исследования острой висцеральной и соматически глубокой боли наиболее распространен тест с внутрибрюшинным введением 0,6% уксусной кислоты (тест «Уксусные корчи»). Болевую реакцию («корчи») оценивают по характерному поведению животных: количеству сокращений/расслаблений мышц брюшной стенки (собственно «корчи»), вытягиванию тазовых конечностей, прогибанию спины [46]. По нашему опыту применения данного метода для сравнительной оценки обезболивающих свойств нестероидных противовоспалительных препаратов он весьма субъективен и требует четкой дифференцировки хорошо видимых тонических и спастических компонентов реакции, выраженность которых тяжело оценить. Эти обстоятельства исключили данный метод из применяемой батареи тестов. В некоторых исследованиях для оценки интерорецептивной чувствительности у грызунов используют модели с введением в мочевой пузырь раствора скипидара или оливкового масла. Ряд авторов полагает, что с позиции биоэтических принципов 3R эксперименты по изучению выраженности острой висцеральной боли противоречат правилам гуманного обращения с лабораторными животными [39].
Оценка специальной чувствительности. Зрительная чувствительность может быть оценена по выраженности оптомоторной реакции. Так, например, аппаратный комплекс PhenoSys qOMR, представляющий собой вращающийся цилиндр с визуальной стимуляцией, позволяет оценить остроту зрения и контрастную чувствительность [47].
Вкусовую чувствительность оценивают посредством густометрии, в некоторых случаях с использованием специально разработанных приборов — густометров. Густометры дозируют животным небольшие объемы жидкостей, что позволяет исследовать немедленные поведенческие реакции в ответ на воздействие различными вкусовыми стимулами. Также используют и другие, более простые подходы — различные мануальные и аппаратные вариации теста на предпочтение жидкости определенного вкуса [48].
Слуховую чувствительность можно исследовать визуально по рефлексу Прейера, непроизвольное движение ушных раковин в ответ на внезапный резкий звук) и различными аппаратными способами (в том числе измерение отоакустической эмиссии), а также при комплексной оценке акустической стартл-реакции [49]. Нами накоплен опыт применения для этих целей чрескожной регистрации слуховых стволовых потенциалов.
Обонятельную чувствительность определяют посредством специальных приборов — ольфактометров, которые помимо оценки активности обонятельных сенсорных нейронов и обонятельных луковиц позволяют также оценить когнитивные способности животных [50].
Таким образом, подходы к оценке специальной чувствительности у грызунов довольно сложные, при этом во многих случаях существует потребность в использовании дорогостоящих программно-аппаратных комплексов, что позволяет достичь сходимости результатов, полученных различными группами исследователей или в разных условиях проведения экспериментов. Тем не менее большую часть экспериментальных исследований проводят с использованием тестов для оценки поверхностной чувствительности, при которых выполняют преимущественно визуальную и субъективную оценку состояния животных. Следует признать, что используемый методический аппарат направлен в основном на выявление грубых и, в некоторых случаях, уже необратимых изменений чувствительности, в то время как возможности объективно регистрировать легкие сенсорные расстройства часто отсутствуют.
Электромиография
В целях уточнения локализации и выраженности токсических эффектов ФАВ на уровне ПНС целесообразно использовать комплексное электромиографическое (ЭМГ) исследование [19][35][38]. С помощью ЭМГ могут быть получены ответы на следующие важные вопросы о характере поражения ПНС [19][51][52].
- Какова природа блока проведения: аксональная или демиелинизирующая? В клинической практике эта информация составляет одну из основных целей исследования, поскольку от этого в значительной степени зависят подходы к лечению и прогнозу течения заболеваний. Обычно аксональные процессы затрагивают чувствительные волокна в большей степени, чем двигательные, тогда как равное вовлечение характерно для большинства демиелинизирующих процессов.
- Какова топика нарушений: очаговая или генерализованная, нарушения симметричные или асимметричные? Для абсолютного большинства токсических поражений ПНС характерны генерализованные симметричные процессы, более выраженные в дистальных отделах длинных нервов.
- Насколько выражено поражение? Отсутствие реакции на стимул может свидетельствовать о полной блокаде проводимости или передачи нервного импульса. При заболеваниях ПНС электрофизиологическая картина далеко не всегда коррелирует с тяжестью клинических признаков, однако для токсических поражений свойственна такая взаимосвязь [35].
- Существует ли субклиническая невропатия? На фоне применения потенциально нейротоксичных препаратов результаты направленного ЭМГ-обследования могут использоваться при подборе дозы, не вызывающей значимого поражения ПНС.
- Каков прогноз и обратимы ли изменения? Как при демиелинизирующих, так и при аксональных ПНП степень потери аксонов служит ориентиром для прогноза.
- Какие структуры ПНС поражены? Результаты ЭМГ позволяют дифференцировать ПНП от МС или других патологических процессов (поражение передних рогов спинного мозга, радикулопатия, миопатия), топически определить уровень поражения (корешок, средняя или дистальная часть нервов) и оценить степень денервационного процесса в пораженных мышцах [52].
К основным электрофизиологическим маркерам токсических поражений ПНС могут быть отнесены следующие признаки [35][52]:
- поражение всех типов волокон (моторных и сенсорных);
- высокая скорость изменения показателей;
- нарастание резидуальной латентности М-ответов;
- сочетание признаков ПНП и МС;
- сочетание признаков демиелинизации и аксонального поражения.
Объем нейрофизиологических исследований, рекомендованный зарубежными регуляторными документами, включает исследование проводимости двигательных нервов при помощи электронейромиографии и чувствительных нервов при помощи соматосенсорных вызванных потенциалов9. Данный протокол не включает выполнение оценки нервно-мышечной передачи при помощи ритмической стимуляции (декремент-тест, проба с тетанизацией) несмотря на то, что именно НМС наиболее подвержен воздействиям ксенобиотиков. Исследование нервно-мышечной передачи должно быть рекомендовано для нейрофизиологического исследования при оценке токсических поражений ПНС, поскольку значительное число ФАВ реализуют свои побочные эффекты на уровне синапса [8][10].
Инструментарий электрофизиологических методов исследования не исчерпан указанными методиками и включает значительное число отдельных тестов, совокупный анализ результатов которых позволяет достаточно точно установить локализацию поражений нервно-мышечного пути на основании количественной оценки основных критериев, указанных в таблице 3. Для большинства приведенных критериев у человека определены референтные интервалы, но для лабораторных животных эти данные отсутствуют, в связи с чем актуальной задачей следует признать накопление таких сведений с целью их дальнейшего внедрения в практику доклинических исследований.
Таблица 3. Основные электрофизиологические признаки
поражений периферической нервной системы
Table 3. Main electrophysiological signs of peripheral nervous system damage
|
Форма поражения периферической нервной системы Form of peripheral nervous system damage |
Электромиография Electromyography |
Ритмическая стимуляция Repetitive nerve stimulation |
|
|
Моторная Motor |
Сенсорная Sensory |
||
|
Аксональная полинейропатия Axonal polyneuropathy |
Снижение амплитуды или повышение силы стимула, полифазия М-ответов Decreased amplitude or increased strength of the stimulus, polyphasic compound muscle action potentials (CMAPs) |
Снижение амплитуды сенсорных потенциалов вплоть до отсутствия Decreased or absent amplitude of sensory nerve action potentials (SNAPs) |
Обычно без патологических изменений Usually without pathological changes |
|
Демиелинизирующая полинейропатия Demyelinating polyneuropathy |
Снижение скорости распространения волны; увеличение латентности М-ответов Decreased motor nerve conduction velocity, increased CMAP latency |
Незначительное снижение амплитуды сенсорных потенциалов; снижение скорости распространения волны Slightly decreased SNAP amplitude, decreased sensory nerve conduction velocity |
Обычно без патологических изменений Usually without pathological changes |
|
Миастения Myasthenia gravis |
Без патологических изменений No pathological changes |
Декремент амплитуды (площади) М-ответов выраженностью более 10% CMAP amplitude (area) decrement of more than 10% |
|
|
Миастенический синдром Myasthenic syndrome |
Декремент, декремент-инкремент или инкремент амплитуды (площади) М-ответов CMAP amplitude (area) decrement, decrement–increment, or increment |
||
Таблица составлена авторами / The table is prepared by the authors
К несомненному преимуществу применения ЭМГ в эксперименте следует отнести возможность его выполнения с помощью оборудования, используемого в клинической практике по схожим протоколам. Для качественного электрофизиологического тестирования у всех видов грызунов необходимо применение анестезии ввиду болезненности и для обездвиживания при проведении исследовательской процедуры. С этой целью пригоден комбинированный препарат на основе тилетамина и золазепама (рекомендуемая доза для крыс 25 мг/кг внутрибрюшинно), поскольку он не оказывает значимого влияния на регистрируемые параметры, коммерчески доступен и не требует применения оборудования для ингаляционного наркоза10. На начальном этапе тестирования целесообразно проводить исследование длинного нерва в дистальном сегменте (n. tibialis), поэтому мы рекомендуем выполнять ЭМГ икроножной мышцы по стандартной методике «мышца–сухожилие» при помощи монополярных игольчатых электродов. В ходе выполнения исследования необходимо поддерживать общую температуру тела животных, так как гипотермия приводит к ухудшению показателей нервно-мышечной передачи, в частности, может быть выявлен ложный декремент. Важно учитывать достаточно высокую распространенность поражений ПНС у интактных белых беспородных крыс. По нашим данным ~10% животных имеют признаки МС (инкремент или декремент), что диктует необходимость предварительного фенотипирования и выбраковки таких животных до начала основного эксперимента. Более подробное описание методологии и основных электрофизиологических паттернов токсических поражений ПНС в зависимости от механизмов действия ФАВ представляет собой обширную задачу и выходит за рамки настоящей работы.
ЗАКЛЮЧЕНИЕ
В настоящем обзоре освещены основные методические подходы к оценке нейротоксических эффектов на уровне ПНС при проведении доклинических исследований безопасности лекарственных препаратов на грызунах. Очевидно, что современный спектр методик позволяет наиболее эффективно и точно оценивать у грызунов расстройства движений, однако трансляция данных и сопоставление выявленных в эксперименте нарушений с аналогичным течением заболеваний, наблюдаемым в клинической практике, до настоящего времени затруднительны. В этом случае с целью топической локализации процесса целесообразно выполнять электрофизиологические исследования, направленные на верификацию патологического процесса на уровне отдельных структур ПНС.
Применение комплексной батареи КФТ, включающей все описанные в настоящей работе методики, безусловно, невозможно ввиду крайне высокой трудоемкости. В каждом конкретном случае следует подбирать свою комбинацию методов, обоснованных данными о механизмах фармакологического (токсического) действия тестируемого лекарственного средства или результатами неврологического осмотра при выполнении предварительных исследований. С целью первичного скрининга нейротоксических побочных эффектов нами рекомендовано применение следующего минимального информативного перечня методик, который обладает оптимальным соотношением трудоемкости и чувствительности: оценка позы животного в покое и при ходьбе по «Сужающейся дорожке», «Подтягивание на горизонтальной перекладине», шкала отведения пальцев, «Тест отдергивания хвоста», рефлекс Прейера.
Детальное описание каждой из упомянутых методик может служить темой отдельной публикации, в то время как анализ всей совокупности полученных данных в каждом случае представляет собой нетривиальную задачу. Следует заключить, что экспериментальная оценка нейротоксичности ФАВ на уровне ПНС требует от исследователя крайне внимательного и методически выверенного отношения, а интерпретация полученных данных должна быть выполнена в соответствии с общепринятыми принципами неврологической семиотики, нацеленной на дифференциацию клинико-нозологических вариантов течения патологий.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Н.С. Ильинский — концепция работы, написание и оформление текста рукописи; М.А. Тюнин — написание текста рукописи, поиск и работа с источниками литературы; С.В. Чепур — концепция работы, формулировка заключения, редактирование и утверждение окончательной версии рукописи для публикации; В.А. Пугач — написание текста рукописи, работа с источниками литературы, оформление рукописи; В.А. Мясников — планирование структуры рукописи и формулировка заключения, утверждение окончательной версии рукописи для публикации.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Nikita S. Ilinskii conceptualised the study, drafted and designed the manuscript. Mikhail A. Tyunin drafted the manuscript, searched literature and worked with the sources. Sergey V. Chepur conceptualised the study, formulated the conclusion, edited and approved the final version of the manuscript for publication. Viktoria A. Pugach drafted the manuscript, worked with sources of literature, and designed the manuscript. Vadim A. Myasnikov planned the general structure of the manuscript, formulated the conclusion, and approved the final version of the manuscript for publication.
1. Решение Совета Евразийской экономической комиссии от 03.11.2016 № 78 «О Правилах регистрации и экспертизы лекарственных средств для медицинского применения».
Миронов АН, ред. Руководство по проведению доклинических исследований лекарственных средств. Ч. 1. М.: Гриф и К; 2012.
ICH S7A. Note for safety pharmacology studies for human pharmaceuticals. CPMP/ICH/539/00. EMEA; 2001.
2. OECD guideline for the testing of chemicals. Test No. 424: Neurotoxicity study in rodents. https://doi.org/10.1787/9789264071025-en
3. OECD guideline for the testing of chemicals. Test No. 426: Developmental neurotoxicity study. https://doi.org/10.1787/9789264067394-en
4. Яхно НН, Штульман ДР. Болезни нервной системы: руководство для врачей. М.: Медицина; 2001.
5. Там же.
6. Там же.
7. Яхно НН, Штульман ДР. Болезни нервной системы: руководство для врачей. М.: Медицина; 2001.
8. Миронов АН, ред. Руководство по проведению доклинических исследований лекарственных средств. Ч. 1. М.: Гриф и К; 2012.
9. Guidelines for neurotoxicity risk assessment. EPA/630/R-95/001F. EPA; 1998.
Health effects test guidelines OPPTS 870.6850 Peripheral nerve function. EPA 712–C–98–241. EPA; 1998.
10. Guidelines for neurotoxicity risk assessment. EPA/630/R-95/001F. EPA; 1998.
Список литературы
1. Куценко СА. Основы токсикологии: научно-методическое издание. СПб: Фолиант; 2004. EDN: QKMWIB
2. Крышень КЛ, Мошков АЕ, Демяновский МН, Ковалева МА. Экспериментальное исследование фармакологической безопасности лекарственных средств, применяемых для купирования лихорадочного синдрома в детском возрасте. Безопасность и риск фармакотерапии. 2020;8(3):151–9. https://doi.org/10.30895/2312-7821-2020-8-3-151-159
3. Han KS, Woo DH. Classification of advanced me thods for evaluating neurotoxicity. Mol Cell Toxicol. 2021;17(4):377–83. https://doi.org/10.1007/s13273-021-00161-6
4. Slater C. Diverse aspects of vulnerability at the neuromuscular junction. Brain. 2012;135(4):997–8. https://doi.org/10.1093/brain/aws057
5. Stubbs EB Jr. Targeting the blood-nerve barrier for the management of immune-mediated peripheral neuropathies. Exp Neurol. 2020;331:113385. https://doi.org/10.1016/j.expneurol.2020.113385
6. Sheikh S, Alvi U, Soliven B, Rezania K. Drugs that induce or cause deterioration of myasthenia gravis: an update. J Clin Med. 2021;10(7):1537. https://doi.org/10.3390/jcm10071537
7. Jones MR, Urits I, Wolf J, Corrigan D, Colburn L, Peterson E, et al. Drug-induced peripheral neuropathy: a narrative review. Curr Clin Pharmacol. 2020;15(1):38–48. https://doi.org/10.2174/1574884714666190121154813
8. Misra UK, Kalita J. Toxic neuropathies. Neurol India. 2009;57(6):697–705. https://doi.org/10.4103/0028-3886.59463
9. Pellacani C, Eleftheriou G. Neurotoxicity of antineoplastic drugs: mechanisms, susceptibility, and neuroprotective strategies. Adv Med Sci. 2020;65(2):265–85. https://doi.org/10.1016/j.advms.2020.04.001
10. Grisold W, Carozzi VA. Toxicity in peripheral nerves: an overview. Toxics. 2021;9(9):218. https://doi.org/10.3390/toxics9090218
11. Cook D, Brown D, Alexander R, March R, Morgan P, Satterthwaite M, et al. Lessons learned from the fate of Astra-Zeneca’s drug pipeline: a five-dimensional framework. Nat Rev Drug Discov. 2014;13(6):419–31. https://doi.org/10.1038/nrd4309
12. Chi LH, Burrows AD, Anderson RL. Can preclinical drug development help to predict adverse events in clinical trials? Drug Discov Today. 2022;27(1):257–68. https://doi.org/10.1016/j.drudis.2021.08.010
13. Masjosthusmann S, Barenys M, El-Gamal M, Geerts L, Gerosa L, Gorreja A, et al. Literature review and appraisal on alternative neurotoxicity testing methods. EFSA Supporting Publications. 2018;15(4):1410E. https://doi.org/10.2903/sp.efsa.2018.en-1410
14. Chinn GA, Pearn ML, Vutskits L, Mintz CD, Loepke AW, Lee JJ et al. Standards for preclinical research and publications in developmental anaesthetic neurotoxicity: expert opinion statement from the SmartTots preclinical working group. Br J Anaesth. 2020;124(5):585–93. https://doi.org/10.1016/j.bja.2020.01.011
15. Shih HP, Zhang X, Aronov AM. Drug discovery effectiveness from the standpoint of therapeutic mechanisms and indications. Nat Rev Drug Discov. 2017;17(1):19–33. https://doi.org/10.1038/nrd.2017.194
16. Александров ИВ, Егорова ЕИ, Васина ЕЮ, Новиков ВК, Матыко ПГ, Галагудза ММ. Экспериментальные исследования на животных в эпоху трансляционной медицины. Какими им быть? Трансляционная медицина. 2017;4(2):52–70. https://doi.org/10.18705/2311-4495-2017-4-2-52-70
17. Llorens J, Li AA, Ceccatelli S, Suñol C. Strategies and tools for preventing neurotoxicity: to test, to predict and how to do it. Neurotoxicology. 2012;33(4):796–804. https://doi.org/10.1016/j.neuro.2012.01.019
18. Cashman CR, Höke A. Mechanisms of distal axonal degeneration in peripheral neuropathies. Neurosci Lett. 2015;596:33–50. https://doi.org/10.1016/j.neulet.2015.01.048
19. Hauser S, ed. Harrison’s Neurology in Clinical Medicine. San Francisco: McGraw-Hill; 2010.
20. Wasinska-Borowiec W, Abri Aghdam K, Matias Saari J, Grzybowski A. An updated review on the most common agents causing toxic optic neuropathies. Current Pharm Des. 2017;23(4):586–95. https://doi.org/10.2174/1381612823666170124113826
21. Lindhard Madsen M, Du H, Ejskjær N, Jensen P, Madsen J, Dybkær K. Aspects of vincristine-induced neuropathy in hematologic malignancies: a systematic review. Cancer Chemother Pharmacol. 2019;84(3):471–85. https://doi.org/10.1007/s00280-019-03884-5
22. Одинак ММ, Дыскин ДЕ. Клиническая диагностика в неврологии. СПб: СпецЛит; 2010. EDN: QLVPQP
23. Tilson HA. Behavioral indices of neurotoxicity: what can be measured? Neurotoxicol Teratol. 1987;9(6):427–43. https://doi.org/10.1016/0892-0362(87)90055-9
24. Schönfeld LM, Dooley D, Jahanshahi A, Temel Y, Hendrix S. Evaluating rodent motor functions: which tests to choose? Neurosci Biobehav Rev. 2017;83:298–312. https://doi.org/10.1016/j.neubiorev.2017.10.021
25. van Dellen A, Blakemore C, Deacon R, York D, Hannan AJ. Delaying the onset of Huntington’s in mice. Nature. 2000;404:721–22. https://doi.org/10.1038/35008142
26. Deacon RM. Measuring motor coordination in mice. J Vis Exp. 2013;75:e2609. https://doi.org/10.3791/2609
27. Воронина ТА, Середенин СБ. Методические указания по изучению транквилизирующего (анксиолитического) действия фармакологических веществ. В кн.: Хабриев РУ, ред. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. М.: Медицина; 2005. EDN: QCIIOB
28. Ахапкина ВИ, Воронина ТА. Изучение противоинсультного действия фенотропила на модели геморрагического инсульта (интрацеребральная посттравматическая гематома) у крыс. Нервные болезни. 2006;(1):37–42. EDN: OOKJEX
29. Brooks SP, Dunnett SB. Tests to assess motor phenotype in mice: a user’s guide. Nat Rev Neurosci. 2009;10(7):519–29. https://doi.org/10.1038/nrn2652
30. Takeshita H, Yamamoto K, Nozato S, Inagaki T, Tsuchimochi H, Shirai M, et al. Modified forelimb grip strength test detects aging-associated physiological decline in skeletal muscle function in male mice. Sci Rep. 2017;(7):42323. https://doi.org/10.1038/srep42323
31. Mintz EL, Passipieri JA, Lovell DY, Christ GJ. Applications of in vivo functional testing of the rat tibialis anterior for evaluating tissue engineered skeletal muscle repair. J Vis Exp. 2016;(116):54487. https://doi.org/10.3791/54487
32. Chiu CS, Weber H, Adamski S, Rauch A, Gentile MA, Alves SE. Non-invasive muscle contraction assay to study rodent models of sarcopenia. BMC Musculoskelet Disord. 2011;12:246. https://doi.org/10.1186/1471-2474-12-246
33. Чичева ММ, Вихарева ЕВ, Мальцев АВ, Устюгов АА. Эволюция методик оценки моторной функции лабораторных грызунов, моделирующих нейродегенеративные заболевания. Biomed Chem Res Meth. 2018;1(3):e00030. https://doi.org/10.18097/bmcrm00030
34. Hsieh TH, Tsai JY, Wu YN, Hwang IS, Chen TI, Chen JJJ. Time course quantification of spastic hypertonia following spinal hemisection in rats. Neuroscience. 2010;167(1):185–98. https://doi.org/10.1016/j.neuroscience.2010.01.064
35. Ильинский НС, Тюнин МА, Матросова МО. Методические подходы к оценке паралитического синдрома токсического генеза в экспериментах на грызунах. Лабораторные животные для научных исследований. 2021;(3):71–4. https://doi.org/10.29296/2618723X-2021-03-09
36. Aoki KR. A comparison of the safety margins of botulinum neurotoxin serotypes A, B, and F in mice. Toxicon. 2001;39(12):1815–20. https://doi.org/10.1016/s0041-0101(01)00101-5
37. Broide RS, Rubino J, Nicholson GS, Ardila MC, Brown MS, Aoki KR, et al. The rat Digit Abduction Score (DAS) assay: a physiological model for assessing botulinum neurotoxininduced skeletal muscle paralysis. Toxicon. 2013;71:18–24. https://doi.org/10.1016/j.toxicon.2013.05.004
38. Nishitani A, Yoshihara T, Tanaka M, Kuwamura M, Asano M, Tsubota Y, et al. Muscle weakness and impaired motor coordination in hyperpolarization-activated cyclic nucleotide-gated potassium channel 1-deficient rats. Exp Anim. 2020;69(1):11–7. https://doi.org/10.1538/expanim.19-0067
39. Turner PV, Pang DS, Lofgren JL. A review of pain assessment methods in laboratory rodents. Comp Med. 2019;69(6):451–67. https://doi.org/10.30802/AALAS-CM-19-000042
40. Deuis JR, Dvorakova LS, Vetter I. Methods used to evaluate pain behaviors in rodents. Front Mol Neurosci. 2017;10:284. https://doi.org/10.3389/fnmol.2017.00284с
41. Modi AD, Parekh A, Pancholi YN. Evaluating pain behaviours: widely used mechanical and thermal methods in rodents. Behav Brain Res. 2023;446:114417. https://doi.org/10.1016/j.bbr.2023.114417
42. Bohic M, Pattison LA, Jhumka ZA. Mapping the neuroethological signatures of pain, analgesia, and recovery in mice. Neuron. 2023;111(18):2811–2830.e8. https://doi.org/10.1016/j.neuron.2023.06.008
43. Presto P, Ji G, Junell R, Griffin Z, Neugebauer V. Fear extinction-based inter-individual and sex differences in pain-related vocalizations and anxiety-like behaviors but not nocifensive reflexes. Brain Sci. 2021;11(10):1339. https://doi.org/10.3390/brainsci11101339
44. Palazzo E, Marabese I, Gargano F, Guida F, Belardo C, Maione S. Methods for evaluating sensory, affective and cognitive disorders in neuropathic rodents. Curr Neuropharmacol. 2021;19(6):736–46. https://doi.org/10.2174/1570159X18666200831153117
45. Chao D, Tran H, Hogan QH, Pan B. Analgesic dorsal root ganglion field stimulation blocks both afferent and efferent spontaneous activity in sensory neurons of rats with monosodium iodoacetate-induced osteoarthritis. Osteoarthritis Cartilage. 2022;30(11):1468–81. https://doi.org/10.1016/j.joca.2022.08.008
46. Бондаренко ДА, Дьяченко ИА, Скобцов ДИ, Мурашев АН. In vivo модели для изучения анальгетической активности. Биомедицина. 2011;(2):84–94. EDN: NVYEMF
47. Liu Q, Liu J, Guo M. Comparison of retinal degeneration treatment with four types of different mesenchymal stem cells, human induced pluripotent stem cells and RPE cells in a rat retinal degeneration model. J Transl Med. 2023;21(1):910. https://doi.org/10.1186/s12967-023-04785-1
48. Gaillard D, Stratford JM. Measurement of behavioral taste responses in mice: two-bottle preference, lickometer, and conditioned taste-aversion tests. Curr Protoc Mouse Biol. 2016;6(4):380–407. https://doi.org/10.1002/cpmo.18
49. McFadden SL, Simmons AM, Erbe C, Thomas JA. Behavioral and physiological audiometric methods for animals. In: Erbe C, Thomas JA, eds. Exploring animal behavior through sound. Springer; 2022. https://doi.org/10.1007/978-3-030-97540-1_10
50. Arevalo N. Open-source JL olfactometer for awake behaving recording of brain activity for mice engaged in olfactory tasks. In: Paredes RG, Portillo W, Bedos M, eds. Animal models of reproductive behavior. New York: Humana; 2023. https://doi.org/10.1007/978-1-0716-3234-5_6
51. Kimura J. Electrodiagnosis in diseases of nerve and muscle: principles and practice. Oxford University Press; 2013. https://doi.org/10.1093/med/9780199738687.001.0001
52. Тюнин МА, Ильинский НС, Гоголевский АС, Кручинин ЕГ, Гладких ВД, Мацейчик ВА, Матросова МО. Электрофизиологические методы диагностики нарушений нервно-мышечной передачи при острых отравлениях фосфорорганическими соединениями. Военно-медицинский журнал. 2020;341(10):11–9. EDN: NSYNCD
Об авторах
Н. С. ИльинскийРоссия
Ильинский Никита Сергеевич, канд. мед. наук
ул. Лесопарковая, д. 4, Санкт-Петербург, 195043
М. А. Тюнин
Россия
Тюнин Михаил Александрович, канд. мед. наук
ул. Лесопарковая, д. 4, Санкт-Петербург, 195043
С. В. Чепур
Россия
Чепур Сергей Викторович, д-р мед. наук, профессор
ул. Лесопарковая, д. 4, Санкт-Петербург, 195043
В. А. Пугач
Россия
Пугач Виктория Александровна, канд. биол. наук
ул. Лесопарковая, д. 4, Санкт-Петербург, 195043
В. А. Мясников
Россия
Мясников Вадим Александрович, канд. мед. наук
ул. Лесопарковая, д. 4, Санкт-Петербург, 195043
Дополнительные файлы
Рецензия
Для цитирования:
Ильинский Н.С., Тюнин М.А., Чепур С.В., Пугач В.А., Мясников В.А. Практические аспекты функциональной оценки токсических поражений периферической нервной системы в доклинических исследованиях на грызунах: обзор. Регуляторные исследования и экспертиза лекарственных средств. 2024;14(3):265-282. https://doi.org/10.30895/1991-2919-2024-14-3-265-282
For citation:
Ilinskii N.S., Tyunin M.A., Chepur S.V., Pugach V.A., Myasnikov V.A. Practical Aspects of Assessing Toxic Lesions of the Peripheral Nervous System in Preclinical Studies in Rodents: A Review. Regulatory Research and Medicine Evaluation. 2024;14(3):265-282. (In Russ.) https://doi.org/10.30895/1991-2919-2024-14-3-265-282



































