Перейти к:
Оптимизация методики приготовления цитогенетических препаратов при проведении метафазного анализа клеток костного мозга млекопитающих in vivo
https://doi.org/10.30895/1991-2919-2024-14-3-295-303
Резюме
ВВЕДЕНИЕ. Для определения мутагенности лекарственных средств используется метафазный анализ, точность теста напрямую зависит от качества приготовленных цитогенетических препаратов. Возможная артефактная потеря хромосом, приводящая к ошибкам при трактовке результатов, длительность и трудоемкость пробоподготовки обусловливают необходимость совершенствования существующих методик подготовки цитогенетических препаратов.
ЦЕЛЬ. Оптимизация методики приготовления цитогенетических препаратов клеток костного мозга млекопитающих in vivo для метафазного анализа.
МАТЕРИАЛЫ И МЕТОДЫ. Исследования выполнены на беспородных мышах-самцах массой 18–20 г. Пробоподготовку цитогенетических препаратов костного мозга выполняли по оригинальным и адаптированным методикам «Руководства по проведению доклинических исследований лекарственных средств» под ред. Миронова А.Н. (2012 г.) и ГОСТ 34659-2020 «Методы испытания по воздействию химической продукции на организм человека. Оценка хромосомных аберраций в клетках костного мозга млекопитающих». Для приготовления препаратов использовали раствор Хенкса, растворы цитрата натрия и хлорида калия, уксусную кислоту, метиловый спирт, среду 199, буферный раствор HEPES и краситель Гимзы.
РЕЗУЛЬТАТЫ. Проведен сравнительный экспериментальный анализ характеристик цитогенетических препаратов для проведения метафазного анализа клеток костного мозга млекопитающих in vivo, подготовленных по различным методикам. Выявлено, что препараты, полученные по методике «Руководства по проведению доклинических исследований лекарственных средств», характеризовались максимальной долей доступных для анализа пластинок по сравнению с препаратами, полученными другими способами пробоподготовки. Оптимизированы условия пробоподготовки, в том числе состав гипотонического раствора (0,56% раствора KCl), время гипотонической обработки (20 мин) и фиксации (12 ч), состав культуральной среды (среда 199 жидкая с солями Хенкса с глутамином), введена стадия префиксации хромосом 6%-ным раствором уксусной кислоты, что в целом способствовало увеличению доли доступных для анализа метафазных пластинок путем снижения разброса и слипания хромосом.
ВЫВОДЫ. Предложена методика приготовления цитогенетических препаратов, позволяющая увеличить долю доступных метафазных пластинок для анализа до 56%, долю хромосом с полным набором (n=40) на 12% и сократить время приготовления образцов на 2–10 ч по сравнению с использовавшимися ранее методиками.
Ключевые слова
Для цитирования:
Вернер А.О., Устинова Т.М., Венгерович Н.Г. Оптимизация методики приготовления цитогенетических препаратов при проведении метафазного анализа клеток костного мозга млекопитающих in vivo. Регуляторные исследования и экспертиза лекарственных средств. 2024;14(3):295-303. https://doi.org/10.30895/1991-2919-2024-14-3-295-303
For citation:
Verner A.O., Ustinova T.M., Vengerovich N.G. Optimisation of a Cytogenetic Sample Preparation Procedure for In Vivo Metaphase Analysis of Mammalian Bone Marrow Cells. Regulatory Research and Medicine Evaluation. 2024;14(3):295-303. (In Russ.) https://doi.org/10.30895/1991-2919-2024-14-3-295-303
ВВЕДЕНИЕ
Метафазный анализ клеток костного мозга млекопитающих широко применяется в доклинических исследованиях безопасности фармакологических субстанций и лекарственных препаратов1 [1]. Данный метод позволяет выявить аберрации всех типов (хроматидные и хромосомные), что, в свою очередь, позволяет оценить степень мутагенности исследуемого вещества, определить зависимость «доза — эффект»2. Однако метафазный анализ имеет ряд недостатков: при его применении учитываются только структурные изменения хромосом, к исполнителям теста предъявляются высокие квалификационные требования, его автоматизация отсутствует. Сложности в проведении данного теста могут возникнуть уже на этапе приготовления цитогенетического препарата костного мозга, от качества которого зависит точность дальнейшего анализа. Важно, чтобы препарат содержал достаточное количество метафазных пластинок, хромосомы были равномерно распределены по стеклу и качественно окрашены.
В Российской Федерации утвержден ряд методических документов3, регламентирующих процедуру проведения теста. Существующие методики имеют различия в части рекомендаций по пробоподготовке препаратов, в том числе в них отсутствует детальное описание этапов приготовления препаратов, вместо чего представлены ссылки на публикации и методические рекомендации 1980–1990 гг.
Цель работы — оптимизация методики приготовления цитогенетических препаратов клеток костного мозга млекопитающих in vivo для метафазного анализа.
МАТЕРИАЛЫ И МЕТОДЫ
На первом этапе было выполнено информационно-аналитическое сравнительное исследование методических руководств по приготовлению цитогенетических препаратов при проведении метафазного анализа клеток костного мозга млекопитающих in vivo, изложенных в монографии «Руководство по проведению доклинических исследований лекарственных средств»4 (далее — Руководство) и ГОСТ 34659-2020 «Методы испытания по воздействию химической продукции на организм человека. Оценка хромосомных аберраций в клетках костного мозга млекопитающих» (далее — ГОСТ 34659-2020). Второй этап исследования был направлен на оптимизацию пробоподготовки клеток костного мозга для проведения метафазного анализа на основе утвержденных методик с применением новых реактивов и методов.
Биологические тест-системы. В качестве тест-систем использовали беспородных мышей-самцов весом 18–20 г. Животные были получены из ФГБУН НЦБМТ ФМБА России филиал «Электрогорский». Транспортировка, содержание и работа с животными проводились согласно ГОСТ 33215-2014 «Правила оборудования помещений и организации процедур». В исследовании было использовано 60 мышей, которых распределяли на 10 групп по 6 животных случайным образом. Мышей содержали в помещении с относительной влажностью воздуха 60±10% при 12-часовом световом дне с неограниченным доступом к еде и воде5. Для кормления животных использовался полнорационный корм ЛБК-120 для крыс и мышей (ЗАО «Тосненский комбикормовый завод»).
Исследование было одобрено заседанием локальной биоэтической комиссии ФГБУ ГНИИИ ВМ МО РФ, протокол заседания № 15 от 17.12.2021, и соответствует гуманистическим и этическим нормам.
Реактивы. В исследовании использовали следующие реактивы: колхицин (НПП «ПанЭко»), раствор Хенкса (НПП «ПанЭко»), питательная среда 199 жидкая с солями Хенкса с глутамином (НПП «ПанЭко»); хлорид калия (АО «Ленреактив»); цитрат натрия (АО «Ленреактив»); метиловый спирт (х.ч., ООО ТД «ХИММЕД»), уксусная кислота ледяная (99,80%, ООО «НеваРеактив»), буферный раствор HEPES 1M (Lonza), краситель Гимзы 10–12-кратный раствор (ООО «БиолоТ»).
Подготовка предметных стекол. Предметные стекла, применяемые для цитогенетических препаратов, готовили следующим способом: стекла обрабатывали теплым мыльным раствором, ополаскивали горячей водой и промывали в течение нескольких часов в проточной воде. Вымытые стекла помещали в хромовую смесь и выдерживали в течение 24 ч. После этого их вновь промывали в проточной воде с последующим кипячением в дистиллированной воде в течение 30 мин. Чистые обезжиренные стекла помещали в свежую дистиллированную воду и выдерживали при температуре 4–8 °С в течение 1 сут, после чего влажные стекла использовали для приготовления цитогенетических препаратов6.
Приготовление цитогенетических препаратов по методике ГОСТ 34659-2020. Мышам вводили колхицин в дозе 4 мг/кг внутрибрюшинно. Через 1,5 ч животных выводили из эксперимента методом цервикальной дислокации. Из бедренных костей вымывали красный костный мозг подогретым до 37 °С раствором Хенкса в объеме 1 мл. В пробирки с костным мозгом добавляли еще 2 мл теплого раствора Хенкса. Клетки осаждали при помощи центрифуги Eppendorf 5804R при 100 g в течение 10 мин. Полностью удаляли супернатант и добавляли 3 мл предварительно подогретого гипотонического раствора (0,9% раствор цитрата натрия), осторожно ресуспендировали и инкубировали на водяной бане при 37 °С в течение 13 мин. По завершении гипотонической обработки пробирки центрифугировали 10 мин при 160 g. Супернатант удаляли и осторожно добавляли 3 мл свежеприготовленного фиксатора Кларка, осадок не ресуспендировали. Фиксатор Кларка готовили из метанола и уксусной кислоты в соотношении 3:1 (по объему) и использовали в течение 12 ч. Клетки костного мозга промывали фиксатором еще 2 раза. После последней смены фиксатора осадок аккуратно ресуспендировали, снимая его со стенок пробирки. Добавляли в каждую пробирку по каплям еще 4 мл фиксатора и оставляли на 12 ч при 4 °С. После выдержки центрифугировали пробирки при 160 g в течение 10 мин. Удаляли надосадочную жидкость и в пробирку к осадку добавляли по каплям 0,5 мл свежеприготовленного фиксатора при комнатной температуре, ресуспендировали. На охлажденные влажные предметные стекла наносили по 1–2 капли клеточной суспензии, держа пипетку перпендикулярно стеклу на высоте 15–20 см. Препараты высушивали на воздухе. Окраску проводили 10% раствором Гимзы в течение 10 мин при комнатной температуре.
Приготовление цитогенетических препаратов по методике «Руководства по проведению доклинических исследований лекарственных средств». За 1,5 ч до эвтаназии мышам вводили внутрибрюшинно колхицин в дозе 4 мг/кг. Затем из бедренных костей 1 мл раствора Хенкса, подогретым до 37 °С, вымывали красный костный мозг. В пробирки с суспензией костного мозга добавляли еще 2 мл теплого раствора Хенкса. Клетки осаждали центрифугированием в течение 5 мин при 100 g, надосадочную жидкость полностью удаляли и медленно добавляли гипотонический раствор, встряхивая при этом пробирку для диспергирования осадка. В качестве гипотонического раствора применяли 1% раствор цитрата натрия либо 0,56% раствор KCl. Длительность гипотонической обработки применяемых растворов составляла 15 и 20 мин при комнатной температуре и при 37 °С соответственно. По окончании гипотонической обработки клетки центрифугировали, фиксировали путем добавления (по каплям) 3 мл свежеприготовленного фиксатора Кларка. Фиксацию проводили троекратно. После последней фиксации пробирки центрифугировали, удаляли супернатант и к осадку добавляли 0,5 мл фиксатора, ресуспендировали. По 1–2 капли клеточной суспензии наносили на охлажденные влажные стекла с высоты 15–20 см и высушивали на воздухе. Препараты окрашивали 10% раствором красителя Гимзы 10 мин и промывали в дистиллированной воде с последующим высушиванием на воздухе.
Модифицированная методика пробоподготовки. С целью повышения эффективности пробоподготовки в методику были внесены следующие изменения:
1) клеточную взвесь после фиксации раскапывали на предметные стекла и помещали во влажную камеру на 2 ч7 [2];
2) эффективность культивирования клеток повышали путем смены питательной среды — вместо раствора Хенкса использовали питательную среду 199 жидкую с солями Хенкса с глутамином (далее — среда 199). Для вымывания клеток костного мозга использовали среду 199, нагретую до 37 °С. В пробирки с клеточной взвесью добавляли среду 199 до 5 мл и культивировали в термостате при температуре 37 °С в течение 2 ч [3–5];
3) для двухступенчатой фиксации использовали два фиксатора: 6% раствор уксусной кислоты и фиксатор Кларка. Клетки, прошедшие гипотоническую обработку, фиксировали 3 мл 6% раствора уксусной кислоты в течение 2 мин при комнатной температуре без центрифугирования и в течение 5 мин при центрифугировании при 100 g. После удаления надосадочной жидкости проводили фиксацию клеток стандартным способом по методике8 [6];
4) для улучшения разброса хромосом в метафазной пластинке применяли обработку буферным гипотоническим раствором (0,4% KCl с HEPES) в течение 15–20 мин [3–5].
Хромосомный анализ проводили с помощью светового микроскопа Nikon Eclipse Ci Н550S (Япония) при увеличении объектива ×20 и ×100 с применением иммерсионного масла. Фоторегистрацию осуществляли при помощи цифровой фотокамеры Nikon DS-Fi3 с базовым программным обеспечением.
Основным критерием оценки цитогенетических препаратов, приготовленных по рекомендованным методикам, являлась доля метафазных пластинок, пригодных для анализа. Оценку хромосомных нарушений в клетках костного мозга выполняют путем анализа метафазных пластинок с модальным числом n=40 (39–41), поэтому среди проанализированных метафаз отдельно учитывали доля метафаз с полным набором хромосом (n=40) и метафаз с анеуплоидией (n<40; n>40). Также учитывали долю метафаз со слипшимися и разлетевшимися хромосомами среди непригодных для анализа метафазных пластинок.
Статистическую обработку данных проводили с использованием программы Statistica 10. При статистическом анализе для всех вариантов приготовления цитогенетических препаратов рассчитывали долю метафаз, доступных для анализа (P), и стандартную ошибку доли (P–Δ; P+Δ). Для оценки результата использовали многофакторный дисперсный анализ. Результат между группами считали статистически значимым при уровне значимости p≤0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На качество препаратов влияют два основных фактора: гипотоническая обработка и фиксация материала. Целью гипотонической обработки является разрыв ядерной оболочки и связей между хромосомами, что позволяет им свободно распределяться по цитоплазме. От качества фиксации зависит количество хромосом в метафазной пластинке. Артефактная потеря хромосом в результате некачественной фиксации также приводит к уменьшению метафаз, пригодных для анализа.
Сравниваемые методики в большей мере отличаются вариантами гипотонической обработки и временем выдержки клеток костного мозга в растворе. В качестве фиксатора в обеих методиках используется фиксатор Кларка с разницей по времени воздействия. По методике ГОСТ 34659-2020 рекомендовано фиксировать клеточную взвесь в течение 12 ч, по методике Руководства — в пределах 2–3 ч. Результаты сравнения цитогенетических препаратов, приготовленных по разным методикам, представлены в таблице 1.
Таблица 1. Сравнение качества цитогенетических препаратов костного мозга мышей-самцов,
приготовленных при разных вариантах гипотонической обработки
Table 1. Comparison of the quality of cytogenetic samples of bone marrow cells of male mice
prepared using different hypotonic treatments
|
Методика Procedure |
Условия гипотонической обработки Hypotonic treatment conditions |
Критерии оценки качества цитогенетических препаратов Quality assessment criteria for cytogenetic preparations |
Время пробо-подготовки, ч Sample preparation time, h |
||||
|
Доля метафазных пластинок Percentage of metaphase plates n=100, P (P–Δ; P+Δ), % |
Доля набора хромосом в проанализированных метафазах Percentage of chromosome sets in the analysed metaphases P (P–Δ; P+Δ), % |
||||||
|
Доступных для анализа Analysable |
Недоступных для анализа Non-analysable |
||||||
|
Слипшиеся хромосомы Sticky chromosomes |
Разлетевшиеся хромосомы Scattered chromosomes |
(n=40) |
(n<40; n>40) |
||||
|
ГОСТ 34659-2020* GOST 34659-2020 |
0,9% цитрат натрия при 37 °С, 13 мин 0.9% sodium citrate, 37 °С, 13 min |
39 (0,295; 0,485) |
46 (0,463; 0,657) |
15 (0,08; 0,22) |
69 (0,60; 0,78) |
31 (0,22; 0,40) |
~14 |
|
Руководство** Guidelines** |
1% цитрат натрия 37 °С , 15 мин 1% sodium citrate, 37 °С, 15 min |
41 (0,314; 0,506) |
48 (0,382; 0,578) |
11 (0,049;0,171) |
65 (0,557; 0,743) |
35 (0,257; 0,443) |
~6 |
|
1% цитрат натрия, 20 мин 1% sodium citrate, 20 min |
45 (0,354; 0,546) |
42 (0,323; 0,517) |
13 (0,064;0,196) |
68 (0,589; 0,771) |
32 (0,229; 0,411) |
||
|
0,56% KCl 37 °С, 15 мин 0.56% KCl, 37 °С, 15 min |
44 (0,343; 0,537) |
55 (0,453; 0,647) |
11 (0,049;0,171) |
71 (0,621; 0,799) |
29 (0,201; 0,379) |
||
|
0,56% KCl, 20 мин 0.56% KCl, 20 min |
51 (0,426; 0,594) |
36*** (0,266; 0,454) |
13 (0,064;0,196) |
76 (0,676; 0,844) |
24 (0,156; 0,324) |
||
|
Модифицированная методика Modified procedure |
Среда 199, префиксация Medium 199, preliminary fixation |
56*** (0,468; 0,652) |
35*** (0,257; 0,443) |
9 (0,037; 0,143) |
88**** (0,818; 0,944) |
12*** (0,056; 0,184) |
~4 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. P — доля; Δ — стандартная ошибка доли; n — модальное число.
* — ГОСТ 34659-2020 Методы испытания по воздействию химической продукции на организм человека. Оценка хромосомных аберраций в клетках костного мозга млекопитающих.
** — Миронов АН, ред. Руководство по проведению доклинических исследований лекарственных средств. Ч. 1. М.: Гриф и К; 2012.
*** — данные имеют статистически значимые отличия в сравнении со значениями, полученными при выполнении цитогенетических препаратов по методике ГОСТ 34659-2020 при p<0,05.
**** — данные имеют статистически значимые отличия в сравнении со значениями, полученными при выполнении цитогенетических препаратов по методике из Руководства (гипотоническая обработка 0,56% KCl, 20 мин) при p<0,05.
Note. P, proportion; Δ, standard error of the proportion; n, modal number.
* GOST 34659-2020. Methods for Testing the Impact of Chemical Products on the Human Body. Assessment of Chromosomal Aberrations in Bone Marrow Cells of Mammals.
** A.N. Mironov (ed.), Guidelines for Conducting Preclinical Studies of Drugs. Part 1. Moscow: Grif and Co; 2012.
*** There is a statistically significant difference between these data and the data obtained for cytogenetic samples prepared according to GOST 34659-2020, with p<0.05.
**** There is a statistically significant difference between these data and the data obtained for cytogenetic samples prepared according to the Guidelines (hypotonic treatment with 0.56% KCl for 20 min), with p<0.05.
При сравнении методик приготовления цитогенетических препаратов выявлено статистически значимое снижение доли слипшихся метафазных пластинок при приготовлении препаратов с гипотонической обработкой 0,56% раствором KCl в течение 20 мин в соответствии с Руководством относительно образцов, подготовленных по методике ГОСТ 34659-2020. Препараты, приготовленные по методике ГОСТ 34659-2020, содержали малую долю доступных для анализа метафаз (39%). Слипанию хромосом могла способствовать гипотоническая обработка при 37 °С. При повышении температуры эффективность гипотонической обработки увеличивается, однако одновременно усиливается и слипание клеток из-за присутствия в костном мозге коллагена и жира. Кроме того, фиксатор Кларка может вызывать значительное сжатие клеток [7], а в данном случае фиксация проходила в течение длительного времени (12 ч). В результате несбалансированной комбинации гипотонической обработки и времени фиксации образуется малое количество доступных для анализа метафаз.
Фиксация препаратов, выполненных по Руководству, осуществлялась в течение 2–3 ч. Из рассмотренных вариантов гипотонической обработки наиболее эффективной является обработка 0,56% раствором KCl в течение 20 мин при комнатной температуре. Доля доступных метафазных пластинок в этом случае составила 51%. Существенным недостатком данной методики является ресуспендирование клеточного осадка на стадии первой фиксации, в момент, когда клетки уже прошли гипотоническую обработку, но еще не были зафиксированы, поэтому механическое перемешивание способствовало повышению доли разлетевшихся хромосом, а также повреждению их структуры.
Оптимальным вариантом гипотонической обработки, при которой регистрировали наибольшую долю доступных для анализа метафазных пластинок, является обработка 0,56% раствором KCl с выдержкой в течение 20 мин и последующей фиксацией смесью метанола и уксусной кислоты (3:1 об./об.) в течение 12 ч.
С целью улучшения качества цитогенетических препаратов были рассмотрены дополнительные условия пробоподготовки, такие как сушка препаратов во влажной камере, использование среды 199 и культивирование клеток костного мозга, использование буферного гипотонического раствора (0,4% KCl с HEPES), применение дополнительной фиксации клеток 6% раствором уксусной кислоты. При использовании буферного гипотонического раствора не было отмечено более выраженной диффузии хромосом по сравнению с обработкой 0,56% раствором KCl, при этом регистрировали высокую долю слипшихся хромосом, доля доступных для анализа метафаз при таких условиях обработки составила 52%. Результаты сравнения влияния гипотонической обработки на слипание хромосом в метафазных пластинках представлены на рисунке 1.
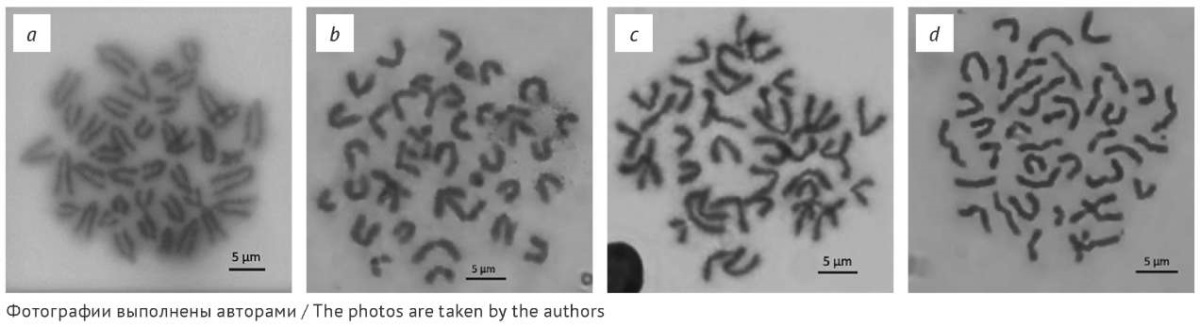
Рис. 1. Метафазные пластинки при обработке различными гипотоническими растворами:
a, b — 0,56% раствор KCl; c, d — буферный гипотонический раствор (0,4% KCl с HEPES)
Fig. 1. Metaphase plates from cytogenetic preparations treated with various hypotonic solutions:
a, b, 0.56% KCl; c, d, hypotonic buffer solution (0.4% KCl and HEPES)
Культивирование клеток в среде 199 после отбора позволило увеличить общее количество метафазных пластинок на стекле, но никак не повлияло на доступность для анализа.
Сушка препаратов во влажной камере способствовала укорачиванию плеч хромосом и более выраженной диффузии хромосом в метафазной пластинке (рис. 2). Несмотря на то что хромосомы расположены более диффузно, укорачивание плеч хромосом может негативно отразиться на качестве исследования из-за сложностей визуализации аберраций. Доля доступных для анализа пластинок в данном случае составила 53%. Фиксация с использованием 6% раствора уксусной кислоты позволила увеличить долю доступных для анализа метафаз до 56% (табл. 1). Повышение качества цитогенетических препаратов отмечали при использовании стадии культивирования клеток костного мозга в среде 199 и стадии дополнительной фиксации 6% раствором уксусной кислоты.
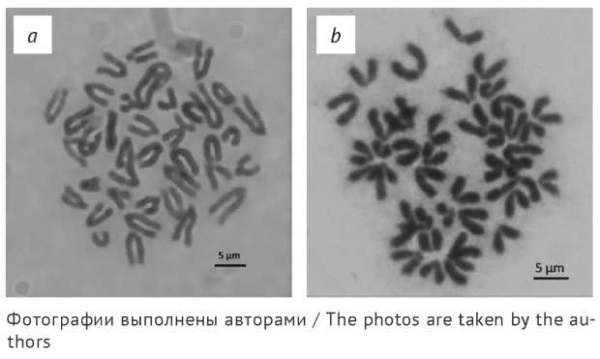
Рис. 2. Метафазные пластинки
при различных условиях высушивания цитогенетических препаратов:
a — сушка на воздухе при комнатной температуре; b — сушка во влажной камере
Fig. 2. Metaphase plates from cytogenetic preparations dried under various conditions:
a, at room temperature and humidity; b, in a humidified chamber
Суммировать описание модифицированной методики приготовления цитогенетических препаратов можно следующим образом:
1) ввести мышам внутрибрюшинно раствор колхицина в дозе 4 мг/кг за 1,5 ч до эвтаназии;
2) извлечь бедренные кости, промыть костный мозг 1 мл среды 199, нагретой до 37 °С. В пробирки с клеточной взвесью добавить еще 4 мл среды 199, после чего выдержать пробирки 1–2 ч при 37 °С;
3) после инкубации пробирки центрифугировать в течение 10 мин при 160 g, удалить супернатант и добавить 3 мл 0,56% раствора KCl, перемешать и оставить при комнатной температуре на 20 мин;
4) после гипотонической обработки клетки снова центрифугировать, удалить супернатант и фиксировать 6% раствором уксусной кислоты 2 мин при комнатной температуре, после чего пробирки центрифугировать в течение 5 мин при 100 g;
5) дальнейшую фиксацию проводить раствором Кларка с двумя сменами фиксатора в течение 12 ч. При первой фиксации осадок не ресуспендировать. Между сменами фиксатора пробирки центрифугировать по 10 мин при 100 g;
6) после фиксации осадок разбавить в 0,5 мл фиксатора, аккуратно ресуспендировать и по 1–2 капли нанести на чистые охлажденные влажные стекла с высоты 15–20 см, держа пипетку перпендикулярно предметному стеклу;
7) высушить препараты при комнатной температуре;
8) поместить препараты в 10% раствор красителя Гимзы на 10 мин.
Таким образом, пробоподготовка по модифицированной методике (модификация условий гипотонической обработки и фиксации материала) позволила увеличить количество доступных для анализа пластинок по сравнению с количеством качественных пластинок, полученных по методике ГОСТ 34659-2020 (с 39 до 56%), а также увеличить количество метафаз с полным набором хромосом. Предложенная модификация методики позволяет сократить время приготовления препаратов на 10 ч по сравнению со способом, описанным в ГОСТ 34659-2020, и на 2 ч по сравнению с методикой из Руководства за счет уменьшения времени на фиксацию клеточной суспензии.
Описанная выше методика оригинальна и не повторяет методики, представленные ранее в научных статьях и методических руководствах.
ЗАКЛЮЧЕНИЕ
В ходе проведения исследований была экспериментально обоснована необходимость модификации методики приготовления цитогенетических препаратов костного мозга млекопитающих in vivo. Предложенная последовательность процедур пробоподготовки образцов метафазных пластинок имеет ряд преимуществ перед методиками, описанными в «Руководстве по проведению доклинических исследований лекарственных средств» и ГОСТ 34659-2020 «Методы испытания по воздействию химической продукции на организм человека. Оценка хромосомных аберраций в клетках костного мозга млекопитающих», в том числе увеличение количества пригодных для анализа метафаз на 5%, увеличение доли хромосом с полным набором (n=40) на 12% и сокращение времени, затрачиваемого на приготовление препаратов на 2–10 ч. Разработанная методика рекомендуется для использования в доклинических исследованиях in vivo для получения цитогенетических препаратов.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: А.О. Вернер — идея, планирование и проведение экспериментальной части исследования, подбор и анализ литературы, написание и оформление рукописи; Т.М. Устинова — подбор и анализ литературы, редактирование текста рукописи, формулировка выводов; Н.Г. Венгерович — редактирование текста рукописи и утверждение окончательного варианта статьи.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Anna O. Verner conceived the idea of the study, designed and conducted the experiments, collected and analysed literature, drafted and designed the manuscript. Tatiana M. Ustinova collected and analysed literature, edited the manuscript, and formulated the conclusions. Nikolai G. Vengerovich edited the manuscript and approved the final version for publication.
1. Руководство по краткосрочным тестам для выявления мутагенных и канцерогенных химических веществ. Женева: ВОЗ; 1989.
2. Миронов АН, ред. Руководство по проведению доклинических исследований лекарственных средств. Ч. 1. М.: Гриф и К; 2012.
3. Миронов АН, ред. Руководство по проведению доклинических исследований лекарственных средств. Ч. 1. М.: Гриф и К; 2012.
ГОСТ 34659-2020. Методы испытания по воздействию химической продукции на организм человека. Оценка хромосомных аберраций в клетках костного мозга млекопитающих.
4. Миронов АН, ред. Руководство по проведению доклинических исследований лекарственных средств. Ч. 1. М.: Гриф и К; 2012.
5. ГОСТ 34659-2020. Методы испытания по воздействию химической продукции на организм человека. Оценка хромосомных аберраций в клетках костного мозга млекопитающих.
6. Руководство по краткосрочным тестам для выявления мутагенных и канцерогенных химических веществ. Женева: ВОЗ; 1989.
7. Плагина КЛ. Разработка методики цитогенетического анализа ооцитов для генотоксикологической оценки лекарственных средств: автореф. дис. … канд. биол. наук. М.: 2018.
8. Миронов АН, ред. Руководство по проведению доклинических исследований лекарственных средств. Ч. 1. М.: Гриф и К; 2012.
Список литературы
1. Дурнев АД, Жанатаев АК. Актуальные аспекты генетической токсикологии лекарственных средств. Ведомости Научного центра экспертизы средств медицинского применения. Регуляторные исследования и экспертиза лекарственных средств. 2022;12(1):90–109. https://doi.org/10.30895/1991-2919-2022-12-1-90-109
2. Deng W, Tsao SW, Lucas JN. A new method for improving metaphase chromosome spreading. Cytometry A. 2003;51(1):46–51. https://doi.org/10.1002/cyto.a.10004
3. Moralli D, Yusuf M, Mandegar MA. An improved technique for chromosomal analysis of human ES and iPS cells. Stem Cell Rev Rep. 2011;7(2):471–7. https://doi.org/10.1007/s12015-010-9224-4
4. Liehr T, Weise A, Person L. How to obtain high-quality metaphase spreads for molecular cytogenetics. Curr Protoc. 2022;2(2):e392. https://doi.org/10.1002/cpz1.392
5. Новгородова ИП. Сравнительный анализ гипотонических растворов для цитогенетических исследований животных. Аграрная наука. 2021;(6):24–6. https://doi.org/10.32634/0869-8155-2021-350-6-24-26
6. Овсепян ВА, Югов ЮИ. Способ приготовления препаратов метафазных хромосом из клеток костного мозга больных гемобластозами. Патент Российской Федерации № 2200318; 2000. EDN: MMDIRO
7. Буданцев АЮ, Демьянов АЮ. Деформация тканей в ходе гистологического процессинга. I. Методы морфометрической оценки деформаций. Цитология. 2017;59(5):362–8. EDN: YQGDZP
8. Коненков ВИ, Королев МА, Чурин АА. Изучение возможных мутагенных свойств нового лекарственного средства на основе комплекса лития, оксида алюминия и полиметилсилоксана. Сибирский научный медицинский журнал. 2019;39(5):62–7. https://doi.org/10.15372/SSMJ20190507
9. Долгова ЕВ, Николин ВП, Попова НА. Патологические изменения, возникающие в организме мышей, обработанных сочетанием циклофосфана и экзогенной ДНК. Вавиловский журнал генетики и селекции. 2013;17(1):129–46. EDN: RUGRAJ
10. Blumenthal AB, Dieden JD, Kapp LN, Sedat JW. Rapid isolation of metaphase chromosomes containing high molecular weight DNA. J Cell Biol. 1979;81(1):255–9. https://doi.org/10.1083/jcd.81.1.255
11. Fukami M, Shima H, Suzuki E, Ogata T, Matsubara K, Kamimaki T. Catastrophic cellular events leading to complex chromosomal rearrangements in the germline. Clin Genet. 2017;91(5):653–60. https://doi.org/10.1111/cge.12928
12. Mardin BR, Drainas AP, Waszak SM, Weischenfeldt J, Isokane M, Stütz AM, et al. A cell-based model system links chromothripsis with hyperploidy. Mol Syst Biol. 2015;11(9):828–40. https://doi.org/10.15252/msb.20156505
13. Pacchierotti F, Stocchi V. Analysis of chromosome aberrations in somatic and germ cells of the mouse. Methods Mol Biol. 2013;1044:147–63. https://doi.org/10.1007/978-1-62703-529-3_7
Об авторах
А. О. ВернерРоссия
Вернер Анна Олеговна
ул. Лесопарковая, д. 4, Санкт-Петербург, 195043
Т. М. Устинова
Россия
Устинова Татьяна Михайловна, канд. биол. наук
ул. Лесопарковая, д. 4, Санкт-Петербург, 195043
Н. Г. Венгерович
Россия
Венгерович Николай Григорьевич, д-р мед. наук, доцент
ул. Лесопарковая, д. 4, Санкт-Петербург, 195043
Дополнительные файлы
Рецензия
Для цитирования:
Вернер А.О., Устинова Т.М., Венгерович Н.Г. Оптимизация методики приготовления цитогенетических препаратов при проведении метафазного анализа клеток костного мозга млекопитающих in vivo. Регуляторные исследования и экспертиза лекарственных средств. 2024;14(3):295-303. https://doi.org/10.30895/1991-2919-2024-14-3-295-303
For citation:
Verner A.O., Ustinova T.M., Vengerovich N.G. Optimisation of a Cytogenetic Sample Preparation Procedure for In Vivo Metaphase Analysis of Mammalian Bone Marrow Cells. Regulatory Research and Medicine Evaluation. 2024;14(3):295-303. (In Russ.) https://doi.org/10.30895/1991-2919-2024-14-3-295-303



































