Перейти к:
Химический состав и антиоксидантная активность экстрактов плодовых тел Ganoderma lingzhi и Ganoderma lucidum
https://doi.org/10.30895/1991-2919-2024-609
Резюме
ВВЕДЕНИЕ. Грибы рода Ganoderma spp., используемые в восточной медицине и в качестве биологически активных добавок к пище, представляют интерес как источники эффективных антиоксидантов. В Российской Федерации и Республике Беларусь не разработана нормативная документация по контролю качества этого вида сырья и его биологически активных веществ, поэтому исследование химического состава и спектра фармакологической активности экстрактов G. lingzhi и G. lucidum является актуальной задачей.
ЦЕЛЬ. Установление химического состава и антиоксидантной активности экстрактов плодовых тел G. lingzhi и G. lucidum.
МАТЕРИАЛЫ И МЕТОДЫ. Объектами исследования явились чистые культуры G. lingzhi и G. lucidum из коллекции штаммов грибов ГНУ «Институт леса НАН Беларуси». Для культивирования биомассы использовали два субстрата на основе опилок ольхи (степень измельчения 1–3 мм) и стружки дуба (степень измельчения 5–10 мм). Экстрагирование биомассы проводили 70% этанолом по методу ремацерации. Для определения антирадикальной активности экстрактов грибов использовали реакцию со стабильным свободным радикалом DPPH (2,2-дифенил-1-пикрилгидразил) и катион-радикалом ABTS (2,2’-азино-бис(3-этилбензтиазолин-6-сульфоновой кислоты). Химический состав экстрактов исследовали методом хроматомасс-спектрометрии. Определение количества фенольных, стероидных и тритерпеновых соединений проводили спектрофотометрически.
РЕЗУЛЬТАТЫ. Установлено, что наибольшую антирадикальную активность проявляет экстракт штамма 334 G. lucidum, выращенный на субстрате ольхи (концентрация полумаксимального ингибирования (IC50) по реакции с DPPH=3,1±0,2 мкг/мл, IC50 (ABTS)=3,7±0,2 мкг/мл) и характеризующийся максимальным содержанием фенольных (326,2±16,5 мкмоль/г) и тритерпеновых соединений (2,00±0,11 ммоль/г). Антиоксидантная активность полученных экстрактов может быть обусловлена содержанием ганодеровой кислоты D, люциденовой кислоты D и нарингенина и других фенольных соединений.
ВЫВОДЫ. Высокий выход экстракта со значительным уровнем антиоксидантной активности позволяет рассматривать искусственно выращенные грибы G. lingzhi и G. lucidum в качестве перспективных источников природных антиоксидантов.
Ключевые слова
Для цитирования:
Горбацевич Г.И., Зеневич Л.С., Баталова И.Р., Коваленко С.А., Бычковский П.М. Химический состав и антиоксидантная активность экстрактов плодовых тел Ganoderma lingzhi и Ganoderma lucidum. Регуляторные исследования и экспертиза лекарственных средств. 2024;14(6):686-697. https://doi.org/10.30895/1991-2919-2024-609
For citation:
Harbatsevich H.I., Zenevich L.S., Batalova I.R., Kovalenko S.A., Bychkovsky P.M. Chemical Composition and Antioxidant Activity of Ganoderma lingzhi and Ganoderma lucidum Fruiting Body Extracts. Regulatory Research and Medicine Evaluation. 2024;14(6):686-697. (In Russ.) https://doi.org/10.30895/1991-2919-2024-609
ВВЕДЕНИЕ
За последние годы описано около 220 видов грибов рода Ganoderma, более 400 таксонов, из которых 167 относится к лакированным видам [1]. Молекулярно-генетический анализ таксонов, обозначенных как G. lucidum, включая штаммы, коммерчески культивируемые для производства лекарственных препаратов и биологически активных добавок к пище, позволил выявить, что это название охватывает множество различных видов и ранее часто применялось неправильно [2]. Ошибки таксономической идентификации штаммов ганодермы препятствуют комплексным стратегиям поиска новых лекарственных средств. Используемые в медицинских, химических, геномных исследованиях изоляты G. lingzhi (син. G. sichuanense), а также коммерчески культивируемые штаммы до сих пор объединяют под общим названием G. lucidum, хотя около 20 лет назад было показано, что образцы G. lucidum из Европы и Восточной Азии в большинстве своем не являются конспецифическими [3], а вид G. lingzhi отличается от близкородственного вида G. lucidum [4].
Экстракты плодовых тел, мицелия, культуральная жидкость, споры G. lucidum и G. lingzhi обладают широким спектром фармакологических свойств и используются в качестве источника биологически активных веществ (БАВ) [5], оказывающих иммуномодулирующее, противоопухолевое [6][7], противовирусное [8], антимикробное [9], гиполипидемическое, гипогликемическое [10], гепатопротекторное [11] и противовоспалительное действия [12]. Стоимость препаратов, получаемых из грибов рода Ganoderma, в настоящее время ежегодно оценивается почти в два млрд $ [4]. Плодовые тела Ganoderma spp. имеют уникальный химический состав: содержат микроэлементы (железо, цинк, медь, марганец, селен) [13], полисахариды [14][15], белки [16], лектины [17], витамины (B1, B2, B6, PP, D2), тритерпеновые соединения преимущественно ланостанового ряда [18].
Биологическая активность Ganoderma spp. в значительной степени может быть обусловлена антиоксидантным действием содержащихся в плодовых телах соединений. Избыточное образование свободных радикалов является причиной повреждения клеточных структур и составляющих их биомолекул (мембранные липиды, нуклеиновые кислоты, белки и ферменты), что может приводить к развитию хронических заболеваний (болезнь Альцгеймера, болезнь Паркинсона, сердечно-сосудистые заболевания, заболевания печени, язвенный колит, воспаление и рак) [19]. Снизить риски или предотвратить прогрессирование этих патологических состояний возможно путем усиления естественной антиоксидантной защиты организма или с помощью экзогенных антиоксидантов. В связи с этим изучение природных антиоксидантов и поиск содержащего их сырья являются весьма актуальными задачами современных исследований в области химии, биологии и фармации [20].
Дополнительной задачей при использовании нового природного сырья для фармацевтических целей является его стандартизация. Химический состав растительного сырья зависит от вида производящего растения, условий выращивания, фазы вегетации и времени сбора, способа подготовки сырья, режима экстракции и других факторов. Если источником сырья являются грибы, то на качественный и количественный состав продукта влияют характеристики не только исходного штамма гриба, но и используемого для его выращивания субстрата. Представляется актуальным изучение влияния этих факторов на биологическую активность целевого продукта с дальнейшей стандартизацией грибного сырья и оптимизацией условий выделения БАВ. необходимым этапом исследования является установление взаимосвязи между химическим составом сырья и биологической активностью полученных экстрактов.
В настоящее время на территории Российской Федерации и Республики Беларусь отсутствуют зарегистрированные лекарственные средства, содержащие компоненты грибов рода Ganoderma. В обращении находится лишь биологически активная добавка «Рейши, трутовик лакированный, сырье растительное 25 г». Отсутствует также нормативная документация по контролю качества этого вида сырья и его биологически активных веществ.
Цель работы — установление химического состава и антиоксидантной активности экстрактов плодовых тел G. lingzhi и G. lucidum.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования по получению плодовых тел G. lucidum и G. lingzhi проведены в лабораторных условиях сектора пищевых и лекарственных ресурсов леса Государственного научного учреждения «Институт леса Национальной академии наук Беларуси». В качестве объектов исследований использовали чистые культуры из коллекции штаммов грибов (FIB) ГНУ «Институт леса НАН Беларуси». G. lingzhi S.H. Wu, Y. Cao & Y.C. Dai (син. G. sichuanense J.D. Zhao & X.Q. Zhang): штаммы 244, 266, 303, 304, 331, 333, 357, 362; G. lucidum (Curtis) P. Karst.: штаммы 171, 334, 335, 358 (табл. 1) и коммерческий доступный продукт из Китая (Bozhou Swanf Commercial and Trade Co., Ltd; серия 09-2022) в качестве образца сравнения.
Таблица 1. Происхождение коллекционных штаммов Ganoderma spp.
Table 1. Origins of collection strains of Ganoderma spp.
№ образца Sample No. | Вид, субстрат Species, substrate | № штамма, год Strain No., year | Источник поступления в коллекцию Source for the collection | Растворитель, использованный для экстракции Solvent used for extraction |
1 | G. lingzhi, дуб G. lingzhi, oak | 244, 2006 | Гомельский р-н, п. Кореневка, выделен из плодового тела Gomel region, Korenevka village, isolated from a fruiting body | Этанол : вода (70:30 об./об.) Ethanol : water (70:30 v/v) |
2 | G. lingzhi, ольха G. lingzhi, alder | |||
3 | G. lingzhi, дуб G. lingzhi, oak | 303, 2011 | Брестская обл., Березовский р-н, г. Белоозерск, грибоводческое хозяйство «Виола», выделен из посевного мицелия Brest region, Byaroza district, Byelaazyorsk, Viola mushroom farm, isolated from seed mycelium | |
4 | G. lingzhi, ольха G. lingzhi, alder | |||
5 | G. lingzhi, дуб G. lingzhi, oak | 304, 2011 | Брестская обл., Березовский р-н, г. Белоозерск, грибоводческое хозяйство «Виола», выделен из посевного мицелия Brest region, Byaroza district, Byelaazyorsk, Viola mushroom farm, isolated from seed mycelium | |
6 | G. lingzhi, ольха G. lingzhi, alder | |||
7 | G. lingzhi, дуб G. lingzhi, oak | 333, 2004 | г. Киев, Институт ботаники им. Н.Г. Холодного, чистая культура штамма IBK-1787 Kyiv, M.G. Kholodny Institute of Botany, pure culture of strain IBK-1787 | |
8 | G. lingzhi, ольха G. lingzhi, alder | |||
9 | G. lucidum, ольха G. lucidum, alder | 334, 2004 | г. Киев, Институт ботаники им. Н.Г. Холодного, чистая культура штамма IBK-1788 Kyiv, M.G. Kholodny Institute of Botany, pure culture of strain IBK-1788 | |
10 | G. lucidum, дуб G. lucidum, oak | 335, 2004 | г. Киев, Институт ботаники им. Н.Г. Холодного, чистая культура штамма IBK-1683 (Германия, Weser-Champignon). Депонирован в БИМ F-373 Д Kyiv, M.G. Kholodny Institute of Botany, pure culture of strain IBK-1683 (Germany, Weser-Champignon). Deposited in the Belarusian Collection of Non-pathogenic Microorganisms (BIM F-373 D) | |
11 | G. lucidum, ольха G. lucidum, alder | |||
12 | G. lingzhi | –* | Китай, Bozhou Swanf Commercial and Trade Co., Ltd China, Bozhou Swanf Commercial and Trade Co., Ltd | |
13 | G. lingzhi | –* | Петролейный эфир 40–70** Petroleum ether 40–70** | |
14 | G. lingzhi | –* | Хлороформ** Trichloromethane** | |
15 | G. lingzhi | –* | Этилацетат** Ethyl acetate** | |
16 | G. lingzhi | –* | Этанол 96% (об.) ** Ethanol 96% (v/v)** |
Таблица составлена авторами по данным работы [21] / The table is prepared by the authors using [21]
Примечание. * Штамм не внесен в коллекцию ГНУ «Институт леса НАН Беларуси».
** Последовательная дробная экстракция растворителями растущей полярности.
Note. *Not part of the collection of the Forest Institute of the National Academy of Sciences of Belarus.
**Consecutive fractional extraction with solvents in order of increasing polarity.
До молекулярно-генетической идентификации, проведенной в 2015 г. в лаборатории геномных исследований и биоинформатики ГНУ «Институт леса НАН Беларуси», считалось, что все штаммы относятся к G. lucidum. Видовая идентификация проводилась с использованием генетических методов анализа: полимеразная цепная реакция, секвенирование по Сэнгеру. В качестве маркерного региона для видового определения использовался фрагмент рибосомной ДНК «18S рДНК-ITS1-5,8S рДНК-ITS2-28S рДНК», который является «золотым стандартом» при идентификации грибов на протяжении нескольких десятилетий и до настоящего времени1 [22].
В эксперименте использовали два опилочных субстрата: на основе опилок ольхи Alnus glutinosa (степень измельчения 1–3 мм) и стружки дуба Quercus robur (степень измельчения 5–10 мм), обогащенных ржаными отрубями (ОАО «Молодечненский КХП», ТУ BY 500022448.002-2019) в весовом соотношении 4:1, с добавлением по 1% мела и гипса (ОАО «Фелуценовое подворье», кормовой), повторность опыта шестикратная. Субстрат стерилизовали при давлении 0,12 МПа (температура 122 ºС) в течение 2 ч. Блоки массой по 1 кг инокулировали зерновым посевным мицелием в количестве 5% от массы субстрата; pH субстрата из ольховых опилок после автоклавирования составляла 5,9, дубовой стружки — 4,7. Влажность ольховых блоков составляла 65%, дубовых — 66%. Субстратные блоки созревали при температуре 22–24 ºС. В период плодоношения в культивационном помещении поддерживали относительную влажность воздуха на уровне 70–80%, температуру 20–22 ºС, уровень освещения не ниже 200 люкс. Плодовые тела отделяли от субстрата и высушивали воздушно-теневым способом (потеря в массе при высушивании сырья составляла 7,0–9,9%).
Для приготовления экстрактов грибов применяли метод ремацерации. Для экстракции использовали 10,0 г высушенного сырья, а в качестве экстрагента — 70% (об./об.) раствор этанола в воде. Экстракцию проводили в течение двух недель при комнатной температуре. Каждые 48 ч экстракт отделяли, а к сырью добавляли свежую порцию экстрагента. По завершении экстракты объединяли и фильтровали. Объединенные экстракты упаривали в вакууме (40–50 ºС) на роторном испарителе RV 05 (Ika Werke GmbH) досуха.
Для получения фракционированных экстрактов использовали последовательную экстракцию растворителями растущей полярности: петролейный эфир (40–70, х.ч., ЭКОС-1), хлороформ (х.ч., ЭКОС-1), этилацетат (х.ч., ЭКОС-1) и этанол (ректифицированный, ОАО «Белхим»). Такой подход позволяет провести предварительное разделение БАВ по полярности. Измельчение проводили после высушивания сырья на дробилке молотковой (MOLOT 200). Для экстракции использовали измельченное сырье массой 20,0 г (размер частиц — не более 1000 мкм). Экстракцию проводили в течение 48 ч для каждого извлечения в аппарате Сокслета. Полученные экстракты упаривали в вакууме (30–50 ºС) на роторном испарителе.
Каждый экстракт готовили в трех параллельных извлечениях. Готовые продукты хранили в герметично закрытой таре в холодильнике при температуре 4±2 ºС. Выход экстракта выражали как отношение массы сухого экстракта к взятой навеске сухого сырья. Потерю в массе при высушивании определяли гравиметрически после высушивания навески сырья до постоянной массы при температуре 105±2 ºС.
Для определения общего содержания фенольных соединений (ОСФ) с реактивом Фолина–Чокальтеу (Merck, кат. № 109001) использовали растворы 1% экстрактов в этаноле 70% (об.). Для построения калибровочного графика готовили серию растворов галловой кислоты (ГК) в диапазоне концентраций 15,625–500 мкг/мл. В пробирки отбирали по 20 мкл растворов экстрактов, добавляли 100 мкл раствора Фолина–Чокальтеу, 400 мкл 10% раствора Na2CO3 (ч.д.а., ЗАО «Пять океанов»), 1500 мкл воды очищенной (получена на аквадистилляторе ДЭ-10М) и оставляли растворы на 1 ч при комнатной температуре в темном месте [23]. ОСФ в экстрактах определяли спектрофотометрически. Оптическую плотность растворов измеряли на спектрофотометре HALO VIS-20 (Dynamica Scientific Ltd.) в кварцевой кювете (длина оптического пути 1 см) при длине волны 725 нм. Содержание фенольных соединений выражали в микромолях галловой кислоты на грамм сухого экстракта (мкмоль/г).
Определение количества стероидных и тритерпеновых соединений (ОСТС) в образцах экстрактов проводили спектрофотометрическим методом [24]. К 0,5 мл 0,1% спиртового раствора экстракта добавляли 0,5 мл 10% спиртового раствора ванилина (Merck, кат. № 8187180100) и 2,5 мл 70% раствора серной кислоты (х.ч., Экос-1), перемешивали, смесь выдерживали при температуре 60 ºC на водяной бане WB-4 (ОДО «БЕЛАКВИЛОН») в течение 10 мин, после чего растворы охлаждали и проводили измерение их оптической плотности при длине волны 548 нм. В качестве раствора сравнения использовали реакционную смесь, не содержащую экстракта, а калибровочный график строили с использованием серии этанольных растворов холестерина 0,1–10,0 мг/мл (Merck, кат. № C8667-5G).
Для определения антирадикальной активности (как одного из составляющих антиоксидантной активности) экстрактов грибов использовали реакцию со стабильным свободным радикалом DPPH (2,2-дифенил-1-пикрилгидразил) и катион-радикалом ABTS (2,2’-азино-бис(3-этилбензтиазолин-6-сульфоновой кислоты) [25]. К 20 мкл растворов экстрактов (область концентраций 0,01–1%) добавляли по 2,0 мл раствора DPPH (Merck, кат. № 300267) или ABTS (Merck, кат. № A1888), перемешивали раствор и выдерживали в течение 40 мин. Оптическую плотность растворов измеряли при длине волны 517 (DPPH) или 734 нм (ABTS) относительно раствора сравнения (20 мкл растворов проб и 2 мл 96% этанола). В качестве контроля использовали раствор, состоящий из 20 мкл этанола и 2 мл раствора DPPH (ABTS). Степень ингибирования (I) свободных радикалов рассчитывали по формуле:
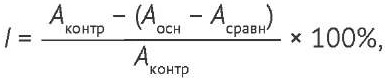 (1)
(1)
где Аконтр — оптическая плотность, полученная в контрольном опыте (без добавления исследуемого экстракта); Аосн — оптическая плотность, полученная в основном опыте; Асравн — оптическая плотность раствора сравнения (для учета поглощения света компонентами экстракта). Антирадикальную активность экстрактов выражали в единицах концентрации полумаксимального ингибирования (IC50).
Качественный и полуколичественный состав экстрактов образцов грибов изучали методом высокоэффективной жидкостной хроматографии (ВЭЖХ). Готовили 0,1% раствор сухого экстракта в метаноле (квалификация для ВЭЖХ, CARLO ERBA Reagents GmbH). Анализ проводили на хроматографе Thermo Scientific Ultimate 3000 с масс-спектрометрическим детектором Q Exactive™ Focus Orbitrap (Thermo Fisher Scientific). Для разделения компонентов использовали колонку с обращенной фазой C18 Kinetex 150 мм × 2,1 мм × 2,6 мкм (Phenomenex). Элюирование проводили в градиентном режиме (табл. 2), объем ввода пробы — 15 мкл, скорость потока — 0,4 мл/мин. Температура колонки поддерживалась на уровне 25 ºC. Ионизация проводилась при напряжении распылительного капилляра 4 кВ в диапазоне сканирования m/z 120–1000. Скрининг молекулярных ионов проводили в режиме Full-MS (отрицательно заряженные ионы), а для идентификации отдельных компонентов дополнительно изучали продукты фрагментации целевых ионов, полученных в режиме MS/MS (энергия соударения 35 эВ). Для обработки хроматограмм использовали программные продукты Thermo Scientific Xcalibur и Chromeleon v.7.2.6.
Статистическую обработку данных проводили с использованием программы MS Excel 2019.
Таблица 2. Соотношение растворителей для градиентного элюирования
Table 2. Solvent ratios for gradient elution
Время, мин Time, min | Подвижная фаза А, 0,5% водный раствор уксусной кислоты, % Mobile phase A (0.5% acetic acid in water), % | Подвижная фаза B, ацетонитрил, % Mobile phase B (acetonitrile), % |
0 | 80 | 20 |
1 | 70 | 30 |
20 | 70 | 30 |
60 | 2 | 98 |
70 | 2 | 98 |
75 | 80 | 20 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Выбор 70% этанола в качестве экстрагента связан с его высокой извлекающей способностью в отношении широкого спектра БАВ, относительно высокой летучестью и химической стабильностью. Метод ремацерации при комнатной температуре, несмотря на свою длительность и высокий расход растворителя, позволяет максимально сохранить содержащиеся в сырье БАВ в нативном состоянии, что крайне важно в исследовании химического состава новых природных объектов. В таблице 3 приведен выход экстрактов, полученных из образцов грибов различных штаммов. Сопоставление этих результатов с уровнем антиоксидантной активности позволяет заключить, что высокий выход экстрактивных веществ из плодовых тел отдельных штаммов Ganoderma spp. (образцы 1, 4, 6, 10–12) при относительно невысоком ОСФ и антирадикальной активности могут свидетельствовать об интенсивной соэкстракции балластных веществ (прежде всего полисахаридов). Напротив, экстракты образцов с максимальной активностью характеризуются сравнительно невысоким выходом (табл. 3).
Таблица 3. Выходы экстрактов, общее содержание фенольных (в пересчете на галловую кислоту), тритерпеновых и стероидных (в пересчете на холестерин) соединений экстрактов Ganoderma spp. и их антирадикальная активность
Table 3. Yield, total phenolic content (expressed as gallic acid), triterpene and steroid content (expressed as cholesterol), and free radical-scavenging activity of the Ganoderma spp. extracts
Образец, из которого получен экстракт Extracted sample | Выход экстракта, % Extract yield, % | ОСФ, мкмоль/г TPC, µmol/g | ОСТС, ммоль/г TSTC, mmol/g | IC50 (DPPH), мкг/мл IC50 (DPPH), μg/mL | IC50 (ABTS), мкг/мл IC50 (ABTS), μg/mL |
1 | 11,3±0,6 | 15,6±0,8 | 1,04±0,05 | 69,5±3,5 | 31,4±1,6 |
2 | 7,9±0,4 | 10,2±0,5 | 0,62±0,03 | 76,7±3,8 | 46,4±2,3 |
3 | 3,8±0,2 | 39,3±1,9 | 1,69±0,08 | 63,3±3,2 | 9,0±0,5 |
4 | 10,4±0,5 | 2,1±0,1 | 0,53±0,03 | 127,6±6,4 | 77,1±3,9 |
5 | 6,4±0,3 | 42,0±2,1 | 1,78±0,09 | 63,8±3,2 | 34,5±1,7 |
6 | 14,4±0,7 | 7,5±0,4 | 0,35±0,02 | 149,9±7,5 | 75,5±3,8 |
7 | 6,3±0,3 | 23,8±1,2 | 0,50±0,03 | 92,3±4,6 | 44,7±2,2 |
8 | 6,7±0,3 | 19,0±0,9 | 1,04±0,05 | 53,3±2,7 | 39,7±2,0 |
9 | 1,3±0,1 | 326,2±16,5 | 2,00±0,11 | 3,1±0,2 | 3,7±0,2 |
10 | 9,6±0,5 | 22,5±1,1 | 0,97±0,05 | 56,3±2,8 | 6,3±0,3 |
11 | 10,2±0,5 | 22,5±1,1 | 0,72±0,04 | 67,4±3,4 | 49,8±2,5 |
12 | 10,3±0,5 | 21,7±1,1 | 0,88±0,04 | 60,9±3,0 | 40,7±2,0 |
13 | 1,3±0,1 | 20,4±1,5 | 0,76±0,06 | >200 | >200 |
14 | 6,1±0,3 | 120,5±9,4 | 1,84±0,09 | 58,7±2,9 | 31,1±1,6 |
15 | 1,0±0,1 | 142,8±10,6 | 1,96±0,10 | 55,2±2,8 | 8,0±0,4 |
16 | 8,1±0,4 | 155,2±8,8 | 0,36±0,02 | 90,7±4,5 | 35,1±1,8 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. ОСФ — общее содержание фенольных соединений в сухом экстракте в пересчете на галловую кислоту; ОСТС — общее содержание тритерпеновых и стероидных соединений в сухом экстракте в пересчете на холестерин; IC50 (DPPH) и IC50 (ABTS) — концентрации полумаксимального ингибирования по реакции со свободным радикалом (2,2-дифенил-1-пикрилгидразил) и катион-радикалом (2,2’-азино-бис(3-этилбензтиазолин-6-сульфоновой кислоты) соответственно.
Note. TPС, total phenolic content in dry extract, expressed as gallic acid; TSTC, total steroid and triterpene content in dry extract, expressed as cholesterol; IC50 (DPPH), half maximal inhibitory concentration in 2,2-diphenyl-1-picrylhydrazyl stable free radical assay; IC50 (ABTS), half maximal inhibitory concentration in 2,2’-azinobis(3-ethylbenzothiazoline-6-sulphonic acid) radical cation assay.
Антиоксидантную активность оценивали по трем параметрам: ОСФ и ингибированию DPPH и ABTS радикалов (табл. 3). Методики являются общепринятыми при оценке антиоксидантной активности природных соединений [26]. Отметим, что определение ОСФ основано на восстановлении соединений Mo(VI) до молибденовой сини. В эту реакцию могут вступать фенольные соединения: флавоноиды (нарингенин), производные гидрохинона (лингжины); а также органические соединения других классов с низким значением электрохимического потенциала (углеводы, стероиды, тритерпены, витамины и др.) [23].
Наибольшая антиоксидантная активность была отмечена для экстракта штамма 334 G. lucidum (образец 9), выращенного на субстрате ольхи: его ОСФ составляет 326,2±16,5 мкмоль/г, IC50 (DPPH)=3,1±0,2 мкг/мл, а IC50 (ABTS)=3,7±0,2 мкг/мл, что на порядок превосходит активность других образцов, в том числе коммерчески доступного продукта (образец 12). Для образца 9 также характерно высокое значение ОСТС (2,00±0,11 ммоль/г), и следует отметить, что стероидные и тритерпеновые соединения наряду с фенолами могут вносить дополнительный вклад в антиоксидантную активность G. lucidum. В представленной выборке наблюдается корреляция величин IC50 (DPPH) и IC50 (ABTS).
Результаты исследования химического состава полученных экстрактов методом ВЭЖХ с масс-спектрометрическим детектированием представлены на рисунке 1 «Общие хроматограммы (масс-детектор, режим полного сканирования отрицательных ионов в области m/z 120–1000) образцов»2, рисунке 2 «Хроматограммы экстракта образца G. lucidum (штамм 335, выращенный на дубовом субстрате) по выбранным молекулярным ионам»3 (опубликованы на сайте журнала) и в таблицах 4 «Идентифицированные компоненты экстрактов Ganoderma spp.» и 5 «Качественный и полуколичественный состав экстрактивных извлечений Ganoderma spp.»4 (опубликована на сайте журнала). Условия разделения и ионизации подбирали эмпирически. Идентификация соединений проводилась путем анализа продуктов фрагментации молекулярных ионов целевых веществ (табл. 4 «Идентифицированные компоненты экстрактов Ganoderma spp.», рис. 3 «Схема фрагментации люциденовой кислоты N. Mr ([M-H–]) = 459,28», рис. 4 «Масс-спектры идентифицированных веществ» (опубликован на сайте журнала)5). В экстрактах были обнаружены тритерпеновые соединения: люциденовые и ганодеровые кислоты и их производные; флавоноид нарингенин, лингжины, а также входящие в состав липидов жирные кислоты: линолевая, стеариновая, α-линоленовая, олеиновая (табл. 4).
Таблица 4. Идентифицированные компоненты экстрактов Ganoderma spp.
Table 4. Identified components of Ganoderma spp. extracts
Соединение Compound | m/z основных осколочных фрагментов, Да m/z of main fragment ions, Da |
Люциденовая кислота N Lucidenic acid N | 459,27 [M–H]–; 441,26 [M–H–H2O]–; 361,20 [M–H–C6H10O (цикл A)]–; 317,21 [M–H– C6H10O–CO2]–; 303,20 [M–H– C8H12O3 (цикл D)]–; 299,16 [M–H–C8H12O3–2H2]–; 289,18 [M–H–C8H12O3–CH2]–; 285,15 [M–H–C8H12O3–CH2–2H2]– 459.27 [M–H]–; 441.26 [M–H–H2O]–; 361.20 [M–H–C6H10O (cycle A)]–; 317.21 [M–H– C6H10O–CO2]–; 303.20 [M–H– C8H12O3 (cycle D)]–; 299.16 [M–H–C8H12O3–2H2]–; 289.18 [M–H–C8H12O3–CH2]–; 285.15 [M–H–C8H12O3–CH2–2H2]– |
Люциденовая кислота А Lucidenic acid A | 457,26 [M–H]–; 439,25 [M–H–H2O]–; 431,27 [M–H]–; 359,19 [M–H–C6H10O (цикл A)]–; 313,18 [M–H–C6H10O–CO2]–; 301,18 [M–H–C8H12O3 (цикл D)]–; 299,17 [M–H–C8H12O3–2H2]–; 287,18 [M–H–C8H12O3–CH2]–; 285,15 [M–H–C8H12O3–CH2–H2]–; 247,13 [M–H–C12H18O3 (циклы С и D)]–; 233,12 [M–H–C12H18O3(циклы С и D)–CH2]– 457.26 [M–H]–; 439.25 [M–H–H2O]–; 431.27 [M–H]–; 359.19 [M–H–C6H10O (cycle A)]–; 313.18 [M–H–C6H10O–CO2]–; 301.18 [M–H–C8H12O3 (cycle D)]–; 299.17 [M–H–C8H12O3–2H2]–; 287.18 [M–H–C8H12O3–CH2]–; 285.15 [M–H–C8H12O3–CH2–H2]–; 247.13 [M–H–C12H18O3 (cycles С and D)]–; 233.12 [M–H–C12H18O3(cycles С and D)–CH2]– |
Ганодеровая кислота А Ganoderic acid A | 515,30 [M–H]–; 497,29 [M–H–H2O]–; 479,28 [M–H–2H2O]–; 453,30 [M–H–H2O–CO2]–; 435,29 [M–H–2H2O–CO2]–; 301,18 [M–H–C8H12O3 (цикл D)]–; 299,17 [M–H–C8H12O3–2H2]–; 285,15 [M–H–C8H12O3–CH2–H2]–; 247,13 [M–H–C12H18O3 (циклы С и D)]–; 233,12 [M–H–C12H18O3–CH2]–; 417,23 [M–H–C6H10O (цикл A)]–; 355,23 [M–H–C6H10O–CO2 — H2O]– 515.30 [M–H]–; 497.29 [M–H–H2O]–; 479.28 [M–H–2H2O]–; 453.30 [M–H–H2O–CO2]–; 435.29 [M–H–2H2O–CO2]–; 301.18 [M–H–C8H12O3 (cycle D)]–; 299.17 [M–H–C8H12O3–2H2]–; 285.15 [M–H–C8H12O3–CH2–H2]–; 247.13 [M–H–C12H18O3 (cycles С and D)]–; 233.12 [M–H–C12H18O3–CH2]–; 417.23 [M–H–C6H10O (cycle A)]–; 355.23 [M–H–C6H10O–CO2 — H2O]– |
Ганодеровая кислота H Ganoderic acid H | 571,29 [M–H]–; 527,27 [M–H–CH3CO–H2]–; 511,31 [M–H–H2O+H2]–; 451,31 [M–H–H2O+H2–CH3COOH]– |
Ганодеровая кислота D Ganoderic acid D | 513,29[M–H]–; 495,28[M–H–H2O]–; 451,29 [M–H–H2O–CO2]–; 247,13 [M–H–C12H18O3 (циклы С и D)–H2O–CO2]–; 149,06 [M–H–C12H18O3–C6H10O (цикл B)– H2O–CO2]–; 417,23 [M–H–C6H10O (цикл A)]–; 355,23 [M–H–C6H10O–H2O–CO2]–; 301,18 [M–H–C8H12O3 (цикл D)]–; 299,17 [M–H–C8H12O3 –2H2]–; 247,13 [M–H–C12H18O3 (циклы С и D)]– 513.29[M–H]–; 495.28[M–H–H2O]–; 451.29 [M–H–H2O–CO2]–; 247,13 [M–H–C12H18O3 (cycles С and D)– H2O–CO2]–; 149.06 [M–H–C12H18O3–C6H10O (cycle B)– H2O–CO2]–; 417.23 [M–H–C6H10O (cycle A)]–; 355.23 [M–H–C6H10O–H2O–CO2]–; 301.18 [M–H–C8H12O3 (cycle D)]–; 299.17 [M–H–C8H12O3 –2H2]–; 247.13 [M–H–C12H18O3 (cycles С and D)]– |
Люциденовая кислота D Lucidenic acid D | 513,25 [M–H]–; 495,32 [M–H–H2O]–; 471,27 [M–H–CH3CO]–; 453,18[M–H–CH3COOH]– |
Ганодеровая кислота XL5 Ganoderic acid XL5 | 547,33 [M–H]–; 499,311 [M–H–CH3OH]–; 481,30 [M–H–H2O–CH3OH]–; 455,30 [M–H–CH3OH–CO2]–; 437,31 [M–H–H2O– CH3OH–CO2]–; 303,20 [M–H–C8H12O3 (цикл D)]–; 301,18 [M–H–C8H12O3–2H2]–; 287,17 [M–H–C8H12O3–CH2–H2]–; 249,15 [M–H–C12H18O3 (циклы С и D)]–; 235,13 [M–H–C12H18O3–CH2]–; 431,24 [M–H–C6H12O2 (цикл A)]–; 355,23 [M–H–C6H12O2–CO2–CH3OH]– 547.33 [M–H]–; 499.311 [M–H–CH3OH]–; 481.30 [M–H–H2O–CH3OH]–; 455.30 [M–H–CH3OH–CO2]–; 437.31 [M–H–H2O– CH3OH–CO2]–; 303.20 [M–H–C8H12O3 (cycle D)]–; 301.18 [M–H–C8H12O3–2H2]–; 287.17 [M–H–C8H12O3–CH2–H2]–; 249.15 [M–H–C12H18O3 (cycles С and D)]–; 235.13 [M–H–C12H18O3–CH2]–; 431.24 [M–H–C6H12O2 (cycle A)]–; 355.23 [M–H–C6H12O2–CO2–CH3OH]– |
3,7-Оксо-12-гидрокси-ганодериновая кислота DM 3,7-Oxo-12-hydroxy-ganoderic acid DM | 483,31 [M–H]–; 465,30 [M–H–H2O]–; 385,24 [M–H–C6H10O (цикл A)]–; 301,18 [M–H–C11H18O2 (цикл D)]–; 247,13 [M–H– C15H24O2 (циклы С и D)]– 483.31 [M–H]–; 465.30 [M–H–H2O]–; 385.24 [M–H–C6H10O (cycle A)]–; 301.18 [M–H–C11H18O2 (cycle D)]–; 247.13 [M–H– C15H24O2 (cycles С and D)]– |
Нарингенин Naringenin | 271,06 [M–H]–; 243,07 [M–H–CO]–; 203,07 [M–H–C3O2 (цикл A)]–; 151,00 [M–H–C8H8O (цикл B и С)]– 271.06 [M–H]–; 243.07 [M–H–CO]–; 203.07 [M–H–C3O2 (cycle A)]–; 151.00 [M–H–C8H8O (cycle B and С)]– |
Линолевая кислота Linoleic acid | 279,22 [M–H]– |
Стеариновая кислота Stearic acid | 283,26 [M–H]– |
12-Гидроксиганодериновая кислота C2 12-Hydroxy-ganoderic acid C2 | 533,31 [M–H]–; 515,30 [M–H–H2O]–; 497,29 [M–H–2H2O]–; 471,31 [M–H–H2O–CO2]–; 453,30 [M–H–2H2O–CO2]–; 433,22 [M–H–C6H12O (цикл A)]– 533.31 [M–H]–; 515.30 [M–H–H2O]–; 497.29 [M–H–2H2O]–; 471.31 [M–H–H2O–CO2]–; 453.30 [M–H–2H2O–CO2]–; 433.22 [M–H–C6H12O (cycle A)]– |
Лингжин D Lingzhine D | 269,08 [M–H]– |
Ганодеровая кислота G Ganoderic acid G | 531,30 [M–H]–; 495,41 [M–H–2H2O]–; 469,36 [M–H–H2O–CO2]– |
Ганодеровая кислота C2 Ganoderic acid C2 | 517,32 [M–H]–; 499,33 [M–H–H2O]–; 481,34 [M–H–2H2O]–; 455,51 [M–H–H2O–CO2]–; 437,47 [M–H–2H2O–CO2]– |
(±)-Лингжин B (±)-Lingzhine B | 257,20 [M–H]– |
α-Линоленовая кислота α-Linolenic acid | 277,21 [M–H]– |
Олеиновая кислота Oleic acid | 281,25 [M–H]–; 267,20 [M–H–CH2]– |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
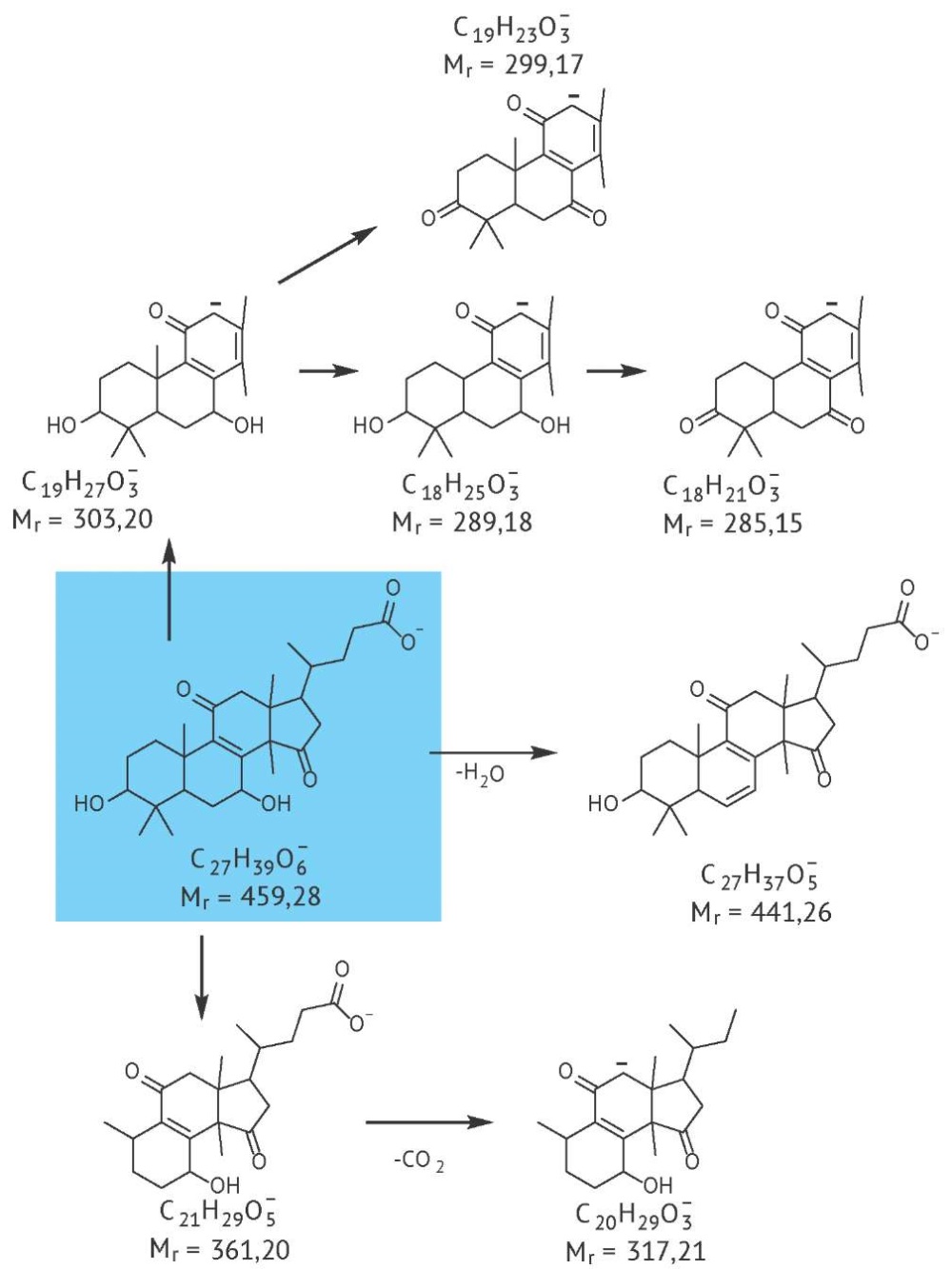
Рис. 3. Схема фрагментации люциденовой кислоты N. Mr ([M-H–]) = 459,28
Fig. 3. Fragmentation scheme for lucidenic acid N. Mr ([M-H–]) = 459.28
Данные таблицы 3 свидетельствуют о взаимосвязи величин ОСФ и антирадикальной активности экстрактов в отношении DPPH и ABTS. В подтверждение этому отмечена низкая радикал-ингибирующая активность экстракта в петролейном эфире (образец 13, табл. 3), содержащего малое количество фенолов (20,4±1,5 мкмоль/г), в то время как для хлороформной (образец 14), этанольной (образец 16) и в особенности этилацетатной (образец 15) фракций характерен достаточно высокий уровень активности (табл. 3). Данные таблицы 56 могут указывать на вклад флавоноида нарингенина и лингжинов в радикал-ингибирующую активность экстрактов [26][27]. Кроме того, высокой радикал-ингибирующей активности экстрактов могут способствовать тритерпеновые кислоты (ганодеровая кислота D и люциденовая кислота D). При этом для хлороформного и этилацетатного экстрактов (табл. 3), содержащих большое количество тритерпеновых соединений (1,84±0,09 и 1,96±0,10 ммоль/г соответственно), также отмечена высокая радикал-ингибирующая активность, но для этанольного экстракта, несмотря на более высокое содержание фенольных соединений, отмечен более низкий уровень активности (образец 16, табл. 3). Ганодеровая кислота D как тетрациклический тритерпеноид является эффективным активатором CaM/CaMKII/NRF2 сигнального пути и вследствие этого обладает способностью предотвращать развитие оксидативного стресса, а наличие 11-оксо-Δ⁸-фрагмента в структурах исследуемых соединений позволяет им образовывать стабильные радикалы [28].
Достоинством полученных экстрактов как потенциальных антиоксидантных средств является наличие БАВ с различной липофильностью: тритерпеновые соединения обладают высокой растворимостью в липидах и защищают их от перекисного окисления при оксидативном стрессе, в то время как флавоноиды действуют в межклеточном пространстве и цитоплазме [29]. Полученные в работе данные согласуются с результатами исследований in vivo, проведенными другими научными коллективами: показано, что этанольные экстракты, проявляя антиоксидантную активность, оказывали цитопротекторное действие на клетки печени, поджелудочной железы и почек у крыс [30]; водные экстракты демонстрировали противодиабетическое действие на стрептозоциновой модели у крыс [31]; терпеноидная фракция G. lucidum оказывала гепатопротекторное действие при инвазиях Plasmodium berghei за счет снижения оксидативного стресса [32].
ЗАКЛЮЧЕНИЕ
По результатам сравнительных исследований экстрактов штаммов грибов G. lucidum и G. lingzhi, выращенных на субстратах ольхи и дуба, было установлено, что наибольшую антиоксидантную активность проявляет экстракт FIB-334 G. lucidum, выращенный на субстрате ольхи: высокая радикал-ингибирующая активность в отношении DPPH (IC50=3,1±0,2 мкг/мл) и ABTS (IC50=3,7±0,2 мкг/мл) согласуется с общим содержанием фенольных соединений (326,2±16,5 мкмоль/г) и общим содержанием тритерпеновых и стероидных соединений (2,00±0,11 ммоль/г) в этом экстракте. Высокая антиоксидантная активность изученных штаммов грибов G. lucidum и G. lingzhi может быть обусловлена наличием фенольных соединений (флавоноидом нарингенином, производными гидрохинона лингжинами B и D), а также тритерпеноидами (ганодеровой кислотой D и люциденовой кислотой D).
Полученные результаты позволяют рассматривать искусственно выращенные штаммы Ganoderma spp. в качестве перспективного источника антиоксидантов.
Дополнительная информация. На сайте журнала «Регуляторные исследования и экспертиза лекарственных средств» размещены рисунки 1, 2, 4 и таблица 5.
https://doi.org/10.30895/1991-2919-2024-609-fig1
https://doi.org/10.30895/1991-2919-2024-609-fig2
https://doi.org/10.30895/1991-2919-2024-609-fig4
https://doi.org/10.30895/1991-2919-2024-609-table5
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Г.И. Горбацевич — руководство исследованием, подготовка сырья, получение экстрактов, проведение хроматомасс-спектрометрического исследования, подготовка публикации; Л.С. Зеневич, И.Р. Баталова — определение антиоксидантной активности с использованием спектрофотометрических методик, подготовка образцов; С.А. Коваленко — выращивание штаммов грибов, их идентификация, формирование коллекции; П.М. Бычковский — методическое руководство и консультация в вопросах хроматографического анализа.
Additional information. Figures 1, 2, 4 and Table 5 are published on the website of Regulatory Research and Medicine Evaluation.
https://doi.org/10.30895/1991-2919-2024-609-fig1
https://doi.org/10.30895/1991-2919-2024-609-fig2
https://doi.org/10.30895/1991-2919-2024-609-fig4
https://doi.org/10.30895/1991-2919-2024-609-table5
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Hleb I. Harbatsevich managed the research, prepared and extracted the herbal drugs, conducted the experiments by high-performance liquid chromatography–mass spectrometry, and drafted the manuscripT. Liliana S. Zenevich, Irina R. Batalova tested the free radical-scavenging activity of extracts by spectrophotometry and carried out sample preparation. Snezhana A. Kovalenko cultivated and identified fungal strains, curated the fungal collection. Pavel M. Bychkovsky provided methodological guidance and advice on chromatographic analysis.
1. The National Center for Biotechnology Information. https://blast.ncbi.nlm.nih.gov/Blast.cgi
2. https://doi.org/10.30895/1991-2919-2024-609-fig1
3. https://doi.org/10.30895/1991-2919-2024-609-fig2
4. https://doi.org/10.30895/1991-2919-2024-609-table5
5. https://doi.org/10.30895/1991-2919-2024-609-fig4
6. https://doi.org/10.30895/1991-2919-2024-609-table5
Список литературы
1. Cabarroi-Hernández M, Villalobos-Arámbula AR, Torres-Torres MG, Decock C, Guzmán-Dávalos L. The Ganoderma weberianum-resinaceum lineage: multilocus phylogenetic analysis and morphology confirm G. mexicanum and G. parvulum in the Neotropics. MycoKeys 2019;59:95–131. https://doi.org/10.3897/MYCOKEYS.59.33182
2. Moncalvo J-M. Molecular systematics of Ganoderma: what is Reishi? Int J Med Mushrooms. 2005:353–4. https://doi.org/10.1615/INTJMEDMUSHROOMS.V7.I3.160
3. Baby S, Johnson AJ, Govindan B. Secondary metabolites from Ganoderma. Phytochemistry. 2015;114:66–101. https://doi.org/10.1016/J.PHYTOCHEM.2015.03.010
4. Cao Y, Wu SH, Dai YC. Species clarification of the prize medicinal Ganoderma mushroom “Lingzhi”. Fungal Divers. 2012;56:49–62. https://doi.org/10.1007/s13225-012-0178-5
5. Galappaththi MCA, Patabendige NM, Premarathne BM, Hapuarachchi KK, Tibpromma S, Dai DQ. A review of Ganoderma triterpenoids and their bioactivities. Biomol. 2022;13:24–35. https://doi.org/10.3390/biom13010024
6. Chan WK, Cheung CCH, Law HKW, Lau YL, Chan GCF. Ganoderma lucidum polysaccharides can induce human monocytic leukemia cells into dendritic cells with immuno-stimulatory function. J Hematol Oncol. 2008;1:9. https://doi.org/10.1186/1756-8722-1-9
7. Kladar N V., Gavarić NS, Božin BN. Ganoderma: insights into anticancer effects. Eur J Cancer Prev. 2016;25:462–71. https://doi.org/10.1097/CEJ.0000000000000204
8. Paydary K, Khaghani P, Emamzadeh-Fard S, Alinaghi SAS, Baesi K. The emergence of drug resistant HIV variants and novel anti-retroviral therapy. Asian Pac J Trop Biomed. 2013;3:515–24. https://doi.org/10.1016/S2221-1691(13)60106-9
9. Kamra A, Bhatt AB, Evaluation of antimicrobial and antioxidant activity of Ganoderma lucidum extracts against human pathogenic. Int J Pharm Sci. 2012;2:359–62.
10. Jia J, Zhang X, Hu YS, Wu Y, Wang QZ, Li NN, et al. Evaluation of in vivo antioxidant activities of Ganoderma lucidum polysaccharides in STZ-diabetic rats. Food Chem. 2009;115:32–6. https://doi.org/10.1016/j.foodchem.2008.11.043
11. Lin JM, Lin CC, Chen MF, Ujiie T, Takada A. Radical scavenger and antihepatotoxic activity of Ganoderma formosanum, Ganoderma lucidum and Ganoderma neo-japonicum. J Ethnopharmacol. 1995;47:33–41. https://doi.org/10.1016/0378-8741(95)01251-8
12. Lee JM, Kwon H, Jeong H, Lee JW, Lee SY, Baek SJ, et al. Inhibition of lipid peroxidation and oxidative DNA damage by Ganoderma lucidum. Phytother Res. 2001;15:245–9. https://doi.org/10.1002/ptr.830
13. Chen DH, Shiou WY, Wang KC, Huang SY, Shie YT, Tsai CM, et al. Chemotaxonomy of triterpenoid pattern of HPLC of Ganoderma lucidum and Ganoderma tsugae. J Chinese Chem Soc. 1999;46:47–51. https://doi.org/10.1002/jccs.199900006
14. Zhou X, Lin J, Yin Y, Zhao J, Sun X, Tang K. Ganodermataceae: natural products and their related pharmacological functions. Am J Chin Med. 2007;35:559–74. https://doi.org/10.1142/S0192415X07005065
15. Mau JL, Lin HC, Chen CC. Non-volatile components of several medicinal mushrooms. Food Res Int. 2001;34:521–6. https://doi.org/10.1016/S0963-9969(01)00067-9
16. Van der Hem LG, Van der Vliet JA, Bocken CF, Kino K, Hoitsma AJ, Tax WJ. Ling Zhi-8. Studies of a new immunomodulating agent. Transplantation. 1995;60(5):438–43. PMID: 7676490
17. Thakur A, Rana M, Lakhanpal TN, Ahmad A, Khan MI. Purification and characterization of lectin from fruiting body of Ganoderma lucidum: lectin from Ganoderma lucidum. Biochim Biophys Acta. 2007;1770:1404–12. https://doi.org/10.1016/j.bbagen.2007.05.009
18. Li DW, Liu M, Leng YQ, Hu JF, Deng S, Leng AJ, et al. Lanostane triterpenoids from Ganoderma lucidum and their inhibitory effects against FAAH. Phytochemistry. 2022;203:113339. https://doi.org/10.1016/j.phytochem.2022.113339
19. Rajkapoor B, Burkan ZE, Senthilkumar R. Oxidants and human diseases: role of antioxidant medicinal plants — a review. Pharmacologyonline. 2010;1:1117–31.
20. Ali SS, Kasoju N, Luthra A, Singh A, Sharanabasava H, Sahu A, et al. Indian medicinal herbs as sources of antioxidants. Food Res Int. 2008;41:1–15. https://doi.org/10.1016/j.foodres.2007.10.001
21. Коваленко СА, Назарова ОМ, Лубянова ВМ. Штаммовое разнообразие Ganoderma lingzhi и G. lucidum в коллекционном фонде Института леса НАН Беларуси. Проблемы лесоведения и лесоводства: сб. науч. тр. ИЛ НАН Беларуси. Вып. 82. Гомель: Институт леса НАН Беларуси; 2022. С. 215–27.
22. White TJ. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. In: Innis MA, Gelfand DH, Sninsky JJ, White TJ, eds. PCR protocols: a guide to methods and applications. New York: Academic Press Inc; 1990. P. 315–22. http://dx.doi.org/10.1016/b978-0-12-372180-8.50042-1
23. Singleton VL, Orthofer R, Lamuela-Raventós RM. Analysis of total phenols and other oxidation substrates and antioxidants by means of Folin–Ciocalteu reagent. Methods Enzymol. 1999;299:152–78. https://doi.org/10.1016/S0076-6879(99)99017-1
24. Hiai S, Oura H, Nakajima T. Color reaction of some sapogenins and saponins with vanillin and sulfuric acid. Planta Med. 1976;29:116–22. https://doi.org/10.1055/s-0028-1097639
25. Blois MS. Antioxidant determinations by the use of a stable free radical. Nature. 1958;181:1199–200. http://dx.doi.org/10.1038/1811199a0
26. Dong Q, He D, Ni X, Zhou H, Yang H. Comparative study on phenolic compounds, triterpenoids, and antioxidant activity of Ganoderma lucidum affected by different drying methods. J Food Meas Charact. 2019;13:3198–205. https://doi.org/10.1007/s11694-019-00242-0
27. Rashmi R, Magesh SB, Ramkumar KM, Suryanarayanan S, SubbaRao MV. Antioxidant potential of naringenin helps to protect liver tissue from streptozotocin-induced damage. Reports Biochem Mol Biol. 2018;7:76. PMID: 30324121
28. Yuan H, Xu Y, Luo Y, Zhang JR, Zhu XX, Xiao JH. Ganoderic acid D prevents oxidative stress-induced senescence by targeting 14-3-3ε to activate CaM/CaMKII/NRF2 signaling pathway in mesenchymal stem cells. Aging Cell. 2022;21:e13686. https://doi.org/10.1111/ACEL.13686
29. Lagouri V. Lipophilic antioxidants. Lipids Ski Heal. 2015:301–10. https://doi.org/10.1007/978-3-319-09943-9_20
30. Olorunnisola O.S. Biochemical and histological investigation on the protective effect of poly-herbal extract in high salt diet-fed male Wistar rats. Phytomedicine Plus. 2021;1(4):100116. https://doi.org/10.1016/j.phyplu.2021.100116
31. Jia J. Evaluation of in vivo antioxidant activities of Ganoderma lucidum polysaccharides in STZ-diabetic rats. Food Chem. 2009;115(1):32. https://doi.org/10.1016/j.foodchem.2008.11.043
32. Oluba OM, Akpor OB, Adebiyi FD, Josiah SJ, Alabi OO, Shoyombo AO, Olusola AO. Effects of co-administration of Ganoderma terpenoid extract with chloroquine on inflammatory markers and antioxidant status in Plasmodium berghei-infected mice. J Integr Med. 2020;18(6):522–9. https://doi.org/10.1016/j.joim.2020.08.002
Об авторах
Г. И. ГорбацевичБеларусь
Горбацевич Глеб Иванович, канд. хим. наук, доцент
пр. Дзержинского, д. 83, г. Минск, 220116
Л. С. Зеневич
Беларусь
Зеневич Лилиана Сергеевна
ул. Академика Курчатова, д. 1, г. Минск, 220045
И. Р. Баталова
Беларусь
Баталова Ирина Ростиславовна
ул. Академика Курчатова, д. 1, г. Минск, 220045
С. А. Коваленко
Беларусь
Коваленко Снежана Александровна, канд. сел.-хоз. наук
ул. Пролетарская, д. 71, г. Гомель, 246001
П. М. Бычковский
Беларусь
Бычковский Павел Михайлович, канд. хим. наук, доцент
ул. Академика Курчатова, д. 1, г. Минск, 220045
Дополнительные файлы

|
1. Рис. 1. Общие хроматограммы (масс-детектор, режим полного сканирования отрицательных ионов в области m/z 120–1000) образцов: а — экстракт G. lingzhi (штамм 333, выращенный на дубовом субстрате), b — G. lucidum (штамм 335, выращенный на дубовом субстрате), c — G. lingzhi (штамм 333, выращенный на ольховом субстрате). Условия анализа: хроматографическая колонка C18 Kinetex 150 мм × 2,1 мм × 2,6 мкм (Phenomenex), элюирование смесью 0,5% уксусной кислоты и ацетонитрила в градиентном режиме, скорость потока — 0,4 мл/мин, температура колонки — 25 °C, объем ввода пробы — 15 мкл | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(411KB)
|
Метаданные ▾ | |

|
2. Рис. 2. Хроматограммы экстракта образца G. lucidum (штамм 335, выращенный на дубовом субстрате) по выбранным молекулярным ионам: a — нарингенин, b — 12-гидроксиганодериновая кислота С2, c — 3-ацетилганодеровая кислота K, d –лингжин D, e — люциденовая кислота N, f — люциденовая кислота A, g — ганодеровая кислота A, h — ганодеровая кислота H. Условия анализа: хроматографическая колонка C18 Kinetex 150 мм × 2,1 мм × 2,6 мкм (Phenomenex), элюирование смесью 0,5% уксусной кислоты и ацетонитрила в градиентном режиме, скорость потока — 0,4 мл/мин, температура колонки — 25 °C, объем ввода пробы — 15 мкл, масс-спектрометрическое детектирование | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(580KB)
|
Метаданные ▾ | |

|
3. Рис. 4. Масс-спектры идентифицированных соединений: a — люциденовая кислота N, b — люциденовая кислота А, c — ганодеровая кислота А, d — ганодеровая кислота H | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(399KB)
|
Метаданные ▾ | |

|
4. Таблица 5. Качественный и полуколичественный состав экстрактивных извлечений Ganoderma spp. | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(375KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Горбацевич Г.И., Зеневич Л.С., Баталова И.Р., Коваленко С.А., Бычковский П.М. Химический состав и антиоксидантная активность экстрактов плодовых тел Ganoderma lingzhi и Ganoderma lucidum. Регуляторные исследования и экспертиза лекарственных средств. 2024;14(6):686-697. https://doi.org/10.30895/1991-2919-2024-609
For citation:
Harbatsevich H.I., Zenevich L.S., Batalova I.R., Kovalenko S.A., Bychkovsky P.M. Chemical Composition and Antioxidant Activity of Ganoderma lingzhi and Ganoderma lucidum Fruiting Body Extracts. Regulatory Research and Medicine Evaluation. 2024;14(6):686-697. (In Russ.) https://doi.org/10.30895/1991-2919-2024-609



































