Перейти к:
Регуляторные требования к аптечному изготовлению радиофармацевтических лекарственных препаратов
https://doi.org/10.30895/1991-2919-2025-15-4-404-420
Резюме
ВВЕДЕНИЕ. Понятие «изготовление радиофармацевтических лекарственных препаратов (РФЛП)» в Российской Федерации было введено в Федеральном законе № 61-ФЗ «Об обращении лекарственных средств». За последние годы произошло существенное изменение законодательства в области производства и изготовления РФЛП. Сегодня стало возможным изготовление незарегистрированных РФЛП в медицинской организации для собственных нужд, что позволит быстро внедрять в клиническую практику новые методы и средства диагностики и лечения злокачественных новообразований, а также некоторых других заболеваний.
ЦЕЛЬ. Определение основных направлений развития ядерных аптек в Российской Федерации.
ОБСУЖДЕНИЕ. Термин «ядерная аптека» применяется к специальному подразделению медицинской организации, где проводится синтез и контроль качества РФЛП. Практика зарубежных госпитальных ядерных аптек доказала их преимущества в плане обеспечения наиболее короткого пути к пациентам жизненно необходимых препаратов. Проанализированы основные требования российских нормативных документов и рекомендаций, регламентирующих функционирование ядерной аптеки, а также опыт производственной ядерной аптеки РФЛП, созданной на базе Медицинского радиологического научного центра им. А.Ф. Цыба — Филиала Национального медицинского исследовательского центра радиологии Минздрава России. Регулярная работа ядерной аптеки позволяет принять на лечение незарегистрированными препаратами до нескольких сотен пациентов. Тем не менее в России практика организации ядерных аптек еще не стала рутинной и есть ряд задач, которые необходимо решить для эффективного функционирования таких аптек: создание системы подготовки специалистов-радиофармацевтов, определение объема предварительных исследований РФЛП, изготавливаемых экстемпорально в аптеке, внесение дополнений и корректировок в документацию по радиационной безопасности, регламентирующую порядок начала работ с новыми радионуклидами в условиях аптеки и др.
ВЫВОДЫ. Сложившаяся мировая практика функционирования госпитальных ядерных аптек доказала целесообразность существования такой формы обращения РФЛП. Подходы к изготовлению РФЛП за рубежом определяются национальным и региональным законодательством. Производственная аптека с правом изготовления РФЛП — новый вид аптечной организации, ранее не существовавший на территории государств — членов ЕАЭС. При формировании регуляторной базы аптечного изготовления РФЛП в России целесообразно учесть элементы мирового опыта, показавшие максимальную эффективность. Первоочередными задачами, которые необходимо решить, являются подготовка специализированного персонала, пересмотр ряда документов по радиационной безопасности, создание консультативной экспертной группы для подготовки решений по организационным и техническим вопросам развития ядерных аптек, определение источников финансирования лечения с применением изготовленных РФЛП.
Ключевые слова
Для цитирования:
Кодина Г.Е., Власова О.П., Тищенко В.К., Дороватовский С.А., Рыжикова Т.П., Иванов С.А., Шегай П.В., Каприн А.Д., Трапкова А.А. Регуляторные требования к аптечному изготовлению радиофармацевтических лекарственных препаратов. Регуляторные исследования и экспертиза лекарственных средств. 2025;15(4):404-420. https://doi.org/10.30895/1991-2919-2025-15-4-404-420
For citation:
Kodina G.E., Vlasova O.P., Tishchenko V.K., Dorovatovsky S.A., Ryzhikova T.P., Ivanov S.A., Shegai P.V., Kaprin A.D., Trapkova A.A. Regulatory Requirements for Small-Scale Preparation of Radiopharmaceuticals. Regulatory Research and Medicine Evaluation. 2025;15(4):404-420. (In Russ.) https://doi.org/10.30895/1991-2919-2025-15-4-404-420
ВВЕДЕНИЕ
Пути сокращения сроков внедрения в клиническую практику новейших разработок в области ядерной медицины активно обсуждаются как в средствах массовой информации, так и в специализированных изданиях научной периодики. В соответствии с «Соглашением о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза»1 от 23.12.2014 и решениями ЕЭК по реализации Соглашения на уровне ЕАЭС в государствах-членах проводится работа по разработке и гармонизации нормативных документов, регулирующих обращение лекарственных средств, в том числе и радиофармацевтических лекарственных препаратов (РФЛП).
В Российской Федерации понятие «изготовление РФЛП» было введено с вступлением в силу Федерального закона от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств». В ст. 5 закона указывалось, что регистрации не подлежат РФЛП, изготовленные непосредственно в медицинских организациях в порядке, установленном уполномоченным федеральным органом исполнительной власти. Однако понадобилось 5 лет для разработки и утверждения подзаконного акта, детализирующего порядок изготовления РФЛП непосредственно в медицинских организациях. Специалисты не смогли прийти к единому мнению о том, кто может и должен изготавливать РФЛП, где найти образцы необходимых документов, как медицинская организация может приобрести материалы, оборудование для изготовления и контроля качества, а также какую профессиональную подготовку должен иметь персонал участков изготовления. В результате утвержденный в 2015 г. «Порядок изготовления радиофармацевтических лекарственных препаратов непосредственно в медицинских организациях»2 фактически не выполнялся.
В 2020 г. Минздравом России был утвержден заменивший предыдущий документ приказ от 12.11.2020 № 1218н3, содержащий более подробные требования, однако и он не решил всех проблем организации изготовления РФЛП (приказ действует до 01.01.2027).
Приказом Минздрава России от 31.07.2020 № 780н4 был утвержден новый вид аптечной организации: производственная аптека с правом изготовления радиофармацевтических лекарственных препаратов как структурное подразделение медицинской организации («ядерная аптека»). Большим прорывом в законодательстве явилось внесение изменений в постановление Правительства Российской Федерации от 31.03.2022 № 547 «О лицензировании фармацевтической деятельности» с дополнением Перечня выполняемых работ, оказываемых услуг, составляющих фармацевтическую деятельность («Изготовление радиофармацевтических лекарственных препаратов для медицинского применения») и установлением Порядка их изготовления5.
Таким образом, в настоящее время в Российской Федерации существует возможность изготовления РФЛП в медицинской организации для собственных нужд без получения лицензии на фармацевтическую деятельность либо в условиях «ядерной аптеки» с возможностью последующей реализации изготовленных РФЛП.
Последние 20 лет в мире наблюдается стремительное развитие исследований, направленных на создание новых РФЛП для диагностики методами позитронно-эмиссионной томографии (ПЭТ на основе 18F, 68Ga, 89Zr, 64Cu, 44Sc, 212Pb), однофотонной компьютерной томографии (ОФЭКТ с 99mTc, 123I, радионуклидами редкоземельных элементов и др.), а также радионуклидной терапии (с препаратами 177Lu, 90Y, 188Re, 223Ra, 225Ac, 211At и др.), еще не описанных в зарубежных фармакопеях. Принятие перечисленных выше нормативных актов обусловило возможность быстрого воспроизведения новых препаратов, сведения о которых публикуются в литературе, силами сотрудников российских медицинских центров.
Цель работы — определение основных направлений развития ядерных аптек в Российской Федерации.
Задачами исследования являлись: анализ зарубежной практики организации маломасштабного изготовления препаратов в индивидуальных дозировках; анализ российских нормативно-правовых документов, регламентирующих организацию изготовления РФЛП; анализ опыта организации аптеки РФЛП на базе медицинской организации, специализирующейся на лечении пациентов с онкопатологией с применением методов ядерной медицины, — Медицинского радиологического научного центра им. А.Ф. Цыба — филиала ФГБУ «Национальный медицинский исследовательский центр» Минздрава России (МРНЦ им. А.Ф. Цыба).
Поиск источников литературы проводили посредством поисковых систем (Google, Yandex) на интернет-порталах профильных ассоциаций (Европейская ассоциация ядерной медицины (European Association of Nuclear Medicine, EANM)6; Общество ядерной медицины США (Society of Nuclear Medicine, SNM)), а также в специализированных отечественных и международных базах данных: eLIBRARY.RU, PubMed, за период с 1946 по апрель 2025 г., по следующим поисковым словосочетаниям — small-scale preparation of radiopharmaceuticals; nuclear pharmacy; hospital radiopharmacy; in-house preparation radiopharmaceuticals.
ОСНОВНАЯ ЧАСТЬ
Формирование радиофармацевтики как отдельного направления фармации
Еще в 1947 г. в Школе фармации Университета Пердью (School of Pharmacy at Purdue University), США, были организованы курсы, на которых изучались основы ядерной физики, инструментарий и применение методологии ядерной физики и радиохимии к исследованиям в фармации и науках о жизни. Однако возникновение радиофармацевтики как отдельного направления фармацевтической науки относят к 1955 г., когда в 15-м издании Фармакопеи США (USP) появились первые монографии по радиофармацевтическим препаратам [1]. В 1960-е гг. образовательные программы в области радиофармацевтики были введены в семи университетах США. Вместе c развитием программ образования в Американской фармацевтической ассоциации (American Pharmaceutical Association, APhA) была создана целевая группа для разработки механизма признания радиофармацевтики как отдельной специальности в фармации. В отчете этой группы, опубликованном в 1974 г., было показано, что функции радиофармацевта значительно выходят за рамки функций общей фармацевтической практики [1].
В 1975 г. было опубликовано уведомление Управления по контролю за качеством продуктов питания и лекарственных средств США (Food and Drug Administration, FDA) о прекращении действия исключения для радиоактивных препаратов из требований Федерального закона о пищевых продуктах, лекарственных средствах и косметических средствах (40 FR 31298). С этого момента обращение всех РФЛП, «…за исключением тех, которые предназначены для определенных исследовательских целей... включая холодные наборы и радиоактивные биологические препараты, должно регулироваться нормативными актами FDA» (цит. по [2]). Одновременно FDA сообщает о намерении рассмотреть новые правила для ядерных аптек или, по крайней мере, центральных радиофармацевтических аптек (Central Radiopharmacies, CRPs). При этом предполагалось, что «…есть время подумать над вопросом, поставленным FDA: есть ли необходимость в дополнительных правилах специально для ядерных аптек?» (цит. по [2]). Таким образом, к 1975 г. в США практика производства/изготовления РФЛП уже была достаточно развита, но обращение этой группы лекарственных средств не регламентировалось требованиями FDA. Кроме того, к этому времени уже существовали мелкие производства, выполняющие коммерческие централизованные поставки РФЛП в медицинские организации. Одновременно некоторое количество различных РФЛП изготавливали в специальных подразделениях университетских клиник для применения у пациентов этих клиник.
В результате работы целевой группы по радиофармацевтике в 1975 г. в США в составе APhA появилась секция ядерной фармации. В источнике [3] дается следующее определение: «ядерная фармация (также называемая радиофармацией) — это специализация аптечной практики, которая стремится улучшать и укреплять здоровье посредством безопасного и эффективного использования радиоактивных лекарств для диагностики и терапии». Одной из первых задач, которые следовало решить, было создание документа, регламентирующего обязанности радиофармацевта, программы обучения, специфику и направления практики. «Стандарты практики ядерной фармации» были одобрены и приняты в 1978 г. Советом по фармацевтическим специальностям в качестве специализированной практики [3], и «радиофармацевтика» стала официально признанной аптечной специальностью в США и мире. Для разработки сертификационных процедур был создан Совет по ядерной фармации, и в 1982 г. по итогам аттестации 63 слушателям был присвоен статус специалиста (Board certified Nuclear Pharmacist, BCNP). В 1998 г. в США насчитывалось более 430 сертифицированных специалистов, а к 2000 г. их количество превысило 1000 человек [2][3].
Первое руководство по изготовлению радио- фармпрепаратов в больницах Великобритании7 было опубликовано Британским институтом радиологии в 1975 г. [4]. Радиофармацевтика как специальность была признана Региональным комитетом фармацевтов в январе 1977 г. Региональный подкомитет по радиофармацевтике в конечном счете преобразовался в Британскую группу по радиофармацевтике (UK Radiopharmacy Group, UKRG).
Единого образовательного стандарта для подготовки радиофармацевтов в государствах Европейского союза в настоящее время не существует. Тем не менее большинство специалистов, работающих в университетских клиниках и центрах ядерной медицины, проходят специальную подготовку, организованную c 1998 г. по инициативе EANM в Цюрихском техническом университете (совместно с Люблянским и Лейпцигским университетами). Полноценная программа последипломного образования по радиофармацевтике состоит из трех модулей («Фармацевтика и законодательство», «Радиофармацевтическая химия», «Радиофармакология и клиническая радиофармацевтика») с обязательной сдачей экзамена по каждому модулю, также обязательны практическая работа в отделении радиофармацевтики в течение 2–3 лет и подготовка в рамках курса национальных требований по радиационной безопасности. После окончания обучения и подтверждения квалификации выпускники получают сертификат об обучении (CAS) в области радиофармацевтики, который дает право для работы в качестве радиофармацевта в Европе.
Госпитальная радиофармация
Переход к интенсивному развитию ядерной медицины и госпитальной радиофармации (изготовлению РФЛП на месте применения) в США, Канаде и ряде европейских государств связывают с внедрением генератора 99Mo/99mTc (вторая половина 1960-х годов) и наборов реагентов (cold kits) для быстрого изготовления РФЛП непосредственно в клинике. В 1980-е годы использовались более 20 различных наборов и РФЛП 99mTc. Применение этого радионуклида становится массовым, и поставки препаратов 99mTc в инъекционной форме начинают выполнять централизованные радиофармацевтические службы «UNIT DOSE SERVISE», а также централизованные ядерные аптеки, работающие в отдельных регионах.
Развитие ПЭТ и массового применения РФЛП «Фтордезоксиглюкоза,18F» инициировало начало поставок этого препарата в инъекционной форме. В середине 1990-х в США около 80% всех доз РФЛП реализовывались через коммерческие аптеки (около 250 аптек), при этом некоторые корпорации отпускали более 20 000 единиц индивидуальных доз в день [5]. Одновременно продолжалось централизованное производство, поставки в клиники и применение ряда РФЛП на основе других радионуклидов, получаемых в ядерных реакторах или циклотронах и имеющих более длительные периоды полураспада по сравнению с 99mTc (6,01 ч), например 131I (8 сут), 32P (14,3 сут), 67Ga (3,3 сут), 201Tl (72,9 ч) и др.
Вместе с тем значительно расширялся перечень РФЛП для ПЭТ, причем не только на основе 18F. Появление на международном рынке российского генератора 68Ge/68Ga [6] инициировало разработку группы новых рецепторспецифичных препаратов для диагностики нейроэндокринных опухолей, рака предстательной железы и других злокачественных новообразований. Практически одновременно аналоги таких препаратов на основе 90Y, 177Lu, а позже 225Ac и других α- и β-эмиттеров начали исследовать в качестве терапевтических средств. В связи с относительно небольшим периодом полураспада 68Ga (~68 мин), РФЛП на основе этого радионуклида удобно получать с использованием генераторов, которые сегодня уже выпускаются несколькими компаниями [7–9], и наборов реагентов, которые в настоящее время находятся на различных стадиях клинических исследований или уже зарегистрированы [9–11]. Альтернативный подход — прямое получение 68Ga в циклотронах средних энергий в соответствии с ядерной реакцией 68Zn(p,n)68Ga также реализуется в некоторых медицинских центрах. Далее выполняется синтез 68Ga-РФЛП с использованием наборов реагентов или кассет аналогично препаратам 18F [12][13]. В обоих случаях РФЛП 68Ga изготавливают непосредственно в радиофармацевтических аптеках медицинских организаций по всему миру.
Два РФЛП 177Lu (LUTATERA® и PLUVICTO®) уже одобрены для медицинского применения FDA и EMA (European Medicines Agency, Европейское агентство по лекарственным средствам), но еще несколько препаратов с этим радионуклидом изготавливаются в медицинских организациях с целью разработки и исследований новых лекарственных средств. Предложены варианты синтеза таких РФЛП с использованием наборов [14–18], поскольку централизованные поставки готовых РФЛП иногда проблематичны в связи с радиационной нестабильностью векторных молекул в составе препарата. Эта проблема также еще не решена окончательно в части РФЛП 225Ac и других новых препаратов [19][20].
Таким образом, с учетом некоторых различий, связанных с требованиями национальных систем регулирования обращения радиоактивных материалов и лекарственных средств, в области радиофармацевтики исторически сложилось разделение промышленного производства и госпитального изготовления РФЛП [21]. К производству РФЛП первой группы жестко применяются требования правил надлежащей производственной практики (GMP), к изготовлению РФЛП эти требования формально не предъявляются.
Роль Европейской ассоциации ядерной медицины (EANM) в формировании нормативно-правовой базы радиофармацевтики
Комитетом EANM по радиофармацевтическим наукам (EANM Radiopharmaceutical Sciences Committee, далее — RSC) в разные годы разработано несколько рекомендаций, основанных на принципах GMP, но учитывающих возможности и специфику синтеза РФЛП непосредственно в медицинской организации и названных «Современная надлежащая радиофармацевтическая практика» (cGRPP) [22]. Положения этих рекомендаций пересматривали неоднократно, последняя редакция8 опубликована в 2021 г. Руководство предназначено для некоммерческих изготовителей РФЛП, таких как ядерные аптеки в медицинских организациях, отделения ядерной медицины, исследовательские ПЭТ-центры. В структуру Руководства включены 3 раздела, в которых рассматриваются: общие аспекты, применимые ко всем уровням операций по изготовлению РФЛП; изготовление малых серий РФЛП с использованием лицензированных (зарегистрированных) генераторов и наборов; в отдельном разделе рассматриваются более сложные процессы изготовления малых серий РФЛП из нелицензионных исходных материалов, часто включающие стадии очистки фильтрованием и стерилизации.
В источнике [23] отмечается, что в связи с подготовкой реформы фармацевтической системы Европейского союза EANM проводит активную работу с целью привлечения внимания европейских регуляторных органов к проблемам ядерной медицины. В ходе подготовки законодательных предложений EANM были определены три основных подхода:
1) исходными материалами для синтеза РФЛП являются радионуклидные предшественники и радионуклидные генераторы, к которым не предъявляются требования обязательной регистрации за исключением уже применяемых в рецептурах на основе наборов или непосредственно в качестве лекарственных средств. Это значительно повысит доступность радионуклидов и РФЛП для отделений радиофармации и ядерной медицины в интересах пациентов [24];
2) требование лицензирования производства для исследуемых РФЛП исключается в случаях, если процесс изготовления осуществляется лицами, юридически уполномоченными в соответствующем государстве — члене ЕС на проведение такого процесса, и если РФЛП предназначен для «внутреннего использования» в больницах, медицинских центрах или клиниках. Данное положение внесено при пересмотре Директивы о клинических исследованиях и в новом Регламенте о клинических исследованиях № 536/20149, EANM также предлагает ввести аналогичное положение при пересмотре Директивы 2001/83/EC;
3) пересмотренная Директива о фармацевтическом законодательстве не должна наносить ущерба каким-либо положениям Директивы Совета 2013/59/Евратом (Council Directive 2013/59/Euratom) [25]. По всем аспектам, связанным с радиационной защитой, а также с дозированием и применением РФЛП, Директива Евратома должна иметь преимущественную силу над Директивой по фармацевтическому законодательству. Крайне важно, чтобы данное положение было отражено не только в декларативной части, но и во всех соответствующих разделах нового фармацевтического законодательства.
С точки зрения авторов настоящей публикации, первое предложение несколько спорно. Можно согласиться с тем, что производитель радионуклидов для разных промышленных целей не может обеспечить полный цикл получения радионуклидного предшественника как медицинского продукта в соответствии с принципами GMP. Однако раствор радионуклида, поступающий в медицинскую организацию для синтеза конкретного РФЛП, должен соответствовать требованиям национальной или международной фармакопей, предъявляемым к качеству аналогичных продуктов. Второй тезис акцентирует внимание на необходимости наличия компетентного сертифицированного персонала, задействованного в синтезе РФЛП в медицинской организации. Если это условие выполняется, нет необходимости изготовления РФЛП, в том числе для клинического исследования, в условиях аттестованной по GMP площадки. Что касается третьего тезиса, следует отметить, что во всех государствах, использующих радиоактивные материалы (в том числе и в составе РФЛП), национальные требования радиационной безопасности всегда имели преимущественную силу по сравнению с другими нормативными актами10. Однако необходимы специальные предостережения или исключение отдельных процедур, приводящих к превышению допустимых доз облучения персонала при фармацевтической разработке и на других стадиях обращения с РФЛП. В целом предложения EANM после принятия могут сыграть исключительно позитивную роль в развитии ядерной медицины не только в ЕС, но и в мире.
В развитие темы совершенствования нормативно-правового регулирования обращения РФЛП в 2024 г. опубликованы материалы с изложением позиции ведущих экспертов в области ядерной медицины «…по облегчению доступа пациентов к радиофармпрепаратам» [26] по результатам междисциплинарного технического совещания МАГАТЭ «Медико-фармацевтическое регулирование радиофармпрепаратов». Эта публикация подробно описывает свойства РФЛП, «…которые требуют специального регулирования, учитывая влияние переменного состава радиофармпрепаратов, требования к персоналу, методы производства и обеспечения качества, необходимость взаимодействия регулирующих органов (фактически имеет место двойное регулирование в направлениях фармации и радиационной безопасности) и специализированного обучения, а также упрощения процедуры получения разрешения на продажу (регистрации) для обеспечения доступности радиофармпрепаратов».
Природа и свойства РФЛП достаточно хорошо описаны, часть характеристик нормирована, однако существуют несколько принципиальных моментов, внимание на которые должно быть акцентировано, в том числе со стороны регуляторных органов.
1) «С точки зрения фармацевтического риска…химическая токсичность и фармакологические эффекты радиофармпрепаратов гораздо менее критичны по сравнению с обычными фармацевтическими субстанциями (вводимыми в количестве миллимолей или более) и обычно вообще не выражены. Кроме того, радиофармпрепараты обычно применяются строго контролируемым образом только один или несколько раз в течение жизни пациента, что нашло отражение в существенном снижении требований, закрепленных в некоторых руководствах, к доклиническим и клиническим исследованиям. Однако до настоящего времени этот подход принят не всеми регуляторными органами, и часто объем доклинических и клинических исследований РФЛП оказывается завышенным, что значительно удорожает разработку и увеличивает ее сроки» [26].
2) Классическое понятие стабильной активной фармацевтической субстанции (активного фармацевтического ингредиента), которую можно выделить, для РФЛП неприменимо. Действующее вещество в составе РФЛП образуется в результате реакции радионуклида и векторной молекулы в процессе (как правило, непрерывном) получения препарата. Это вещество не может быть выделено и отдельно протестировано, поэтому «контроль, основанный на риске, обычно применяется на уровне исходных материалов или предшественников, контроля в процессе производства и, насколько это возможно, определения характеристик конечной рецептуры» [26]. Как правило, радионуклид вводят в реакционную смесь, уже содержащую химический предшественник, буферы и эксципиенты. Далее вводят (при необходимости) радиопротектор и другие стабилизаторы радиохимической чистоты, а также разбавляют препарат до необходимого значения объемной активности. Химические предшественники и радионуклиды (радионуклидные предшественники) не являются лекарственными субстанциями и могут рассматриваться как исходные материалы, что должно быть отражено в регуляторных требованиях.
3) Экстемпоральное изготовление значительно расширяет возможности быстрого применения новых РФЛП, необходимых ограниченному кругу пациентов (вплоть до единичных пациентов). Регистрация таких препаратов не требуется. Однако, по мнению экспертов, должен существовать механизм, при котором местные регулирующие органы здравоохранения следует уведомить о намерении организации изготавливать препарат собственными силами [26].
В целом публикация [26] содержит указания на все проблемные моменты, касающиеся современного состояния доступности РФЛП последнего поколения, с том числе и на основе α-излучателей. При этом отмечается, что представленные материалы отражают личные мнения и заключения экспертов в этой области. В заключении рекомендуется «создать международную группу экспертов для предоставления нормативных указаний по РФЛП государствам — членам МАГАТЭ. Такая группа могла бы способствовать общему пониманию требований для многих стран и служить ограничению потенциальных препятствий или проблем из-за разного понимания и ожиданий заинтересованных сторон» [26].
Авторы [27] проанализировали национальные нормативно-правовые базы 9 государств (Франция, Италия, Бельгия, Германия, Дания, Финляндия, Испания, Австрия и Великобритания), в которых применяется Директива 2001/83/ЕС Европейского парламента и Совета ЕС в отношении изготовления РФЛП вне рамок процедуры регистрации в Европе. В каждом из государств существуют национальные особенности в отношении требований к процедурам, оборудованию и документации по изготовлению РФЛП, уровню подготовки персонала и другие. Эти требования изложены в документах, разработанных национальными регуляторными агентствами. Результаты исследования свидетельствуют об отсутствии согласованности регуляторных требований, действующих в различных государствах Европы в отношении маломасштабного изготовления РФЛП. Большинство не считает необходимым придерживаться соответствия GMP при изготовлении РФЛП, а последняя редакция «Руководства по надлежащей практике изготовления… (cGRPP)11», созданная с участием экспертов всех государств на уровне EANM, фактически принята к исполнению только в Австрии и некоторых землях Германии (где требования устанавливаются на местном уровне). Авторы [27] отмечают, что «отсутствие согласованности в отношении маломасштабных радиофармацевтических препаратов… приводит к значительным различиям в использовании, обеспечении качества и доступности радиофармацевтических препаратов по всей Европе». Поэтому «…власти должны стремиться найти способ решить эту сложную проблему… на благо пациентов».
Практика изготовления радиофармацевтических лекарственных препаратов в Российской Федерации
Основные этапы истории развития российской радиофармацевтики описаны в источнике [28], а также в справочном издании12. С началом серийного производства генераторов 99mTc и первых наборов к ним (1970-е гг. — завод «Медрадиопрепарат», а затем предприятия Министерства среднего машиностроения СССР), а также поставок аналогичной импортной продукции в отделениях радионуклидной диагностики отечественных медицинских организаций фактически началось изготовление РФЛП. Следует с сожалением отметить, что процедура растворения реагента в растворе Na99mТсО4 (когда происходит образование нового соединения — комплекса восстановленного 99mТс определенного состава) казалась аналогичной, например, растворению пенициллина в новокаине. Считалось, что с такой процедурой вполне может справиться медсестра, в обязанности которой входило внутривенное введение РФЛП пациенту и которой не обязательно знать, что в случае получения таким образом РФЛП происходит химическая реакция с образованием нового соединения радионуклида. Инструкции по медицинскому применению РФЛП этой группы не включали требования обязательного контроля качества до введения пациенту (в отличие от инструкций для зарубежных аналогов этих РФЛП), поэтому его не проводили, время от времени получая неудовлетворительные и необъяснимые результаты сцинтиграфии. В штатных расписаниях отделений, где выполнялась планарная сцинтиграфия и (или) ОФЭКТ, отсутствовали должности радиохимиков или провизоров. Нет их и сегодня, и в этом плане опыт российской ядерной медицины нельзя считать позитивным.
В Государственную фармакопею (ГФ) СССР требования, касающиеся РФЛП, впервые были внесены в 1968 г.13 Одновременно в 1968 г. на базе Препарационной лаборатории Института биофизики Министерства здравоохранения СССР образованы первое отечественное производство РФЛП (завод «Медрадиопрепарат») и научное подразделение «Отдел изотопов и источников излучения», основными задачами которого стали разработка и внедрение в производство и клиническую практику новых РФЛП. В ГФ СССР ХI изд. (1987 г.) были введены две общие фармакопейные статьи (ОФС), касающиеся общих свойств РФЛП, «Радиоактивность» и «Определение примесей химических элементов в радиофармацевтических препаратах», одновременно разрабатывались и ежегодно вводились в действие временные фармакопейные статьи (ВФС), а позже фармакопейные статьи (ФС) на все РФЛП, используемые в клинической практике. В ГФ РФ ХII изд. (2008 г.) появляется ОФС 42-0073-07 «Радиофармацевтические препараты», разработанная на основе упомянутых выше ОФС ГФ СССР ХI изд. и аналогичной монографии Европейской фармакопеи. В разделе «Перечень основных разделов ФС и фармакопейных статей предприятия (ФСП) на радиофармацевтический препарат» этой ОФС приводится перечень показателей качества для РФЛП, поставляемых в медицинские организации в готовой для использования форме, и для препаратов, приготавливаемых на месте применения. При этом отдельно описан лиофилизат (нерадиоактивный реагент) для приготовления РФЛП и готовый к применению РФЛП.
Следует отметить, что в фармакопеях США, Европы, Международной и других национальных и региональных фармакопеях до настоящего времени отсутствуют монографии на лиофилизаты (холодные наборы) для изготовления РФЛП и приводятся только сведения, касающиеся РФЛП в инъекционной форме, содержащих соединения 99mТс, 68Ga и др. В ОФС.1.11.0001.15, включенной в ГФ РФ ХIII изд. (2015 г.) и ГФ РФ ХIV изд. (2018 г.), лиофилизаты не упоминаются, а в ОФС.1.11.0001 (ГФ РФ ХV изд., 2023 г.) перечень показателей качества РФЛП, изготавливаемых в медицинских организациях, представлен в двух вариантах:
- для РФЛП, изготовленных с использованием радионуклидных генераторов или растворов радионуклидов и наборов реагентов;
- для РФЛП, изготовленных в ПЭТ-центрах на базе циклотронов, расположенных непосредственно в медицинских учреждениях.
Таким образом, в ГФ РФ установлены различия между разными типами изготовленных РФЛП, что в некоторой степени аналогично градации, описанной в европейском руководстве cGRPP [22]. Однако установленные в ОФС.1.11.0001 требования неоднозначны и иногда трудно выполнимы по следующим причинам:
- не всегда понятно, что относится к наборам реагентов для изготовления РФЛП, которые сами по себе лекарственными препаратами не являются, но сегодня поступают в медицинские организации, будучи зарегистрированными в установленном порядке; однако в течение последних 10 лет стихийно сложились два пути государственной регистрации наборов реагентов для приготовления РФЛП в медицинских организациях, а именно:
а) регистрация набора каждого наименования в качестве лекарственного средства с полным циклом доклинических и клинических исследований, представлением результатов в виде регистрационного досье, длительной (иногда многолетней) экспертизой и последующим выполнением всех требований, сопровождающих ввод лекарственного средства в обращение, а также системы фармаконадзора ЛП, при этом сведения о государственной регистрации ЛП вносятся в государственный реестр лекарственных средств14, например ЛП-№(008179)-(РГ-RU); ЛП-№(00005559)-(РГ-RU); ЛП-№(004429)-(РГ-RU); ЛП-008717);
б) регистрация одного или одновременно нескольких наборов как расходных материалов к радионуклидному генератору, регистрируемому в качестве медицинского изделия; при этом наборы могут поставляться отдельно от генератора; сведения о регистрации вносятся в государственный реестр медицинских изделий15, например РЗН 2014/1389; РЗН 2022/18648, в целом процедура значительно менее затратна по стоимости, объему представляемой информации и времени по сравнению с регистрацией ЛП;
- не ясно, можно ли рассматривать кассету для изготовления РФЛП с помощью модуля синтеза как такой же набор, отличающийся только видом упаковки, и как должны (или не должны) регистрироваться такие кассеты; часть поставщиков провела регистрацию кассет как расходных материалов к модулям синтеза, но во многих организациях используются незарегистрированные, иногда самодельные кассеты;
- в ведущих медицинских центрах, получивших право изготовления РФЛП (соответствующее указание в лицензии на фармацевтическую деятельность), проводят изготовление РФЛП для радионуклидной терапии на основе β- и α-излучающих радионуклидов, указания о требованиях к показателям качества которых отсутствуют в ОФС.1.11.0001, но именно в случае терапевтических РФЛП применение ненадежных исходных компонентов и нечеткое соблюдение требований контроля качества синтезируемых РФЛП может иметь негативные последствия.
В ОФС.1.11.004 «Радиофармацевтические лекарственные препараты экстемпорального изготовления» изложены требования к системе обеспечения качества при изготовлении РФЛП, персоналу, помещениям и оборудованию, процессам изготовления и контроля качества, но в части перечня показателей качества приведена ссылка на ОФС.1.11.0001, где требования к РФЛП для радионуклидной терапии отсутствуют.
Очевидно, что система ядерных аптек, существующая несколько десятилетий за рубежом, не может мгновенно возникнуть и стать совершенной в России. С публикацией приказа Минздрава России от 22.05.2023 г. № 249н16 (далее — приказ № 249н) сложилась ситуация, когда в России фактически действуют два документа, устанавливающих порядок изготовления РФЛП17. Отличительной особенностью приказа № 249н (по сравнению с приказом № 1218н) является отсутствие требования изготовления РФЛП непосредственно в медицинской организации и рекомендуемых перечней показателей качества РФЛП. Кроме того, при изготовлении РФЛП разрешается использование лекарственных средств или субстанций, включенных в ГРЛС или единый реестр лекарственных средств ЕАЭС. Очевидно, что конкретные требования могут быть установлены и согласованы при подготовке и прохождении аптечной организацией процедуры лицензирования фармацевтической деятельности, но при этом действует приказ № 780н18, в котором установлено, что аптека РФЛП должна быть структурным подразделением медицинской организации. В результате многочисленных дискуссий о том, в рамках какого порядка изготовления РФЛП можно организовать работу, практически все медицинские организации, где имеет место изготовление незарегистрированных РФЛП (кроме тех, где работают только с РФЛП 99mTc), предпочли пройти процедуру лицензирования фармацевтической деятельности. Сегодня перечень медицинских организаций, имеющих лицензированные подразделения изготовления РФЛП, насчитывает около 20 позиций. Наряду с ведущими национальными медицинскими центрами в перечень входят частные медицинские организации.
Таким образом, приказы Минздрава России 2020–2023 гг., новые монографии ГФ РФ ХV изд. и другие документы создали базу для внедрения в клиническую практику новых методов и средств диагностики и лечения в первую очередь злокачественных новообразований, а также некоторых других заболеваний. Тем не менее в нашей стране практика организации ядерных аптек еще не стала рутинной, и есть ряд задач, которые необходимо решить для нормального функционирования таких аптек. Предстоит создать систему подготовки специалистов, владеющих одновременно знаниями в области фармации, ядерной физики и радиохимии, то есть фактически создать специализацию «радиофармацевтическая химия». В настоящее время в Российской Федерации отсутствуют нормативные документы, регламентирующие необходимость проведения доклинических исследований для РФЛП, изготавливаемых экстемпорально в рамках аптеки медицинской организации. На наш взгляд, для оригинальных РФЛП аптечного изготовления необходимо проведение исследований, которые в полной мере подтвердили бы безопасность, качество и эффективность в рекомендованном для клинического применения РФЛП режиме. В отдельных случаях программа исследований воспроизведенных в аптеке известных и (или) гибридных РФЛП может быть существенно ограничена или отменена, однако следует установить порядок согласования объема таких исследований. Следует ускорить процедуры внесения дополнений и корректировок в документацию по радиационной безопасности, регламентирующую порядок начала работ с новыми радионуклидами в условиях аптеки и клинического применения соответствующих РФЛП.
Следует отметить нерешенные задачи по финансированию лечения пациентов с применением незарегистрированных РФЛП. Такие препараты нельзя применять для лечения по квотам. Применение РФЛП 223Ra, 177Lu, 188Re, 90Y, 153Sm, 89Sr19 возможно в рамках оказания платных услуг, но это не всегда по силам пациентам. Кроме того, внесение изменений в нормативные документы федерального уровня с появлением каждого нового препарата, например РФЛП 225Ас и других радионуклидов, не происходит мгновенно, а требует определенного времени.
Опыт организации аптеки с правом изготовления радиофармацевтических препаратов
Приказ Минздрава России от 31.07.2020 № 780н «Об утверждении видов аптечных организаций» был первым нормативным актом, который ввел новый вид аптечной организации — «аптека, как структурное подразделение медицинской организации: …производственная с правом изготовления радиофармацевтических лекарственных препаратов». Практически одновременно был уточнен «Порядок изготовления радиофармацевтических лекарственных препаратов непосредственно в медицинских организациях20». Это открыло возможность изготовления незарегистрированных РФЛП и применения их у пациентов российских медицинских организаций. В 2021 г. первая в России аптека РФЛП была создана в клинике № 2 Медицинского радиологического научного центра им. А.Ф. Цыба — филиала ФГБУ «Национальный медицинский исследовательский центр радиологии» Минздрава России (далее — Аптека РФЛП).
Для организации процесса изготовления РФЛП были подготовлены следующие помещения (рис. 1): санпропускник, блок подготовки неактивных реагентов для синтеза РФЛП (растворителей, буферных растворов и др.), блок синтеза РФЛП, блок контроля качества. Все помещения соединены между собой передаточными шлюзами. Перед началом работ Аптеки РФЛП были получены: лицензия Ростехнадзора на эксплуатацию радиационных источников (открытых) с перечнем применяемых радионуклидов и санитарно-эпидемиологическое заключение на работы с открытыми источниками ионизирующего излучения в данных помещениях организации, а также лицензия Росздравнадзора на фармацевтическую деятельность, включая вид выполняемых работ — «изготовление радиофармацевтических лекарственных препаратов для медицинского применения».
Номенклатура препаратов аптечного изготовления в 2021–2022 гг. включала 3 РФЛП (табл. 1), два из которых — оригинальные препараты на основе микросфер альбумина крови человека (МСА), меченных 188Re. РФЛП «Артрорен-МРНЦ» содержит МСА размером 5–10 мкм и применяется для радиосиновиортеза [29], в клиническом исследовании РФЛП «Гепаторен-МРНЦ» на основе МСА 20–40 мкм подтверждена его безопасность для внутриартериальной радиоэмболизации неоперабельных опухолей печени [30]. РФЛП «Лютапрост-МРНЦ» является воспроизведенным аналогом препарата «Pluvicto®» — таргетного РФЛП для лечения пациентов с метастатическим кастрационно-резистентным раком предстательной железы (РПЖ) [31]. Фармацевтическая разработка и доклинические исследования этих и последующих РФЛП до начала изготовления в Аптеке РФЛП были выполнены в Лаборатории экспериментальной ядерной медицины МРНЦ им. А.Ф. Цыба. Потоки по изготавливаемым РФЛП разделяют по времени — в один день изготавливают только один вид РФЛП, которые используют для лечения пациентов в день изготовления. В 2022 г. в связи с необходимостью начала работ с новыми РФЛП, в том числе на основе α-излучающих радионуклидов, в состав Аптеки РФЛП включен второй блок синтеза РФЛП, оборудованный защитным шкафом с ламинарным потоком воздуха.
С 2023 г. в Аптеке РФЛП МРНЦ им. А.Ф. Цыба начали изготавливать РФЛП «Простактин-МРНЦ» (225Ас-ДОТА-ПСМА, терапия метастазирующего кастрационно-резистентного РПЖ), планируется разработка других РФЛП с 225Ac. В 2024 г. в номенклатуре Аптеки появился воспроизведенный аналог зарубежного РФЛП «Lutatera®» (177Lu-DOTATATE), применяемого для терапии злокачественных нейроэндокринных новообразований. В первом блоке синтеза изготавливают РФЛП 177Lu, во втором блоке синтеза — РФЛП 225Ac и 188Re (проводятся работы по трансферу технологии разработанного ранее РФЛП «Золерен, 188Re» [32], табл. 1).
В соответствии с приказом по МРНЦ им. А.Ф. Цыба заведующая Аптекой РФЛП (специалист с высшим фармацевтическим образованием) и сотрудники, имеющие доступ к работе в Аптеке РФЛП, а также медперсонал, непосредственно работающий с РФЛП, относятся к категории А. На всех этапах изготовления РФЛП обеспечен контроль радиационной безопасности. Химические предшественники (ДОТА-ПСМА, ДОТАТАТЕ и др.) в МРНЦ им. А.Ф. Цыба поставляет АО «Фарм-Синтез» в виде лиофилизатов по 0,1 или 0,3 мг. Такое количество предшественника обычно необходимо для изготовления серии РФЛП для нескольких пациентов. Сертификат анализа каждого продукта свидетельствует о его соответствии показателям, установленным в ОФС.1.11.0005 «Химические предшественники для радиофармацевтических лекарственных препаратов». Предприятие имеет лицензию Минпромторга России на производство лекарственных средств и соответствует принципам надлежащей производственной практики ЕАЭС. Однако выполнить выпускающий контроль качества предшественника в заказанных фасовках у производителя, а также входной контроль у изготовителя РФЛП не представляется возможным. Производитель проводит контроль готового продукта на нерасфасованной серии. Радионуклидные предшественники поставляют предприятия Госкорпорации «Росатом» (табл. 2). Следует отметить, что в настоящее время силами этих предприятий проводится работа по актуализации сертификатов радионуклидной продукции в соответствии с требованиями новых монографий ГФ РФ ХV изд.
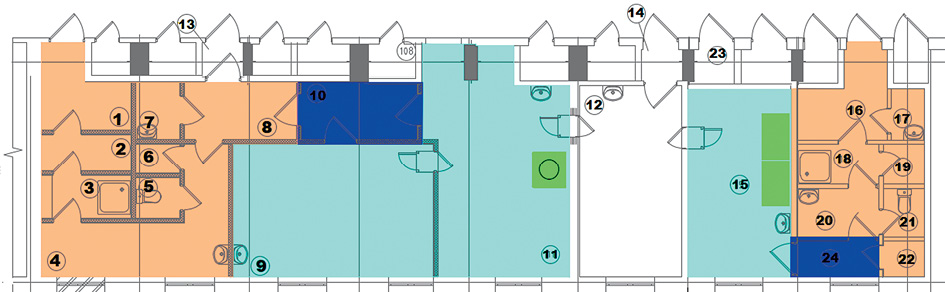

Рисунок подготовлен авторами / The figure is prepared by the authors
Рис. 1. Схема расположения помещений аптеки с правом изготовления радиофармацевтических лекарственных препаратов МРНЦ им. А.Ф. Цыба
1–7 — санпропускник № 1. 1 — гардероб домашней одежды; 2 — пункт радиометрического контроля; 3 — душевая; 4 — гардероб спецодежды; 5 — санузел; 6 — кладовая грязной спецодежды; 7 — комната уборочного инвентаря; 8 — тамбур; 9 — помещение подготовки к синтезу (комната с неактивными реагентами); 10 — шлюз; 11 — помещение синтеза РФЛП (177Lu); 12 — помещение приемки и контроля качества; 13 — шлюз (аварийный выход); 14 — шлюз; 15 — помещение синтеза РФЛП (225Ас, 227Th, 188Re); 16–23 — санпропускник № 2. 16 — гардероб домашней одежды; 17 — комната уборочного инвентаря; 18 — душевая; 19 — пункт радиометрического контроля; 20 — гардероб спецодежды; 21 — санузел; 22 — кладовая грязной спецодежды; 23 — техническое помещение; 24 — шлюз
Fig. 1. Radiopharmacy Layout, A. Tsyb Medical Radiological Research Centre
1–7 — sanitary inspection room No. 1. 1 — plain suits cloakroom; 2 — radiometric control point; 3 — shower room; 4 — workwear room; 5 — toilet; 6 — dirty workwear storage; 7 — cleaning equipment room; 8 — tambour; 9 — synthesis preparation room (room wth inactive reagents); 10 — airlock; 11 — RP synthesis room (177Lu); 12 — acceptance and quality control room; 13 — airlock (emergency exit); 14 — airlock; 15 — RP synthesis room (225Ас, 227Th, 188Re); 16–23 — sanitary inspection room No. 2. 16 — street clothes cloakroom; 17 — cleaning equipment room; 18 — shower room; 19 — radiometric control point; 20 — workwear room; 21 — toilet; 22 — dirty workwear storage; 23 — technical room; 24 — airlock
Таблица 1. Сведения о радиофармацевтических лекарственных препаратах, изготовленных в аптеке МРНЦ им. А.Ф. Цыба
Table 1. Radiopharmaceuticals produced in the Radiopharmacy, A.F. Tsyb Medical Radiological Research Centre
|
Радионуклид Radionuclide |
Радиофармацевтический лекарственный препарат Radiopharmaceutical |
Количество изготовленных доз по годам Number of prepared doses by year |
|||||
|
Наименование Name |
Назначение Purpose |
2021 |
2022 |
2023 |
2024 |
2025 |
|
|
188Re |
Артрорен-МРНЦ (МСА,188Re 5–10 мкм) Artroren-MRRC (MSA,188Re 5–10 μm) |
Радиосиновиортез Radiosynoviorthesis |
2 |
20 |
30 |
10 |
10 |
|
Изготовление в понедельник/вторник; максимально 100 доз/год Preparation on Monday/Tuesday; maximum 100 doses/year |
|||||||
|
Гепаторен-МРНЦ (МСА,188Re 20–40 мкм) Hepatoren-MRRC (MSA,188Re 20–40 μm) |
Лечение неоперабельного рака печени методом радиоэмболизации Radioembolisation of unresectable liver cancer |
2 |
18 |
32 |
4 |
0 |
|
|
Изготовление в понедельник/вторник; максимально 60 доз/год Preparation on Monday/Tuesday; maximum 60 doses/year |
|||||||
|
Золерен,188Re (Золедронат, 188Re) Zoleren, 188Re (Zoledronate, 188Re) |
Терапия костных метастазов Treatment of bone metastases |
0 |
0 |
0 |
0 |
5 |
|
|
177Lu |
Лютапрост-МРНЦ (177Lu-ДОТА-ПСМА) Lutaprost-MRRC (177Lu-DOTA-PSMA) |
Терапия рака предстательной железы Therapy of prostate cancer |
5 |
98 |
219 |
280 |
350 |
|
Изготовление в среду, каждые 2 недели; максимально 300 доз/год Preparation on Wednesday; every two weeks; maximum 300 doses/year |
|||||||
|
177Lu-DOTATOC/ТАТЕ |
Терапия нейроэндокринных опухолей Therapy of neuroendocrine tumours |
0 |
0 |
0 |
45 |
240 |
|
|
Изготовление в четверг, 1 раз в месяц; максимально 100 доз/год Preparation on Thursday; once a month; maximum 100 doses/year |
|||||||
|
99mТс* |
99mTc-Hynic-iPSMA |
Диагностика рака предстательной железы Diagnostics of prostate cancer |
0 |
0 |
0 |
3 |
8 |
|
99mТс-Hynic-ТОС/ТАТЕ |
Диагностика нейроэндокринных опухолей Diagnostics of neuroendocrine tumours |
0 |
0 |
0 |
0 |
5 |
|
|
225Ас** |
Простактин-МРНЦ (225Ас-ДОТА-ПСМА) Prostactin-MRRC (225Ас-DOTA-PSMA) |
Терапия рака предстательной железы Therapy of prostate cancer |
0 |
0 |
90 |
188 |
150 (200) |
|
Изготовление в пятницу, каждые 2 недели; максимально 150 доз/год Preparation on Friday; every two weeks; maximum 150 doses/year |
|||||||
|
225Ас-ДОТА-SP (в рамках сотрудничества с Neurosurgical Center, Bern) 225Ас-DOTA-SP (in cooperation with Neurosurgical Center, Bern) |
Таргетная α-терапия мультиформной глиобластомы Targeted alpha therapy of glioblastoma multiforme |
0 |
0 |
0 |
0 |
2 (5) |
|
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. МСА — микросферы альбумина крови человека.
* Изготовление в требуемых количествах после освоения передано в отделение радионуклидной диагностики, оснащенное для работ с 99mТс.
** В скобках — плановая потребность в РФЛП, содержащем 225Ас, на 2025 г., несоответствие объемов фактического и планового изготовления объясняется недостатком (по количеству) поставляемого предшественника 225Ас.
Note. HSAM, Human serum albumin microspheres.
* The required quantities of the developed radiopharmaceuticals are produced in the Department of radionuclide diagnostics equipped to work with 99mТс.
** In parenthesis — estimated RP requirement containing 225Ас for 2025; discrepancy between the estimated and the actual scope is caused by undersupply (quantity not sufficient) of 225Ас precursor.
Таблица 2. Радионуклидные предшественники для изготовления радиофармацевтических препаратов в аптеке МРНЦ им. А.Ф. Цыба
Table 2. Radionuclide precursors for RP preparations in the Radiopharmacy, A.F. Tsyb Medical Radiological Research Centre
|
Наименование Name |
Химическая форма Chemical form |
Производитель Manufacturer |
Примечания Notes |
|
Генератор 188Re 188Re generator |
Раствор натрия перрената, 188Re Sodium perrenate, 188Re solution |
АО «ГНЦ РФ ФЭИ» I.I. Leypunsky Institute of Physics and Power Engineering |
Зарегистрирован как медицинское изделие Registered as a medical device Marketing authorisation No. РЗН 2021/13914 |
|
177Lu (без добавления носителя) (no carrier added) |
Раствор [ 177Lu]LuCl3 в 0,1 М HCl Solution [ 177Lu]LuCl3 in 0.1 М HCl |
АО «ГНЦ НИИАР» Research Institute of Atomic Reactors |
Удельная активность не менее 1110 ТБк/г Specific activity not less than 1,110 TBq/g |
|
177Lu (с носителем) (carrier added) |
Раствор [ 177Lu]LuCl3 в 0,05 М HCl Solution [ 177Lu]LuCl3 in 0,05 М HCl |
АО «ИРМ» Institute of Reactor Materials |
Удельная активность не менее 1110 ТБк/г на дату отправки Specific activity not less than 1,110 TBq/g on the date of sending |
|
225Ас |
[ 225Ас]АсCl3 в твердой форме in solid form |
АО «ГНЦ-ФЭИ» I.I. Leypunsky Institute of Physics and Power Engineering |
Отношение суммарной массы нерадиоактивных примесей к активности 225Ас не более 370 мкг/ГБк The ratio of the total non-radioactive mass to the activity of actinium-225 is no more than 370 μg/GBq |
|
Генератор 99mТс 99mTc generator |
Раствор натрия пертехнетата,99mТс Sodium pertechnetate, 99mTc solution |
АО «НИФХИ им. Л.Я. Карпова» Karpov Research Institute of Physics and Chemistry |
Зарегистрирован как лекарственное средство Registered as a medicine Р N001868/01 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. Сведения о показателях качества можно найти в Каталоге радионуклидной продукции научного дивизиона Госкорпорации «Росатом» (рекламное издание). Димитровград: АО «ГНЦ НИИАР»; 2022.
Note. For quality parameters, see Catalogue of radionuclide products, Scientific division, Rosatom State Atomic Energy Corporation (promotion material). Dimitrovgrad Research Institute of Atomic Reactos, 2022.
ЗАКЛЮЧЕНИЕ
Практика первичной клинической апробации новых РФЛП, изготовленных в госпитальной ядерной аптеке, многократно оправдала себя во всем мире, несмотря на то что практически в каждом государстве существуют свои подходы и варианты такой практики. Поэтому нет смысла целиком ориентироваться на опыт какого-то государства или, например, Европы в целом, но стоит, создавая свою систему организации работы по изготовлению РФЛП, выбрать то лучшее, что уже годами наработано и подтвердило целесообразность. Бесспорны два преимущества практики изготовления в начале жизненного цикла каждого РФЛП:
- это наиболее короткий путь к пациенту жизненно необходимого для него препарата;
- возможность без серьезных капиталовложений оценить необходимость последующей организации крупномасштабного промышленного производства РФЛП для ввода препарата в широкую клиническую практику.
За последние годы произошло существенное изменение российского законодательства в области производства и изготовления РФЛП. Производственная аптека с правом изготовления РФЛП — новый вид аптечной организации, ранее не существовавший ни в нашей стране, ни где-либо на территории ЕАЭС. Тем не менее практика аптечного изготовления РФЛП не заменяет и не отменяет необходимость государственной регистрации РФЛП, доказавших свою безопасность и эффективность и производимых в промышленных масштабах. При этом специфика свойств, методов получения и контроля качества РФЛП диктует необходимость специальных подходов и разработки специальных руководств по доклиническим и клиническим исследованиям РФЛП.
Необходимо отметить активность зарубежных профессиональных сообществ по организации дискуссий, опросов и других форм работы, способствующих разработке и принятию решений регуляторными органами, с целью ускорения доступности новейших РФЛП пациентам. В этой связи хотелось бы продолжить и развить установившуюся относительно недавно практику участия сотрудников регуляторных органов в тематических конференциях, организуемых Российским обществом ядерной медицины. Нельзя не согласиться с европейскими экспертами в отношении неприменимости классического понятия «лекарственной субстанции» (активного фармацевтического ингредиента), которую можно выделить, для РФЛП. Поэтому требование описания производства субстанции в регистрационном досье на РФЛП по сути не имеет смысла. Безусловно, позитивным фактором является введение и многолетнее существование во многих регионах мира специальностей «ядерная медицина» и «радиофармацевтика», а также наличие систем подготовки соответствующих специалистов.
Появление в наших ведущих медицинских центрах аптек, изготавливающих РФЛП, будет способствовать развитию отечественной ядерной медицины. Однако нужны дальнейшие шаги на уровне органов исполнительной власти и регуляторных органов, требующие, по мнению авторов, решения. Первоочередными задачами, которые необходимо решить, являются:
1) включение в штатное расписание медицинской организации специалистов с высшим и средним техническим образованием в области радиохимии и радиоаналитической химии;
2) формирование системы полноценного высшего или среднего специального образования для провизоров в области ядерной физики, радиохимии, радиоаналитической химии;
3) подготовка новых редакций Основных санитарных правил обеспечения радиационной безопасности и Норм радиационной безопасности, регламентирующих правила лечения пациентов с применением РФЛП аптечного изготовления, в том числе на основе радионуклидов 177Lu, 90Y, 223Ra, 225Ac и др.;
4) создание системы обучения медицинских специалистов методам лечения с использованием незарегистрированных РФЛП;
5) определение источников финансирования лечения с применением изготовленных РФЛП, в том числе с привлечением системы обязательного медицинского страхования;
6) создание сети мелкосерийных производителей исходных предшественников и других расходных материалов для синтеза РФЛП в аптеках;
7) создание консультативного совета, в который войдут эксперты ведущих медицинских организаций, уже работающих по системе ядерной аптеки, для подготовки решений по организационным и техническим вопросам изготовления и применения незарегистрированных РФЛП в медицинских организациях.
1 Соглашение о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза от 23.12.2014 (ратифицировано Федеральным законом от 31.01.2016 № 5-ФЗ, вступило в силу для Российской Федерации 12.02.2016).
2 Приказ Минздрава России от 27.04.2015 № 211н «Об утверждении Порядка изготовления радиофармацевтических лекарственных препаратов непосредственно в медицинских организациях», утратил силу 01.01.2021.
3 Приказ Минздрава России от 12.11.2020 № 1218н «Об утверждении Порядка изготовления радиофармацевтических лекарственных препаратов непосредственно в медицинских организациях».
4 Приказ Минздрава России от 31.07.2020 №780н «Об утверждении видов аптечных организаций».
5 Приказ Минздрава России от 22.05.2023 № 249н «Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, имеющими лицензию на фармацевтическую деятельность», раздел Х.
6 Профессиональная организация, основанная в 1985 г., объединяющая национальные общества и отдельных членов, работающих в области ядерной медицины. Организационная структура включает в том числе комитет по радиофармацевтическим наукам. https://eanm.org
7 Taylor DM, Brock M, Frier M, et al. Guidelines for the preparation of radiopharmaceuticals in hospitals. London: British Institute of Radiology; 1975.
8 Gillings N, Hjelstuen O, Ballinger J, et al. Guideline on current good radiopharmacy practice (cGRPP) for the small-scale preparation of radiopharmaceuticals. EJNMMI Radiopharm Chem. 2021;6(1):8. https://doi.org/10.1186/s41181-021-00123-2
9 Regulation (EU) No 536/2014 of the European Parliament and of the Council of 16 April 2014 on clinical trials on medicinal products for human use, and repealing Directive 2001/20/EC.
10 Например, в России — Указ Президента Российской Федерации от 13.10.2018 № 585 «Об утверждении Основ государственной политики в области обеспечения ядерной и радиационной безопасности Российской Федерации на период до 2025 года и дальнейшую перспективу».
11 Gillings N, Hjelstuen O, Ballinger J, et al. Guideline on current good radiopharmacy practice (cGRPP) for the small-scale preparation of radiopharmaceuticals. EJNMMI Radiopharm Chem. 2021;6(1):8. https://doi.org/10.1186/s41181-021-00123-2
12 Скворцова ВИ, ред. Ядерная медицина: справочник для персонала отделений, лабораторий и центров ядерной медицины. М.: ФГБУ ГНЦ ФМБЦ им. А.И. Бурназяна ФМБА России; 2020. Гл. 2. С. 17–63.
13 ФС 624. Раствор натрия о-йодгиппурата, меченного йодом-131, для инъекций. Государственная фармакопея СССР. Х изд. М.: 1968.
14 https://grls.minzdrav.gov.ru
15 https://roszdravnadzor.gov.ru
16 Приказ Минздрава России от 22.05.2023 № 249н «Об утверждении правил изготовления и отпуска лекарственных препаратов для медицинского применения аптечными организациями, имеющими лицензию на фармацевтическую деятельность» (раздел Х).
17 Приказ Минздрава России от 12.11.2020 № 1218н «Об утверждении Порядка изготовления радиофармацевтических лекарственных препаратов непосредственно в медицинских организациях».
18 Приказ Минздрава России от 31.07.2020 № 780н «Об утверждении видов аптечных организаций».
19 Приказ Минздрава России от 13.10.2017 № 804н «Об утверждении номенклатуры медицинских услуг».
20 Приказ Минздрава России от 12.11.2020 № 1218н «Об утверждении Порядка изготовления радиофармацевтических лекарственных препаратов непосредственно в медицинских организациях».
Список литературы
1. Shaw SM, Ice RD. Nuclear pharmacy, Part I: Emergence of the specialty of nuclear pharmacy. J Nucl Med Technol. 2000;28(1):8–11. PMID: 10763775
2. Robinson RG, Rhodes BA. Editorial: Whither nuclear pharmacy? J Nucl Med. 1976;17(7):577–8. PMID: 1271103.
3. Ponto JA, Hung JC. Nuclear Pharmacy, Part II: Nuclear Pharmacy Practice Today. J Nucl Med Technol. 2000;28(2):76–81. PMID: 10824617
4. Ballinger JR. Hospital radiopharmacy in the UK. In: McCready R, Gnanasegaran G, Bomanji J, eds. A history of radionuclide studies in the UK. Springer Cham; 2016. P. 129–34. https://doi.org/10.1007/978-3-319-28624-2_17
5. Callahan RJ. The role of commercial nuclear pharmacy in the future practice of nuclear medicine. Semin Nucl Med. 1996; 26(2):85–90. https://doi.org/10.1016/s0001-2998(96)80029-8
6. Кодина ГЕ, Козлова МД, Краснов НН и др. Радионуклидный генератор 68Ge/68Ga для получения физиологически приемлемого раствора 68Ga. Патент Российской Федерации № 2126271; 1998. EDN: QSGILW
7. Waterhouse NN, Amor-Coarasa A, Nikolopoulou A, Babich JW. Otto: a 4.04 GBq (109 mCi) 68Ge/68Ga generator, first of its kind — extended quality control and performance evaluation in the clinical production of [68Ga] Ga-PSMA-11. EJNMMI Radiopharm Chem. 2020;5(1):5. https://doi.org/10.1186/s41181-019-0087-y
8. Lee JY, Choi PS, Yang SD, Park JH. TiO2 decorated low-molecular chitosan a microsized adsorbent for a 68Ge/68Ga generator system. Molecules. 2021;26(11):3185. https://doi.org/10.3390/molecules26113185
9. Lepareur N. Cold kit labeling: The future of 68Ga radiopharmaceuticals? Front Med (Lausanne). 2022;9:812050. https://doi.org/10.3389/fmed.2022.812050
10. Dittrich RP, De Jesus O. Gallium Scan. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025. https://www.ncbi.nlm.nih.gov/books/NBK567748/
11. van Brandwijk EA, Aalbersberg EA, Hosseini AS, et al. Automated radiolabelling of [68Ga]Ga-PSMA-11 (gallium (68Ga)-gozetotide) using the Locametz® kit and two generators. EJNMMI Radiopharm Chem. 2024;9(1):31. https://doi.org/10.1186/s41181-024-00260-4
12. Pandey MK, DeGrado TR. Cyclotron production of PET radiometals in liquid targets: Aspects and prospects. Curr Radiopharm. 2021;14(4):325–39. https://doi.org/10.2174/1874471013999200820165734
13. Tremblay S, Beaudoin JF, Bélissant Benesty O, et al. 68Ga-DOTATATE prepared from cyclotron-produced 68Ga: An integrated solution from cyclotron vault to safety assessment and diagnostic efficacy in neuroendocrine cancer patients. J Nucl Med. 2023;64(2):232–8. https://doi.org/10.2967/jnumed.121.263768
14. Wurzer A, De Rose F, Fischer S, et al. Preclinical comparison of [177Lu]Lu-rhPSMA-10.1 and [177Lu]Lu-rhPSMA-10.2 for endoradiotherapy of prostate cancer: biodistribution and dosimetry studies. EJNMMI Radiopharm Chem. 2024;9(1):18. https://doi.org/10.1186/s41181-024-00246-2
15. Wojdowska W, Karczmarczyk U, Balog L, et al. Impact of DOTA-chelators on the antitumor activity of 177Lu-DOTA-rituximab preparations in lymphoma tumor-bearing mice. Cancer Biother Radiopharm. 2020;35(8):558–62. https://doi.org/10.1089/cbr.2019.3405
16. Roohi S, Rizvi SK, Naqvi SAR. 177Lu-DOTATATE peptide receptor radionuclide therapy: Indigenously developed freeze dried cold kit and biological response in in-vitro and in-vivo models. Dose Response. 2021;19(1):1559325821990147. https://doi.org/10.1177/1559325821990147
17. Waked A, Crabbé M, Neirinckx V, et al. Preclinical evaluation of CXCR4 peptides for targeted radionuclide therapy in glioblastoma. EJNMMI Radiopharm Chem. 2024;9(1):52. https://doi.org/10.1186/s41181-024-00282-y
18. Ladrière T, Faudemer J, Levigoureux E, et al. Safety and therapeutic optimization of Lutetium-177 based radiopharmaceuticals. Pharmaceutics. 2023;15(4):1240. https://doi.org/10.3390/pharmaceutics15041240
19. Nelson BJB, Krol V, Bansal A, et al. Aspects and prospects of preclinical theranostic radiopharmaceutical development. Theranostics. 2024;14(17):6446–70. https://doi.org/10.7150/thno.100339
20. Hooijman EL, Radchenko V, Ling SW, et al. Implementing Ac-225 labelled radiopharmaceuticals: Practical considerations and (pre-)clinical perspectives. EJNMMI Radiopharm Chem. 2024;9(1):9. https://doi.org/10.1186/s41181-024-00239-1
21. Faivre-Chauvet A, Bourdeau C, Bourgeois M. Radiopharmaceutical good practices: Regulation between hospital and industry. Front Nucl Med. 2022;2:990330. https://doi.org/10.3389/fnume.2022.990330
22. Decristoforo A, Peñuelas I. Towards a harmonized radiopharmaceutical regulatory framework in Europe? Q J Nucl Med Mol Imaging. 2009;53(4):394–401. PMID: 19834449
23. Patt M, Decristoforo C, de Martini A, et al. The revision of the pharmaceutical legislation — it is time to act for nuclear medicine in Europe. Eur J Nucl Med Mol Imaging. 2023; 51(1):20–4. https://doi.org/10.1007/s00259-023-06472-1
24. Neels O, Patt M, Decristoforo C. Radionuclides: medicinal products or rather starting materials? EJNMMI Radiopharm Chem. 2019;4(1):22. https://doi.org/10.1186/s41181-019-0074-3
25. Konijnenberg M, Herrmann K, Kobe C, et al. EANM position paper on article 56 of the Council Directive 2013/59/ Euratom (basic safety standards) for nuclear medicine therapy. Eur J Nucl Med Mol Imaging. 2021;48(1):67–72. https://doi.org/10.1007/s00259-020-05038-9
26. Position paper to facilitate patient access to radiopharmaceuticals: Considerations for a suitable pharmaceutical regulatory framework. EJNMMI Radiopharm Chem. 2024;9(1):2. https://doi.org/10.1186/s41181-023-00230-2
27. Moya E, Cerrato C, Bedoya LM, Guerra JA. Radiopharmaceutical small-scale preparation in Europe: will we be able to harmonize the situation? EJNMMI Radiopharm Chem. 2024;9(1):64. https://doi.org/10.1186/s41181-024-00281-z
28. Кодина ГЕ. Институт биофизики — место рождения отечественной ядерной медицины. В кн.: Ильин ЛА, Уйба ВВ, Самойлов АС, ред. Сборник статей, посвященных 70-летию ФГБУ ГНЦ ФМБЦ им. А.И. Бурназяна. М.; 2017. С. 96–117.
29. Дороватовский СА, Петриев ВМ, Зверев АВ и др. Радиофармацевтическая композиция для терапии воспалительных заболеваний суставов на основе радионуклида 188Re и микросфер альбумина крови человека, а также состав и способ ее получения. Патент Российской Федерации № 2698101; 2019. EDN: DTFUFY
30. Кучеров ВВ, Петросян АП, Власова ОП и др. Результаты клинического исследования безопасности радиофармацевтического лекарственного препарата с 188Re при проведении внутриартериальной радиоэмболизации. Радиация и риск. 2024;33(3):18–29. https://doi.org/10.21870/0131-3878-2024-33-3-18-29
31. Крылов ВВ, Легкодимова НС, Кочетова ТЮ и др. Радиолигандная терапия 177Lu-ДОТА-ПСМА при метастатическом кастрационно-резистентном раке предстательной железы. Фармакокинетика, безопасность, противоопухолевая эффективность. Лучевая диагностика и терапия. 2022;13(4):75–85. https://doi.org/10.22328/2079-5343-2022-13-4-75-85
32. Kochetova T, Krylov V, Smolyarchuk M, et al. 188Re zoledronic acid in the palliative treatment of painful bone metastases. Int J Nucl Med Res. 2017;(S):92–100. https://doi.org/10.15379/2408-9788.2017.08
Об авторах
Г. Е. КодинаРоссия
Кодина Галина Евгеньевна - канд. хим. наук, доцент.
ул. Королева, д. 4, Обнинск, 249036
О. П. Власова
Россия
Власова Оксана Петровна - канд. биол. наук.
ул. Королева, д. 4, Обнинск, 249036
В. К. Тищенко
Россия
Тищенко Виктория Константиновна - д-р биол. наук.
ул. Королева, д. 4, Обнинск, 249036
С. А. Дороватовский
Россия
Дороватовский Станислав Анатольевич.
ул. Королева, д. 4, Обнинск, 249036
Т. П. Рыжикова
Россия
Рыжикова Тамара Павловна.
ул. Королева, д. 4, Обнинск, 249036
С. А. Иванов
Россия
Иванов Сергей Анатольевич - д-р мед. наук, профессор.
ул. Королева, д. 4, Обнинск, 249036; ул. Миклухо-Маклая, д. 6, Москва, 117198
П. В. Шегай
Россия
Шегай Петр Викторович - канд. мед. наук.
ул. Королева, д. 4, Обнинск, 249036; 2-й Боткинский пр-д, д. 3, Москва, 125284
А. Д. Каприн
Россия
Каприн Андрей Дмитриевич - академик РАН, д-р мед. наук, профессор.
ул. Королева, д. 4, Обнинск, 249036; ул. Миклухо-Маклая, д. 6, Москва, 117198; 2-й Боткинский пр-д, д. 3, Москва, 125284
А. А. Трапкова
Россия
Трапкова Алла Аркадьевна - канд. биол. наук.
Петровский б-р, д. 8, стр. 2, Москва, 127051
Дополнительные файлы
Рецензия
Для цитирования:
Кодина Г.Е., Власова О.П., Тищенко В.К., Дороватовский С.А., Рыжикова Т.П., Иванов С.А., Шегай П.В., Каприн А.Д., Трапкова А.А. Регуляторные требования к аптечному изготовлению радиофармацевтических лекарственных препаратов. Регуляторные исследования и экспертиза лекарственных средств. 2025;15(4):404-420. https://doi.org/10.30895/1991-2919-2025-15-4-404-420
For citation:
Kodina G.E., Vlasova O.P., Tishchenko V.K., Dorovatovsky S.A., Ryzhikova T.P., Ivanov S.A., Shegai P.V., Kaprin A.D., Trapkova A.A. Regulatory Requirements for Small-Scale Preparation of Radiopharmaceuticals. Regulatory Research and Medicine Evaluation. 2025;15(4):404-420. (In Russ.) https://doi.org/10.30895/1991-2919-2025-15-4-404-420



































