Перейти к:
Изучение распределения 5-[5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида и его метаболитов на крысах
https://doi.org/10.30895/1991-2919-2025-743
Резюме
ВВЕДЕНИЕ. Статья является продолжением цикла работ по исследованию фармакокинетики нового соединения для лечения открытоугольной глаукомы 5-[5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида (TFISA). Распределение данного вещества и его метаболитов по органам и тканям ранее в доклинических исследованиях не изучалось.
ЦЕЛЬ. Валидация методик определения 5-[5-(трифторметил)-1,2-оксазол-3-ил]- фуран-2-сульфонамида и его метаболитов в биологических образцах. Оценка распределения и тканевой доступности 5-[5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида и его метаболитов в органах и тканях крыс.
МАТЕРИАЛЫ И МЕТОДЫ. Исследование выполнено на 60 крысах-самцах линии Wistar. Введение TFISA проводили путем закапывания в каждый глаз 40 мкл 1% глазной суспензии (около 3,7 мг/кг). Отбор проб печени, почек, легких, мозга, сердца, селезенки, кожи, мышц, глаз осуществляли через 1, 2, 4, 8, 12, 24, 48, 72, 144, 216 ч после инстилляции. На каждую точку использовано по 6 особей. Образцы немедленно гомогенизировали с применением метанола и стабилизировали добавлением аскорбиновой кислоты. Количественное определение TFISA, N-гидрокси-5-[5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида (М1) и N-ацетил-5-[5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида (М2) в образцах выполняли методом высокоэффективной жидкостной хроматографии с тандемным масс-спектрометрическим детектированием.
РЕЗУЛЬТАТЫ. Полная валидация методик определения 5-[5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида и его метаболитов была выполнена отдельно для тканей глаз и отдельно для других биологических объектов. Тканевая биодоступность (ft) TFISA уменьшалась в следующей последовательности в диапазоне 13,0–0,7: ткани глаза (место введения и действия) > селезенка > легкие ≥ сердце > печень > почки > мозг > кожа ≥ мышцы. Величина ft М1 снижалась с 52,0 до 2,5 в ряду селезенка ≥ легкие ≥ сердце ≥ печень > почки > мозг > мышцы ≥ ткани глаза > кожа. Значения ft М2 были ниже, чем TFISA и M1, и уменьшались с 6,4 до 0,3 в ряду печень ≥ почки > сердце > легкие > ткани глаза > кожа > селезенка ≥ мышцы > мозг.
ВЫВОДЫ. Валидированные биоаналитические методики успешно применены для изучения распределения TFISA и его метаболитов на самцах крыс. Действующее вещество лучше всего проникает в глаза и органы животных с хорошей васкуляризацией. Высокая тканевая биодоступность М1 наблюдается в селезенке, сердце, легких; высокая тканевая биодоступность М2 — в печени и почках крыс.
Ключевые слова
Для цитирования:
Яичков И.И., Хохлов А.Л., Корсаков М.К., Вольхин Н.Н., Петухов С.С., Лазарянц О.Э., Коровина А.В. Изучение распределения 5-[5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида и его метаболитов на крысах. Регуляторные исследования и экспертиза лекарственных средств. 2025;15(3):301-312. https://doi.org/10.30895/1991-2919-2025-743
For citation:
Yaichkov I.I., Khokhlov A.L., Korsakov M.K., Volkhin N.N., Petukhov S.S., Lazariants O.E., Korovina A.V. Distribution Study of 5-[5-(trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonamide and Its Metabolites in Rats. Regulatory Research and Medicine Evaluation. 2025;15(3):301-312. (In Russ.) https://doi.org/10.30895/1991-2919-2025-743
ВВЕДЕНИЕ
Изучение распределения активных веществ и их метаболитов в организме лабораторных животных является обязательным при создании новых лекарственных препаратов. В ходе данного исследования оценивают динамику накопления действующего вещества и его метаболитов в органах и тканях, скорость их выведения, выявляют возможные области их депонирования, что позволяет создать многокамерную фармакокинетическую модель1.
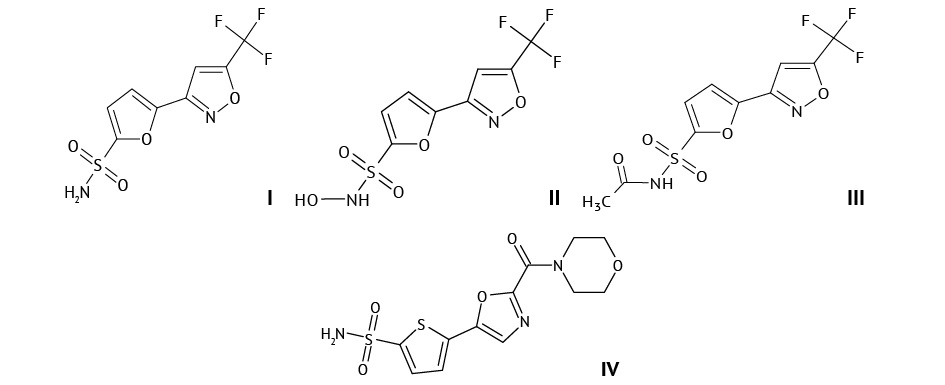
Синтезированный нами ингибитор карбоангидразы II типа 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамид (TFISA) (I) способен эффективно снижать внутриглазное давление после местного применения [1], при этом он всасывается в системный кровоток [2]. Так, величина относительной биодоступности TFISA после закапывания в глаза крысам 1% суспензии TFISA по сравнению с внутрибрюшинной инъекцией составляет около 90%. После попадания в организм сульфонамидная группа действующего вещества подвергается гидроксилированию с образованием N-гидрокси-5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида (II) (M1) и ацетилированию с образованием N-ацетил-5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида (III) (М2). Данные вещества, как и другие ингибиторы карбоангидразы, способны накапливаться в эритроцитах, что обуславливает их длительное выведение из организма. Так, TFISA и его метаболиты присутствовали в пробах мочи и фекалий на протяжении 336 ч после инстилляции его глазной суспензии крысам. Основным путем экскреции изучаемых соединений является ренальный [2]. Исследование распределения TFISA и его метаболитов ранее не проводили.
N-гидроксиметаболит TFISA способен разлагаться в биологических пробах с образованием 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфоновой кислоты [2], поэтому для достоверного определения концентрации М1 в органах крысы необходим подбор специальных условий его стабилизации в пробах. Cразу после аутопсии животного требуется немедленная гомогенизация образцов, наиболее подходящим способом которой является механическое измельчение тканей с помощью лабораторных шаровых мельниц [3][4]. Данный способ быстрее и универсальнее, чем ультразвуковая [5][6] и ферментативная гомогенизация [7]. Его применение позволяет максимально сократить время перевода М1 в жидкую фазу для последующего добавления растворов антиоксиданта. В качестве экстрагентов при этом возможно применение воды [8], физиологических растворов [5][9], 0,1 М раствора хлорной кислоты [6], фосфатного буферного раствора [3] и других растворителей и их смесей [9–11]. При проведении протеомных и метаболомных исследований возможна обработка образцов тканей и органов специфическими ингибиторами ферментов [12].
Известны случаи использования антиоксидантов для предотвращения разложения катехоламинов в пробах мозга крыс. Так, к метанольным гомогенатам добавляли 5% раствор аскорбиновой кислоты [13], данное соединение также применяли для количественного определения М1 в плазме и моче крыс [2], поэтому возможность его использования для стабилизации N-гидроксипроизводного TFISA необходимо оценить в первую очередь.
Цель работы — оценка распределения и тканевой биодоступности 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида и его метаболитов в органах и тканях крыс. В задачи исследования также входили подбор метода стабилизации проб, содержащих N-гидроксисульфонамиды, и валидация методик исследования.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы. Субстанция 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида и его 1% глазная суспензия (лабораторная серия) были произведены в Центре трансфера фармацевтических технологий им. М.В. Дорогова ЯГПУ им. К.Д. Ушинского (г. Ярославль). Стандартные образцы TFISA, его метаболитов, внутреннего стандарта 5-[ 2-(морфолин-4-карбонил)-1,3-оксазол-5-ил]-тиофен-2-сульфонамида (THSA) (IV) также были синтезированы и аттестованы в данной лаборатории. Подтверждение структуры и чистоты данных веществ осуществляли методами спектроскопии ядерного магнитного резонанса, масс-спектрометрии высокого и низкого разрешения, инфракрасной спектроскопии, высокоэффективной жидкостной и газовой хроматографии.
Для исследования использован тандемный масс-спектрометрический детектор AB Sciex QTRAP 5500 (AB Sciex) в комбинации с жидкостным хроматографом Agilent 1260 Infinity (Agilent Technologies). Для управления ВЭЖХ-МС/МС-системой использовано программное обеспечение «Analyst 1.6.2», для интегрирования хроматограмм и количественных расчетов — «MultiQuant 3.0.5» (AB Sciex).
Методы. Хроматографическое разделение проводили в тех же условиях, что и при исследованиях плазмы и крови в работах [2], с применением хроматографической колонки Zorbax Eclipse Plus C18 (150×3,0 мм, 3,5 мкм) с предколонкой Zorbax Eclipse Plus C18 (12,5×2,1 мм, 5,0 мкм) (Agilent Technologies). Подвижная фаза — 0,1% водный раствор муравьиной кислоты (Optima LC-MS-Grade, Thermo Fisher Scientific) (компонент А) и метанол (LiChrosolv hypergrade for LC-MS, Merck KGaA) (компонент Б). Масс-спектрометрическое детектирование в режиме мониторинга множественных реакций (MRM) проводили при тех же условиях и по той же методике, что и в работе [2].
Основные растворы с концентрацией 1000 мкг/мл готовили путем растворения субстанций TFISA (99,1%), его метаболитов М1 (98,2%) и М2 (98,5%) и внутреннего стандарта THSA (98,3%) в диметилсульфоксиде (х.ч., АО «Ленреактив») (режим хранения — не выше +4 °С). Комбинированные рабочие растворы аналитов получали с применением метанола (ос.ч., ООО «ТД «Химмед»»). Концентрации изучаемых соединений в калибровочных образцах (К1–К8), образцах контроля качества (нижнего предела количественного определения (НПКО), нижнего (LQC), среднего (MQC) и верхнего (HQC) уровня концентраций), образцах для проведения теста разведения (Dil) представлены в таблице 1.
Таблица 1. Концентрация изучаемых соединений в образцах органов и тканей крыс с добавкой стандарта
Table 1. Concentrations of the studied compounds in spiked organ and tissue samples
Образец Sample | Концентрация, нг/г Concentration, ng/g | |||||
TFISA | M1 | M2 | ||||
Органы и ткани Organs and tissues | Глаза Eyes | Органы и ткани Organs and tissues | Глаза Eyes | Органы и ткани Organs and tissues | Глаза Eyes | |
K1 (НПКО / LLOQ) | 20 | 80 | 2 | 8 | 0,1 | 0,4 |
K2 | 100 | 400 | 10 | 40 | 0,5 | 2,0 |
K3 | 500 | 2000 | 50 | 200 | 2,5 | 12,5 |
K4 | 2000 | 8000 | 200 | 800 | 10,0 | 40,0 |
K5 | 5000 | 20000 | 500 | 2000 | 25,0 | 100,0 |
K6 | 10000 | 40000 | 1000 | 4000 | 50,0 | 200,0 |
K7 | 15000 | 60000 | 1500 | 6000 | 75,0 | 300,0 |
K8 | 20000 | 80000 | 2000 | 8000 | 100,0 | 400,0 |
LQC | 60 | 240 | 6 | 24 | 0,3 | 1,2 |
MQC | 7500 | 30000 | 750 | 3000 | 37,5 | 187,5 |
HQC | 17500 | 70000 | 1750 | 7000 | 87,5 | 350,0 |
Dil | 35000 | 140000 | 3500 | 14000 | 175,0 | 700,0 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. TFISA — 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамид; M1 — N-гидрокси-5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамид; М2 — N-ацетил-5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамид; К1–К8 — калибровочные образцы; НПКО — нижний предел количественного определения; LQC, MQC, HQC — образцы контроля качества нижнего, среднего и верхнего уровня концентраций; Dil — концентрация для оценки эффекта разведения.
Note. TFISA, 5-[ 5-(trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonamide; M1, N-hydroxy-5-[ 5-(trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonamide; M2, N-acetyl-5-[ 5-(trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonamide; K1–K8, calibration samples; LLOQ, lower limit of quantification; LQC, low concentration quality control sample; MQC, middle concentration quality control sample; HQC, high concentration quality control sample; Dil, concentration for the dilution integrity test.
Пробы каждого органа взвешивали с точностью до 0,1 мг. Затем к навескам образцов добавляли метанол: к навескам тканей глаз в соотношении 1:3 (мг : мкл), к навескам других объектов — в соотношении 1:1 (мг : мкл). Гомогенизацию проводили с помощью шарикового гомогенизатора Homogenizer Bioprep-6 (Allsheng) двумя стальными шариками диаметром 5 мм (2 цикла перемешивания по 1 мин, интервал 5 с). Смесь центрифугировали 5 мин при 3000 об./мин (Heraeus Multifuge X3R, Thermo Fisher Scientific), затем к 95 мкл надосадочной жидкости добавляли растворы аскорбиновой кислоты в различных концентрациях и 5 мкл рабочего раствора аналитов. Для предотвращения разложения N-гидрокси-5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида к супернатантам гомогенатов тканей глаза добавляли 5% раствор аскорбиновой кислоты в соотношении 1:5 (об. : об.), к супернатантам гомогенатов других изучаемых органов и тканей — 10% раствор аскорбиновой кислоты в соотношении 1:1 (об. : об.). Полученные образцы хранили при температуре не выше –70 °С (морозильная камера MELING DV-HL218).
Лабораторные животные. Исследование распределения TFISA и его метаболитов проводили на 60 крысах-самцах линии Wistar (питомник ООО «СМК Стезар», г. Владимир). Масса животных составила 227±1 г, возраст — 15 недель. Доступ к комбикорму (АО «Гатчинский ККЗ») и воде ограничивали за 4 ч до введения изучаемого препарата и 2 ч после введения. Режим освещения во время эксперимента: 12 ч — день, 12 ч — ночь.
Образцы сравнения органов и тканей получали от интактных крыс линии Wistar массой более 350 г после их декапитации.
Валидация биоаналитических методик выполнена с соблюдением требований ЕАЭС и руководства Международного совета по гармонизации (International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use, ICH)2. Испытания тканей глаза крыс проводили в полном объеме3, так как для данного объекта при гомогенизации применяли другие, нежели в экспериментах с другими тканями, соотношения метанола и биологического образца, концентрации раствора стабилизатора, объемное соотношение гомогената и раствора стабилизатора, также исследования проводились в других диапазонах концентрации аналитов.
Селективность, эффект матрицы, линейность, долгосрочную стабильность оценивали отдельно для каждого органа и ткани. После успешных испытаний дизайн валидации был оптимизирован и количество серий по определению правильности и прецизионности сокращено до 2 для каждого объекта. Исследования эффекта разведения, эффекта переноса из предыдущей пробы, воспроизводимости при повторном введении, краткосрочной стабильности, стабильности после 3 циклов разморозки/заморозки, стабильности проб в автодозаторе выполняли на образцах печени.
Фармакокинетическое исследование. Глазную суспензию 1% TFISA закапывали в каждый глаз в объеме около 40 мкл, что соответствовало дозировке 3,7 мг/кг, использовавшейся в ранее проведенных исследованиях [2]. Отбор образцов печени, почек, легких, мозга, сердца, селезенки, кожи, мышц, глаз осуществляли спустя 1, 2, 4, 8, 12, 24, 48, 72, 144, 216 ч после инстилляции препарата. На каждую временную точку использовали по 6 особей. Крыс эвтаназировали декапитацией с применением лабораторной гильотины (ООО «НПК Открытая Наука») сразу после обязательной анестезии ингаляцией диэтиловым эфиром (х.ч., ООО «Кузбассоргхим»)4. Данное средство, как и изофлуран, не влияет на активность печеночных ферментов, что не искажает результаты исследований фармакокинетики [14].
Животных немедленно подвергали аутопсии: вскрывали брюшную полость, извлекали сердце, затем легкие, селезенку, печень и почки. Далее получали образцы глаз и головного мозга после вскрытия черепной коробки5 [15]. Последними отбирали образцы кожи и мышц бедра [16]. Разделение глаза на отдельные ткани не проводили, что связано с небольшим размером цилиарного тела, в которое должно проникнуть действующее вещество для подавления активности карбоангидразы II [17][18], что не позволит получить достаточный для анализа объем биоматериала. Для подобных исследований, как правило, используют более крупных животных — кроликов [19–21].
Изучаемые органы и ткани промывали деионизированной водой для удаления остатков крови с поверхности, обрабатывали жидким азотом, взвешивали с точностью до 0,1 мг, затем гомогенизировали и стабилизировали по описанной выше методике. Затем образцы замораживали и хранили при температуре не выше –70 °С (морозильная камера MELING DV-HL218). Исследование одобрено этическим комитетом ЯГПУ им. К.Д. Ушинского (протокол № 2 от 10.10.2023).
Фармакокинетические параметры оценивали с применением программного пакета R v. 3.3.2 (модуль Bear v. 2.7.7) (R-Project)6. Фармакокинетические кривые строили по средним значениям концентраций изучаемых соединений в каждой временной точке, по ним рассчитывали: максимальную концентрацию аналита в органе или ткани (Cmax); время достижения максимальной концентрации аналита в органе или ткани (Tmax); площадь под фармакокинетической кривой с точки приема препарата до точки отбора (AUC0-t); площадь под фармакокинетической кривой с точки приема препарата до бесконечности (AUC0-∞); период полувыведения аналита из органа или ткани (Т1/2Т); среднее время удержания аналита в органе или ткани (MRTТ).
Тканевую биодоступность (ft ) изучаемых соединений по отношению к плазме крови рассчитывали по формуле (1).
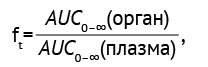 (1)
(1)
где AUC0–∞(орган) — площадь под фармакокинетической кривой с точки приема препарата до бесконечности в изучаемом органе или ткани, AUC0–∞(плазма) — площадь под фармакокинетической кривой с точки приема препарата до бесконечности в плазме (по данным [2]).
Статистические методы. Описательная статистика (среднее арифметическое (M), стандартное отклонение (SD), относительное стандартное отклонение (RSD), стандартная ошибка среднего (SEM)) выполнена с помощью программного обеспечения «Statsoft Statistica 10.0.1011».
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследование стабильности проб. Перед валидацией методики определения содержания TFISA и его метаболитов проведены предварительные испытания краткосрочной стабильности (STS), стабильности при замораживании/оттаивании (FTS) TFISA в гомогенатах органов и его стабильности в пробах, находящихся в автодозаторе (ASS). Для приготовления гомогенатов выбран метанол, как и в случае определения аналитов в фекалиях [2]. Концентрация аналитов в пробах находилась на уровне HQC. Было изучено влияние добавок 5 и 10% растворов аскорбиновой кислоты (АА) на стабильность M1. На начальной стадии анализировали по 2 пробы каждого биологического объекта с применением растворов АА обеих концентраций. В экспериментах были последовательно использованы объемные соотношения 1:5, 1:2 и 1:1 (раствор АА : гомогенат). Условия стабилизации образца считались подобранными, если количество М1, определяемое в пробах после процедуры стабилизации, составляло 85–115% от начального значения М1. Для подтверждения найденных условий проводили дополнительно по 4 эксперимента на образцах каждого органа и ткани.
В случае менее концентрированных гомогенатов глаз приемлемая стабильность была достигнута добавлением 5% раствора АА в объемном соотношении раствор АА : гомогенат 1:5. Разложение М1 в образцах печени, почек, селезенки, сердца, головного мозга, легких, кожи и мышц удалось предотвратить путем добавления 10% раствора АА в соотношении раствор АА : гомогенат 1:1. Также была подтверждена стабильность M1 в случае гомогенизации в отсутствие стабилизаторов (SPS): к навеске неизмельченной ткани добавляли рабочий раствор аналитов с концентрацией HQC (табл. 1) из расчета 0,1 мкл на 1 мг ткани (0,2 мкл на 1 мг в случае глаз), а затем метанол в пропорциях 1:3 (мг образца тканей глаз : мкл метанола) и 1:1 для остальных органов (мг образца : мкл метанола) (за вычитанием объема добавленного рабочего раствора) (рис. 1 «Стабильность N-гидрокси-5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида в пробах биологического материала», опубликован на сайте журнала7). В ходе экспериментов проводили 6 циклов измельчения по 1 мин с интервалом 5 с вместо 2 циклов, рекомендованных при проведении описанной выше пробоподготовки. Содержание М1, TFISA и М2 сразу после гомогенизации в испытании SPS укладывалось в требуемый диапазон 85–115% от начальной концентрации.
Эффект матрицы также оценивали на гомогенатах каждого исследуемого органа и ткани. Было проанализировано по 6 образцов на нижнем и верхнем уровнях концентрации. RSD нормализованного матричного коэффициента (NMF) TFISA, M1 и M2 каждого изучаемого объекта не превышал 15% (табл. 2 «Оценка статистических характеристик методики количественного определения 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфаниламида и его метаболитов в гомогенатах образцов биологических тканей крыс», опубликована на сайте журнала8). Абсолютные значения NMF аналитов во всех матрицах были близки. Их расхождение составляло менее 15%.
Оценку селективности проводили на образцах каждого исследуемого объекта. На хроматограммах холостых проб пики идентифицировались только на MRM-переходах TFISA. Величина их площади составляла 1,5–12,5% от площади пика TFISA на соответствующей хроматограмме образца, содержащего аналиты на уровне НПКО. Хроматографических пиков в области времени удерживания метаболитов М1 и М2, а также THSA не обнаружено (рис. 2 «Примеры хроматограмм холостого образца печени крысы и печени образца, содержащего 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфаниламид и его метаболиты на уровне концентраций уровне нижнего предела количественного определения», опубликован на сайте журнала9). Относительная погрешность количественного определения анализируемых веществ на уровне НПКО в каждом изучаемом органе и ткани составляла ±20% от теоретического значения, коэффициент вариации рассчитанной концентрации не превышал 20% (табл. 3 «Оценка правильности и прецизионности метода количественного определения 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфаниламида и его метаболитов в гомогенатах образцов биологических тканей крыс», опубликована на сайте журнала10).
Линейность калибровочных кривых в экспериментах с использованием гомогенатов, полученных при добавке 10% раствора AA в объемном соотношении (раствор AA : гомогенат) 1:1, была доказана в диапазоне 20–20000 нг/г для TFISA, 2–2000 нг/г для M1 и 0,1–100,0 нг/г для M2 (табл. 211). Было проанализировано 6 серий образцов печени, поскольку на этой матрице было выполнено бóльшее количество валидационных тестов. Гомогенаты почек, сердца, селезенки, легких, мозга, кожи и мышц были использованы для проведения трех серий валидационных исследований (внутрисерийные исследования правильности и прецизионности, селективность, долгосрочная стабильность). Средние значения наклонов калибровочных кривых, полученных на образцах исследуемых биологических объектов, были близки (табл. 212).
Таким образом, по результатам испытаний селективности, линейности и эффекта матрицы значительных различий между гомогенатами разных органов, приготовленными с добавкой 10% раствора AA в объемном соотношении (раствор AA : гомогенат) 1:1, не выявлено, поэтому объем дальнейших валидационных тестов был сокращен.
Оценка внутрисерийной правильности и прецизионности методики осуществлена путем анализа 2 валидационных серий для каждого вида биоматериала (печени, почек, селезенки, сердца, легких, мозга, кожи и мышц). Среднее значение относительной погрешности количественного определения (δ) TFISA, M1 и M2 в пробах с концентрациями НПКО, LQC, MQC, HQC составляло ±15%. Значение RSD результатов на каждом уровне концентрации не превышало 15%. Межсерийная правильность и прецизионность рассчитана путем объединения данных, полученных в ходе всех 16 валидационных серий. Величина δ для TFISA составляла 0,73–2,42%, для M1 — 1,18–2,57%, для M2 — 0,90–1,89%. Значение RSD по результатам всех испытаний на каждом уровне концентрации не превышало 10,05% (табл. 313).
Метрологические характеристики методики сохранялись на требуемом уровне после двукратного разведения гомогенатов печени с концентрацией Dil (табл. 1) чистым гомогенатом. Величина δ для TFISA, M1 и М2 составила –3,11; –2,44; –1,45% соответственно, а значение RSD рассчитанных концентраций не превышало 15%. Воспроизводимость результатов при повторном введении оценивали на образцах печени. Серия данных проб была успешно проанализирована через 48 ч после первой инжекции (табл. 314).
Валидационные тесты для образцов глаза были проведены в полном объеме. Аналитический диапазон для определения TFISA, M1 и М2 составил 80–80000; 8–8000, 0,4–400,0 нг/г, соответственно. Результаты исследования селективности, прецизионности и правильности, эффекта разведения, воспроизводимости при повторном введении, эффекта матрицы соответствовали критериям приемлемости15 (табл. 4 «Результаты валидации методики определения 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида и его метаболитов в глазах крыс», опубликована на сайте журнала16).
Стабильность анализируемых веществ в метанольных гомогенатах с объемным соотношением 1:1 (раствор АА : гомогенат) в ходе валидационных тестов STS, FTS и ASS была подтверждена на образцах печени (табл. 5 «Исследование стабильности 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида и его метаболитов в гомогенатах органов крыс», опубликована на сайте журнала17). Относительная погрешность TFISA, M1 и M2 находились в пределах допустимого диапазона ±15%1. Результаты STS, FTS и ASS для образцов глаза (гомогенаты в соотношении 1:3 (масса ткани : объем метанола)) также были приемлемыми. Исследование стабильности в условиях длительного хранения (LTS) было успешно проведено для всех исследуемых органов и тканей. Качественные и количественные различия ферментативных систем и состава эндогенных соединений печени, почек, легких, головного мозга, сердца, селезенки, кожи, мышц, глаза не влияли на стабильность N-гидроксиметаболита.
Для исследования распределения TFISA в организме крыс были выбраны органы экскреции (печень и почки); органы с хорошей (сердце, легкие, селезенка), умеренной (мышцы), слабой васкуляризацией (кожа); места инстилляции и действия (глаза)18. Для оценки возможности проникновения через гематоэнцефалический барьер и взаимодействия с карбоангидразой в тканях центральной нервной системы проводили количественное определение аналитов в головном мозге крыс. Рассчитанные в ходе экспериментов значения фармакокинетических параметров изучаемых соединений представлены в таблице 6 «Фармакокинетические параметры 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида и его метаболитов в органах и тканях крыс» (опубликована на сайте журнала19).
TFISA хорошо распределяется по изучаемым органам и тканям. Tmax в исследуемых объектах, за исключением глаз и кожи, достигается через 12 ч после введения препарата (рис. 4a «Фармакокинетические кривые 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфаниламида в органах и тканях крыс», опубликован на сайте журнала20). Наибольшая концентрация TFISA в месте действия наблюдалась спустя 1 ч после введения, в течение последующего часа наблюдалось ее резкое снижение. Спустя 24–72 ч в пробах глаз фиксировались следовые количества TFISA, а спустя 72 ч содержание было ниже предела количественного определения методики (рис. 4b21). Наибольшая ft действующего вещества выявлена в тканях глаз, а также в селезенке. Высокие величины ft наблюдали в хорошо васкуляризированных органах — сердце и легких, низкие величины ft — в тканях с умеренным и слабым кровотоком — мышцах и коже (рис. 3).
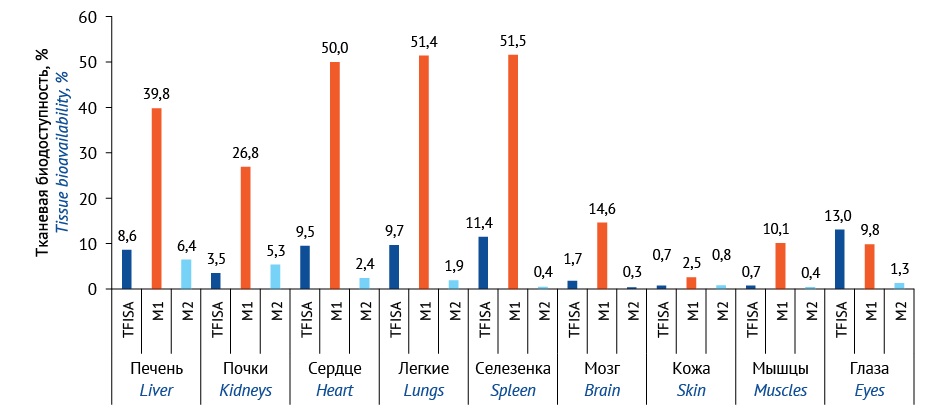
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 3. Тканевая биодоступность 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфаниламида и его метаболитов. TFISA — 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамид; M1 — N-гидрокси-5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамид; М2 — N-ацетил-5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамид
Fig. 3. Tissue bioavailability of TFISA and its metabolites. TFISA, 5-[ 5-(trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonamide; M1, N-hydroxy-5-[ 5-(trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonamide; M2, N-acetyl-5-[ 5-(trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonamide
Максимальная концентрация N-гидроксипроизводного TFISA в изучаемых биопробах, в том числе в месте введения, достигается спустя 12 ч после инстилляции. Раннего Tmax у М1 в глазах не наблюдалось, в отличие от М2 (рис. 5a «Фармакокинетические кривые метаболитов 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфаниламида в органах и тканях крыс», опубликован на сайте журнала22). Вероятно, ферментные системы данного органа не вносят значительный вклад в N-гидроксилирование сульфонамидной группы TFISA, следовательно, данный метаболит преимущественно образуется в печени. Значение ft М1 в органах и тканях в несколько раз выше, чем у действующего вещества. Лучше всего N-гидроксиметаболит проникает в органы с хорошей васкуляризацией и интенсивным кровотоком — селезенку, легкие и сердце. Величина ft N-гидроксипроизводного в печени и почках ниже: 39,8 и 26,8 соответственно. Основной метаболит также проходит через гематоэнцефалический барьер. Самое низкое значение ft для данного соединения наблюдали в коже. В глаза М1 проникает хуже, чем TFISA: величина ft М1 на ~30% ниже (табл. 623). Продолжительность периода полувыведения основного метаболита из изучаемых объектов также большая, за исключением глаз.
Величина Tmax N-ацетилпроизводного TFISA в большинстве изучаемых органов и тканей достигается в точке 12 ч (рис. 5b24), максимальная концентрация M2 в глазах достигается раньше — через 4 ч после инстилляции, а затем начинает резко снижаться (табл. 625) и через 24 ч М2 в месте введения не детектируется. Схожая ситуация наблюдалась в случае TFISA. Это может указывать на начало ацетилирования действующего вещества еще в тканях глаза. Так, в данном органе подтверждена высокая ферментативная активность как N-ацетилтрансферазы [23], так и S9-фракции [24]. После полного выведения из области нанесения суспензии ацетилирование TFISA продолжается в печени, поэтому М2 обнаруживается в пробах печени, почек, а также сердца и легких на протяжении всего эксперимента. M2 после образования распределяется по организму крыс хуже, чем TFISA и М1. Наибольшая величина ft у минорного метаболита наблюдалась в печени и почках. Значение ft в селезенке у М2 одно из самых низких, в отличие от TFISA и М1. Так же плохо N-ацетилметаболит проникает в мышцы и головной мозг. Период полувыведения N-ацетилпроизводного длительный только в органах, в которых наблюдали высокие величины ft более 1,9.
Для TFISA и его метаболитов характерен длительный период полувыведения из изученных органов и тканей, как и из биологических жидкостей [2]. Это вызвано накоплением в эритроцитах действующего вещества. Так, ft для крови у TFISA и у М1 составляет около 50, а у М2 — около 2 (рассчитано по данным [2][3]). Время достижения максимальной концентрации действующего вещества в исследуемых биообъектах наступало спустя 12 ч после введения (рис. 426), что значительно позже, чем в биологических жидкостях крыс. Вероятно, TFISA постепенно высвобождается из эритроцитов и проникает в органы и ткани, особенно с интенсивным кровотоком. В точке 12 ч также наблюдали Сmax метаболита М1, что связано с повышением экспозиции TFISA в печени (рис. 527). При этом N-гидроксиметаболит попадает в кровь и в хорошо васкуляризованные органы в сопоставимых количествах [2].
N-ацетилпроизводное, вероятно, образуется уже в месте инстилляции. Его накопление не происходит из-за сравнительно низкого сродства к эритроцитам и быстрого выведения с мочой. Так, максимальная скорость его ренальной экскреции приходилась на промежуток 4–12 ч после инстилляции [2]. Резкое падение концентрации и отсутствие М2 в пробах тканей глаз спустя 24 ч после введения (рис. 5b28) указывает на то, что N-ацетилметаболит не попадает обратно в ткани из системного кровотока. Величина ft М2 в хорошо васкуляризованных органах значительно ниже, чем у TFISA и М2. Наибольшая экспозиция данного соединения зафиксирована в органе образования — печени и органе выведения [2] — почках.
Таким образом, TFISA и его основной метаболит М1 интенсивно распределялись в ряд органов и тканей. В глазах концентрации действующего вещества свыше 3000 нг/г сохраняются в течение 12 ч после закапывания глазной суспензии. Фармакологический эффект сохраняется даже при следовых количествах TFISA в точке 24 ч [1], что позволяет использовать данный препарат 1 раз в сутки. Тканевая биодоступность М2 в соответствующих объектах хуже, чем у TFISA и М1. Наибольшее содержание N-ацетилметаболита выявлено в органах экскреции — печени и почках.
ЗАКЛЮЧЕНИЕ
Разработанные биоаналитические методики количественного определения TFISA и его метаболитов были успешно валидированы и использованы для определения содержания действующего вещества и его метаболитов в органах и тканях крыс. Установлена необходимость стабилизации проб путем немедленной обработки метанолом с последующим добавлением водных растворов аскорбиновой кислоты для предотвращения разложения N-гидрокси-5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфаниламида. Концентрации действующего вещества и его N-гидроксипроизводного в сердце, легких, селезенке, имеющих хорошую васкуляризацию и интенсивный кровоток, выше, чем в органах экскреции, что может быть связано с их накоплением в эритроцитах. Для лекарственных средств местного действия это является нежелательным явлением, однако в случае репозиционирования 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфаниламида длительный период полувыведения позволит увеличить интервалы между приемами. Для N-ацетилметаболита, который менее склонен к депонированию, наибольшее содержание наблюдали в печени и почках.
Таким образом, в рамках выполненного цикла исследований выявлены особенности фармакокинетики 5-[ 5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфаниламида у крыс при однократном введении. Задачами дальнейшего изучения являются оценка кумуляции данного соединения после многократного применения, а также изучение системной экспозиции на втором виде животного — кроликах.
Дополнительная информация. На сайте журнала «Регуляторные исследования и экспертиза лекарственных средств» размещены таблицы 2–6, рис. 1, 2, 4 и 5.
https://doi.org/10.30895/1991-2919-2025-743-annex
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: И.И. Яичков — разработка и валидация биоаналитической методики, анализ образцов биоматериала животных, статистическая обработка данных, написание текста рукописи; А.Л. Хохлов — критическое обсуждение и окончательное утверждение текста рукописи; М.К. Корсаков — критическое обсуждение и редактирование текста рукописи; Н.Н. Вольхин, С.С. Петухов, O.E. Лазарянц, А.В. Коровина — работа с лабораторными животными.
Соответствие принципам этики. Проведение исследования было одобрено этическим комитетом ЯГПУ им. К.Д. Ушинского (протокол № 2 от 10.10.2023).
Additional information. Tables 2–6, and Figures 1, 2, 4, 5 are published on the website of Regulatory Research and Medicine Evaluation.
https://doi.org/10.30895/1991-2919-2025-743-annex
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Ilya I. Yaichkov developed and validated the bioassay, analysed animal biomaterial samples, conducted statistical data processing, and drafted the manuscript. Alexander L. Khokhlov critically discussed the manuscript and approved the final version of the manuscript for publication. Mikhail K. Korsakov critically discussed and edited the manuscript. Nikita N. Volkhin, Sergey S. Petukhov, Olga E. Lazariants, and Alena V. Korovina worked with laboratory animals.
Ethics approval. This study was approved by the Ethics Committee at the Yaroslavl State Pedagogical University named after K.D. Ushinsky (Approval No. 2 of 10 October 2023).
1. Миронов АН, ред. Руководство по проведению доклинических исследований лекарственных средств. Ч. 1. М.: Гриф и К; 2012.
2. Решение Совета Евразийской экономической комиссии от 03.11.2016 № 85 «Об утверждении Правил проведения исследований биоэквивалентности лекарственных препаратов в рамках Евразийского экономического союза».
ICH guideline M10 on bioanalytical method validation and study sample analysis. ICH; 2022.
3. Были проведены все необходимые эксперименты для валидации хроматографических методик испытания.
4. Рекомендация Коллегии Евразийской экономической комиссии от 14.11.2023 № 33 «О Руководстве по работе с лабораторными (экспериментальными) животными при проведении доклинических (неклинических) исследований».
5. Беляева ЕВ, Гущин ЯА, Устенко ЖЮ. Рекомендации по проведению некропсии лабораторных животных. СПб.: Дом фармации; 2023.
6. https://cran.r-project.org/
7. https://doi.org/10.30895/1991-2919-2025-743-annex
8. https://doi.org/10.30895/1991-2919-2025-743-annex
9. https://doi.org/10.30895/1991-2919-2025-743-annex
10. https://doi.org/10.30895/1991-2919-2025-743-annex
11. https://doi.org/10.30895/1991-2919-2025-743-annex
12. https://doi.org/10.30895/1991-2919-2025-743-annex
13. https://doi.org/10.30895/1991-2919-2025-743-annex
14. https://doi.org/10.30895/1991-2919-2025-743-annex
15. Решение Совета Евразийской экономической комиссии от 03.11.2016 № 85 «Об утверждении Правил проведения исследований биоэквивалентности лекарственных препаратов в рамках Евразийского экономического союза».
ICH guideline M10 on bioanalytical method validation and study sample analysis. ICH; 2022.
16. https://doi.org/10.30895/1991-2919-2025-743-annex
17. https://doi.org/10.30895/1991-2919-2025-743-annex
18. Миронов АН, ред. Руководство по проведению доклинических исследований лекарственных средств. Ч. 1. М.: Гриф и К; 2012.
19. https://doi.org/10.30895/1991-2919-2025-743-annex
20. https://doi.org/10.30895/1991-2919-2025-743-annex
21. https://doi.org/10.30895/1991-2919-2025-743-annex
22. https://doi.org/10.30895/1991-2919-2025-743-annex
23. https://doi.org/10.30895/1991-2919-2025-743-annex
24. https://doi.org/10.30895/1991-2919-2025-743-annex
25. https://doi.org/10.30895/1991-2919-2025-743-annex
26. https://doi.org/10.30895/1991-2919-2025-743-annex
27. https://doi.org/10.30895/1991-2919-2025-743-annex
28. https://doi.org/10.30895/1991-2919-2025-743-annex
Список литературы
1. Хохлов АЛ, Шетнев АА, Корсаков МК, Федоров ВН, Тюшина АН, Вольхин НН, Вдовиченко ВП. Фармакологические свойства производных сульфонамидов — новых ингибиторов карбоангидразы. Бюллетень экспериментальной биологии и медицины. 2023;175(2):166–70. https://doi.org/10.47056/0365-9615-2023-175-2-166-170
2. Яичков ИИ, Хохлов АЛ, Корсаков МК, Вольхин НН, Петухов СС, Зайкова ВЕ, Лазарянц ОЭ. Изучение экскреции 5-[5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида на крысах. Регуляторные исследования и экспертиза лекарственных средств. 2025;15(3). https://doi.org/10.30895/1991-2919-2025-697
3. Chen M, Jin J, Ji X, Chang K, Li J, Zhao L. Pharmacokinetics, bioavailability and tissue distribution of chitobiose and chitotriose in rats. Bioresour Bioprocess. 2022;9(1):13. https://doi.org/10.1186/s40643-022-00500-y
4. Sheng Y-H, Siemiątkowska A, Kosicka-Noworzyń K, Brunetti L, Kagan L. A validated LC-MS/MS method for simultaneous quantitation of piperacillin, cefazolin, and cefoxitin in rat plasma and twelve tissues. J Pharm Biomed Anal. 2024;248:116259. https://doi.org/10.1016/j.jpba.2024.116259
5. Hu H, Xiao H, Bao H, Li M, Xue C, Li YT, et al. Tissue distribution comparison of six active ingredients from an Eucommiae cortex extract between normal and spontaneously hypertensive rats. Evid Based Complement Alternat Med. 2020;2020:2049059. https://doi.org/10.1155/2020/2049059
6. Körmöczi T, Szabó Í, Farkas E, Penke B, Janáky T, Ilisz I, Berkecz R. Heart-cutting two-dimensional liquid chromatography coupled to quadrupole-orbitrap high resolution mass spectrometry for determination of N,N-dimethyltryptamine in rat plasma and brain; Method development and application. J Pharm Biomed Anal. 2020;191:113615. https://doi.org/10.1016/j.jpba.2020.113615
7. Rosebooma IC, Thijssena B, Rosinga H, Alvesb F, Mondalc D, Teunissend MBM, et al. Development and validation of an HPLC-MS/MS method for the quantification of the anti-leishmanial drug miltefosine in human skin tissue. J Pharm Biomed Anal. 2021;207:114402. https://doi.org/10.1016/j.jpba.2021.114402
8. Eom HY, Jang S-I, Lee J-H. Development and validation of a bioanalytical method for 3'- and 6'-sialyllactose in minipig liver and kidney using liquid chromatography-tandem mass spectrometry and its application to analysis of tissue distribution. Molecules. 2020;25(23):5721. https://doi.org/10.3390/molecules25235721
9. Liang D, Wu Z, Liu Y, Li C, Li X, Yang B, Xie H, Sun H. HPLC-MS/MS-mediated analysis of the pharmacokinetics, bioavailability, and tissue distribution of schisandrol B in rats. Int J Anal Chem. 2021;2021:8862291. https://doi.org/10.1155/2021/8862291
10. Аладышева ЖИ, Беляев ВВ, Береговых ВВ, Бркич ГЭ, Грейбо СВ, Демина НБ и др. Промышленная фармация. Путь создания продукта. М.: Российская академия наук; 2019. EDN: KWJJUK
11. Попов НС, Гавриленко ДА, Балабаньян ВЮ, Петрова МБ, Донсков СА, Атаджанов ИБ, Шатохина НА. Количественное определение моноаминовых нейротрансмиттеров в гомогенатах головного мозга крыс с помощью ВЭЖХ-МС/МС. Фармакокинетика и фармакодинамика. 2022;(4):33–42. https://doi.org/10.37489/2587-7836-2022-4-33-42
12. Barbosa da Silva Pereira HA, de Lima Leite A, Charone S, Vaz Madureira Lobo JG, Cestari TM, Peres-Buzalaf C, et al. Proteomic analysis of liver in rats chronically exposed to fluoride. PLoS One. 2013;8(9):e75343. https://doi.org/10.1371/journal.pone.0075343
13. Хохлов АЛ, Яичков ИИ, Корсаков МК, Каграманян ИН, Вольхин НН, Петухов СС, Зайкова ВЕ. Разработка и валидация методики количественного определения моноаминовых нейромедиаторов и их метаболитов в тканях мозга крыс с помощью ВЭЖХ-МС/МС. Acta Biomedica Scientifica. 2024;9(1):177–91. https://doi.org/10.29413/ABS.2024-9.1.18
14. Plate AYA, Crankshaw DL, Gallaher DD. The effect of anesthesia by diethyl ether or isoflurane on activity of cytochrome P450 2E1 and P450 reductases in rat liver. Anesth Analg. 2005;101(4):1063–4. https://doi.org/10.1213/01.ane.0000166791.30963.ef
15. Коптяева КЕ, Мужикян АА, Гущин ЯА, Беляева ЕВ, Макарова МН, Макаров ВГ. Методика вскрытия и извлечения органов лабораторных животных (крысы). Лабораторные животные для научных исследований. 2018;(2):71–92. https://doi.org/10.29296/2618723X-2018-02-08
16. Liang Y, Wang L, Zhang R, Pan J, Wu W, Huang Y, et al. Determination of the metabolites and metabolic pathways for three β-receptor agonists in rats based on LC-MS/MS. Animals. 2022;12(15):1885. https://doi.org/10.3390/ani12151885
17. Popovic MM, Schlenker MB, Thiruchelvam D, Redelmeier DA. Serious adverse events of oral and topical carbonic anhydrase inhibitors. JAMA Ophthalmol. 2022;140(3):235–42. https://doi.org/10.1001/jamaophthalmol.2021.5977
18. Курышева НИ. Ингибиторы карбоангидразы в ле чении глаукомы. Обзор. Часть 2. Офтальмология. 2020; 17(4):676–82. https://doi.org/10.18008/1816-5095-2020-4-676-682
19. Gu X-F, Mao B-Y, Xia M, Yang Y, Zhang J-L, Yang D-S, et al. Rapid, sensitive and selective HPLC–MS/MS method for the quantification of topically applied besifloxacin in rabbit plasma and ocular tissues: Application to a pharmacokinetic study. J Pharm Biomed Anal. 2016;117:37–46. https://doi.org/10.1016/j.jpba.2015.08.023
20. Kim E, Jang E, Jung W, Kim W, Lee J, Choi DH, et al. Establishment of an LC-MS/MS method for quantification of lifitegrast in rabbit plasma and ocular tissues and its application to pharmacokinetic study. J Chromatogr B Analyt Technol Biomed Life Sci. 2023;1229:123892. https://doi.org/10.1016/j.jchromb.2023.123892
21. Amo EM, Hammid A, Tausch M, Toropainen E, Sadegh A, Valtari A, et al. Ocular metabolism and distribution of drugs in the rabbit eye: Quantitative assessment after intracameral and intravitreal administrations. Int J Pharm. 2022;613:121361. https://doi.org/10.1016/j.ijpharm.2021.121361
22. Яичков ИИ, Корсаков МК, Вольхин НН, Петухов СС, Тюшина АН, Зайкова ВЕ, Лазарянц ОЭ. Изучение фармакокинетики нового производного 4,5-дигидроизоксазол-5-карбоксамида на крысах. Разработка и регистрация лекарственных средств. 2024;13(4):238–50. https://doi.org/10.33380/2305-2066-2024-13-4-1876
23. Al-Ghananeem AM, Crooks PA. Phase I and Phase II ocular metabolic activities and the role of metabolism in ophthalmic prodrug and codrug design and delivery. Molecules. 2007;12(3):373–88. https://doi.org/10.3390/12030373
24. Argikar UA, Dumouchel JL, Dunne CE, Saran C, Cirello AL, Mithat G. Ocular metabolism of levobunolol: Historic and emerging metabolic pathways. Drug Metab Dispos. 2016;44(8):1304–12. https://doi.org/10.1124/dmd.116.070458
Об авторах
И. И. ЯичковРоссия
Яичков Илья Игоревич, канд. фарм. наук
ул. Республиканская, д. 108/1, Ярославль, 150000
А. Л. Хохлов
Россия
Хохлов Александр Леонидович, д-р мед. наук, профессор, академик РАН
ул. Революционная, д. 5, Ярославль, 150000
М. К. Корсаков
Россия
Корсаков Михаил Константинович, д-р хим. наук, доцент
ул. Республиканская, д. 108/1, Ярославль, 150000
Н. Н. Вольхин
Россия
Вольхин Никита Николаевич
ул. Республиканская, д. 108/1, Ярославль, 150000
ул. Революционная, д. 5, Ярославль, 150000
С. С. Петухов
Россия
Петухов Сергей Станиславович
ул. Республиканская, д. 108/1, Ярославль, 150000
О. Э. Лазарянц
Россия
Лазарянц Ольга Эммануиловна
ул. Республиканская, д. 108/1, Ярославль, 150000
А. В. Коровина
Россия
Коровина Алена Вадимовна
ул. Республиканская, д. 108/1, Ярославль, 150000
Дополнительные файлы

|
1. таблицы 2–6, рис. 1, 2, 4 и 5 | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(1MB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Яичков И.И., Хохлов А.Л., Корсаков М.К., Вольхин Н.Н., Петухов С.С., Лазарянц О.Э., Коровина А.В. Изучение распределения 5-[5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида и его метаболитов на крысах. Регуляторные исследования и экспертиза лекарственных средств. 2025;15(3):301-312. https://doi.org/10.30895/1991-2919-2025-743
For citation:
Yaichkov I.I., Khokhlov A.L., Korsakov M.K., Volkhin N.N., Petukhov S.S., Lazariants O.E., Korovina A.V. Distribution Study of 5-[5-(trifluoromethyl)-1,2-oxazole-3-yl]-furan-2-sulfonamide and Its Metabolites in Rats. Regulatory Research and Medicine Evaluation. 2025;15(3):301-312. (In Russ.) https://doi.org/10.30895/1991-2919-2025-743



































