Перейти к:
Интерпретация данных токсикологических исследований лекарственных средств при определении дозы, не вызывающей видимых нежелательных эффектов (NOAEL)
https://doi.org/10.30895/1991-2919-2025-15-3-262-277
Резюме
ВВЕДЕНИЕ. Токсикологические исследования лекарственных средств на лабораторных животных — обязательный этап оценки риска применения лекарственных средств, направленный на выявление токсических эффектов, их потенциальной обратимости и зависимости от дозы и (или) системной экспозиции. Основным количественным результатом токсикологических исследований является доза, не вызывающая видимых нежелательных эффектов (NOAEL). Ключевым практическим применением NOAEL является выбор стартовой дозы для ранних фаз клинических исследований. Для выбора NOAEL необходимо четко определить, какие именно изменения следует считать нежелательными. Дизайн токсикологического исследования является сложным и включает в себя широкий спектр оцениваемых параметров: физиологических, инструментальных, клинико-лабораторных, патоморфологических. По окончании эксперимента накапливается большой массив данных, который требуется проанализировать и дать научно обоснованную оценку обнаруженным изменениям.
ЦЕЛЬ. Разработка комплексного подхода к интерпретации данных токсикологических исследований лекарственных средств, направленного на повышение объективности при установлении дозы NOAEL.
ОБСУЖДЕНИЕ. Ввиду отсутствия терминологической строгости в описании дозы NOAEL в работе предпринята попытка по унификации этого термина. Отдельное внимание уделено вопросу биологической значимости наблюдаемых изменений, а также описанию критериев для определения их нежелательности. Разработанная схема интерпретации экспериментальных данных включает три последовательных этапа: анализ взаимосвязи между наблюдаемым эффектом и введением тестируемого объекта; оценка размера эффекта и (или) степени изменений; определение характера выявленных изменений с точки зрения их нежелательности, включая оценку их обратимости, фармакодинамической приемлемости, возможности развития адаптационной реакции и др. Ключевым элементом предложенной методологии является принцип весомости доказательств (Weight-of-Evidence), который позволяет ранжировать выявленные нежелательные эффекты по их значимости и интегрировать их в единую систему оценки.
ВЫВОДЫ. Разработанный комплексный подход, основанный на многофакторном анализе данных (включая количественные и качественные показатели) и принципе оценки весомости доказательств, может повысить объективность оценки наблюдаемых эффектов и определении дозы, не вызывающей видимых нежелательных эффектов (NOAEL).
Ключевые слова
Для цитирования:
Крышень К.Л., Гущин Я.А., Фаустова Н.М., Гущина С.В., Устенко Ж.У., Кательникова А.Е., Султанова К.Т., Матичин А.А., Вавилова В.А., Муразов Я.Г., Мирошников М.В., Ковалева М.А., Шубин Д.В., Макаров В.Г., Макарова М.Н. Интерпретация данных токсикологических исследований лекарственных средств при определении дозы, не вызывающей видимых нежелательных эффектов (NOAEL). Регуляторные исследования и экспертиза лекарственных средств. 2025;15(3):262-277. https://doi.org/10.30895/1991-2919-2025-15-3-262-277
For citation:
Kryshen K.L., Gushchin Ya.A., Faustova N.M., Gushchina S.V., Ustenko Zh.Yu., Katelnikova A.E., Sultanova K.T., Matichin A.A., Vavilova V.A., Murazov Ya.G., Miroshnikov M.V., Kovaleva M.A., Shubin D.V., Makarov V.G., Makarova M.N. Interpretation of toxicological research data in establishing the no observed adverse effect level (NOAEL) for medicinal products. Regulatory Research and Medicine Evaluation. 2025;15(3):262-277. (In Russ.) https://doi.org/10.30895/1991-2919-2025-15-3-262-277
ВВЕДЕНИЕ
Токсикологические исследования с использованием лабораторных животных являются неотъемлемой частью комплексного изучения безопасности новых лекарственных средств и позволяют оценить потенциальные риски при первом клиническом применении у человека. Для оригинального лекарственного средства необходимо провести широкий спектр исследований безопасности, включая изучение общетоксических свойств при однократном и многократном введении, фармакологической безопасности, репродуктивной токсичности, специфических видов токсичности1. Основной целью исследований безопасности является выявление токсических эффектов, их потенциальной обратимости и зависимости от дозы и (или) системной экспозиции. Полученная информация в дальнейшем используется для определения безопасного диапазона доз при проведении ранних фаз клинических исследований и параметров клинического мониторинга потенциальных нежелательных реакций.
Наиболее важным количественным результатом исследований безопасности является NOAEL (no observed adverse effect level) — доза, не вызывающая видимых нежелательных эффектов. Этот показатель дополняет такие классические параметры, как терапевтический индекс (ТИ = ЛД50/ЕД50) и широта терапевтического действия, обеспечивая более комплексную оценку рисков. Классический ТИ отражает результат острой токсичности, связанной с летальным исходом, и не учитывает нежелательные эффекты, возникающие ниже порога летальности, — функциональные нарушения, хронические токсические реакции или органоспецифические повреждения. В отличие от ТИ, NOAEL определяет максимальную дозу, при которой отсутствуют все видимые нежелательные эффекты, включая сублетальные и долгосрочные. Это позволяет установить «нижнюю границу» токсического диапазона, критически важную для расчета широты терапевтического действия — интервала между минимальной эффективной дозой и дозой, вызывающей первые токсические проявления (близкой к NOAEL).
Практическим применением NOAEL для оригинальных лекарственных средств является расчет стартовой дозы для первой фазы клинических исследований2. Дозу NOAEL также используют для оценки рисков при производстве лекарственных средств, в частности расчете допустимых пределов воздействия химических субстанций на здоровье человека, уровня PDE (допустимая ежедневная экспозиция, permitted daily exposure)3.
Следует отметить отсутствие терминологической строгости в описании дозы NOAEL. Так, в Руководстве по проведению доклинических исследований лекарственных средств4 NOAEL определяется как доза без наблюдаемого отрицательного эффекта, в ГОСТ Р 56701-20155 используется понятие высокой нетоксической дозы, в решении Совета Евразийской экономической комиссии (ЕЭК) № 786 NOAEL описывается как уровень невыявления нежелательного воздействия, в решении Коллегии ЕЭК № 2027 — как доза, не оказывающая явного нежелательного эффекта, в решении Коллегии ЕЭК № 18 — как доза, не оказывающая видимого нежелательного эффекта. В открытых источниках литературы также встречается интерпретация NOAEL как дозы, не вызывающей видимых побочных эффектов, дозы без наблюдаемых нежелательных эффектов и др. Все вышеперечисленные определения отражают суть этого уровня доз и фактически представляют разные варианты перевода англоязычного термина.
Необходимо предпринять попытку унификации рабочего определения термина NOAEL, который дословно переводится как «доза без наблюдаемых неблагоприятных эффектов». В Федеральном законе Российской Федерации от 12.04.2010 № 61-ФЗ «Об обращении лекарственных средств» дается определение таким терминам, как «побочное действие» и «нежелательная реакция». Побочное действие может иметь как терапевтическую ценность, так и негативные последствия для организма. Например, седативный эффект, возникающий при применении H1-антигистаминных препаратов первого поколения, может быть целенаправленно использован в качестве дополнительного снотворного действия. Нежелательная реакция — это непреднамеренная неблагоприятная реакция организма, которая может быть связана с применением лекарственного препарата. С этой точки зрения термин «нежелательная реакция» точнее отражает именно негативные последствия приема лекарственного средства, в отличие от более общего термина «побочное действие», который может включать и полезные эффекты препарата.
Нежелательная реакция и нежелательный эффект — также разные, хотя и связанные понятия. Вариант с «реакцией» чуть менее точен, так как в контексте определения безопасной дозы важнее говорить именно об эффекте как итоге воздействия. Термин «видимые» в определении NOAEL отражает нежелательные эффекты, которые могут быть зафиксированы при визуальном осмотре или с помощью базовых диагностических методов, фокусируясь на наиболее очевидных и значимых проявлениях токсического действия, включая маркеры явной токсичности (клинические признаки, макро- и микроскопические поражения), суррогатные маркеры токсичности (например, уровень ферментов печени в сыворотке), а также маркеры чрезмерных фармакодинамических эффектов.
Таким образом, NOAEL целесообразно определить как дозу, не вызывающую видимых нежелательных эффектов.
При рассмотрении термина NOAEL критическим является вопрос, какой уровень воздействия в эксперименте следует считать нежелательным, а какой нет. Нежелательным эффектом называют связанное с тестируемым объектом изменение морфологии, физиологии, роста, развития, репродуктивной функции или продолжительности жизни тест-системы, которое приводит к ухудшению функциональной способности поддерживать гомеостаз и/или ухудшению способности реагировать на дополнительные нагрузки со стороны окружающей среды [1]. В Руководстве Управления по контролю за качеством продуктов питания и лекарственных средств (FDA) по выбору стартовой дозы в клинических исследованиях подчеркивается, что нежелательным эффектом является такой эффект, который был бы неприемлемым при первом применении препарата у человека9.
В токсикологических исследованиях нередко можно наблюдать изменения отдельных параметров по сравнению с контрольной группой, но лишь часть из них можно отнести к категории действительно нежелательных. Например, гипогликемию, индуцированную введением инсулина здоровым животным, можно считать ожидаемым фармакодинамическим эффектом. Незначительное повышение активности печеночных ферментов c сохранением нормальной архитектоники печени может отражать адаптационные процессы, связанные с метаболизмом лекарственного средства, и тоже не учитываться при определении NOAEL. В то же время выраженные гистологические изменения (такие как некроз гепатоцитов даже при отсутствии статистически значимых изменений в активности печеночных ферментов) могут свидетельствовать о токсическом воздействии и служить ключевым основанием для установления NOAEL.
Отсутствие четких критериев нежелательности при оценке токсикологического профиля тестируемого объекта затрудняет интерпретацию данных, что подтверждается продолжающимися дискуссиями на международных симпозиумах и в научной литературе. R. Lewis и соавт. [2] предложили поэтапную методологию выявления нежелательных эффектов, которая в дальнейшем была дополнена и развита другими авторами [3–7].
При анализе существующих подходов к оценке NOAEL обращает на себя внимание отсутствие четкого разграничения между количественными и качественными данными. В работе V. Kale и соавт. [7] были выделены ключевые аспекты и критерии выявления нежелательных токсикологических эффектов. Однако некоторым вопросам, на наш взгляд, уделяется недостаточно внимания, в частности обсуждению биологической значимости выявляемых отличий, поскольку ряд источников определяют дозу NOAEL как наивысший уровень воздействия, при котором не наблюдается статистически или биологически значимого увеличения частоты и (или) тяжести неблагоприятных эффектов в сравнении с соответствующим контролем [2][3]. Остается неясным, что именно подразумевается под биологически значимым эффектом, означает ли это, что статистически незначимые отличия необходимо учитывать при оценке нежелательности выявленных эффектов? Неоднозначность трактовки биологической значимости создает методологические сложности при анализе и интерпретации статистически незначимых отличий, а также при определении критериев нежелательности при оценке токсикологического риска.
Вопросы оценки биологической значимости наравне с оценкой нежелательности эффектов являются, по всей видимости, наиболее дискуссионными и требуют междисциплинарного подхода.
Цель работы — разработка комплексного подхода к интерпретации данных токсикологических исследований лекарственных средств, направленного на повышение объективности при установлении дозы NOAEL.
ОСНОВНАЯ ЧАСТЬ
Определение взаимосвязи между наблюдаемым эффектом и введением тестируемого объекта. Биологическая значимость изменений
Ключевым экспериментом, позволяющим получить основную информацию о потенциальных нежелательных эффектах лекарственного средства, является исследование токсичности при многократном введении10. В зависимости от планируемого курса клинического применения длительность эксперимента может составлять от 2 нед. до 9 мес. и более. В исследованиях общетоксических свойств рекомендуется испытание как минимум трех доз. При этом дозы выбираются тщательно, исходя из предположения, что у животных, подвергшихся воздействию низкой дозы, не проявится никакого эффекта по сравнению с контролем, а высокая доза будет обеспечивать достаточный уровень токсического воздействия без избыточной гибели животных [8].
Все получаемые в ходе эксперимента данные можно разделить на количественные и качественные (рис. 1). Количественные данные могут быть представлены непрерывными (масса тела, массовые коэффициенты, биохимические или гематологические параметры и др.), а также дискретными (количество павших животных, количество животных с тем или иным признаком и др.) данными. Качественные данные подразделяют на номинальные (картина интоксикации, гистологические находки и др.), порядковые (степень изменений и баллы гистологического исследования), бинарные (наличие или отсутствие какого-либо признака/исхода).
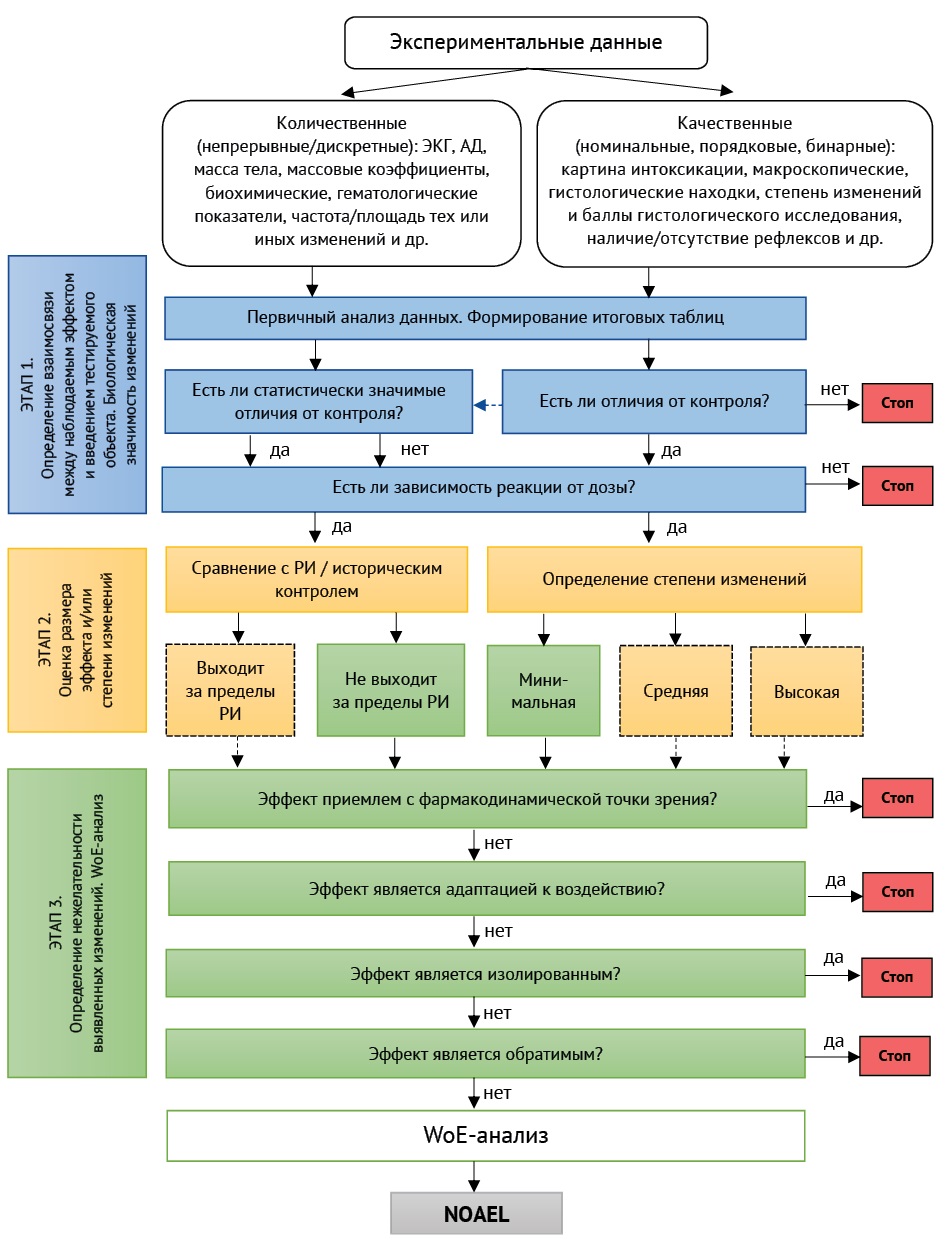
Рисунок подготовлен авторами / The figure is prepared by the authors
Рис. 1. Возможная схема определения нежелательных эффектов и выбора NOAEL в токсикологических исследованиях. ЭКГ — электрокардиограмма, АД — артериальное давление, РИ — референтные интервалы, WoE-анализ — Weight-of-Evidence-анализ, анализ весомости доказательств
Fig. 1. A possible scheme for determining adverse effects and selecting NOAEL in toxicological studies. ECG — electrocardiogram, BP — blood pressure, RI — reference intervals, WoE analysis — Weight-of-Evidence analysis
Количественные данные. Для каждого оцениваемого показателя исследователь вычисляет точечную и интервальную оценку в зависимости от типа и распределения данных и формирует итоговые таблицы, объединенные по соответствующим разделам.
Несмотря на все усилия получить максимально гомогенные группы животных по возрасту, массе тела, клиническому состоянию, исследователи могут столкнуться с экстремально низкими или высокими значениями отдельных клинико-лабораторных показателей (выбросами), которые отличаются от основной выборки. Существует множество причин возникновения выбросов, включая ошибку измерения, ошибку выборки, неправильную регистрацию или неверную спецификацию предположений о распределении. Выбросы могут быть определены путем визуальной оценки первичных данных, однако решение об исключении результатов нужно принимать, опираясь на специальные статистические критерии, например критерий Граббса [9]. В случае если экстремальные показатели обнаружены и при оценке других связанных параметров, это может указывать на наличие индивидуальной чувствительности к токсическому воздействию лекарственного препарата, и данные этого животного необходимо учитывать при интерпретации полученных данных.
Неотъемлемой частью любого исследования является проверка статистических гипотез. На этапе подготовки плана (протокола) исследования необходимо установить критический уровень значимости α (как правило, 0,05), а также мощность (1–β), обычно принимаемую за 80%. Выбор подходящего статистического метода зависит от цели и задач исследования, типа и распределения данных, а также характера наблюдений. В данной публикации не представлено описание статистических подходов, однако важно подчеркнуть необходимость грамотного планирования и выполнения статистического анализа, от которого во многом зависит обоснованность сделанных выводов [10].
После проведения статистического анализа необходимо оценить дозозависимый характер реакции. Так, большинство авторов пришли к выводу, что ключевым фактором, который может свидетельствовать о непосредственном воздействии лекарственного препарата на организм животного, является наличие прямой зависимости реакции от дозы. При этом верно и обратное: отсутствие прямой зависимости реакции от дозы является достаточным аргументом, чтобы не считать обнаруженные изменения следствием введения тестируемого объекта [2][3][7].
В представленном примере (табл. 1) дозозависимое повышение активности аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ) и уровня билирубина свидетельствует о воздействии тестируемого объекта на организм животных. В то же время статистически значимые изменения уровня общего белка в группе животных, получивших исследуемый препарат в низкой дозе, вероятно, не имеют причинно-следственной связи с исследуемым воздействием, так как не демонстрируют прямого дозозависимого эффекта.
Таблица 1. Пример оценки зависимости изменений биохимических параметров от дозы тестируемого лекарственного средства при проведении токсикологического исследования на крысах, M±SD (среднее значение ± стандартное отклонение), n=5
Table 1. Example of assessing the relationship between changes in biochemical parameters and the dose of the tested pharmaceutical agent during a toxicological study in rats, M±SD (mean ± standart deviation), n=5
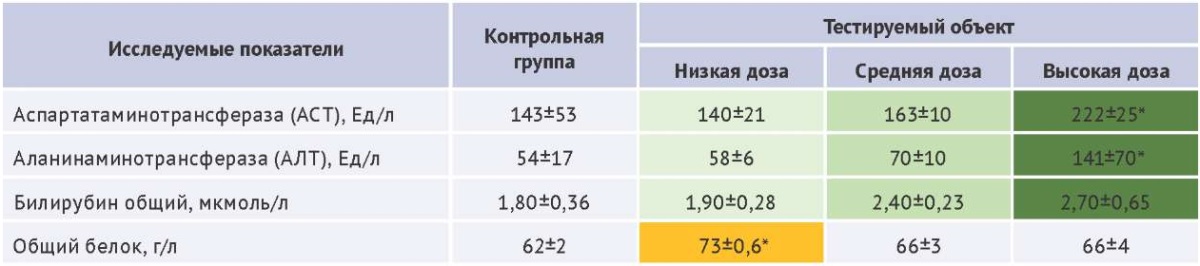
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
* Однофакторный дисперсионный анализ ANOVA, критерий Даннета, отличия статистически значимы в сравнении с контрольной группой, p<0,05
Применение этого простого правила допустимо только при линейной фармакокинетике. Для подтверждения взаимосвязи между эффектом и экспозицией тестируемого объекта необходимо включать в дизайн исследования оценку ключевых токсикокинетических параметров, таких как площадь под фармакокинетической кривой (AUC) и (или) максимальная концентрация в плазме (Cmax). Это позволит установить взаимосвязь между концентрацией препарата в плазме крови и частотой возникновения или тяжестью наблюдаемого эффекта, что критически важно для правильной интерпретации полученных результатов.
Однако следует учитывать, что подобный подход может быть некорректным и привести к ложным выводам. Известно, что для некоторых соединений зависимость «доза–эффект» может иметь нелинейную форму, обратную дозозависимость, приближаться к U-образной или перевернутой U-образной кривой. Такие немонотонные зависимости характерны, например, для многих гормонов и так называемых эндокринных дизрапторов [11]. В таких случаях требуется комплексный подход к анализу данных с учетом возможных нелинейных зависимостей.
Качественные данные. На схеме, представленной на рисунке 1, возможность статистической обработки качественных данных обозначена пунктиром, поскольку в ряде ситуаций (например, при регистрации гибели животных) достаточно констатации самого факта наличия этих изменений в экспериментальных группах, чтобы сделать вывод о влиянии исследуемого объекта.
Для статистического анализа качественных данных применяются специализированные методы, включая частотный и регрессионный анализ, анализ времени до наступления событий. Приемлемо использование порядковых шкал, позволяющих ранжировать выраженность эффекта (например, от минимальных до тяжелых изменений) на основе интенсивности отдельных признаков. Например, для анализа гистопатологических изменений широко используют балльные шкалы оценки степени (0 — нет, 1 — минимальное, 2 — слабое, 3 — умеренное и 4 — выраженное) или доли пораженной ткани (0 — норма, 1 — ≤25%, 2 — 26–50%, 3 — 51–75%, 4 — >75%).
Важно учитывать, что при гистологическом исследовании органов и тканей лабораторных животных встречается достаточно много различных отклонений от нормы, причем некоторые могут быть отнесены к фоновым патологиям, напрямую не связанным с воздействием тестируемого объекта. Поэтому для корректной интерпретации результатов необходимо тщательно дифференцировать вызванные препаратом изменения от фоновых патологий.
Среди фоновой патологии у лабораторных животных можно выделить: возрастные изменения — патологические изменения, частота которых коррелирует со старением организма; спонтанные изменения — нарушения, не связанные с внешними факторами (включая возраст); изменения, индуцированные манипуляциями (прижизненными процедурами (внутримышечные инъекции, травматизация кожи при бритье и др.), использованием вспомогательных веществ (крахмальная взвесь, масла, твин и другие носители для введения тестируемых объектов), эвтаназией.
Спектр ассоциированной с возрастом патологии у мелких лабораторных грызунов затрагивает все органы и системы организма, включая дыхательную, сердечно-сосудистую, мочевыделительную, репродуктивную, пищеварительную системы. Так, например, к наиболее частым возрастным патологиям лабораторных крыс относят хроническую прогрессирующую нефропатию [12], а также злокачественные новообразования [13][14]. Патологические изменения, связанные с возрастом, необходимо учитывать в первую очередь в хронических экспериментах длительностью 6 и более месяцев. Спонтанные патологии характерны для всех видов лабораторных животных [15]. В частности, R. Chamanza и соавт. проведено большое ретроспективное исследование с целью определения частоты и диапазона спонтанных проявлений патологии у яванских макак, которых широко используют в качестве релевантной тест-системы в исследованиях безопасности большинства моноклональных антител и многих генотерапевтических лекарственных средств. Наиболее частой находкой были лимфоплазмоцитарные инфильтраты, наблюдавшиеся в печени, почках, сердце, слюнных железах и желудке. Частыми дегенеративными нарушениями являлись локализованные жировые изменения в печени, дегенерация миокарда, а также минерализация и пигментные отложения в различных тканях [16].
Для того чтобы определить, относятся ли выявленные изменения к возрастным или спонтанным патологиям, необходимо сравнить частоту этих изменений с данными литературы или, что корректнее, с внутрилабораторными нормами (историческим контролем). В литературе крайне редко встречаются данные по частоте встречаемости спонтанных патологий, исследование [16] является редким исключением, и зачастую обзоры ограничены только описанием. В этой связи возникает необходимость накапливать собственные данные и формировать внутрилабораторные нормы по частоте встречаемости возрастных и спонтанных патологий у разных видов лабораторных животных.
Экспериментальные манипуляции, включая стандартные процедуры введения исследуемых препаратов, эвтаназии и др., часто становятся источником артефактов, которые необходимо учитывать при интерпретации данных. Так, используемые в эксперименте способы введения лекарственных средств животным могут приводить к повреждению тканей вследствие простого механического воздействия, например при внутримышечном или эндотрахеальном введении. Воздействие углекислого газа как гуманного метода эвтаназии грызунов приводит к постмортальному развитию отека и геморрагиям в тканях легких [17].
Вспомогательные компоненты и носители также способны вызывать неспецифические патологические изменения. Например, оливковое масло, используемое в качестве носителя, может длительное время сохраняться в тканях организма и вызывать образование липогранулем, причем эти образования могут появляться не только в месте введения, но и в отдаленных от него областях [18]. Адъюванты на основе гидроксида алюминия вызывают локальное воспаление в месте инъекции, что является частью иммунологического механизма действия [19]. Такие фоновые изменения могут затруднять интерпретацию полученных данных.
Включение в дизайн исследования дополнительных контрольных групп, таких как интактная группа (без введения объектов), группа плацебо (введение вспомогательных компонентов без активного вещества), позволяют оценить вклад экспериментальных процедур, носителей или вспомогательных компонентов в наблюдаемые эффекты, снижая возможность ложной интерпретации.
Для подтверждения причинно-следственной связи между введением исследуемого препарата и патоморфологическими изменениями, как и в случае с количественными данными, требуется установить зависимость между дозой и выраженностью выявленных патологических изменений, оценить, как частоту их возникновения, так и степень тяжести. В таблице 2 представлен пример оценки взаимосвязи эффекта (с применением простой полуколичественной шкалы) с введением тестируемого объекта для гистопатологических изменений почек, встречающихся как спонтанная фоновая патология и в контрольной группе животных. В предложенном примере наблюдается дозозависимое увеличение частоты и степени тяжести патологии, что указывает на взаимосвязь эффекта с введением лекарственного средства.
Таблица 2. Пример оценки зависимости частоты и тяжести гистологических изменений почек крыс от дозы тестируемого лекарственного средства при проведении токсикологического исследования
Table 2. Example of assessing the dose-dependent relationship between the frequency and severity of renal histological changes and the tested pharmaceutical agent in a rat toxicological study.
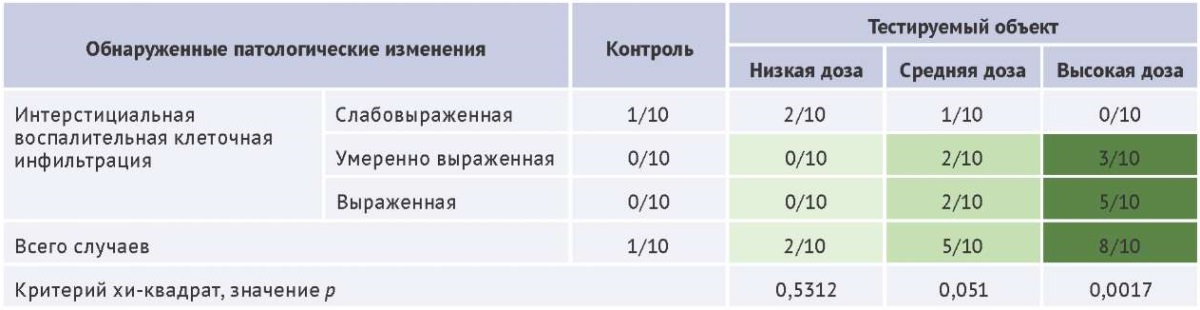
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
В завершение обсуждения данного этапа следует отметить, что даже при отсутствии статистически значимых различий выявленные тенденции требуют особого внимания. Как следует из данных, представленных в таблице 1, концентрация билирубина, а также активность АЛТ и АСТ демонстрируют дозозависимый рост. При этом для билирубина статистическая значимость изменений не была достигнута при введении ни одной из исследуемых доз (критический уровень значимости p>0,05). Подобные тенденции, даже при p>0,05, требуют тщательного анализа, так как их комбинация может свидетельствовать о гепатотоксических свойствах исследуемого лекарственного средства. Совокупное повышение трех биохимических маркеров позволяет предположить определенное влияние на функциональную активность печени.
Аналогичная ситуация наблюдается и во втором примере: в группе животных, которым вводили среднюю дозу, частота патологических изменений не отличалась статистически от контроля (p>0,05), однако их выраженность (тяжесть) возрастала. Даже при отсутствии значимых различий между группами прогрессирование морфофункциональных нарушений требует оценки в контексте их потенциальной опасности.
Все наблюдаемые статистически значимые и незначимые изменения, которые связаны с воздействием лекарственного средства, необходимо учитывать как биологически значимые в контексте дальнейшей оценки их нежелательности. Под термином «биологическая значимость» понимается такая реакция организма, которая оказывает существенное или заслуживающее внимания влияние (положительное или отрицательное) на благополучие биологической тест-системы [2].
Для доказательства биологической значимости выявленных изменений необходимо строго придерживаться принципа дозовой зависимости и (или) воспроизводимости результатов в независимых сериях экспериментов. Так, при невозможности однозначно истолковать полученные результаты целесообразно инициировать последующее подтверждающее исследование. Обнаружив выраженное (не всегда статистически подтвержденное) отличие от контроля в группе воздействия, исследователь может разработать дизайн эксперимента, направленный на проверку конкретной гипотезы о значимости интересующего изменения с учетом предполагаемого эффекта и необходимой мощности анализа. Подобный подход хотя и является более затратным, позволит с большей уверенностью судить о полученных результатах и с большей объективностью оценивать риски клинического применения.
Таким образом, на первом этапе представленного подхода к интерпретации данных токсикологических исследований требуется определить биологически значимые изменения. Ключевым фактором при выборе этих изменений является оценка прямой зависимости реакции от дозы.
При этом статистическая значимость не всегда является обязательным условием для выбора биологически значимых отличий, поскольку обнаруженные тенденции могут являться следствием патологических изменений в ответ на введение лекарственного средства или быть предиктором более серьезных нарушений, которые могут возникнуть с увеличением дозы или длительности введения.
На втором этапе с целью первичной оценки потенциальной нежелательности выявленных биологически значимых эффектов необходимо определить величину (размер эффекта) или выраженность выявленных изменений.
Оценка размера эффекта и (или) степени изменений
Определение размера эффекта для количественных (непрерывных) данных или степени выраженности изменений качественных показателей представляет собой важнейший этап в оценке нежелательности выявленных эффектов. Данная задача является методологически сложной и дискуссионной. В качестве примера можно привести снижение массы тела на 20%, которое является достаточно надежным интегральным критерием, указывающим на значительное ухудшение состояния животного, и часто используется в качестве гуманной конечной точки во многих экспериментах [20]. С другой стороны, только существенное (в 2–4 раза) увеличение активности АЛТ (в совокупности с другими биомаркерами) у грызунов будет указывать на развитие гепатотоксических эффектов11. Для большинства параметров отсутствуют четкие критерии, что сильно усложняет интерпретацию результатов и требует разработки специальных подходов.
В области клинических исследований и метаанализа для оценки размера эффекта широкое распространение получили специальные математические подходы с использованием стандартизованной разницы средних (SMD), коэффициентов d Коэна, g Хеджеса, дельты Гласса и др. Используя категориальные правила оценки числовых значений относительного размера эффекта (например, для d коэффициента Коэна — малый 0,2; средний 0,5; большой 0,8; очень большой 1,3), можно судить о клинической эффективности лечения [21].
В доклинических исследованиях как эффективности, так и безопасности лекарственных средств подобные подходы не распространены. В частности, ряд авторов обоснованно утверждает, что в биомедицинских исследованиях с участием животных требуется разработка собственных категориальных оценок размера эффекта [22]. Тем не менее существуют некоторые простые приемы по оценке размера эффекта, которые удобно использовать в рутинной практике. Например, для определения порога нежелательности выявленных изменений в исследованиях безопасности возможно использование данных исторического контроля. Так, А. Kobayashi и соавт. предлагают провести сравнение данных экспериментальной группы с данными исторического контроля c помощью t-теста, а также убедиться, что все значения в экспериментальной группе лежат в пределах референтного интервала [23]. К подобному подходу нужно относиться с осторожностью, чтобы не исключить действительно значимые отличия [7]. Необходимо учитывать, что исторический контроль не описывает реальную исследуемую группу (как в случае с параллельной контрольной группой), и выборка может отличаться по условиям содержания, кормления, сезону, количеству манипуляций и др. [24].
Для более объективной и надежной интерпретации данных в испытательном центре необходимо вести отдельную работу по накоплению и систематизации данных контрольных групп у разных видов лабораторных животных с учетом линии, возраста, пола, сезона наблюдения. Референтные интервалы должны устанавливаться каждой лабораторией самостоятельно, так как зависят от преаналитического этапа, пробоподготовки, приборов, на которых проводился анализ, применяемых методик, реагентов и др.
После оценки размера эффекта для количественных данных становится возможным дифференцировать изменения, выходящие за пределы референтных интервалов, от тех, которые находятся в их пределах. Также и для качественных данных возможно ранжирование изменений в зависимости от интенсивности проявления конкретного признака — например, от минимальной до высокой степени тяжести или от слабовыраженной до выраженной.
Эффекты, выходящие за пределы референтных интервалов и характеризующиеся средней и высокой степенью тяжести, с большей вероятностью представляют собой действительно значимые нежелательные эффекты. Для формирования окончательного заключения необходим дальнейший анализ полученных данных с учетом следующих ключевых факторов:
1) фармакодинамическая приемлемость эффекта;
2) возможность адаптационной реакции организма на воздействие;
3) изолированность изменения;
4) обратимость выявленных эффектов.
Определение «нежелательности» выявленных изменений. Использование принципа Weight-of-Evidence
Фармакодинамическая приемлемость эффекта. Некоторые эффекты, наблюдаемые у животного, могут быть приемлемыми с фармакодинамической точки зрения. Самый простой пример — гипогликемия при введении инсулина здоровым животным. Сюда также можно отнести отложения железа в органах и тканях на фоне внутривенного введения коллоидного железа лабораторным животным или увеличение показателей эритропоэза, гипертрофию селезенки, экстрамедуллярный гемопоэз на фоне введения эритропоэтинов (табл. 3).
Таблица 3. Оценка фармакодинамической приемлемости эффекта на примере курсового подкожного введения дарбэпоэтина крысам-самцам, M±SD (среднее значение ± стандартное отклонение), n=5
Table 3. Assessment of pharmacodynamic acceptability of the effect based on the example of course subcutaneous administration of darbepoetin to male rats, M±SD (mean ± standard deviation), n=5
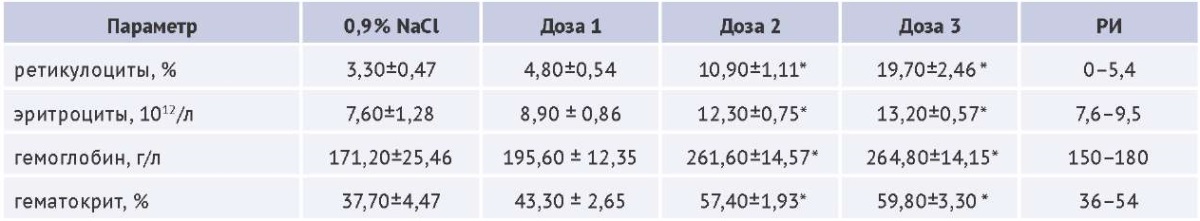
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. РИ — внутрилабораторный референтный интервал.
* Cтатистически значимые отличия (ANOVA, post-hoc Тьюки) в сравнении с группой животных, получавшей контрольное вещество.
В примере, представленном в таблице 3, наблюдается дозозависимое увеличение доли ретикулоцитов, абсолютного количества эритроцитов, гемоглобина и гематокрита. Статистическая значимость этих изменений в сравнении с контрольной группой достигается при применении средней и высокой доз препарата. Учитывая известные фармакодинамические свойства препарата дарбэпоэтин, данные эффекты можно классифицировать как связанные с первичной фармакодинамикой. Примечательно, что увеличение указанных показателей отмечается уже при применении низкой дозы, однако выход за пределы референтного интервала наблюдается только при использовании средней и высокой доз, что может свидетельствовать о переходе от ожидаемого желательного терапевтического эффекта к нежелательным изменениям.
Стоит отметить, что это достаточно условная граница, и представляется весьма сложным, опираясь в том числе на референтные интервалы, провести границу между приемлемым и чрезмерным фармакодинамическим эффектом, при условии, что в токсикологическом исследовании используются здоровые животные с нормальным уровнем всех показателей, а фармакологическое действие препарата изучается на животных с модельной патологией. Порог может сильно различаться в зависимости от класса препарата, характера фармакодинамических эффектов и терапевтической широты.
Возможность адаптационной реакции организма на воздействие. Выявленные морфологические изменения могут являться адаптивными (компенсаторными) реакциями организма. При длительном ингаляционном введении у животных может наблюдаться ряд характерных изменений: плоскоклеточная метаплазия гортани, гиперплазия и метаплазия клеток слизистой носовых ходов, а также увеличение количества альвеолярных макрофагов [25]. При оценке подобных эффектов необходимо учитывать их выраженность. Так, фокальная плоскоклеточная метаплазия гортани минимальной или легкой степени может рассматриваться как адаптивная реакция. В то же время диффузную метаплазию умеренной или тяжелой степени, затрагивающую несколько уровней гортани, следует классифицировать как нежелательный эффект [26].
Еще одним примером часто встречающейся адаптивной реакции может являться гепатоцеллюлярная гипертрофия и увеличение массы печени как ответ на введение исследуемого объекта, вызывающего индукцию цитохрома Р450. Считается, что при минимальной и легкой степени тяжести гепатоцеллюлярной гипертрофии без каких-либо сопутствующих некротических изменений и повышения активности трансаминаз в сыворотке крови данные состояния не следует считать нежелательными. С другой стороны, гепатоцеллюлярная гипертрофия с сопутствующим гепатоцеллюлярным некрозом и выраженной активностью печеночных ферментов может считаться нежелательным эффектом [27].
Оценка изолированности эффекта. При оценке нежелательных эффектов требуется комплексный анализ взаимосвязанных параметров. Для иллюстрации этого принципа можно рассмотреть батарею тестов Ирвина и функциональные наблюдательные тесты (Functional observation battery, FOB), которые используются для оценки фармакологической безопасности воздействия на центральную нервную систему. Эти методики включают около 40 различных тестов, сгруппированных по оценке двигательной активности, координации движений, сенсорных рефлексов и других показателей [28].
Важно отметить, что любое изменение отдельного параметра должно подтверждаться соответствующими изменениями других показателей в той же группе параметров. Иными словами, выявленный эффект не может быть изолированным — он должен иметь подтверждение в виде согласованных изменений в связанных показателях, что позволяет более достоверно интерпретировать полученные результаты.
Анализ обратимости морфологических изменений. При оценке нежелательности выявленных изменений целесообразно учитывать и их обратимость. С этой целью в дизайн исследования включают дополнительное количество животных, оценку основных показателей которых проводят после периода отмены введения исследуемого лекарственного препарата.
По способности к регенерации ткани принято разделять на лабильные (состоящие из непрерывно делящихся клеток, например эпителий кишечника), стабильные (состоящие из клеток, находящихся в состоянии покоя, например паренхиматозные клетки печени, почек, поджелудочной железы) и статические (состоящие из неделящихся клеток, например нейроны/миоциты). Лабильные ткани обладают значительным потенциалом восстановления через пролиферацию идентичных клеток при сохранном внеклеточном матриксе, в то время как стабильные ткани демонстрируют более ограниченную способность к регенерации, существенно зависящую от целостности матрикса. При повреждении стромального каркаса происходит неправильное распределение регенерированных паренхиматозных клеток, что приводит к неэффективной репарации, а статические ткани при повреждении полностью утрачивают способность к регенерации, замещаясь соединительной тканью.
С точки зрения дальнейшего клинического применения особое внимание следует уделять тканям со сниженным потенциалом восстановления и репарации. При оценке нежелательности выявленных изменений критически важно анализировать их обратимость и естественную способность к регенерации. Некоторые изменения обладают высокой способностью к восстановлению [29] и при надлежащем обосновании могут не учитываться при определении NOAEL.
Таким образом, в данном разделе проанализированы основные аспекты, которые следует учитывать при оценке нежелательности выявленных изменений. Представленный перечень не является исчерпывающим. Необходимо принимать во внимание временный характер эффектов, их возможную видоспецифичность, соответствие ожидаемым изменениям для исследуемого класса соединений и другие факторы [2].
Важно подчеркнуть, что итоговая оценка NOAEL должна базироваться на всестороннем анализе всех выбранных нежелательных эффектов с применением принципа весомости доказательств — Weight-of-Evidence (WoE-анализ), который позволяет оценить совокупность различных факторов и их вес с точки зрения степени влияния на органы и ткани, их функцию, потенциальные риски клинического применения.
Методологические подходы WoE-анализа при доклинической разработке лекарственных средств подробно освещены в публикации [30]. Основные этапы WoE-анализа включают в себя формулировку проблемы, сбор, оценку, взвешивание и объединение доказательств с формированием основного вывода12 [30]. Ключевыми элементами анализа являются определение факторов риска (WoE-факторов), их оценка по степени критичности и дальнейшее взвешивание доказательств.
Применительно к стандартному токсикологическому исследованию факторы риска целесообразно выбрать на основе используемых первичных и вторичных конечных точек.
Высокая степень критичности (первичные конечные точки). К этой категории относятся маркеры явной токсичности, напрямую угрожающие жизнедеятельности организма или функции органов: гибель животных; клинические признаки интоксикации (судороги, угнетение дыхания и пр.); снижение массы тела более 20%; функциональные нарушения органов (например, снижение клубочковой фильтрации почек); необратимые патоморфологические изменения (некрозы, опухоли).
Умеренная степень критичности (вторичные конечные точки). Включает суррогатные маркеры токсичности, которые указывают на потенциальные риски, но требуют подтверждения первичными данными: биохимические параметры (повышение АЛТ/АСТ и проч.); гематологические сдвиги (анемия, тромбоцитопения); обратимые гистологические изменения (вакуолизация гепатоцитов, гиперплазия эпителия).
Низкая степень критичности (маркеры чрезмерной фармакодинамики). К этой группе относятся эффекты, связанные с первичной фармакодинамикой изучаемого лекарственного средства: доля ретикулоцитов для эритропоэтинов (дарбэпоэтин); увеличение уровня железа в крови, отложения железа в органах и тканях (препараты железа).
Требуется отметить, что выбор WoE-факторов будет зависеть от выбранных первичных и вторичных конечных точек для каждого отдельного эксперимента. Это требует тщательного планирования эксперимента с надлежащим обоснованием объема определяемых параметров. Так, в зависимости от предполагаемого фармакологического или токсического профиля исследуемого препарата дизайн может быть дополнен специальными функциональными тестами изучения дыхательной (например, плетизмография), центральной нервной (батарея тестов Ирвина, тесты распознавания объектов), сердечно-сосудистой (параметры ЭКГ, артериальное давление, частота сердечных сокращений) систем организма, анализом целевых маркеров органной токсичности (например, оценкой клиренса креатинина для изучения фильтрационной функции почек, половых гормонов или гормонов щитовидной железы и др.) или фармакодинамических маркеров (активность ферментов-мишеней, концентрация белков, изменение экспрессии генов и др.).
На рисунке 2 представлен пример использования WoE-анализа при выборе NOAEL для препарата дарбэпоэтин. В качестве факторов риска выбраны основные первичные и вторичные конечные точки. Во всех дозах отсутствовала гибель, картина интоксикации и выраженные гистопатологические изменения в органах и тканях, во всех дозах наблюдали развитие экстрамедуллярного эритропоэза (обратимое), биологически значимое увеличение массового коэффициента селезенки, гематологических маркеров эритрогенной активности, включая долю ретикулоцитов, с выходом уровней за референтные интервалы в средней и высокой дозе. По совокупности полученных данных в качестве NOAEL целесообразно выбрать минимальную дозу, при которой выявленные фармакодинамические эффекты находятся в пределах референтных интервалов.
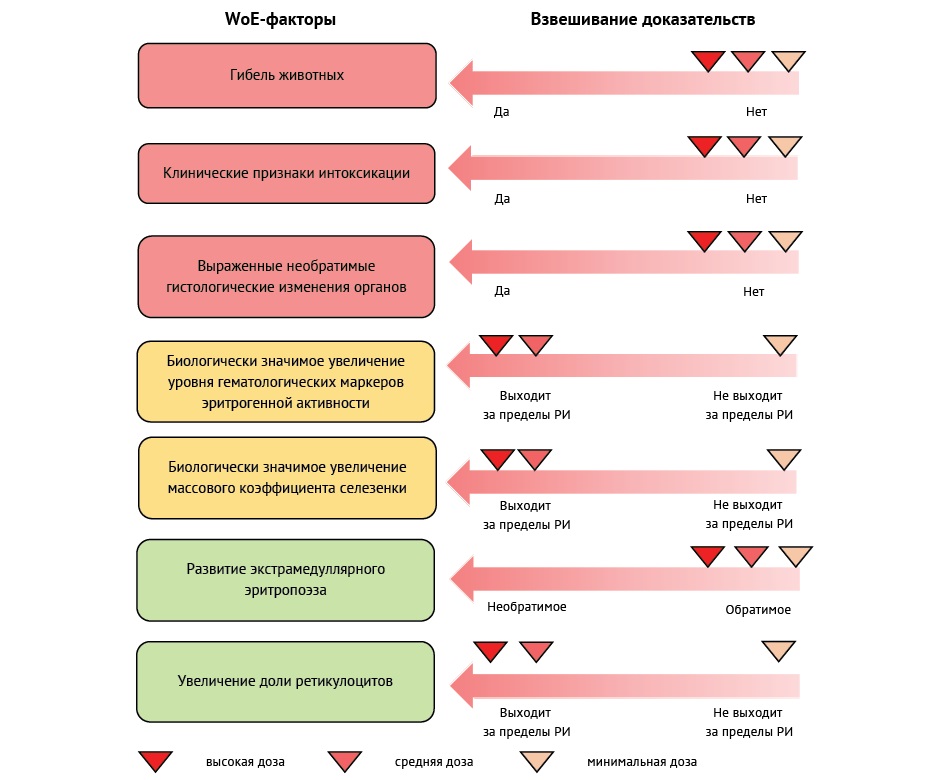
Рисунок подготовлен авторами / The figure is prepared by the authors
Рис. 2. Гипотетический пример WoE-анализа выбора NOAEL на примере препарата дарбэпоэтин. Красным выделены факторы, имеющие высокую степень критичности, желтым — умеренную и зеленым — низкую
Fig. 2. A hypothetical example of Weight-of-Evidence (WoE) analysis for NOAEL selection using darbepoetin as a case study. Factors with high criticality are marked in red, moderate criticality in yellow, and low criticality in green
ЗАКЛЮЧЕНИЕ
Доза, не вызывающая видимых нежелательных эффектов, или NOAEL, является ключевым количественным параметром доклинических исследований безопасности новых лекарственных средств. Являясь фактически нижней границей токсического диапазона, NOAEL используется для оценки широты терапевтического действия новых лекарственных средств, а также служит основой для расчета стартовой дозы в клинических исследованиях с участием человека.
Оценка нежелательности выявленных изменений является наиболее сложной методологической задачей в интерпретации данных токсикологического эксперимента. В работе предложена схема определения нежелательных эффектов, включающая три последовательных этапа: анализ взаимосвязи между наблюдаемым эффектом и введением тестируемого объекта; оценка размера эффекта и (или) степени изменений; определение характера выявленных изменений с точки зрения их нежелательности.
Для окончательного выбора NOAEL эффективным инструментом служит подход Weight-of-Evidence (WoE-анализ), или весомости доказательств, основанный на комплексной оценке рисков. Данный метод позволяет провести всестороннюю оценку всей совокупности выявленных нежелательных эффектов с учетом выбранных первичных и вторичных конечных точек, обеспечивая более объективное и обоснованное определение NOAEL.
Внедрение данного комплексного подхода позволяет существенно повысить объективность интерпретации токсикологических данных и обеспечить более надежную оценку рисков при планировании и проведении клинических исследований лекарственных средств.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: К.Л. Крышень — концепция работы, сбор и систематизация информации, написание текста рукописи, формулировка заключения; Я.А. Гущин, Н.М. Фаустова, С.В. Гущина, Ж.Ю. Устенко, В.А. Вавилова, М.В. Мирошников — участие в подготовке основного раздела рукописи; А.Е. Кательникова — работа с источниками литературы; К.Т. Султанова — редактирование текста рукописи; А.А. Матичин — редактирование текста рукописи; Я.Г. Муразов — участие в подготовке схемы определения нежелательных эффектов; М.А. Ковалева, Д.В. Шубин — критический пересмотр текста рукописи; В.Г. Макаров, М.Н. Макарова — утверждение окончательной версии рукописи для публикации.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Kirill L. Kryshen — the concept of the work, the collection and systematization of information, the writing of the text of the manuscript, the formulation of conclusions. Yaroslav A. Gushchin, Natalia M. Faustova, Svetlana V. Gushchina, Zhanna Yu. Ustenko, Valeria А. Vavilova, and Мikhail V. Miroshnikov — participation in the preparation of the main section of the manuscript. Anastasiia E. Katelnikova — working with literature sources. Kira T. Sultanova — editing the text of the manuscript. Аlexandr А. Matichin — editing the text of the manuscript. Iaroslav G. Murazov — participation in the preparation of scheme for determining adverse effects. Мariya А. Kovaleva, Dmitriy V. Shubin — critrevision of the manuscript text. Valeriy G. Makarov, Мarina N. Makarova — approval of the final version of the manuscript for publication.
1. Решение Коллегии Евразийской экономической комиссии от 26.11.2019 № 202 «Об утверждении Руководства по доклиническим исследованиям безопасности в целях проведения клинических исследований и регистрации лекарственных препаратов».
2. Estimating the maximum safe starting dose in initial clinical trials for therapeutics in adult healthy volunteers. Guidance for industry. Rockville: Food and Drug Administration; 2005.
3. Решение Коллегии Евразийской экономической комиссии от 14.01.2020 № 1 «Об утверждении Руководства по установлению допустимых пределов воздействия на здоровье в целях идентификации рисков при производстве лекарственных средств на общих производственных (технологических) линиях».
4. Миронов АН, ред. Руководство по проведению доклинических исследований лекарственных средств. Ч. 1. М.: Гриф и К; 2012.
5. ГОСТ Р 56701-2015 Лекарственные средства для медицинского применения. Руководство по планированию доклинических исследований безопасности с целью последующего проведения клинических исследований и регистрации лекарственных средств.
6. Решение Совета Евразийской экономической комиссии (ЕЭК) от 03.11.2016 № 78 «О Правилах регистрации и экспертизы лекарственных средств для медицинского применения».
7. Решение Коллегии ЕЭК от 26.11.2019 № 202 «Об утверждении Руководства по доклиническим исследованиям безопасности в целях проведения клинических исследований и регистрации лекарственных препаратов».
8. Решение Коллегии ЕЭК от 14.01.2020 № 1 «Об утверждении Руководства по установлению допустимых пределов воздействия на здоровье в целях идентификации рисков при производстве лекарственных средств на общих производственных (технологических) линиях».
9. Estimating the maximum safe starting dose in initial clinical trials for therapeutics in adult healthy volunteers. Guidance for industry. Rockville: Food and Drug Administration; 2005.
10. Решение Коллегии ЕЭК от 26.11.2019 № 202 «Об утверждении Руководства по доклиническим исследованиям безопасности в целях проведения клинических исследований и регистрации лекарственных препаратов».
11. Non-clinical guideline on drug-induced hepatotoxicity. European Medicines Agency; 2008.
12. OECD Guiding Principles and Key Elements for Establishing a Weight of Evidence for Chemical Assessment. OECD Series on Testing and Assessment, No. 311. OECD; 2019. https://doi.org/10.1787/f11597f6-en
Список литературы
1. Palazzi X, Burkhardt JE, Caplain H, Dellarco V, Fant P, Foster JR, et al. Characterizing “adversity” of pathology findings in nonclinical toxicity studies: Results from the 4th ESTP International Expert Workshop. Toxicol Pathol. 2016;44(6):810–24. https://doi.org/10.1177/0192623316642527
2. Lewis RW, Billington R, Debryune E, Gamer A, Lang B, Carpanini F. Recognition of adverse and nonadverse effects in toxicity studies. Toxicol Pathol. 2002;30(1):66–74. https://doi.org/10.1080/01926230252824725
3. Dorato MA, Engelhardt JA. The no-observed-adverse-effect-level in drug safety evaluations: use, issues, and definition(s). Regul Toxicol Pharmacol. 2005;42(3):265–74. https://doi.org/10.1016/j.yrtph.2005.05.004
4. Park YC, Cho MH. A new way in deciding NOAEL based on the findings from GLP-toxicity test. Toxicol Res. 2011;27(3):133–5. https://doi.org/10.5487/tr.2011.27.3.133
5. Keller DA, Juberg DR, Catlin N, Farland WH, Hess FG, Wolf DC, Doerrer NG. Identification and characterization of adverse effects in 21st century toxicology. Toxicol Sci. 2012;126(2):291–7. https://doi.org/10.1093/toxsci/kfr350
6. Kerlin R, Bolon B, Burkhardt J, Francke S, Greaves P, Meador V, et al. Scientific and regulatory policy committee: Recommended (“best”) practices for determining, communicating, and using adverse effect data from nonclinical studies. Toxicol Pathol. 2016;44(2):147–62. https://doi.org/10.1177/0192623315623265
7. Kale VP, Bebenek I, Ghantous H, Kapeghian J, Singh BP, Thomas LJ. Practical considerations in determining adversity and the No-Observed-Adverse-Effect-Level (NOAEL) in Nonclinical Safety Studies: Challenges, perspectives and case studies. Int J Toxicol. 2022;41(2):143–62. https://doi.org/10.1177/10915818211073047
8. Енгалычева ГН, Сюбаев РД. Выбор высокой дозы для изучения общетоксического действия новых лекарственных средств. Безопасность и риск фармакотерапии. 2023;11(2):145–54. https://doi.org/10.30895/2312-7821-2023-11-2-145-154
9. Chrominski K., Magdalena T. Comparison of outlier detection methods in biomedical data, Journal of Medical Informatics & Technologies. 2010; 16.
10. Hothorn LA. Statistical evaluation of toxicological bioassays – A review. Toxicol Res. 2014;3(6):418–32. https://doi.org/10.1039/c4tx00047a
11. Vandenberg LN, Colborn T, Hayes TB, Heindel JJ, Jacobs DR Jr, Lee DH, et al. Hormones and endocrine-disrupting chemicals: Low-dose effects and nonmonotonic dose responses. Endocr Rev. 2012;33(3):378–455. https://doi.org/10.1210/er.2011-1050
12. Owen RA, Heywood R. Age-related variations in renal structure and function in Sprague-Dawley rats. Toxicol Pathol. 1986;14(2):158–67. https://doi.org/10.1177/019262338601400203
13. Chandra M, Riley MG, Johnson DE. Spontaneous neoplasms in aged Sprague–Dawley rats. Arch Toxicol. 1992;66(7):496–502. https://doi.org/10.1007/BF01970675
14. Poteracki J, Walsh KM. Spontaneous neoplasms in control Wistar rats: A comparison of reviews. Toxicol Sci. 1998;45(1):1–8. https://doi.org/10.1006/toxs.1998.2493
15. McInnes E. Common spontaneous and background lesions in laboratory animals: principles and practices of laboratory animal pathology for study personnel. In: McInnes E, ed. Pathology for toxicologists. Chennai: Wiley; 2017. P. 59–71. https://doi.org/10.1002/9781118755174.ch4
16. Chamanza R, Marxfeld HA, Blanco AI, Naylor SW, Bradley AE. Incidences and range of spontaneous findings in control cynomolgus monkeys (Macaca fascicularis) used in toxicity studies. Toxicol Pathol. 2010;38(4):642–57. https://doi.org/10.1177/0192623310368981
17. Беляева ЕВ, Рыбакова АВ, Гущин ЯА, Ваганова ДС, Коптяева КЕ, Мужикян АА и др. Патоморфологическая диагностика легких при различных методах эвтаназии лабораторных животных. Лабораторные животные для научных исследований. 2018;(3):49–60. https://doi.org/10.29296/2618723X-2018-03-05
18. Ramot Y, Ben-Eliahu S, Kagan L, Ezov N, Nyska A. Subcutaneous and intraperitoneal lipogranulomas following subcutaneous injection of olive oil in Sprague–Dawley rats. Toxicol Pathol. 2009;37(7):882–6. https://doi.org/10.1177/0192623309347911
19. He P, Zou Y, Hu Z. Advances in aluminum hydroxide-based adjuvant research and its mechanism. Hum Vaccin Immunother. 2015;11(2):477–88. https://doi.org/10.1080/21645515.2014.1004026
20. Talbot SR, Biernot S, Bleich A, van Dijk RM, Ernst L, Häger C, et al. Defining body-weight reduction as a humane endpoint: a critical appraisal. Lab Anim. 2020;54(1):99–110. https://doi.org/10.1177/0023677219883319
21. Sullivan GM, Feinn R. Using effect size – or why the p value is not enough. J Grad Med Educ. 2012;4(3):279–82. https://doi.org/10.4300/JGME-D-12-00156.1
22. Carneiro CFD, Moulin TC, Macleod MR, Amaral OB. Effect size and statistical power in the rodent fear conditioning literature – A systematic review. PLoS One. 2018;13(4):e0196258. https://doi.org/10.1371/journal.pone.0196258
23. Kobayashi A, Suzuki Y, Sugai S. Specificity of transaminase activities in the prediction of drug-induced hepatotoxicity. J Toxicol Sci. 2020;45(9):515–37. https://doi.org/10.2131/jts.45.515
24. Hall RL. Lies, damn lies, and reference intervals (or hysterical control values for clinical pathology data). Toxicol Pathol. 1997;25(6):647–9. https://doi.org/10.1177/019262339702500617
25. Burger GT, Renne RA, Sagartz JW, Ayres PH, Coggins CR, Mosberg AT, et al. Histologic changes in the respiratory tract induced by inhalation of xenobiotics: physiologic adaptation or toxicity? Toxicol Appl Pharmacol. 1989;101(3):521–42. https://doi.org/10.1016/0041-008x(89)90200-7
26. Kaufmann W, Bader R, Ernst H, Harada T, Hardisty J, Kittel B, et al. 1st international ESTP expert workshop: “Larynx squamous metaplasia”. A re-consideration of morphologic and diagnostic approaches in rodent studies and its relevance for human assessment. Exp Toxicol Pathol. 2009;61(6):591–603. https://doi.org/10.1016/j.etp.2009.01.001
27. Hall AP, Elcombe CR, Foster JR, Harada T, Kaufmann W, Knippel A, et al. Liver hypertrophy: a review of adaptive (adverse and non-adverse) changes – conclusions from the 3rd International ESTP Expert Workshop. Toxicol Pathol. 2012;40(7):971–94. https://doi.org/10.1177/0192623312448935
28. Mathiasen JR, Moser VC. The Irwin test and Functional Observational Battery (FOB) for assessing the effects of compounds on behavior, physiology, and safety pharmacology in rodents. Curr Protoc. 2023;3(5):e780. https://doi.org/10.1002/cpz1.780
29. Perry R, Farris G, Bienvenu JG, Dean C Jr, Foley G, Mahrt C, et al. Society of Toxicologic Pathology position paper on best practices on recovery studies: the role of the anatomic pathologist. Toxicol Pathol. 2013;41(8):1159–69. https://doi.org/10.1177/0192623313481513
30. Енгалычева Г.Н., Сюбаев Р.Д. WoE-анализ и ключевые факторы риска при доклинической разработке лекарственных препаратов: обзор. Безопасность и риск фармакотерапии. 2024;12(4):463–476. https://doi.org/10.30895/2312-7821-2024-12-4-463-476
Об авторах
К. Л. КрышеньРоссия
Крышень Кирилл Леонидович, канд. биол. наук
Заводская ул., д. 3, к. 245, г.п. Кузьмоловский, Всеволожский р-н, Ленинградская обл., 188663
Я. А. Гущин
Россия
Гущин Ярослав Александрович
Заводская ул., д. 3, к. 245, г.п. Кузьмоловский, Всеволожский р-н, Ленинградская обл., 188663
Н. М. Фаустова
Россия
Фаустова Наталья Михайловна, канд. хим. наук
Заводская ул., д. 3, к. 245, г.п. Кузьмоловский, Всеволожский р-н, Ленинградская обл., 188663
С. В. Гущина
Россия
Гущина Светлана Валерьевна
Заводская ул., д. 3, к. 245, г.п. Кузьмоловский, Всеволожский р-н, Ленинградская обл., 188663
Ж. У. Устенко
Россия
Устенко Жанна Юрьевна, канд. вет. наук
Заводская ул., д. 3, к. 245, г.п. Кузьмоловский, Всеволожский р-н, Ленинградская обл., 188663
А. Е. Кательникова
Россия
Кательникова Анастасия Евгеньевна, канд. мед. наук
Заводская ул., д. 3, к. 245, г.п. Кузьмоловский, Всеволожский р-н, Ленинградская обл., 188663
К. Т. Султанова
Россия
Султанова Кира Тимуровна, канд. мед. наук
Заводская ул., д. 3, к. 245, г.п. Кузьмоловский, Всеволожский р-н, Ленинградская обл., 188663
А. А. Матичин
Россия
Матичин Александр Алексеевич
Заводская ул., д. 3, к. 245, г.п. Кузьмоловский, Всеволожский р-н, Ленинградская обл., 188663
В. А. Вавилова
Россия
Вавилова Валерия Александровна
Заводская ул., д. 3, к. 245, г.п. Кузьмоловский, Всеволожский р-н, Ленинградская обл., 188663
Я. Г. Муразов
Россия
Муразов Ярослав Геннадьевич, канд. биол. наук
Заводская ул., д. 3, к. 245, г.п. Кузьмоловский, Всеволожский р-н, Ленинградская обл., 188663
М. В. Мирошников
Россия
Мирошников Михаил Владимирович, канд. мед. наук
Заводская ул., д. 3, к. 245, г.п. Кузьмоловский, Всеволожский р-н, Ленинградская обл., 188663
М. А. Ковалева
Россия
Ковалева Мария Александровна, канд. биол. наук
Заводская ул., д. 3, к. 245, г.п. Кузьмоловский, Всеволожский р-н, Ленинградская обл., 188663
Д. В. Шубин
Россия
Шубин Дмитрий Валерьевич
Заводская ул., д. 3, к. 245, г.п. Кузьмоловский, Всеволожский р-н, Ленинградская обл., 188663
В. Г. Макаров
Россия
Макаров Валерий Геннадьевич, д-р мед. наук, профессор
Заводская ул., д. 3, к. 245, г.п. Кузьмоловский, Всеволожский р-н, Ленинградская обл., 188663, Российская Федерация
М. Н. Макарова
Россия
Макарова Марина Николаевна, д-р мед. наук
Заводская ул., д. 3, к. 245, г.п. Кузьмоловский, Всеволожский р-н, Ленинградская обл., 188663
Дополнительные файлы
Рецензия
Для цитирования:
Крышень К.Л., Гущин Я.А., Фаустова Н.М., Гущина С.В., Устенко Ж.У., Кательникова А.Е., Султанова К.Т., Матичин А.А., Вавилова В.А., Муразов Я.Г., Мирошников М.В., Ковалева М.А., Шубин Д.В., Макаров В.Г., Макарова М.Н. Интерпретация данных токсикологических исследований лекарственных средств при определении дозы, не вызывающей видимых нежелательных эффектов (NOAEL). Регуляторные исследования и экспертиза лекарственных средств. 2025;15(3):262-277. https://doi.org/10.30895/1991-2919-2025-15-3-262-277
For citation:
Kryshen K.L., Gushchin Ya.A., Faustova N.M., Gushchina S.V., Ustenko Zh.Yu., Katelnikova A.E., Sultanova K.T., Matichin A.A., Vavilova V.A., Murazov Ya.G., Miroshnikov M.V., Kovaleva M.A., Shubin D.V., Makarov V.G., Makarova M.N. Interpretation of toxicological research data in establishing the no observed adverse effect level (NOAEL) for medicinal products. Regulatory Research and Medicine Evaluation. 2025;15(3):262-277. (In Russ.) https://doi.org/10.30895/1991-2919-2025-15-3-262-277



































