Перейти к:
Роль отдельных институтов в реализации достижения фармацевтического суверенитета на примере Центра трансфера медицинских технологий ФГБУ «НЦЭСМП» Минздрава России
https://doi.org/10.30895/1991-2919-2024-14-5-505-512
Резюме
ВВЕДЕНИЕ. Укрепление практического здравоохранения и повышение доступности фармакотерапии напрямую зависят от разработки и вывода в обращение инновационных отечественных препаратов. Среди инструментов вывода препаратов на рынок одним из важнейших является трансфер технологий.
ЦЕЛЬ. Оценка роли Центра трансфера медицинских технологий ФГБУ «НЦЭСМП» Минздрава России в исполнении мероприятий федеральных проектов в области медицинской науки и в достижении целей фармацевтического суверенитета.
ОБСУЖДЕНИЕ. В статье рассмотрены основные тенденции развития фармацевтической отрасли на национальном (в России) и международном уровне. Отмечены знаковые решения, принимаемые на федеральном уровне в целях достижения фармацевтического суверенитета и повышения доступности фармакотерапии для населения. Рассмотрено Положение о деятельности Центра трансфера медицинских технологий ФГБУ «НЦЭСМП» Минздрава России, очерчен круг его полномочий, проанализированы возможности по сопровождению всех этапов проектов разработки лекарственных препаратов, в том числе по вопросам эффективности деятельности по разработке лекарственных препаратов, вопросам патентного права, а также коммерциализации продукта. Оценена роль Центра трансфера медицинских технологий в развитии фармацевтической отрасли в Российской Федерации.
ВЫВОДЫ. Деятельность Центра трансфера медицинских технологий ФГБУ «НЦЭСМП» Минздрава России по сопровождению проектов осуществляется в целях исполнения отдельных мероприятий федеральных проектов в области медицинской науки для человека и может являться одним из инструментов, способствующих эффективному инновационному развитию отечественной фармацевтической отрасли.
Ключевые слова
Для цитирования:
Кошевенко А.С., Деграве Т.В., Буренков П.В., Беланов К.Ю., Косенко В.В. Роль отдельных институтов в реализации достижения фармацевтического суверенитета на примере Центра трансфера медицинских технологий ФГБУ «НЦЭСМП» Минздрава России. Регуляторные исследования и экспертиза лекарственных средств. 2024;14(5):505-512. https://doi.org/10.30895/1991-2919-2024-14-5-505-512
For citation:
Koshevenko A.S., Degrave T.V., Burenkov P.V., Belanov K.Yu., Kosenko V.V. Roles of Individual Institutions in Achieving Pharmaceutical Sovereignty as Exemplified by the Medical Technology Transfer Centre of the Scientific Centre for Expert Evaluation of Medicinal Products. Regulatory Research and Medicine Evaluation. 2024;14(5):505-512. (In Russ.) https://doi.org/10.30895/1991-2919-2024-14-5-505-512
ВВЕДЕНИЕ
Непрерывное развитие мировой фармацевтической отрасли осуществляется по ключевым принципам доказательной медицины, направленным на обеспечение и практическую оценку качества, безопасности и эффективности лекарственных средств с использованием накопленных теоретических знаний. Благодаря такому подходу для пациентов как основных потребителей фармацевтической продукции сформированы условия, позволяющие получать необходимую фармакотерапию с оптимальным балансом рисков для жизни и здоровья. Принимая за основу концепцию наивысшей ценности человеческой жизни, современная фармацевтическая отрасль находится в состоянии постоянного улучшения собственной исследовательской и операционной деятельности, поиска новых молекул и соединений, способных стать активными действующими веществами, а также новых лекарственных форм, обеспечивающих необходимые пациентам режимы дозирования с учетом приемлемой биодоступности лекарственных средств.
Использование трансфера технологий как одного из эффективных инструментов вывода инновационных отечественных препаратов на рынок способствует укреплению практического здравоохранения и повышению доступности фармакотерапии. Для достижения целей по инновационному развитию отечественной фармацевтической отрасли в 2022 г. в ФГБУ «НЦЭСМП» Минздрава России создан Центр трансфера медицинских технологий.
Цель работы — оценка роли Центра трансфера медицинских технологий ФГБУ «НЦЭСМП» Минздрава России в исполнении мероприятий федеральных проектов в области медицинской науки и в достижении целей фармацевтического суверенитета.
ОСНОВНАЯ ЧАСТЬ
Тенденции развития фармацевтической отрасли
Развитие мировой и отечественной фармацевтической отрасли на современном этапе характеризуется высоким уровнем инновационности и наукоемкости. Данная отрасль является одним из наиболее социально ориентированных сегментов экономики. Все это в совокупности и предопределяет следующие тенденции развития:
- общий рост фармацевтического рынка темпами около 10% в год и выше. Данная тенденция формируется благодаря как стремительному росту численности населения, увеличению продолжительности жизни, растущей урбанизации и миграции, так и росту заболеваемости населения новыми нозологическими формами, в том числе инфекционными, изменениями в патогенезе уже известных заболеваний, что в итоге приводит к увеличению количества регистрируемых случаев и, соответственно, росту потребности в адекватной терапии [1];
- цифровизация и автоматизация фармацевтики, более глубокая интеграция электронно-вычислительной техники и искусственного интеллекта во всех сферах отрасли, от поиска новых молекул до процессов производства и мониторинга за обращением лекарственных средств. Развитие данной тенденции обусловлено в том числе пандемией COVID-19, ее последствиями и предпринятыми решениями в целях их минимизации [2];
- развитие персонализированной медицины. Данная тенденция формулируется как оценка и использование индивидуальных онтогенетических особенностей каждого отдельного пациента при лечении выявленных заболеваний в различных отраслях медицины [3–5]. Основной тезис персонализированной медицины: «лечение человека, а не болезни» [6];
- принцип трансляционности при развитии фармацевтики. Данный принцип сформирован как использование технического прогресса и достижений фундаментальной науки при разработке новых лекарственных средств для их обязательного последующего внедрения в регулярную клиническую практику [7];
- стратегирование отрасли и проектный подход. Постановка стратегических целей, обеспечение всех инструментов для их достижения, гибкое управление различными по масштабам проектами в отрасли в зависимости от постоянно меняющихся условий внешней среды и внутренней инфраструктуры могут обеспечить планомерное и гармоничное развитие мировой и отечественной фармацевтики [8–12];
- новаторство и инновационный характер развития как ключевой маркер прогресса научно-исследовательской деятельности в фармацевтике. Принято считать, что инновационное развитие фармацевтической отрасли определяется разработкой и внедрением в клиническую практику оригинальных лекарственных препаратов, механизмы действия которых основаны на результатах самых передовых фундаментальных медико-биологических исследований. Для отдельных разработок может быть продемонстрирован принципиально новый механизм действия и достигаемые фармакологические эффекты, однако разработка последующих генераций лекарственных препаратов известных классов при наличии явных преимуществ медицинского применения препаратов более новых поколений также, несомненно, относится к инновациям [13].
Основными тенденциями инновационных решений в области поиска новых лекарственных форм являются комбинирование действующих веществ [14], модификации лекарственных форм [15], использование специализированных носителей с целью таргетной доставки действующих веществ [16]. Среди современных инновационных лекарственных форм принято выделять трансдермальные системы, медицинские газы как носители активных веществ, липосомы и микросферы, подкожные импланты, лекарственные формы с использованием нанотехнологий и содержащие различные векторы как перспективные средства доставки [17–19], а также иные лекарственные формы, обеспечивающие надлежащее дозирование, приемлемую биодоступность и комфорт при приеме препарата пациентами.
Развитие фармацевтической отрасли в Российской Федерации
В Российской Федерации в 2024 г. согласно аналитическим данным DSM Group растет объем инвестирования в строительство новых фармацевтических производств и при этом продолжает осуществляться импорт активных фармацевтических субстанций (АФС) зарубежного производства [20], полученных как путем химического синтеза, так и при помощи биотехнологий [21][22]. Также на отечественном фармацевтическом рынке широко представлены импортные вспомогательные вещества, малотоннажная химическая продукция [23] и иные ингредиенты для разработки и производства лекарственных препаратов. Аналитические данные показывают, что лидерами по объему ввозимых субстанций в количественном и финансовом исчислениях являются такие субстанции, как метформин и иные противодиабетические средства, ацетилсалициловая кислота, аскорбиновая кислота, АФС для противовирусных препаратов, парацетамол, метамизол натрия [24]. Многие из ввозимых АФС входят в состав лекарственных препаратов из списков жизненно необходимых и важнейших лекарственных препаратов, от доступности которых напрямую зависят показатели качества жизни населения. Основными поставщиками АФС в настоящее время являются Китайская Народная Республика и Республика Индия [21][24], в то же время на территории Российской Федерации около 50% общего фармацевтического рынка занимают транснациональные корпорации [20].
На фоне сохраняющегося потока импортных АФС и вспомогательных ингредиентов для производства лекарственных препаратов, а также масштабной деятельности иностранных фармацевтических компаний в Российской Федерации продолжают формироваться условия, определяющие долгосрочный инновационный статус и устойчивое развитие отечественной фармацевтической отрасли. На федеральном уровне на период до 2030 г. и далее на перспективу определены основные проекты в области медицинской науки1, реализация которых позволит значимо повлиять на благополучие населения и осуществить разработку инновационных лекарственных препаратов, включая высокотехнологичные препараты, а также биотехнологические и клеточные продукты для индивидуального медицинского применения, что позволит существенно укрепить национальный фармацевтический суверенитет. В прикладной плоскости федеральные проекты направлены на реализацию принципов трансляционной медицины, что способствует доступности инновационных лекарственных препаратов для целевых групп пациентов.
Федеральные проекты включают в себя 8 основных типов приоритетов разработки медицинской продукции, определенных на уровне Координационного совета по исследованиям и разработкам в области медицинской науки при Министерстве здравоохранения Российской Федерации: снижение смертности, инвалидизации, временной нетрудоспособности; улучшение качества жизни, связанного со здоровьем; терапия орфанных заболеваний; новые технологические тренды; импортозамещение и технологическое превосходство. В общей сложности определены 311 приоритетных направлений разработок медицинской продукции с учетом их востребованности и анализа трендов заболеваемости по ключевым категориям нозологий различных органов и систем.
В рамках федеральных проектов в области медицинской науки для человека разработчиками выступают государственные организации различной подведомственности2, научная деятельность которых позволяет отбирать перспективные молекулы-кандидаты, формулировать и доказывать гипотезы в отношении разработки оригинальных лекарственных препаратов, а дальнейшие процессы по трансферу технологий в совместной кооперации с представителями фармацевтической индустрии обеспечат реализацию проекта разработки как готового продукта. Принцип трансляционности реализуется за счет последовательного трансфера сформированной и доказанной гипотезы эффективности нового лекарственного препарата по основным этапам разработки доказательной базы в целях государственной регистрации, а также обеспечения качества разрабатываемого лекарственного препарата и организации его промышленного производства.
Для возможности доведения научных концепций и доказанных гипотез до стадии готового продукта, доступного для целевых групп пациентов, на уровне Министерства здравоохранения Российской Федерации и подведомственных учреждений сформирована и функционирует инфраструктура, позволяющая определить наиболее перспективные проекты, координировать прикладные исследования, проводимые в целях разработки доказательной базы, а также осуществлять комплексное сопровождение и экспертную поддержку отдельных проектов разработок. В целях реализации комплексного сопровождения наиболее значимых и приоритетных проектов разработок лекарственных препаратов в 2022 г. на базе ФГБУ «НЦЭСМП» Минздрава России сформирован Центр трансфера медицинских технологий3.
О сопровождении проектов Центром трансфера медицинских технологий
Деятельность Центра трансфера медицинских технологий (ЦТМТ) характеризуется как информационно-аналитическое сопровождение проектов разработки лекарственных препаратов подведомственных организаций на этапах от возникновения и тестирования гипотезы до государственной регистрации лекарственного препарата и его ввода в гражданский оборот4. ЦТМТ принимает активное участие в оценке проектов разработок лекарственных препаратов с учетом установленных типов приоритетов и приоритетных направлений. Для практической оценки проектов ЦТМТ составлены и внедрены инструменты собственной разработки. В соответствии с решениями Координационного Совета по исследованиям и разработкам в области медицинской науки при Министерстве здравоохранения Российской Федерации разработки лекарственных препаратов, определенные как наиболее перспективные, направляются в ЦТМТ для дальнейшего сопровождения.
Проектное управление в рамках сопровождения разработок лекарственных препаратов базируется на использовании шкалы уровней готовности технологий5. Уровни готовности технологий (УГТ) рассматриваются как сформированный маршрут из последовательных мероприятий в хронологическом порядке, продвижение по которому позволяет в рамках разработки лекарственных препаратов осуществить переход на последующие этапы проекта начиная от самых ранних этапов по формированию гипотезы. Для систематизации данных, удобства подготовки контрольных документов и отслеживания текущего статуса развития проекта по разработке лекарственного препарата ЦТМТ подготовил и апробировал отраслевые уровни готовности технологии с учетом действующего нормативно-правового регулирования в фармацевтической отрасли (рис. 1).
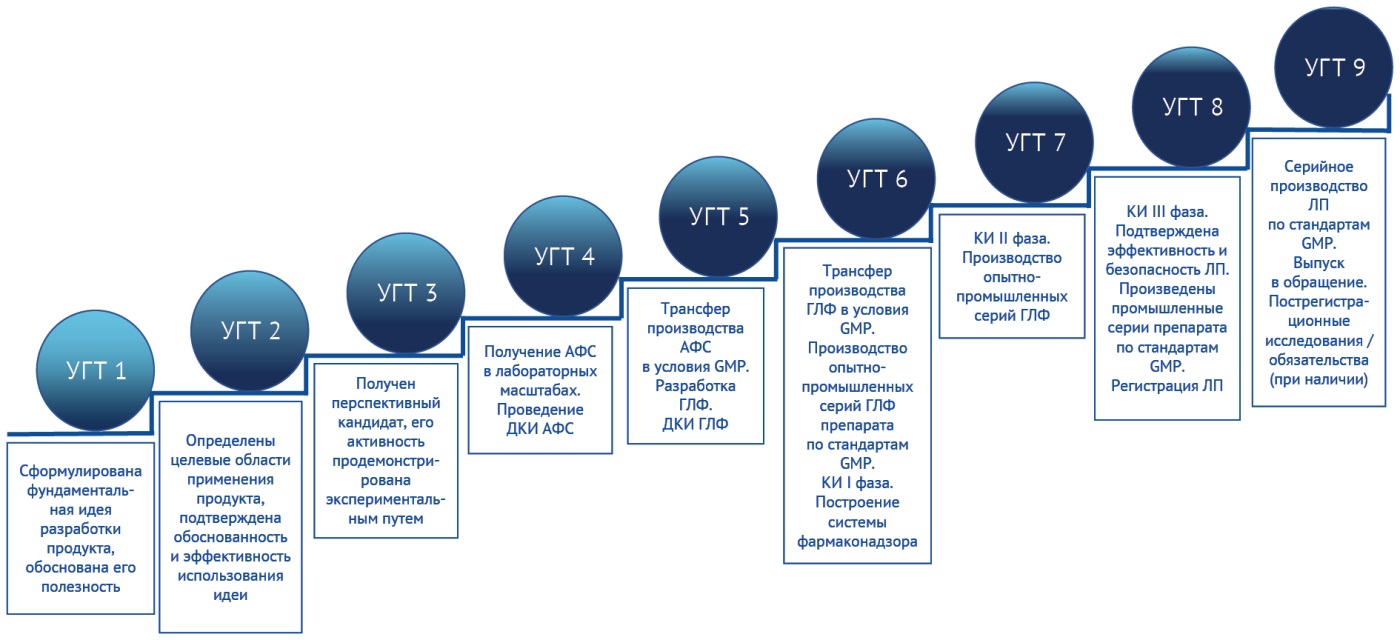
Рисунок подготовлен авторами / The figure is prepared by the authors
Рис. 1. Шкала уровней готовности технологий для разработки оригинальных лекарственных препаратов
Fig. 1. Technology readiness level (TRL) scale for the development of original medicinal products
Шкала УГТ размещена в отраслевом сегменте Единой государственной системы учета научно-исследовательских, опытно-конструкторских и технологических работ гражданского назначения (ЕГИСУ НИОКТР)6. Определение УГТ, согласно адаптированным под отраслевую специфику шкалам, активно используется разработчиками фармацевтической и медицинской продукции по отношению к собственным проектам при их учете в ЕГИСУ НИОКТР.
Мероприятия по проектному управлению в рамках деятельности ЦТМТ направлены на комплексное сопровождение и экспертную поддержку подведомственных организаций по ключевым вопросам и этапам осуществления разработки лекарственных препаратов с целью их дальнейшего внедрения в практическое здравоохранение. Общие принципы проектного управления включают в себя проработку стратегий защиты результатов интеллектуальной деятельности разработчика, сопровождение этапов разработки лекарственного препарата с учетом УГТ, а также мероприятия по коммерциализации разрабатываемых лекарственных препаратов.
Располагая соответствующими ресурсами, ЦТМТ способствует формированию и укреплению защиты результатов интеллектуальной деятельности для разработчиков как основы для ведения проекта разработки лекарственного препарата.
Сопровождение этапов разработки в вопросах управления интеллектуальной собственностью осуществляется с момента определения текущего УГТ, далее для каждой разработки составляется детализированная дорожная карта, включающая в себя основные мероприятия фармацевтической разработки и исследований, а также отображающая стратегию вывода лекарственного препарата на рынок. В рамках проектной деятельности ЦТМТ руководствуется принципом необходимости информационно-аналитического сопровождения каждой разработки от текущего УГТ к последующим уровням согласно представленной шкале УГТ. В целях продвижения проекта по шкале УГТ на каждом этапе ЦТМТ осуществляет детальный анализ регуляторной стратегии разработки, в соответствии с которой разработчику предоставляются рекомендации о достаточности запланированных и проведенных мероприятий для перехода к следующему УГТ с учетом установленных требований нормативных правовых актов в рамках государственного регулирования разработки и медицинского обращения лекарственных препаратов в Российской Федерации и Евразийском экономическом союзе.
Мероприятия по коммерциализации разработок направлены на формирование устойчивых деловых взаимоотношений разработчиков с индустриальными партнерами, способствующих активному продвижению проекта разработки лекарственного препарата на соответствующем этапе его жизненного цикла. В рамках данной деятельности ЦТМТ выступает как связующее звено в коммуникациях между подведомственными учреждениями и представителями фармацевтической индустрии. Данные взаимодействия позволяют привлечь необходимые инвестиции при переходе к клиническим исследованиям поздних фаз, а также организовать как производство образцов для проведения клинических исследований, так и серийное промышленное производство зарегистрированного лекарственного препарата в соответствии с лицензионным договором и достигнутыми договоренностями между подведомственным учреждением и индустриальным партнером.
В целях комплексного сопровождения и экспертной поддержки проектов разработки лекарственных препаратов, определенных Координационным Советом по исследованиям и разработкам Министерства здравоохранения Российской Федерации в качестве приоритетных, ЦТМТ сформировал и актуализирует собственную информационную базу, включающую в себя перечни индустриальных партнеров как для проведения отдельных этапов разработки, так и для привлечения инвестиций с дальнейшей организацией промышленного производства готового лекарственного препарата. Информационная база включает в себя перечень исполнителей доклинических исследований, исследовательских центров для проведения клинических исследований, перечень питомников лабораторных животных, перечень производителей и разработчиков АФС и готовых лекарственных форм. Представленные перечни активно дополняются и расширяются, как инструмент способствуют оперативному поиску и привлечению партнеров на всех этапах проекта.
ЗАКЛЮЧЕНИЕ
Активные согласованные действия федеральных органов исполнительной власти, подведомственных им учреждений и фармацевтической индустрии являются основой и необходимым условием успешной реализации масштабных задач национального проекта «Новые технологии сбережения здоровья» и поручений по итогам участия Президента Российской Федерации В.В. Путина в пленарном заседании Форума будущих технологий и его встречи с учеными в апреле 2024 г., достижения стратегических целей в области лекарственной безопасности и суверенитета, удовлетворения потребностей системы здравоохранения и граждан Российской Федерации в качественных, эффективных и безопасных инновационных лекарственных препаратах.
Деятельность Центра трансфера медицинских технологий ФГБУ «НЦЭСМП» Минздрава России по сопровождению проектов осуществляется в целях исполнения отдельных мероприятий федеральных проектов в области медицинской науки для человека и может являться одним из инструментов, способствующих эффективному инновационному развитию отечественной фармацевтической отрасли.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: А.С. Кошевенко — подготовка иллюстративного материала, работа с источниками литературы; Т.В. Деграве — оформление текста рукописи, подготовка резюме и раздела «Введение»; П.В. Буренков — подготовка основной части текста рукописи; К.Ю. Беланов — концепция статьи; В.В. Косенко — утверждение окончательной версии статьи для публикации.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Anastasia S. Koshevenko prepared the illustrative material and worked with references. Tatiana V. Degrave designed the manuscript and drafted the abstract and the Introduction section. Pavel V. Burenkov drafted the main section of the manuscript. Konstantin Yu. Belanov conceptualised the study. Valentina V. Kosenko approved the final version of the article for publication.
1. Перечень поручений по итогам участия Президента на Форуме будущих технологий и его встречи с учеными от 18.04.2024 № Пр-755.
Распоряжение Правительства Российской Федерации от 07.06.2023 № 1495-р «Об утверждении Стратегии развития фармацевтической промышленности Российской Федерации на период до 2030 года».
2. Перечень поручений по итогам участия Президента на Форуме будущих технологий и его встречи с учеными от 18.04.2024 № Пр-755.
Федеральный проект «Медицинская наука для человека».
Национальный проект «Новые технологии сбережения здоровья».
3. Приказ Министерства здравоохранения Российской Федерации от 28.01.2022 № 40 «О центре трансфера медицинских технологий».
4. Там же.
5. Приказ Министерства науки и высшего образования Российской Федерации от 06.02.2023 № 107 «Об утверждении Порядка определения уровней готовности разрабатываемых или разработанных технологий, а также научных и (или) научно-технических результатов, соответствующих каждому уровню готовности технологий».
6. Единая государственная система учета научно-исследовательских, опытно-конструкторских и технологических работ гражданского назначения. https://rosrid.ru/
Список литературы
1. Дремова НБ, Соломка СВ. Мировой фармацевтический рынок: трендвотчинг. Лабораторная и клиническая медицина. Фармация. 2022;2(1):56–68. https://doi.org/10.14489/lcmp.2022.01.pp.056-068
2. Романова ОВ, Авруцкая СГ. Цифровые тренды в фармацевтической отрасли в период пандемии коронавируса. Успехи в химии и химической технологии. 2021;35(1):59–61. EDN: RSKKLJ
3. Долгополов ИС, Рыков МЮ. Эволюция персонализированной медицины: обзор литературы. Исследования и практика в медицине. 2022;9(3):117–28. https://doi.org/10.17709/2410-1893-2022-9-3-9
4. Голубев АМ. Персонализированная медицина критических состояний (обзор). Общая реаниматология. 2022;18(4):45–54. https://doi.org/10.15360/1813-9779-2022-4-45-54
5. Абаимов ДА, Федотова ЕЮ, Полещук ВВ, Андреев МН, Трифонова ОП, Лохов ПГ, Иллариошкин СН. Принципы персонализированной медицины и современные фармацевтические технологии в оптимизации леводопа-терапии болезни Паркинсона. Анналы клинической и экспериментальной неврологии. 2021;15(2):73–82. https://doi.org/10.25692/ACEN.2021.2.9
6. Шляхто ЕВ, Конради АО. Персонализированная медицина. История, современное состояние проблемы и перспективы внедрения. Российский журнал персонализированной медицины. 2021;1(1):6–20. EDN: ISXQRM
7. Мокрышева НГ, Мельниченко ГА. Персонализированная медицина — этапы формирования концепции и пути практической ее реализации. Российский журнал персонализированной медицины. 2021;1(1):43–58. EDN: FMLQUG
8. Ткаченко СН, Ткаченко ИС, Егорова АИ. Стратегирование химической промышленности. В кн.: Теория и практика стратегирования. М.; 2021. С. 94–8. EDN: AGOALW
9. Чернышева АМ, Зобов АМ, Федоренко ЕА. Анализ стратегии развития фармацевтической промышленности РФ на период до 2030 и метрик устойчивого развития стратегических альянсов фармацевтической отрасли. Вестник Академии знаний. 2021;46(5):338–47. https://doi.org/10.24412/2304-6139-2021-5-338-347
10. Костин КБ, Шанава ЛА. Ключевые тенденции развития российского фармацевтического рынка в условиях неопределенности. Экономика, предпринимательство и право. 2022;12(5):1639–58. https://doi.org/10.18334/epp.12.5.114635
11. Матвеева АВ. К вопросу проектирования инновационной деятельности в фармацевтической отрасли. Научные горизонты. 2021;(6):19–29. EDN: FWJOWK
12. Прожерина Ю. Тренды мирового фармацевтического рынка в 2021 году. Ремедиум. 2021;(1):9–11. https://doi.org/10.21518/1561-5936-2021-1-9-11
13. Спирин НН, Власов ЯВ, Захарова МН, Хачанова НВ, Попова ЕВ, Хабиров ФА и др. Новые возможности в терапии пациентов с рассеянным склерозом. Журнал неврологии и психиатрии им. C.C. Корсакова. 2022;122(7–2):84–8. https://doi.org/10.17116/jnevro202212207284
14. Унку ЛВ, Чобану НТ, Валика ВВ. Перспективы разработки комбинированных препаратов для фармакотерапии некоторых ушных заболеваний. В кн.: Современные технологии в медицинском образовании. Минск; 2021. EDN: VHADSV
15. Полковникова ЮА, Гущина ОС. Перспективы разработки твердых дисперсных систем антибиотиков: обзор предметного поля. Health, Food & Biotechnology. 2022;4(1):24–33. https://doi.org/10.36107/hfb.2022.i1.s129
16. Морозкина СН, Олехнович РО, Снетков ПП. Некоторые биологически активные вещества природного происхождения и системы их доставки на основе гиалуроновой кислоты. СПб: ИТМО; 2021. EDN: XYBOCV
17. Гегирова АХ. Инновационные лекарственные формы. Тенденции развития науки и образования. 2022;(81–6):5–7. https://doi.org/10.18411/trnio-01-2022-206
18. Карнышева НГ, Кудинова ЛВ. Новые лекарственные формы. В кн.: Проблемы современных интеграционных процессов и пути их решения. Стерлитамак; 2021. С. 104–15. EDN: LDZUOF
19. Каримова АФ, Меркурьева ГЮ, Камаева СС. Липосомы — перспективная система доставки лекарственных веществ. Проблемы и тенденции научных преобразований в условиях трансформации общества. Стерлитамак; 2021. С. 172. EDN: XEJJHJ
20. Нечаева Ю. Импорт фармацевтических субстанций в Россию в 2020 году. Ремедиум. 2021;(2):32–5. https://doi.org/10.21518/1561-5936-2021-2-32-35
21. Доржиева ВВ. Стратегия новой индустриализации фармацевтической промышленности: национальные приоритеты и новые вызовы. Научные труды Вольного экономического общества России. 2023:240(2):198–215. https://doi.org/10.38197/2072-2060-2023-240-2-198-215
22. Гусев АБ, Юревич МА. Фармацевтический суверенитет России: проблемы и пути достижения. Terra Economicus. 2023:21(3):17–31. https://doi.org/10.18522/2073-6606-2023-21-3-17-31
23. Шахнович ОА. Малотоннажная химия России: история и перспективы. Лаборатория и производство. 2023;(3–4):24–38. EDN: HKBKBI
24. Василевич НИ. Активные фармацевтические субстанции — главное условие инновационного развития отечественной фармацевтики. Лаборатория и производство. 2021;(1):30–40. EDN: PCDMUM
Об авторах
А. С. КошевенкоРоссия
Кошевенко Анастасия Сергеевна - канд. фарм. наук.
Петровский б-р, д. 8, стр. 2, Москва, 127051
Т. В. Деграве
Россия
Деграве Татьяна Витальевна.
Петровский б-р, д. 8, стр. 2, Москва, 127051
П. В. Буренков
Россия
Буренков Павел Валерьевич.
Петровский б-р, д. 8, стр. 2, Москва, 127051
К. Ю. Беланов
Россия
Беланов Константин Юрьевич.
Петровский б-р, д. 8, стр. 2, Москва, 127051
В. В. Косенко
Россия
Косенко Валентина Владимировна - канд. фарм. наук.
Петровский б-р, д. 8, стр. 2, Москва, 127051
Рецензия
Для цитирования:
Кошевенко А.С., Деграве Т.В., Буренков П.В., Беланов К.Ю., Косенко В.В. Роль отдельных институтов в реализации достижения фармацевтического суверенитета на примере Центра трансфера медицинских технологий ФГБУ «НЦЭСМП» Минздрава России. Регуляторные исследования и экспертиза лекарственных средств. 2024;14(5):505-512. https://doi.org/10.30895/1991-2919-2024-14-5-505-512
For citation:
Koshevenko A.S., Degrave T.V., Burenkov P.V., Belanov K.Yu., Kosenko V.V. Roles of Individual Institutions in Achieving Pharmaceutical Sovereignty as Exemplified by the Medical Technology Transfer Centre of the Scientific Centre for Expert Evaluation of Medicinal Products. Regulatory Research and Medicine Evaluation. 2024;14(5):505-512. (In Russ.) https://doi.org/10.30895/1991-2919-2024-14-5-505-512



































