Перейти к:
Формирование устойчивости микроорганизмов в эксперименте in vitro: метод адаптивной лабораторной эволюции (обзор)
https://doi.org/10.30895/1991-2919-2024-656
Резюме
ВВЕДЕНИЕ. Высокие темпы возникновения и распространения резистентности микроорганизмов к антибиотикам обуславливают необходимость быстрой разработки новых антибактериальных препаратов. Оценка способности микроорганизмов формировать устойчивость к разрабатываемым антибактериальным препаратам в контролируемых условиях in vitro позволяет экономить ресурсы при разработке и регистрации препарата, а также создавать наиболее эффективные препараты.
ЦЕЛЬ. Оценка возможности использования метода адаптивной лабораторной эволюции при изучении формирования устойчивости микроорганизмов.
ОБСУЖДЕНИЕ. Одним из методов оценки механизмов резистентности и выяснения влияния препаратов на эволюцию устойчивости бактерий к антибактериальным препаратам является тест «Адаптивная лабораторная эволюция» (adaptive laboratory evolution — ALE). Исследования ALE проводятся в контролируемых условиях с длительным воздействием антибактериального агента на микроорганизмы. Постановка эксперимента ALE проводится различными способами путем серийного переноса микроорганизмов в жидкой среде, путем переноса колоний на чашках или непрерывным культивированием в хемостате. Протоколы ALE используются для развития устойчивости к различным антибактериальным агентам и требуют тщательного контроля условий эксперимента, которые могут повлиять на развитие устойчивости у микроорганизмов (концентрация антибактериального агента, количество последовательных пассажей, длительность инкубации и т.п.).
ВЫВОДЫ. Формирование устойчивости микроорганизмов может быть достигнуто при соблюдении следующих условий постановки теста ALE: использование антибактериального агента в субингибирующей или динамически увеличивающейся концентрации относительно минимальной подавляющей концентрации предкового штамма, выполнение определенного количества пассажей в течение 20 поколений и более, инкубация посевов до достижения стационарной фазы и т.п. Несмотря на то что эксперименты ALE являются достаточно длительными, данные исследования позволяют сократить потенциальный расход ресурсов при разработке соединения, производство которого может быть прекращено из-за развития резистентности.
Ключевые слова
Для цитирования:
Боровкова К.Е. Формирование устойчивости микроорганизмов в эксперименте in vitro: метод адаптивной лабораторной эволюции (обзор). Регуляторные исследования и экспертиза лекарственных средств. 2025;15(1):24-33. https://doi.org/10.30895/1991-2919-2024-656
For citation:
Borovkova K.E. Antimicrobial Resistance Development In Vitro: Adaptive Laboratory Evolution Method (Review). Regulatory Research and Medicine Evaluation. 2025;15(1):24-33. (In Russ.) https://doi.org/10.30895/1991-2919-2024-656
ВВЕДЕНИЕ
Открытие антибиотиков в XX веке изменило подход к лечению инфекционных заболеваний и помогло спасти миллионы жизней, однако в результате постоянно растущего и неправильного использования антибиотиков появились микроорганизмы, проявляющие устойчивость по отношению к известным антибактериальным средствам [1–5]. Для возможного решения данной проблемы во многих регионах мира была принята стратегия сдерживания устойчивости к антибактериальным препаратам. Всемирная организация здравоохранения (ВОЗ) разработала и опубликовала в 2001 г. схему процедур и мероприятий для замедления возникновения и снижения распространения резистентных микроорганизмов1. В 2016 г. на сессии Генеральной ассамблеи ООН главы государств приняли «обязательство развернуть широкую и скоординированную деятельность по борьбе с антибиотикорезистентностью», что инициировало разработку национальных планов действий по решению данной проблемы. В 2017 г. в России была разработана «Стратегия предупреждения распространения антимикробной резистентности в Российской Федерации на период до 2030 года»2. Принятие стратегий и планов подтверждает серьезность проблемы возникновения и распространения устойчивости микроорганизмов для всего человечества.
Эта проблема остается актуальной и на сегодняшний день, так как фармацевтические компании не успевают разрабатывать новые антибактериальные препараты в ответ на возникновение и быстрое распространение резистентности микроорганизмов. На увеличение темпов роста резистентности огромное влияние оказало неконтролируемое использование антибактериальных препаратов в сельском хозяйстве (для увеличения массы откармливаемых животных), а также в медицине — когда антибиотики назначаются не по показаниям и используются не по назначению [6]. Согласно прогнозам, ожидается, что через четверть века почти 100% бактерий будут устойчивы к большинству антибактериальных препаратов, используемых в медицине. Эксперты также прогнозируют, что число смертей из-за устойчивости к антибактериальным препаратам может вырасти до 10 млн к середине XXI века по сравнению с нынешним показателем (около 700 тыс. случаев) в год [7].
Для борьбы с возникновением и распространением резистентности микроорганизмов к антибактериальным препаратам необходимо продолжать поиски новых антибактериальных агентов, способных обходить механизмы защиты бактериальной клетки. При выводе в обращение нового антибактериального препарата следует заранее знать о его преимуществах и возможных рисках, в том числе о том, как быстро может возникнуть и распространиться резистентность среди бактериальных патогенов. Эта информация полезна не только с точки зрения общественного здравоохранения, но и для фармацевтической промышленности, поскольку позволяет сократить потенциальный расход ресурсов при разработке соединения, производство которого может быть прекращено из-за развития резистентности.
Одним из методов, позволяющих оценить возможность возникновения устойчивости микроорганизмов к антибактериальным препаратам, является метод адаптивной лабораторной эволюции (adaptive laboratory evolution, ALE). Однако из-за сложности данного метода при постановке теста необходимо учитывать методологические особенности, позволяющие создать необходимые условия для формирования устойчивости микроорганизмов в лабораторных условиях in vitro.
Цель работы — оценка возможности использования метода адаптивной лабораторной эволюции при изучении формирования устойчивости микроорганизмов.
Материалом для исследования являлись источники отечественной и зарубежной научной литературы (научные журналы и публикации научных конференций) информационно-поисковых (PubMed, Google Scholar) и библиографических баз данных (eLIBRARY.RU, КиберЛенинка). В обзор включали публикации, доступные на 26.04.2024. В приоритете были статьи, опубликованные за последние 5 лет. Наиболее часто применяемые ключевые слова и выражения, используемые для поиска публикаций и информации: антибиотики, антибактериальные препараты, резистентность, формирование устойчивости, адаптивная лабораторная эволюция, исследование ALE, antibiotics, antibacterial agents, resistance, resistance development, adaptive laboratory evolution, ALE study.
ОСНОВНАЯ ЧАСТЬ
Механизмы устойчивости бактерий
Устойчивость (резистентность) — одно из проявлений способности микроорганизмов адаптироваться к неблагоприятным условиям внешней среды. Под антибиотикорезистентностью подразумевают способность бактериальных возбудителей инфекционных болезней формировать устойчивость к антибактериальным препаратам [8]. Антибиотикорезистентность может быть природной (естественной) и приобретенной. Природная устойчивость является видовым признаком микроорганизма и характеризуется отсутствием мишени для конкретного антибактериального агента или ее недоступностью. Приобретенная устойчивость характеризуется способностью отдельных штаммов микроорганизмов выживать под действием антибактериальных препаратов в концентрациях, способных ингибировать основную часть бактериальной популяции данного вида3. Приобретенная устойчивость может возникать и распространяться в популяции бактерий в результате мутаций в генах, контролирующих синтез клеточных элементов, а также путем переноса генов [9]. Перенос генов антибиотикорезистентности между бактериями осуществляется за счет активности мобильных генетических элементов: способных самостоятельно перемещаться между бактериями (конъюгативные плазмиды и конъюгативные транспозоны), и способных перемещаться в пределах бактериальной клетки (по хромосоме, от хромосомы к плазмиде и наоборот: транспозоны, генные кассеты, интегроны и др.) [10]. Разнообразные механизмы горизонтального переноса генов среди даже филогенетически отдаленных видов бактерий способствовали возникновению множественной лекарственной устойчивости (полирезистентности) [11]. Данная проблема особенно значима для внутрибольничных инфекций, вызываемых так называемыми госпитальными штаммами3.
Действие антибактериальных препаратов может быть нейтрализовано по следующим механизмам (рис. 1) [1][8][10][12]:
- ограничение поступления антибактериального препарата в клетку — барьер возникает за счет слоя липополисахарида оболочки клетки у грамотрицательных бактерий;
- активный отток антибактериального препарата (эффлюкс-механизм) — отток возникает за счет транспортных систем, обеспечивающих активное выведение экзогенных веществ (в том числе и антибактериальных препаратов) из бактериальной клетки;
- инактивация антибактериального препарата — путем фактической деградации (распада) молекулы препарата или его модификации;
- модификация мишени действия антибактериального препарата — в результате мутаций в кодирующих их генах или иных генетических событий, что может привести к снижению или утрате способности мишени связываться с антибактериальным препаратом.
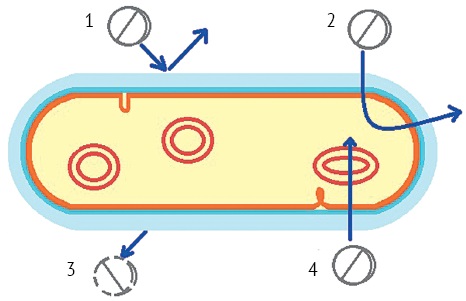
Рисунок подготовлен авторами / The figure is prepared by the author
Рис. 1. Основные механизмы антибактериальной резистентности: 1 — ограничение поступления в клетку; 2 — эффлюкс-механизм; 3 — инактивация; 4 — модификация мишени
Fig. 1. Main mechanisms involved in antimicrobial resistance: 1, reduced cell permeability; 2, efflux mechanism; 3, inactivation; 4, target modification
Устойчивость бактерий может вырабатываться относительно всех известных антибактериальных препаратов, и, возможно, не все механизмы нейтрализации антибактериального действия изучены.
Методы оценки устойчивости
Существуют различные методы, позволяющие оценить возможность возникновения устойчивости микроорганизмов к антибактериальным препаратам. Одними из таких методов являются методы математического моделирования, направленные на построение вероятностных моделей возникновения и распространения резистентности в микробных популяциях. Математические модели распространения устойчивости чаще используются для обоснования мероприятий в области общественного здравоохранения по борьбе с инфекционными заболеваниями, особенно в контексте новых патогенов [13]. Оценка устойчивости бактерий к антибактериальным препаратам обычно проводится с использованием стандартизированных фенотипических методов. Молекулярные методы используются в дополнение к фенотипическим методам обнаружения генов резистентности [14].
На формирование резистентности могут существенно влиять пространственные или временные неоднородности концентрации антибактериальных агентов [15]. Для оценки пространственно-временной эволюции микроорганизмов был разработан метод, в котором используется экспериментальное устройство — пластина Microbial Evolution and Growth Arena (MEGA). Данное устройство представляет собой чашку с питательной средой с антибактериальным препаратом, концентрация которого градиентно увеличивается от центра к периферии. Чашку инокулируют подвижной бактерией «дикого типа», которая изначально не обладает устойчивостью к используемому антибактериальному препарату. Подвижные бактерии, инокулированные в одном месте на пластине, локально истощают питательные вещества, а затем распространяются посредством хемотаксиса в другие области. Только наиболее устойчивые мутанты могут распространяться в секции, содержащие антибактериальный агент в высокой концентрации. Воздействие на бактерии пространственными градиентами антибиотиков приводит к значительному повышению устойчивости путем последовательных адаптивных шагов в конкурирующих линиях [16][17].
Для выявления новых механизмов резистентности и изучения влияния комбинаций и концентраций препаратов на эволюцию устойчивости бактерий к антибактериальным препаратам наиболее часто используют подход ALE [18]. Суть адаптивной лабораторной эволюции заключается в длительном выращивании микроорганизмов в определенных условиях, часто при селективном давлении. Данный подход также используют для создания промышленных штаммов с желаемыми характеристиками [19].
Впервые об эксперименте ALE было сообщено в 1950-х годах. А. Novick и L. Szilard опубликовали результаты исследования по спонтанным мутациям бактерий, культивируемых в хемостате. В результате длительного культивирования чувствительного к бактериальному вирусу штамма микроорганизма происходили мутации, способствующие появлению более «приспособленного» к вирусу штамма [20]. В 1988 г. R. Lenski начал долгосрочный эксперимент по ALE на Escherichia coli, продолжающийся до сих пор.
Постановку эксперимента ALE проводят тремя различными способами (рис. 2) [21]:
1) серийный (последовательный) перенос — основан на повторении субкультивирования бактерий на свежей жидкой среде через регулярные промежутки времени;
2) перенос колоний — основан на повторении посева штрихами одной колонии на чашке с агаром на следующую чашку со свежим агаром;
3) непрерывное культивирование — культивирование в хемостате с использованием ферментера, данный метод позволяет контролировать темпы роста, плотность популяции клеток, поступление питательных веществ и условия окружающей среды.
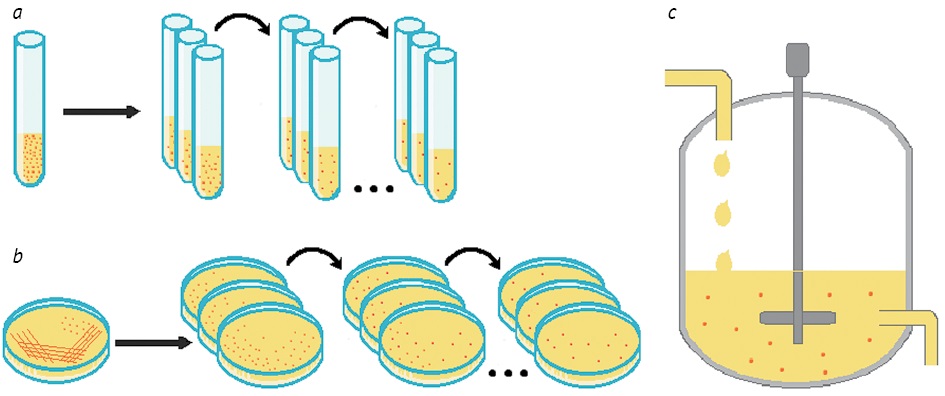
Рисунок подготовлен авторами / The figure is prepared by the author
Рис. 2. Методы постановки эксперимента ALE (adaptive laboratory evolution): a — последовательный перенос в жидкой среде; b — перенос колоний; c — непрерывное культивирование
Fig. 2. Experimental setups for adaptive laboratory evolution (ALE): a, serial transfer in a liquid medium; b, colony transfer; c, continuous chemostat culture
Постановка теста серийным переносом культуры позволяет автоматизировать процесс и проводить высокопроизводительные эксперименты. Однако данный способ неприменим к клеткам, которые агрегируют или образуют биопленку в жидкой культуре. Рост культуры по своей природе прерывистый, и контроль условий роста часто ограничен и временен для данного способа. При постановке теста на твердых средах переносом колоний следует учитывать, что данный способ характеризуется низкой пропускной способностью и имеет ограничения в автоматизации. Контролировать условия роста также сложно из-за прерывистого характера роста культуры. Однако преимуществом данного способа является возможность визуализации эволюционной динамики с помощью агара. Для метода непрерывного культивирования основным преимуществом является возможность контролировать условия окружающей среды. Однако данный способ имеет ограничение многократного параллельного повторения из-за стоимости эксплуатации установки. Клетки также могут адаптироваться к биореакторам путем образования биопленки, предотвращающей вымывание [21].
Методологические особенности проведения исследования ALE
Для анализа адаптационных механизмов антибиотикорезистентности и (или) выделения антибиотикорезистентных клонов может быть использован метод серийного переноса. В исследованиях по данной методике применяют разные условия давления на отбор мутантных бактерий. Обычно используют два режима концентраций антибактериального агента: суб-МПК (субингибирующие) — концентрации ниже минимальной подавляющей концентрации (МПК) и динамически увеличивающиеся концентрации [18][22]. Концентрации антибиотиков ниже МПК могут быть выбраны для получения низкого уровня резистентности микроорганизма, что в конечном итоге может привести к высокому уровню резистентности. Сообщалось, что несколько классов антибиотиков (таких как фторхинолоны, β-лактамы и аминогликозиды) на уровнях ниже МПК способны индуцировать SOS-ответ и общий стрессорный ответ регулона RpoS в клетках бактерий, что может приводить к генетическим изменениям, включая перемещение мобильных элементов, которые могут нести детерминанты резистентности или вирулентности, и увеличение скорости мутагенеза во время репликации хромосом [23].
Концентрация антибиотиков напрямую изменяет силу отбора, который испытывают мутантные бактерии в эксперименте ALE, и, следовательно, влияет на качественный и количественный результат эксперимента. В исследованиях с увеличением концентрации антибактериального агента оказывается постоянно сильное давление отбора на бактерии. Скорость изменения окружающей среды является решающим параметром для вымирания популяции бактерий. Изменения окружающей среды, которые превышают адаптационные возможности организма или оставляют слишком мало времени для адаптации, обычно приводят к вымиранию. Следовательно, во избежание чрезмерной гибели микроорганизмов можно использовать более медленную скорость изменения окружающей среды либо большее количество повторов, чтобы компенсировать вымирание линии [22].
R. Vinchhi, Ch. Jena и N. Matange разработали протокол адаптивной лабораторной эволюции устойчивости бактерий к антибактериальным препаратам для генетического и фенотипического анализа. Данный протокол описывает адаптивную лабораторную эволюцию устойчивости к антибактериальным препаратам на примере Escherichia coli K-12 MG1655 путем серийного пассирования штамма в питательной среде с добавлением антибиотиков. Этот протокол использовался для развития устойчивости к триметоприму, рифампицину, налидиксовой кислоте, спектиномицину и амоксициллину. В своем исследовании авторы использовали концентрации антибиотиков равные МПК/3, что, по мнению авторов, служит достаточным давлением для адаптивной лабораторной эволюции устойчивых к лекарствам бактерий. При использовании очень низких концентраций антибиотика может оказаться недостаточным давление отбора [18].
В исследовании по формированию устойчивости Streptococcus pneumoniae и Staphylococcus aureus к грамицидину С использовали антибактериальные агенты в концентрациях равных МПК и МПК/2 [24]. МПК антибактериального агента служит ориентиром для выбора концентраций в исследованиях по формированию устойчивости, поэтому перед последовательными пассажами бактерий с антибактериальным агентом устанавливают МПК для предкового штамма. Для определения МПК наиболее часто используют культуральные методы, основанные на выявлении фенотипической устойчивости путем оценки роста бактерий в присутствии антибактериальных агентов. Такими методами являются разведение агара, градиентный тест, диффузия в агаре (метод дисков) и микроразведение в бульоне [25][26].
Помимо выбора концентраций антибактериального агента, влияющих на отбор мутаций резистентности в популяции микроорганизмов, необходимо определить количество последовательных пассажей. Количество поколений, на которых необходимо провести эволюционный эксперимент, значительно влияет на результат экспериментов ALE. Стандартный эксперимент ALE по выделению устойчивых к препаратам бактерий может проводиться в течение 20–100 поколений, хотя для некоторых целей могут потребоваться более длительные эксперименты. Для эксперимента ALE можно использовать «узкое место» в пассаже в размере 0,1–10%, хотя чаще всего используется 1%, что приводит к 6–7 поколениям бактерий за цикл роста [18]. «Узкие места», то есть сокращение размера бактериальной популяции, приводят к усилению влияния случайных эффектов (генетического дрейфа) в ходе эволюции бактерий [27].
Также немаловажным фактором, влияющим на отбор мутантных бактериальных клеток, является длительность инкубации бактерий. 24-часовой цикл роста значительно упрощает проведение эксперимента и избавляет от необходимости пересевать культуры в нерабочее время. Однако это также приводит к длительной инкубации клеток в стационарной фазе. Стационарная фаза — это фаза роста бактериальной популяции, когда число жизнеспособных клеток достигает своего максимума, рост бактерий прекращается, но клетки при этом остаются метаболически активными. В период отсутствия роста бактерии экспрессируют гены, необходимые для их выживания. Формирование персистирующих клеток (формы покоящихся клеток) также приписывают генам, дифференциально экспрессирующимся в стационарной фазе. Персистирующие клетки устойчивы к воздействию антибиотиков и часто являются основной причиной лекарственной устойчивости [28]. Таким образом, выбор продолжительности инкубации должен определяться на основании закономерности роста популяции бактериальных клеток. Определение скорости роста и времени до достижения стационарной фазы бактериальной культуры необходимо проводить перед началом эксперимента ALE.
Чтобы оценить надежность и стохастическую природу эволюционных изменений, в каждом эксперименте одновременно используют несколько независимых линий культур [29]. При каждом пассаже бактерий в среду, содержащую антибиотик, параллельно ведут пассажи бактериальных клеток в среду без антибиотика. Эти контрольные линии бактериальных клеток служат для выявления изменений, вызванных воздействием антибактериального препарата [18]. Многие типичные эксперименты по ALE были проведены во встряхиваемых колбах и аналогичных условиях выращивания с плотностью клеток 10⁷–10⁹ клеток/мл для типичных бактериальных культур [30]. Инкубацию посевов проводят в термостате при постоянном встряхивании для предотвращения оседания бактериальных клеток. После инкубации выращенные культуры повторно инокулируют в свежую среду с добавлением антибиотика в соответствующей концентрации, чтобы инициировать цикл роста 2 (или пассаж 2). Далее повторяют столько циклов роста, сколько необходимо для исследования.
При постановке теста с большим количеством повторов (>10) желательно использовать небольшие объемы культуры, 150–200 мкл, в 96-луночных планшетах. Для отслеживания генетических или фенотипических изменений бактерий в ходе исследования сохраняют часть культуры путем замораживания. При длительном исследовании возможно проводить замораживание каждые 10 пассажей или при каждом повышении концентрации антибиотика [18][31]. В исследованиях с использованием 96-луночных планшетов возможно сохранение оставшихся клеток в лунках путем добавления в них глицерина до концентрации 20% и хранение планшетов при -80 °C [22]. С сохраненными клетками проводят дальнейшие исследования по оценке формирования устойчивости. При обнаружении увеличения МПК в сравнении с предковым штаммом можно оценить стабильность выявленной устойчивости. Для этого проводят последовательные пассажи бактериальных клеток (с увеличенной МПК) в среду без антибактериального агента, после чего определяют МПК для каждого пассажа. Таким образом, бактерии могут восстановить свою чувствительность к антибактериальному агенту до уровня концентрации, который наблюдался перед многократным воздействием антибактериального препарата на них [31].
Исходя из представленных данных по постановке теста методом адаптивной лабораторной эволюции (ALE), можно указать основные параметры (табл. 1), влияющие на результаты исследования формирования устойчивости микроорганизмов.
Таблица 1. Ключевые условия метода адаптивной лабораторной эволюции (ALE)
Table 1. Key conditions of the adaptive laboratory evolution (ALE) method
|
Параметры Parameters |
Характеристики Characteristics |
|
Определение МПК антибактериального агента Determination of the MIC of the antibacterial agent |
Устанавливают МПК антибактериального агента для предкового штамма культуральными методами The MIC of the antibacterial agent is determined for the ancestral strain using culture techniques |
|
Концентрация антибактериального агента Antibacterial agent concentrations |
Используют субингибирующие или динамически увеличивающиеся относительно МПК концентрации The experiment uses sub-inhibitory or dynamically increasing concentrations relative to the MIC |
|
Определение достоверности и стохастической природы эволюционных изменений Determination of the reliability and stochastic nature of evolutionary changes |
Одновременное ведение нескольких независимых линий культур Multiple parallel independent cultures are maintained |
|
Длительность инкубации бактерий с антибактериальным агентом Duration of incubation of bacteria with the antibacterial agent |
До достижения стационарной фазы Incubation lasts until the stationary phase is reached |
|
Количество последовательных пассажей Number of consecutive passages |
В течение 20–100 поколений, для некоторых целей могут потребоваться более длительные эксперименты Cultures are passaged for 20–100 generations; longer experiments may be required for some purposes |
|
Отслеживание генетических или фенотипических изменений культуры Monitoring of genetic or phenotypic changes in culture |
Сохранение части культур в ходе исследования путем замораживания Portions of cultures are preserved during research by freezing |
Таблица составлена авторами / The table is prepared by the author
Примечание. МПК — минимальная подавляющая концентрация.
Note. MIC, minimum inhibitory concentration.
ЗАКЛЮЧЕНИЕ
Одним из методов оценки формирования устойчивости микроорганизмов к антибактериальным препаратам является анализ адаптивной лабораторной эволюции (ALE). ALE предполагает длительное культивирование микроорганизмов в условиях селективного давления. Данный метод может использоваться для прогнозирования появления антибиотикоустойчивых мутантов в бактериальных популяциях. Исследования ALE являются достаточно трудоемкими и длительными. Не существует стандартизированных процедур для проектирования и проведения экспериментов по адаптивной лабораторной эволюции.
Основными условиями, позволяющими получить надежные результаты при постановке эксперимента методом ALE, являются: определение МПК антибактериального агента к предковому штамму культуральными методами; использование субингибирующих или динамически увеличивающихся концентраций антибактериального агента относительно МПК; ведение нескольких независимых линий культур для определения надежности и стохастической природы эволюционных изменений; инкубация бактерий с антибактериальным агентом до достижения стационарной фазы; использование определенного количества пассажей в течение 20 поколений и более; сохранение части культур в ходе исследования путем замораживания для отслеживания генетических или фенотипических изменений. Таким образом, поскольку эксперименты ALE основаны на долгосрочном культивировании, они должны быть тщательно разработаны и подготовлены с учетом целей исследований.
Вклад авторов. Автор подтверждает соответствие своего авторства критериям ICMJE.
Authors’ contributions. The author confirms that she meets the ICMJE criteria for authorship.
1. WHO global strategy for containment of antimicrobial resistance. Geneva: WHO; 2001.
2. Распоряжение правительства Российской Федерации № 2045-р от 25.09.2017 «О стратегии предупреждения распространения антимикробной резистентности в Российской Федерации на период до 2030 года».
3. Зверев ВВ, Бойченко МН. Медицинская микробиология, вирусология и иммунология. Учебник. Т. 1. М.: ГЭОТАР-Медиа; 2016.
Список литературы
1. Salam MA, Al-Amin MY, Salam MT, Pawar JS, Akhter N, Rabaan AA, et al. Antimicrobial resistance: A growing serious threat for global public health. Healthcare (Basel). 2023;11(13):1946. https://doi.org/10.3390/healthcare11131946
2. Endale H, Mathewos M, Abdeta D. Potential causes of spread of antimicrobial resistance and preventive measures in one health perspective — a review. Infect Drug Resist. 2023;16:7515–45. https://doi.org/10.2147/IDR.S428837
3. Ayukekbong JA, Ntemgwa M, Atabe AN. The threat of antimicrobial resistance in developing countries: Causes and control strategies. Antimicrob Resist Infect Control. 2017;6:47. https://doi.org/10.1186/s13756-017-0208-x
4. Watkins RR, Bonomo RA. Overview: Global and local impact of antibiotic resistance. Infect Dis Clin North Am. 2016;30(2):313–22. https://doi.org/10.1016/j.idc.2016.02.001
5. Collaborators AR. Global burden of bacterial antimicrobial resistance in 2019: A systematic analysis. Lancet. 2022;399(10325):629–55. https://doi.org/10.1016/S0140-6736(21)02724-0
6. Намазова-Баранова ЛС, Баранов АА. Антибиотикорезистентность в современном мире. Педиатрическая фармакология. 2017;14(5):341–54. https://doi.org/10.15690/pf.v14i5.1782
7. Halawa EM, Fadel M, Al-Rabia MW, Behairy A, Nouh NA, Abdo M, et al. Antibiotic action and resistance: Updated review of mechanisms, spread, influencing factors, and alternative approaches for combating resistance. Front Pharmacol. 2024;14:1305294. https://doi.org/10.3389/fphar.2023.1305294
8. Сидоренко СВ, Тишков ВИ. Молекулярные основы резистентности к антибиотикам. Успехи биологической химии. 2004;44:263–306.
9. Peterson E, Kaur P. Antibiotic resistance mechanisms in bacteria: Relationships between resistance determinants of antibiotic producers, environmental bacteria, and clinical pathogens. Front Microbiol. 2018;9:2928. https://doi.org/10.3389/fmicb.2018.02928
10. Супотницкий МВ. Механизмы развития резистентности к антибиотикам у бактерий. БИОпрепараты. Профилактика, диагностика, лечение. 2011;(2):4–13. EDN: RDTUFZ
11. Землянко ОМ, Рогоза ТМ, Журавлева ГА. Механизмы множественной устойчивости бактерий к антибиотикам. Экологическая генетика. 2018;16(3):4–17. https://doi.org/10.17816/ecogen1634-17
12. Reygaert WC. An overview of the antimicrobial resistance mechanisms of bacteria. AIMS Microbiol. 2018;4(3):482–501. https://doi.org/10.3934/microbiol.2018.3.482
13. Niewiadomska AM, Jayabalasingham B, Seidman JC, Willem L, Grenfell B, Spiro D, et al. Population-level mathematical modeling of antimicrobial resistance: A systematic review. BMC Med. 2019;17(1):81. https://doi.org/10.1186/s12916-019-1314-9
14. Anjum MF, Zankari E, Hasman H. Molecular methods for detection of antimicrobial resistance. Microbiol Spectr. 2017;5(6):10. https://doi.org/10.1128/microbiolspec.arba-0011-2017
15. Steel H, Papachristodoulou A. The effect of spatiotemporal antibiotic inhomogeneities on the evolution of resistance. J Theor Biol. 2020;486:110077. https://doi.org/10.1016/j.jtbi.2019.110077
16. Baym M, Lieberman TD, Kelsic ED, Chait R, Gross R, Yelin I, et al. Spatiotemporal microbial evolution on antibiotic landscapes. Science. 2016;353(6304):1147–51. https://doi.org/10.1126/science.aag0822
17. Kleinman A. The Kishony mega-plate experiment, a Markov process. bioRxiv. 2021;474071. https://doi.org/10.1101/2021.12.23.474071
18. Vinchhi R, Jena C, Matange N. Adaptive laboratory evolution of antimicrobial resistance in bacteria for genetic and phenotypic analyses. STAR Protoc. 2023;4(1):102005. https://doi.org/10.1016/j.xpro.2022.102005
19. Дебабов ВГ. Современные подходы к созданию промышленных штаммов микроорганизмов. Генетика. 2015;51(4):365–76. https://doi.org/10.7868/S0016675815040049
20. Novick A, Szilard L. Experiments with the Chemostat on spontaneous mutations of bacteria. Proc Natl Acad Sci USA. 1950;36(12):708–19. https://doi.org/10.1073/pnas.36.12.708
21. Hirasawa T, Maeda T. Adaptive laboratory evolution of microorganisms: Methodology and application for bioproduction. Microorganisms. 2023;11(1):92. https://doi.org/10.3390/microorganisms11010092
22. Jahn LJ, Munck C, Ellabaan MMH, Sommer MOA. Adaptive laboratory evolution of antibiotic resistance using different selection regimes lead to similar phenotypes and genotypes. Front Microbiol. 2017;8:816. https://doi.org/10.3389/fmicb.2017.00816
23. Li J, Xie S, Ahmed S, Wang F, Gu Y, Zhang C, et al. Antimicrobial activity and resistance: influencing factors. Front Pharmacol. 2017;8:364. https://doi.org/10.3389/fphar.2017.00364
24. Гуров АВ, Боровкова КЕ, Крышень КЛ, Никифорова ЛР, Салмова ЮВ. Оценка бактерицидной активности грамицидина С в отношении клинических изолятов Streptococcus pneumoniae и Staphylococcus aureus при однократном и многократном воздействии. Антибиотики и химиотерапия. 2022;67(7–8):8–18. https://doi.org/10.37489/0235-2990-2022-67-7-8-8-18
25. Kaprou GD, Bergšpica I, Alexa EA, Alvarez-Ordóñez A, Prieto M. Rapid methods for antimicrobial resistance diagnostics. Antibiotics (Basel). 2021;10(2):209. https://doi.org/10.3390/antibiotics10020209
26. Guliy OI, Evstigneeva SS, Karavaeva OA. Antimicrobial resistance and current methods for its detection. Front Biosci Elite. 2023;15(3):19. https://doi.org/10.31083/j.fbe1503019
27. Mahrt N, Tietze A, Künzel S, Franzenburg S, Barbosa C, Jansen G, et al. Bottleneck size and selection level reproducibly impact evolution of antibiotic resistance. Nat Ecol Evol. 2021;5(9):1233–42. https://doi.org/10.1038/s41559-021-01511-2
28. Jaishankar J, Srivastava P. Molecular basis of stationary phase survival and applications. Front Microbiol. 2017;8:2000. https://doi.org/10.3389/fmicb.2017.02000
29. Maeda T, Furusawa C. Laboratory evolution of antimicrobial resistance in bacteria to develop rational treatment strategies. Antibiotics (Basel). 2024;13(1):94. https://doi.org/10.3390/antibiotics13010094
30. Dragosits M, Mattanovich D. Adaptive laboratory evolution — principles and applications for biotechnology. Microb Cell Fact. 2013;12:64. https://doi.org/10.1186/1475-2859-12-64
31. Hong J, Hu J, Ke F. Experimental induction of bacterial resistance to the antimicrobial peptide tachyplesin I and investigation of the resistance mechanisms. Antimicrob Agents Chemother. 2016;60(10):6067–75. https://doi.org/10.1128/AAC.00640-16
Об авторе
К. Е. БоровковаРоссия
Боровкова Кристина Евгеньевна
Заводская ул., д. 3, к. 245, г.п. Кузьмоловский, Всеволожский район, Ленинградская обл., 188663
Дополнительные файлы
Рецензия
Для цитирования:
Боровкова К.Е. Формирование устойчивости микроорганизмов в эксперименте in vitro: метод адаптивной лабораторной эволюции (обзор). Регуляторные исследования и экспертиза лекарственных средств. 2025;15(1):24-33. https://doi.org/10.30895/1991-2919-2024-656
For citation:
Borovkova K.E. Antimicrobial Resistance Development In Vitro: Adaptive Laboratory Evolution Method (Review). Regulatory Research and Medicine Evaluation. 2025;15(1):24-33. (In Russ.) https://doi.org/10.30895/1991-2919-2024-656



































