Перейти к:
Методы доклинической оценки эффективности противоопухолевых лекарственных средств in vivo (обзор)
https://doi.org/10.30895/1991-2919-2025-655
Резюме
ВВЕДЕНИЕ. Основной риск низкой транслируемости результатов доклинических исследований препаратов для лечения онкологических заболеваний в клиническую практику базируется на сложности моделирования клинических условий в эксперименте. Всего около 5% из общего числа препаратов-кандидатов оказываются эффективными в клинических условиях, поэтому поиск новых подходов для доклинической оценки эффективности противоопухолевых лекарственных препаратов является одним из актуальных направлений в медицине.
ЦЕЛЬ. Анализ и систематизация методов, используемых в доклинических исследованиях эффективности противоопухолевых средств в условиях in vivo, для формирования методической поддержки при планировании экспериментальной работы с моделированием опухолевого процесса.
ОБСУЖДЕНИЕ. Рассмотрены этапы создания опухолевых моделей на животных, выбора клеточных линий, их тестирования на туморогенность и жизнеспособность. Показано, что использование систем визуализации, окраски витальными красителями, флуоресцентного и люминесцентного методов позволяет производить оценку эффективности противоопухолевых препаратов на моделях как солидных, так и гематологических опухолей. Основные разновидности опухолевых моделей на мышах представлены в виде схемы. Показано, что универсальной модели для экспериментального моделирования опухолевых заболеваний in vivo не существует. Особое внимание при выборе моделей и оценке их преимуществ и недостатков следует уделять сходству механизмов заболевания в модели и у человека на тканевом и молекулярном уровнях в зависимости от поставленных задач исследования.
ВЫВОДЫ. Результаты проведенного сравнительного анализа методов доклинической оценки эффективности противоопухолевых средств необходимы для планирования экспериментальных исследований и для обеспечения достоверности получаемых результатов. Правильный выбор метода исследований позволит повысить успех трансляции экспериментальных данных в клиническую практику.
Ключевые слова
Для цитирования:
Васютина М.Л., Лепик К.В., Истомина М.С., Левчук К.А., Петухов А.В., Щелина Е.В., Ершова А.Е., Демидов О.Н., Торопова Я.Г. Методы доклинической оценки эффективности противоопухолевых лекарственных средств in vivo (обзор). Регуляторные исследования и экспертиза лекарственных средств. 2025;15(3):289-300. https://doi.org/10.30895/1991-2919-2025-655
For citation:
Vasyutina M.L., Lepik K.V., Istomina M.S., Levchuk K.A., Petukhov A.V., Shchelina E.V., Ershova A.E., Demidov O.N., Toropova Ya.G. Methods for Preclinical Assessment of the Efficacy of Anticancer Medicines in vivo (Review). Regulatory Research and Medicine Evaluation. 2025;15(3):289-300. (In Russ.) https://doi.org/10.30895/1991-2919-2025-655
ВВЕДЕНИЕ
Онкологические заболевания характеризуются сложностью патогенеза и на разных стадиях своего развития демонстрируют ряд специфических признаков, таких как неконтролируемая пролиферация, подавление клеточной гибели, стимуляция ангиогенеза, активация инвазии и метастазирования. Поиск подходов для лечения онкологических заболеваний является одним из актуальных направлений медицины. При этом среди вновь разрабатываемых лекарственных средств всего около 5% из общего числа препаратов-кандидатов демонстрируют свою эффективность в клинических условиях [1][2]. Основной риск низкой транслируемости противоопухолевых эффектов лекарственных препаратов в клиническую практику базируется на сложности воспроизведения злокачественного новообразования в эксперименте [3]. Исследования in vitro не позволяют в полной мере воспроизвести весь комплекс патогенетических звеньев, характерных для опухолевого процесса в организме [4]. Модели in vitro пригодны на этапе скрининга, а также для подтверждения эффективности препарата в рамках пилотных экспериментов «proof-of-concept» (т.е. проверки концепции применимости). Ключевую роль в успехе трансляции противоопухолевых инноваций в клиническую практику играет выбор релевантной модели опухолевого процесса на животных [5][6].
Представленные в литературе методологические подходы к моделированию опухолевых процессов в эксперименте, а также методы исследования и оценки эффективности противоопухолевых лекарственных препаратов с различными механизмами действия требуют анализа их применимости и информативности.
Цель работы — анализ и систематизация методов, используемых в доклинических исследованиях эффективности противоопухолевых средств в условиях in vivo для формирования методической поддержки при планировании экспериментальной работы с моделированием опухолевого процесса.
В обзор включены публикации с открытым доступом в базах данных PubMed и Google Scholar на 10 октября 2024 г. В приоритете были научные статьи, опубликованные за последние 5–10 лет. Ключевыми словами для поиска являлись: ксенографтные модели; PDX (patient-derived xenograft — ксенотрансплантат, полученный от пациента); in vivo визуализация; противоопухолевая активность; модели рака на животных; доклинические исследования.
ОСНОВНАЯ ЧАСТЬ
Подготовка опухолевых клеток для моделирования опухолевого процесса на лабораторных животных
Крупнейшие на сегодняшний день клеточные банки содержат более 1800 линий клеток человека и более 1500 клеток линий животных [7][8]. Такое разнообразие клеточных линий позволяет подобрать наиболее валидную клеточную модель исходя из поставленных задач в рамках запланированных исследований. Основной критерий для создания релевантной модели in vivo: клеточная линия должна отражать основные генотипические и фенотипические характеристики опухоли, в отношении которой направлена разрабатываемая терапия. Существуют панели опухолевых линий, категоризированных не только по нозологиям, но и по генетическим особенностям, таким как мутация, на которую направлена разрабатываемая терапия, или экспрессия опухолевых неоантигенов [9–11].
Методы визуализации антителами позволяют идентифицировать поверхностные и (или) внутриклеточные онкомаркеры (иммуногистохимически [12] или при использовании проточной цитофлуометрии [13]), а затем подтверждать наличие мутаций с помощью секвенирования целевой последовательности. Для проверки соответствия клеточных линий предполагаемому генотипу существует возможность проведения STR-типирования (short tandem repeats — короткие тандемные повторы).
Высокая вероятность развития опухолевого процесса у животных характерна не для всех клеточных линий. В связи с этим на этапе планирования экспериментов целесообразно проводить анализ конкретных опухолевых линий на туморогенность, используя при этом данные научной литературы. Полученные результаты позволят повысить успешность трансфера при переходе к исследованиям in vivo.
Для повышения успешности моделирования опухолевого процесса у животных с помощью введения в их организм опухолевых клеток рекомендуется провести ряд следующих тестов: тесты на жизнеспособность и пролиферацию клеток, анализы миграции и инвазии, детекцию апоптоза и других типов клеточной смерти, окраску сенесцентных клеток, определение энергетического метаболизма и его изменений, оценку ангиогенеза, окислительного стресса, анализы экспрессии генов и белков ключевых сигнальных путей [14–16].
Большинство доступных к использованию тестов основаны на определении активности клеточных ферментов, скорости синтеза и количественного содержания ДНК, уровня клеточного АТФ и целостности мембран, которые являются индикаторами жизнеспособности клеток [17][18]. Окраска витальными красителями (трипановый синий) позволяет выявить клетки с нарушением целостности мембраны. Для оценки пролиферативного потенциала проводят исследование включения 3[Н]тимидина с последующей оценкой суммарной включенной радиоактивности, однако метод ограничен в использовании из-за требований по радиационной безопасности [19].
Для определения жизнеспособности клеток широко используют фермент-субстратные методы c последующим колориметрическим или флуориметрическим анализом. К их числу можно отнести измерения внеклеточного уровня цитозольного фермента лактатдегидрогеназы (LDH-тест). Также применяют тесты, основанные на превращении субстрата жизнеспособными клетками в окрашенный или флуоресцентный продукт, содержание которого прямо пропорционально количеству жизнеспособных клеток. Принцип действия этих тестов основан на способности митохондриальных дегидрогеназ живых клеток восстанавливать соли тетразолия до водонерастворимых кристаллов пурпурного формазана, которые после растворения в органических растворителях определяют колориметрическим способом [20]. Для этой цели могут быть использованы различные соли тетразолия: 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромид (МТТ), 3-(4,5-диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфофенил)-2H-тетразолий (MTS), 2,3-бис-(2-метокси-4-нитро-5-сульфофенил)-2H-тетразолий-5-карбоксанилид (ХТТ), 2-(2-метокси-4-нитропентил)-3-(4-нитропентил)-5-(2,4-дисульфофенил)-2H-тетразолий (WST-8). Кроме того, используют проникающие сквозь клеточную мембрану ДНК-красители, имеющие флуоресценцию при связывании с нуклеиновыми кислотами для специфического окрашивания ядер: 7-аминоактиномицин D (7-AAD), пропидий йодид, DRAQ7™ и др. [21][22].
Ключевую роль в количественной оценке жизнеспособности индивидуальных клеток играет метод проточной цитофлуориметрии. Фенотипирование опухолевых клеток имеет особое значение для исследования противоопухолевой активности исследуемых препаратов в отношении пула опухолевых и лейкемических стволовых клеток [23]. Кроме того, существует подход, основанный на анализе способности одной клетки вырасти в колонию (клоногенный анализ или анализ образования колоний)1 [24]. Для непрерывного мониторинга пролиферации клеток используют платформы, требующие специализированного оборудования: IncuCyte, Cell-IQ, Evos XL Core, ZEISS Celldiscoverer 7, Cytation 5, xCELLigence RTCA, которые позволяют в режиме реального времени визуализировать и регистрировать клеточные изменения. Для тестирования миграции опухолей и инвазии наиболее распространенным методом является Скретч-тест (scratch assay), направленный на оценку скорости зарастания дефекта монослоя клеток. Принцип данного метода заключается в создании стандартизованного повреждения монослоя, которое инициирует миграцию опухолевых клеток, находящихся на краю данного повреждения, в свободную сторону [25]. Более информативными методами для этих целей являются: анализ миграции клеток с помощью камеры Бойдена, миграции клеток в капиллярной камере, анализ зоны исключения клеток, миграции сфероидов и мониторинг миграции клеток в реальном времени, в том числе с помощью оборудования xCELLigence.
Моделирование опухолевого процесса на лабораторных животных
При большом количестве исследований в области экспериментального моделирования опухолевых заболеваний in vivo идеальной (универсальной) модели все еще не существует. Поэтому при выборе моделей необходимо оценить их особенности, достоинства и недостатки, степень пригодности для решения поставленных задач. При моделировании опухолевого процесса на животных должно быть соблюдено ключевое условие — сходство механизмов заболевания в модели и у человека на различных уровнях (в зависимости от поставленных задач — тканевой, молекулярный) [26–29].
Для моделирования злокачественных опухолей и последующей оценки эффективности исследуемых препаратов с противоопухолевым эффектом могут быть использованы животные различных видов, включая Danio rerio (зебрафиш) [30][31], генетически модифицированных свиней [32–35] и нечеловекообразных приматов [36–39]. Эти модели имеют значительный потенциал в области онкологических исследований, однако классическим объектом для моделирования рака являются лабораторные мыши [40–42]. Основные разновидности опухолевых моделей на мышах представлены на рисунке 1.
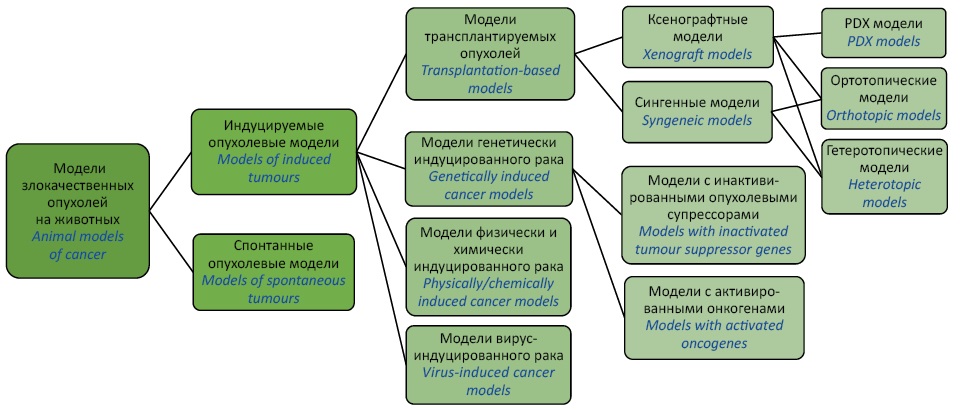
Рисунок подготовлен авторами по данным источников [26–29][40–42] / The figure is prepared by the authors using data from [26–29][40–42]
Рис. 1. Разновидности моделей злокачественных опухолей на животных. PDX (patient-derived xenograft) — ксенотрансплантат, полученный от пациента
Fig. 1. Variety of animal models in cancer research. PDX, patient-derived xenograft
С точки зрения прогностической фармакологии основными задачами при разработке и в доклинических исследованиях противоопухолевых препаратов являются [43]:
- демонстрация ингибирования патологического процесса (ингибирование опухолевого роста, влияние на отдельные патогенетические звенья опухолевого процесса);
- идентификация и валидация биомаркеров доклинической модели (путем сравнения профилей экспрессии генов первичных опухолей в ходе терапии);
- поиск комбинированных подходов к лечению злокачественных новообразований;
- исследование роли отдельных генов в развитии опухолевого процесса;
- определение механизма действия препаратов;
- анализ побочных эффектов.
Использование одной модели не позволяет отразить патогенез опухолевого процесса с учетом генетики, эпигенетики, иммунологии, гистопатологии и гетерогенности. В ходе одного исследования, связанного с разработкой и тестированием противоопухолевых препаратов, возможно использование нескольких моделей in vitro и in vivo [44][45]. Также в некоторых случаях динамику опухолевого роста in vivo целесообразно оценивать с использованием гетеротопических моделей, а оценку продолжительности жизни — с помощью ортотопических.
Опухоли, индуцированные у лабораторных животных с помощью химического или физического воздействия, как и при спонтанном опухолевом процессе, развиваются непосредственно из клеток хозяина. Следовательно, преимуществом этих моделей в сравнении с моделями перевиваемых опухолей является бóльшая приближенность патогенеза к действительному клиническому сценарию [46]. Однако существует видовая чувствительность к химическим веществам-канцерогенам, связанная с особенностями их метаболизма у различных животных в органах-мишенях [47–49]. Поэтому наиболее часто применяют модели перевиваемых опухолей и используют для этого линии раковых клеток, тканевые или клеточные материалы, полученные от человека или лабораторных животных.
В зависимости от метода трансплантации такие модели могут быть разделены на гетеротопические и ортотопические. В качестве примера гетеротопической трансплантации можно привести подкожное или внутрибрюшинное введение опухолевых клеток молочной железы. В этом случае опухоль будет развиваться в области участка введения с образованием твердых (солидных) опухолевых узлов под кожей или асцитных изменений в брюшной полости соответственно. Процедура инокуляции в этом случае проста в техническом исполнении, что удобно для проведения скрининговых исследований противоопухолевых препаратов.
Ортотопическая трансплантация предполагает инокуляцию опухоли непосредственно в орган-мишень путем инъекции или, нередко, хирургических манипуляций. Например, модель рака мочевого пузыря у мышей была создана с использованием ортотопической трансплантации клеток карциномы мочевого пузыря человека UM-UC-3 [50]. Было показано, что хирургическая трансплантация усиливает метастатическую активность опухоли [51]. Такой подход позволяет приблизить процесс моделирования к естественному развитию опухоли с учетом формирования стромы, микроокружения, ангиогенеза и ответа на терапию.
В зависимости от происхождения трансплантируемого опухолевого материала модели на животных разделяют на сингенные и ксенографтные. Сингенные модели предполагают использование опухолевого материала, полученного от животных того же вида, на котором производится моделирование. Также необходимо сродство генетического фона для того, чтобы обеспечить максимальный уровень приживления трансплантата и снизить вероятность не связанного с онкологией иммунного ответа. Опухоли в этом случае, как правило, изначально спонтанные или химически индуцированные, поддерживаются и банкируются в виде клеточных линий и могут быть сравнительно легко привиты животным в исследовании. Однако в таких моделях отсутствует возможность изучить отдельные патогенетические механизмы, видоспецифичные для человека.
Ксенографтные модели являются наиболее часто используемыми в доклинических испытаниях. В данном случае для трансплантации используется опухолевый материал или клеточные линии, полученные от человека, что приближает такие модели к фактическим клиническим сценариям.
Следует учитывать, что в зависимости от участка трансплантации поведение опухоли может меняться: во время введения опухолевые клетки подвергаются кинетическим изменениям, часто при пассажах снижается скорость удвоения, однако ксенотрансплантированные опухоли человека сохраняют множество оригинальных морфологических и биохимических характеристик. Поэтому именно ксенографтные модели на текущий момент являются наиболее востребованными [52].
Поскольку трансплантат имеет видовую специфику, для исключения реакции «трансплантат против хозяина» животные для моделирования должны обладать определенной степенью иммунодефицита, который может быть достигнут путем медикаментозной иммуносупрессии или хирургически (удаление тимуса). Однако такие подходы трудоемки и не в полной мере поддаются валидации, в отличие от использования генетически модифицированных иммунодефицитных животных. Наиболее часто используют атимических мышей (например, линия Balb/c-Nude) и мышей с комбинированным иммунодефицитом (severe combined immunodeficiency, SCID). На фоне отсутствия определенных компонентов иммунной системы такие животные не демонстрируют отторжения трансплантируемого материала.
Использование мышей линии NSG (NOD/SCID/Gamma) позволило вывести биомоделирование на новый уровень. Тяжелый комбинированный иммунодефицит животных этой линии определяет возможность выполнения трансплантации различных типов человеческих клеток и тканей. В случае модификации этой линии и ее аналогов (NOG hIL2, NSG-SGM) может быть учтена специфика гемопоэза и иммунитета человека, реализована экспрессия человеческих цитокинов, что позволяет в еще большей степени воссоздать вероятные иммунные ответы на терапию, например в случае применения биологически модифицированных клеточных продуктов, таких как CAR-T (chimeric antigen receptor T-cells — Т-клетки с химерным антигенным рецептором) [53].
Особый интерес для исследований представляют гуманизированные животные [54]. Взаимосвязь состояния иммунной системы организма с вероятностью канцерогенеза и с ответом на противоопухолевую терапию [55] использована в исследованиях по иммунотерапии рака [56][57]. Гуманизированные мыши — модельный объект, особенностью которого является наличие человеческих генов, клеток или тканей, что позволяет в большей степени отобразить специфику патофизиологических процессов, характерных для человека [58].
Гуманизированные мыши с функционирующими звеньями иммунной системы человека используются для исследования роли иммунных механизмов в патогенезе рака у человека [59–61]. Для получения таких животных применяется трансплантация человеческих гематопоэтических клеток, для приживления которых необходимо предварительное подавление гематопоэза, которое достигается путем облучения иммунодефицитных мышей (irNSG, irradiated NOD/SCID/Gamma) или же путем генетической модификации (линия NBSGW) [62].
Области применения, ограничения и преимущества моделей трансплантируемых опухолей у мышей представлены в таблице 1.
Таблица 1. Модели трансплантируемых опухолей у лабораторных мышей [1][63–66]
Table 1. Transplantation-based tumour models in laboratory mice [1][63–66]
Модель Model | Применение Application | Преимущества Advantages | Ограничения Limitations |
Ксенографты клеточных линий (CDX) Cell-derived xenografts | · Скрининг молекул-кандидатов (фармакокинетика, эффективность) · Тестирование широкого спектра противоопухолевых препаратов различного механизма действия, в том числе клеточных продуктов · Некоторые модели могут быть использованы для исследования процессов метастазирования · Screening candidate molecules (pharmacokinetics, efficacy) · Testing a wide range of anticancer medicinal products varying in the mechanism of action (including cell-based medicinal products) · Studying the mechanism of metastasis (some models) | · Доступная логистика · Стандартизированность · Наличие вариантов с люминесцентными и флуоресцентными метками · Affordable logistics · High level of standardisation · Available options with fluorescent and luminescent labels | · Низкая предиктивность · Ограниченная генетическая однородность · Необходимо использование иммунодефицитных мышей, т.е. нежелательны при исследовании иммуноопосредованных эффектов · Low predictive value · Limited genetic homogeneity · Need for immunodeficient mice (not eligible for studying immune-mediated effects) |
Ксенографты опухолей, полученных от пациентов (PDX) Patient-derived xenografts | · Скрининг препаратов · Исследование эффективности · Исследование фармакодинамики · Исследование механизмов устойчивости к препаратам · Screening medicinal product candidates · Studying the efficacy · Studying pharmacodynamics · Studying drug resistance mechanisms | · Гистологическое сходство с исходной опухолью пациента · Подробно охарактеризованы · Показывают высокий уровень предиктивности · Histological similarity between patient tumours and patient-derived xenografts · High level of characterisation · High predictive value | · Необходимо использование иммунодефицитных мышей · Затрудненная логистика и сравнительная дороговизна · Обычно показывают более медленный рост · Need for immunodeficient mice · Cumbersome logistics and relatively high cost · Lower growth rate (usually) |
Модели на гуманизированных животных Humanised animal models | · Разработка терапевтических подходов в случае отсутствия «мышиного гомолога» мишени или суррогатных антител · Исследование аспектов иммунного ответа человека на мышиной модели · Developing therapeutic approaches in the absence of murine homologous targets or surrogate antibodies · Studying aspects of human immune responses in murine models | · Возможность оценки выработки человеческих антител · Возможно применение как CDX, так и PDX линий животных · Имитация некоторых аспектов иммунной системы человека · Possibility to assess human antibody production · Possibility to use both CDX and PDX animal models · Possibility to mimic certain aspects of the human immune system | · Дорогостоящие исследования · Невосприимчивость к аллографтам · Развитие реакции «трансплантат против хозяина» · Expensive studies · Resistance to xenotransplantation · Graft-versus-host reaction |
Трансплантация клеток сингенных опухолей Transplantation of syngeneic tumour cells | · Скрининг молекул-кандидатов · Исследование эффективности противоопухолевых препаратов · Исследование механизмов действия противоопухолевых препаратов · Screening candidate molecules · Studying the efficacy of anticancer medicinal products · Studying the mechanisms of action of anticancer medicinal products | · Интактная иммунная система · Сравнительно доступная логистика · Наличие вариантов с люминесцентными и флуоресцентными метками · Intact immune system · Relatively affordable logistics · Available options with fluorescent and luminescent labels | · Низкая предиктивность · За счет массивного бэкграунда возможно генетическое загрязнение, и, следовательно, разница в результатах между разными лабораториями · Общее число моделей ограничено · Low predictive value · Potential genetic contamination due to massive background, and hence interlaboratory result variability · Limited total number of applicable models |
Таблица составлена авторами по данным источников [1][63–66] / The table is adapted by the authors from [1][63–66]
Методы оценки эффективности противоопухолевых препаратов in vivo
Изменение размера опухоли является наиболее важным показателем при проведении исследований эффективности противоопухолевых препаратов. В зависимости от участка расположения опухоли для измерения ее размера могут быть использованы штангенциркуль (солидные опухоли, инокулированные подкожно) или специальные методы визуализации: компьютерная томография, магнитно-резонансная томография, 3D-система оптической визуализации in vivo (in vivo imaging system, IVIS). IVIS особенно важна для оценки динамики роста гематологических опухолей (так называемых «жидких» опухолей) и ортотопически инокулированных опухолей. В ходе исследования производят мониторинг увеличения или уменьшения размера опухоли индивидуально по каждому животному и затем групповой анализ.
Для работы с животными и получения ксенографтных моделей клеточные линии часто модифицируют для визуализации. Наиболее распространенная модификация для биолюминесцентной детекции осуществляется благодаря стабильной повышенной экспрессии люциферазы. Обычно используют два типа люцифераз: целентеразин расщепляющие или люциферин расщепляющие, иногда одновременно оба типа. Овер-экспрессия люцифераз в клеточных линиях достигается доставкой соответствующего гена под конститутивным промотором, что позволяет осуществить стабильную экспрессию. Наиболее используемым методом доставки генов люцифераз является лентивирусная трансдукция [67]. Лентивирус, несущий целевой ген, производится в иммортализованных клетках почки эмбриона человека HEK293T методом транзиентной трансфекции трех и более плазмидных векторов, кодирующих оболочку лентивируса, систему упаковки и ген люциферазы. Лентивирусные частицы спустя 2–3 суток после трансфекции собирают в культуральную среду и концентрируют в ней для последующего заражения необходимой клеточной линии. Данные генно-инженерные модификации не влияют на свойства и чувствительность опухолевых клеток, но позволяют им расщеплять субстрат, вводимый животному, с выделением света, что детектируется оборудованием для визуализации.
Применение оптической биолюминесцентной визуализации позволяет проводить широкий спектр биологических исследований in vivo на мелких лабораторных животных. Поскольку большинство клеток организма не обладают собственной люминесценцией, использование данного типа визуализации позволяет достичь высокого отношения сигнал/шум и избежать фоновой автофлуоресценции ткани. Использование меток с излучением в диапазоне от красного до инфракрасного (>600 нм) является наиболее предпочтительным из-за низкого поглощения в тканях при этих длинах волн. Результаты моделирования распространения фотонов через ткани показывают, что количество биолюминесцентных клеток на уровне нескольких сотен может быть обнаружено подкожно, в то время как для обнаружения сигналов на глубине ~2 см в ткани требуется ~10⁶ клеток [68].
Кроме подхода, основанного на люминесценции, в последнее время широко используют флуоресцентную детекцию, основанную на трансдукции клеточных линий лентивирусами, кодирующими флуоресцентные белки дальне-красного и ближнего инфракрасного спектра [69][70]. Данный подход не требует наличия субстрата, а оптическая визуализация в ближней инфракрасной области спектра позволяет повысить чувствительность детекции и избежать автофлуоресценции, возникающей из-за эндогенных флуоресцентных молекул в биологических тканях [71].
Для достижения уровня модификации клеток, близкого к 100% в популяции, как при работе с люциферазами, так и с флуоресцентными белками, используют бицистронные системы генной экспрессии, и часто вторым овер-экспрессируемым геном является ген устойчивости к селективным антибиотикам: пуромицину, зеоцину, генетицину, бластицидину, гигромицину. В связи с этим модифицированные линии проходят этап селекции от 1 до 3 недель. После проведенной селекции наличие данных антибиотиков в культуральной среде не обязательно.
Подходы с применением систем визуализации позволяют производить оценку эффективности противоопухолевых препаратов на моделях как солидных, так и гематологических опухолей, при этом существует возможность отслеживать динамику опухолевого процесса на одном животном.
Другой значимый показатель в исследованиях эффективности лекарственных препаратов с противоопухолевым действием — продолжительность жизни животного с опухолевым процессом. Учитывают гуманные конечные точки: животные должны быть выведены из исследования в случае устойчивой тенденции к потере массы тела, проявления признаков боли и дистресса. Отдельно оценивают физическое состояние животного (body condition score, BCS), так как при развитии опухолевого процесса масса тела животного может выходить на плато, а в некоторых случаях даже расти только за счет увеличения массы опухоли при том, что животное может быть истощено [72]. Кроме того, показателями для выведения животного из эксперимента являются: нарушение целостности опухолевого узла, превышения им размеров 1,5–2 см в диаметре или 2000 мм³ в объеме, нарушение основных физиологических функций на фоне онкологического процесса (невозможность передвигаться, принимать пищу) [73][74].
Кроме данных о динамике роста опухоли и продолжительности жизни лабораторных животных, могут быть использованы и другие показатели эффективности терапии в зависимости от типа опухоли и метода лечения. Так, возможна оценка уровня подавления метастатической активности опухоли в условиях противоопухолевого лечения с оценкой количества и размера метастаз. В том случае, если терапия направлена на усиление противоопухолевого иммунитета, необходимы исследования, направленные на выявление рецидивов опухолевого процесса.
ЗАКЛЮЧЕНИЕ
Успешная трансляция результатов доклинических исследований эффективности противоопухолевых препаратов в клинику в значительной степени зависит от правильности выбора экспериментальной модели (релевантного вида животного, соответствия генетического статуса животного и человека, сходства патогенеза заболеваний и способа терапии).
В работе систематизированы представленные в литературе экспериментальные подходы для моделирования опухолевых процессов у лабораторных животных и способы оценки эффективности противоопухолевых препаратов. Проведен сравнительный анализ используемых в доклинических исследованиях моделей опухолевого процесса у мышей. Определены преимущества и ограничения каждой из них, позволяющие сделать выбор релевантной модели для конкретных задач исследования.
Ввиду высокой востребованности исследований в области онкологии и стремительно растущей информационной и методологической базы количество подходов и инструментов для доклинических исследований противоопухолевых препаратов непрерывно растет. Появляются новые методы флуоресцентного или люминесцентного мечения опухолевых линий для их визуализации in vivo, новые возможности тестирования клеточного материала перед in vivo этапом. Такое обилие инструментов позволяет максимально комплексно подойти к дизайну исследования и его реализации, что позволяет учесть больше специфических факторов и облегчает преодоление трансляционных барьеров между разными этапами исследований. Использование информации, представленной в настоящей работе, позволит обеспечить достоверность получаемых экспериментальных данных об эффективности противоопухолевых лекарственных средств, а также повысить успех трансляции результатов исследований в клиническую практику.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: М.Л. Васютина, Я.Г. Торопова, К.В. Лепик, А.В. Петухов — концепция работы, написание текста рукописи, формулирование выводов; М.С. Истомина, К.А. Левчук, Е.В. Щелина, А.Е. Ершова — сбор и анализ источников литературы; О.Н. Демидов — участие в формулировании выводов, критический пересмотр текста и утверждение окончательного варианта рукописи для публикации.
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Marina L. Vasyutina, Yana G. Toropova, Kirill V. Lepik, and Alexey V. Petukhov conceptualised the study, drafted the manuscript, and formulated the conclusions. Maria S. Istomina, Ksenia A. Levchuk, Ekaterina V. Shchelina, and Alina E. Ershova collected and analysed literature. Oleg N. Demidov participated in the formulation of the conclusions, critically revised the manuscript, and approved the final version of the manuscript for publication.
1. Croft J. Colony formation assay counting: Advancing the frontiers of cancer research. Presentation. 2018. https://www.researchgate.net/publication/328048722_Colony_formation_assay_counting_Advancing_the_frontiers_of_cancer_research
Список литературы
1. Day CP, Merlino G, Van Dyke T. Preclinical mouse cancer models: a maze of opportunities and challenges. Cell. 2015;163(1):39–53. https://doi.org/10.1016/j.cell.2015.08.068
2. Sajjad H, Imtiaz S, Noor T, Siddiqui YH, Sajjad A, Zia M. Cancer models in preclinical research: A chronicle review of advancement in effective cancer research. Animal Model Exp Med. 2021;4(2):87–103. https://doi.org/10.1002/ame2.12165
3. Галагудза ММ, Гущин ЯА, Исакова-Сивак ИН, Карал-Оглы ДД, Ковалева МА, Ловать МЛ и др. Методология доклинических исследований. В кн.: Макаров ВГ, Шестаков ВН, ред. Консультант GLP-planet. Мнение фармацевтической отрасли. М.: Русский врач; 2021. С. 56–73. https://doi.org/10.29296/978-5-7724-0177-4-s3
4. Китаева КВ, Ризванов АА, Соловьева ВВ. Современные методы доклинического скрининга противоопухолевых препаратов с применением тест-систем на основе культур клеток. Ученые записки Казанского университета. Серия: Естественные науки. 2021;163(2):155–76. https://doi.org/10.26907/2542-064X.2021.2.155-176
5. Lee MW, Miljanic M, Triplett T, Ramirez C, Aung KL, Eckhardt SG, Capasso A. Current methods in translational cancer research. Cancer Metastasis Rev. 2021;40(1):7–30. https://doi.org/10.1007/s10555-020-09931-5
6. Mahalmani V, Sinha S, Prakash A, Medhi B. Translational research: Bridging the gap between preclinical and clinical research. Indian J Pharmacol. 2022;54(6):393–6. https://doi.org/10.4103%2Fijp.ijp_860_22
7. Hay RJ, Reid YA, McClintock PR, Chen TR, Macy ML. Cell line banks and their role in cancer research. J Cell Biochem Suppl. 1996;24:107–30. https://doi.org/10.1002/jcb.240630507
8. Mirabelli P, Coppola L, Salvatore M. Cancer cell lines are useful model systems for medical research. Cancers (Basel). 2019;11(8):1098. https://doi.org/10.3390/cancers11081098
9. Yu C, Mannan AM, Yvone GM, Ross KN, Zhang YL, Marton MA, et al. High-throughput identification of genotype-specific cancer vulnerabilities in mixtures of barcoded tumor cell lines. Nat Biotechnol. 2016;34(4):419–23. https://doi.org/10.1038/nbt.3460
10. Barretina J, Caponigro G, Stransky N, Venkatesan K, Margolin AA, Kim S, et al. The Cancer Cell Line Encyclopedia enables predictive modelling of anticancer drug sensitivity. Nature. 2012;483(7391):603–7. https://doi.org/10.1038/nature11003
11. Yang X, Wen Y, Song X, He S, Bo X. Exploring the classification of cancer cell lines from multiple omic views. PeerJ. 2020;8:e9440. https://doi.org/10.7717/peerj.9440
12. Amereh M, Akbari M. Immunohistochemistry (IHC) staining of in-vitro cancer cell-generated tumoroids. MethodsX. 2023;10:102242. https://doi.org/10.1016/j.mex.2023.102242
13. Mentink A, Isebia KT, Kraan J, Terstappen L, Stevens M. Measuring antigen expression of cancer cell lines and circulating tumour cells. Sci Rep. 2023;13(1):6051. https://doi.org/10.1038/s41598-023-33179-y
14. Hayes JD, Dinkova-Kostova AT, Tew KD. Oxidative stress in cancer. Cancer Cell. 2020;38(2):167–97. https://doi.org/10.1016/j.ccell.2020.06.001
15. Rockwell S. In vivo-in vitro tumour cell lines: Characteristics and limitations as models for human cancer. Br J Cancer Suppl. 1980;4:118–22. PMID: 6932914
16. Pinho JO, Matias M, Godinho-Santos A, Amaral JD, Mendes E, Perry MJ, et al. A step forward on the in vitro and in vivo assessment of a novel nanomedicine against melanoma. Int J Pharm. 2023;640:123011. https://doi.org/10.1016/j.ijpharm.2023.123011
17. Almutairi MS, Hassan ES, Keeton AB, Piazza GA, Abdelhameed AS, Attia MI. Antiproliferative activity and possible mechanism of action of certain 5-methoxyindole tethered C-5 functionalized isatins. Drug Des Devel Ther. 2019;13:3069–78. https://doi.org/10.2147/dddt.s208241
18. Ediriweera MK, Tennekoon KH, Samarakoon SR. In-vitro anti-proliferative assays and techniques used in pre-clinical anti-cancer drug discovery. Frontiers in Anti-Cancer Drug Discovery. 2019;10:43–61. https://doi.org/10.2174/9789811400711119100005
19. Mishra R, Mishra PS, Varshney S, Mazumder R, Mazumder A. In vitro and in vivo approaches for screening the potential of anticancer agents: A review. Curr Drug Discov Technol. 2022;19(3):e060122200071. https://doi.org/10.2174/1570163819666220106122811
20. Афанасьева АН, Сапарова ВБ, Сельменских ТА, Макаренко ИЕ. Выбор оптимального метода детекции жизнеспособности клеточных культур для тестов на пролиферативную активность и цитотоксичность. Лабораторные животные для научных исследований. 2021;(2)16–24. https://doi.org/10.29296/2618723X-2021-02-03
21. Dadmehr M, Mortezaei M, Korouzhdehi B. Dual mode fluorometric and colorimetric detection of matrix metalloproteinase MMP-9 as a cancer biomarker based on AuNPs@gelatin/AuNCs nanocomposite. Biosens Bioelectron. 2023;220:114889. https://doi.org/10.1016/j.bios.2022.114889
22. Batool S, Javaid S, Javed H, Asim L, Shahid I, Khan M, Muhammad A. Addressing artifacts of colorimetric anticancer assays for plant-based drug development. Med Oncol. 2022;39(12):198 https://doi.org/10.1007/s12032-022-01791-z
23. Cobaleda C, Sánchez-García I. Leukemia stem cell drug discovery. Methods Mol Biol. 2021;2185:39–48. https://doi.org/10.1007/978-1-0716-0810-4_3
24. Nakamura D. The evaluation of tumorigenicity and characterization of colonies in a soft agar colony formation assay using polymerase chain reaction. Sci Rep. 2023;13:5405. https://doi.org/10.1038/s41598-023-32442-6
25. Bobadilla AVP, Arévalo J, Sarró E, Byrne HM, Maini PK, Carraro T, et al. In vitro cell migration quantification method for scratch assays. J R Soc Interface. 2019;16(151):20180709. https://doi.org/10.1098/rsif.2018.0709
26. Cheon D-J, Orsulic S. Mouse models of cancer. Annu Rev Pathol. 2011;6:95–119. https://doi.org/10.1146/annurev.pathol.3.121806.154244
27. Rivina L, Schiestl R. Mouse models of radiation-induced cancers. Adv Genet. 2013;84:83–122. https://doi.org/10.1016/b978-0-12-407703-4.00003-7
28. Li Z, Zheng W, Wang H, Cheng Y, Fang Y, Wu F, et al. Application of animal models in cancer research: Recent progress and future prospects. Cancer Manag Res. 2021;13:2455–75. https://doi.org/10.2147/CMAR.S302565
29. Yusuf K, Umar S, Ahmed I. Animal models in cancer research. In: Pathak S, Banerjee A, Bisgin A, eds. Handbook of animal models and its uses in cancer research. Singapore: Springer; 2023. https://doi.org/10.1007/978-981-19-3824-5_17
30. Chen X, Li Y, Yao T, Jia R. Benefits of zebrafish xenograft models in cancer research. Front Cell Dev Biol. 2021;9:616551. https://doi.org/10.3389/fcell.2021.616551
31. Gamble JT, Elson DJ, Greenwood JA, Tanguay RL, Kolluri SK. The zebrafish xenograft models for investigating cancer and cancer therapeutics. Biology (Basel). 2021;10(4):252. https://doi.org/10.3390/biology10040252
32. Schachtschneider KM, Schwind RM, Newson J, Kinachtchouk N, Rizko M, Mendoza-Elias N, et al. The oncopig cancer model: An innovative large animal translational oncology platform. Front Oncol. 2017;7:190. https://doi.org/10.3389/fonc.2017.00190
33. Bailey KL, Carlson MA. Porcine models of pancreatic cancer. Front Oncol. 2019;9:144. https://doi.org/10.3389/fonc.2019.00144
34. Kalla D, Kind A, Schnieke A. Genetically engineered pigs to study cancer. Int J Mol Sci. 2020;21(2):488. https://doi.org/10.3390/ijms21020488
35. Robertson N, Schook LB, Schachtschneider KM. Porcine cancer models: Potential tools to enhance cancer drug trials. Expert Opin Drug Discov. 2020;15(8):893–902. https://doi.org/10.1080/17460441.2020.1757644
36. Simmons HA, Mattison JA. The incidence of spontaneous neoplasia in two populations of captive rhesus macaques (Macaca mulatta). Antioxid Redox Signal. 2011;14(2):221–7. https://doi.org/10.1089/ars.2010.3311
37. Chapman KL, Pullen N, Andrews L, Ragan I. The future of non-human primate use in mAb development. Drug Discov Today. 2010;15(5–6):235–42. https://doi.org/10.1016/j.drudis.2010.01.002
38. Deycmar S, Gomes B, Charo J, Ceppi M, Cline JM. Spontaneous, naturally occurring cancers in non-human primates as a translational model for cancer immunotherapy. J Immunother Cancer. 2023;11(1):e005514. https://doi.org/10.1136/jitc-2022-005514
39. Dewi FN, Cline JM. Nonhuman primate model in mammary gland biology and neoplasia research. Lab Anim Res. 2021;37(1):3. https://doi.org/10.1186/s42826-020-00053-1
40. Pisano M, Cheng Y, Sun F, Dhakal B, D’Souza A, Chhabra S, et al. Laboratory mice — a driving force in immunopatholo gy and immunotherapy studies of human multiple myeloma. Front Immunol. 2021;12:667054. https://doi.org/10.3389/fimmu.2021.667054
41. Sargent JK, Warner MA, Low BE, Schott WH, Hoffert T, Coleman D, et al. Genetically diverse mouse platform to xenograft cancer cells. Dis Model Mech. 2022;15(9):dmm049457. https://doi.org/10.1242/dmm.049457
42. Onaciu A, Munteanu R, Munteanu VC, Gulei D, Raduly L, Feder RI, et al. Spontaneous and induced animal models for cancer research. Diagnostics (Basel). 2020;10(9):660. https://doi.org/10.3390/diagnostics10090660
43. Hoffmann J. Integrative oncology drug discovery accompanied by preclinical translational research as prerequisite for clinical development. Chin Clin Oncol. 2014;3(2):15. https://doi.org/10.3978/j.issn.2304-3865.2014.05.09
44. Durinikova E, Buzo K, Arena S. Preclinical models as patients’ avatars for precision medicine in colorectal cancer: Past and future challenges. J Exp Clin Cancer Res. 2021;40(1):185. https://doi.org/10.1186/s13046-021-01981-z
45. Hanahan D, Weinberg RA. Hallmarks of cancer: The next generation. Cell. 2011;144(5):646–74. https://doi.org/10.1016/j.cell.2011.02.013
46. Guerin MV, Finisguerra V, Van den Eynde BJ, Bercovici N, Trautmann A. Preclinical murine tumor models: A structural and functional perspective. Elife. 2020;9:e50740. https://doi.org/10.7554/elife.50740
47. Kemp CJ. Animal models of chemical carcinogenesis: Driving breakthroughs in cancer research for 100 years. Cold Spring Harb Protoc. 2015;(10):865–74. https://doi.org/10.1101/pdb.top069906
48. Oka K, Fujioka S, Kawamura Y, Komohara Y, Chujo T, Sekiguchi K, et al. Resistance to chemical carcinogenesis induction via a dampened inflammatory response in naked mole-rats. Commun Biol. 2022;5(1):287. https://doi.org/10.1038/s42003-022-03241-y
49. IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Chemical agents and related occupations. Lyon: International Agency for Research on Cancer; 2012.
50. Naito T, Higuchi T, Shimada Y, Kakinuma C. An improved mouse orthotopic bladder cancer model exhibiting progression and treatment response characteristics of human recurrent bladder cancer. Oncol Lett. 2020;19(1):833–9. https://doi.org/10.3892/ol.2019.11172
51. Khanna C, Hunter K. Modeling metastasis in vivo. Carcinogenesis. 2005;26(3):513–23. https://doi.org/10.1093/carcin/bgh261
52. Liu Y, Wu W, Cai C, Zhang H, Shen H, Han Y. Patient-derived xenograft models in cancer therapy: Technologies and applications. Signal Transduct Target Ther. 2023;8(1):160. https://doi.org/10.1038/s41392-023-01419-2
53. Richmond A, Su Y. Mouse xenograft models vs GEM models for human cancer therapeutics. Dis Model Mech. 2008;1(2–3):78–82. https://doi.org/10.1242/dmm.000976
54. Tian H, Lyu Y, Yang Y-G, Hu Z. Humanized rodent models for cancer research. Front Oncol. 2020;10:1696. https://doi.org/10.3389/fonc.2020.01696
55. Chen DS, Mellman I. Elements of cancer immunity and the cancer-immune set point. Nature. 2017;541(7637):321–30. https://doi.org/10.1038/nature21349
56. Waldman AD, Fritz JM, Lenardo MJ. A guide to cancer immunotherapy: From T cell basic science to clinical practice. Nat Rev Immunol. 2020;20(11):651–68. https://doi.org/10.1038/s41577-020-0306-5
57. Esfahani K, Roudaia L, Buhlaiga N, Del Rincon SV, Papneja N, Miller WH Jr. A review of cancer immunotherapy: From the past, to the present, to the future. Curr Oncol. 2020;27(Suppl 2):S87–S97. https://doi.org/10.3747/co.27.5223
58. Cogels MM, Rouas R, Ghanem GE, Martinive P, Awada A, Van Gestel D, Krayem M. Humanized mice as a valuable pre-clinical model for cancer immunotherapy research. Front Oncol. 2021;11:784947. https://doi.org/10.3389/fonc.2021.784947
59. Shultz LD, Brehm MA, Garcia-Martinez JV, Greiner DL. Humanized mice for immune system investigation: Progress, promise and challenges. Nat Rev Immunol. 2012;12(11):786–98.https://doi.org/10.1038/nri3311
60. Tan JHL, Hwang YY, Chin HX, Liu M, Tan SY, Chen Q. Towards a better preclinical cancer model — human immune aging in humanized mice. Immun Ageing. 2023;20(1):49. https://doi.org/10.1186/s12979-023-00374-4
61. Hu Z, Yang YG. Human lymphohematopoietic reconstitution and immune function in immunodeficient mice receiving cotransplantation of human thymic tissue and CD34(+) cells. Cell Mol Immunol. 2012;9(3):232–6. https://doi.org/10.1038/cmi.2011.63
62. McIntosh BE, Brown ME, Duffin BM, Maufort JP, Vereide DT, Slukvin II, Thomson JA. Nonirradiated NOD,B6.SCID Il2rγ-/- Kit W41/W41 (NBSGW) mice support multilineage engraftment of human hematopoietic cells. Stem Cell Reports. 2015;4(2):171–80. https://doi.org/10.1016/j.stemcr.2014.12.005
63. Jin J, Yoshimura K, Sewastjanow-Silva M, Song S, Ajani JA. Challenges and prospects of patient-derived xenografts for cancer research. Cancers (Basel). 2023;15(17):4352. https://doi.org/10.3390/cancers15174352
64. He M, Henderson M, Muth S, Murphy A, Zheng. Preclinical mouse models for immunotherapeutic and non-immunotherapeutic drug development for pancreatic ductal adenocarcinoma. Ann Pancreat Cancer. 2020;3:7. https://doi.org/10.21037/apc.2020.03.03
65. Long Y, Xie B, Shen HC, Wen D. Translation potential and challenges of in vitro and murine models in cancer clinic. Cells. 2022;11(23):3868. https://doi.org/10.3390/cells11233868
66. Li Q-X, Feuer G, Ouyang X, An X. Experimental animal modeling for immuno-oncology. Pharmacol Ther. 2017;173:34–46. https://doi.org/10.1016/j.pharmthera.2017.02.002
67. Brennan TV, Lin L, Huang X, Yang Y. Generation of luciferase-expressing tumor cell lines. Bio Protoc. 2018;8(8):e2817. https://doi.org/10.21769/BioProtoc.2817
68. Rice BW, Cable MD, Nelson MB. In vivo imaging of light-emitting probes. J Biomed Opt. 2001;6(4):432–40. https://doi.org/10.1117/1.1413210
69. Левчук КА, Богданова ДА, Ершова АЕ, Смирнов СВ, Голдаева АА, Васютина МЛ и др. Прямое сравнение вариантов дальне-красных флуоресцентных белков KATUSHKA с люциферазной биолюминесценцией на ксенографтных мышиных моделях изучения опухолей эпителиального происхождения. Трансляционная медицина. 2022;9(6):59–70. https://doi.org/10.18705/2311-4495-2022-9-6-59-70
70. Choi YJ, Ramos SC, Sim HB, Han JY, Park DH, Mun SK, Lee JB, Lee CH, Lee YA, Kim JJ. Promising approach for optimizing in vivo fluorescence imaging in a tumor mouse model: Precision in cancer research. Anticancer Research.2024;44(10):4347–58. https://doi.org/10.21873/anticanres.17264
71. Diao S, Hong G, Antaris AL, Blackburn JL, Cheng K, Cheng Z, et al. Biological imaging without autofluorescence in the second near-infrared region. Nano Res. 2015;8:3027–34. https://doi.org/10.1007/s12274-015-0808-9
72. Paster EV, Villines KA, Hickman DL. Endpoints for mouse abdominal tumor models: refinement of current criteria. Comp Med. 2009;59(3):234–41. PMCID: PMC2733284
73. Silva-Reis R, Faustino-Rocha AI, Gonçalves M, Ribeiro CC, Ferreira T, Ribeiro-Silva C, et al. Refinement of animal model of colorectal carcinogenesis through the definition of novel humane endpoints. Animals (Basel). 2021;11(4):985. https://doi.org/10.3390/ani11040985
74. Winn CB, Hwang SK, Morin J, Bluette CT, Manickam B, Jiang ZK, et al. Automated monitoring of respiratory rate as a novel humane endpoint: A refinement in mouse metastatic lung cancer models. PLoS One. 2021;16(9):e0257694. https://doi.org/10.1371/journal.pone.0257694
Об авторах
М. Л. ВасютинаРоссия
Васютина Марина Львовна
ул. Аккуратова, д. 2, Санкт-Петербург, 197341
К. В. Лепик
Россия
Лепик Кирилл Викторович, канд. мед. наук
ул. Рентгена, 12, Санкт-Петербург, 197022
М. С. Истомина
Россия
Истомина Мария Сергеевна
ул. Аккуратова, д. 2, Санкт-Петербург, 197341
К. А. Левчук
Россия
Левчук Ксения Александровна
ул. Аккуратова, д. 2, Санкт-Петербург, 197341
А. В. Петухов
Россия
Петухов Алексей Вячеславович
ул. Аккуратова, д. 2, Санкт-Петербург, 197341
Е. В. Щелина
Россия
Щелина Екатерина Викторовна
ул. Аккуратова, д. 2, Санкт-Петербург, 197341
А. Е. Ершова
Россия
Ершова Алина Евгеньевна
ул. Аккуратова, д. 2, Санкт-Петербург, 197341
Олимпийский просп., д. 1, Краснодарский край, федеральная территория «Сириус», 354340
О. Н. Демидов
Россия
Демидов Олег Николаевич, д-р мед. наук
Тихорецкий пр., д. 4, Санкт-Петербург, 194064
Олимпийский просп., д. 1, Краснодарский край, федеральная территория «Сириус», 354340
Я. Г. Торопова
Россия
Торопова Яна Геннадьевна, д-р биол. наук
ул. Аккуратова, д. 2, Санкт-Петербург, 197341
ул. Ивана Черных, д. 31–33, Санкт-Петербург, 198095
Дополнительные файлы
Рецензия
Для цитирования:
Васютина М.Л., Лепик К.В., Истомина М.С., Левчук К.А., Петухов А.В., Щелина Е.В., Ершова А.Е., Демидов О.Н., Торопова Я.Г. Методы доклинической оценки эффективности противоопухолевых лекарственных средств in vivo (обзор). Регуляторные исследования и экспертиза лекарственных средств. 2025;15(3):289-300. https://doi.org/10.30895/1991-2919-2025-655
For citation:
Vasyutina M.L., Lepik K.V., Istomina M.S., Levchuk K.A., Petukhov A.V., Shchelina E.V., Ershova A.E., Demidov O.N., Toropova Ya.G. Methods for Preclinical Assessment of the Efficacy of Anticancer Medicines in vivo (Review). Regulatory Research and Medicine Evaluation. 2025;15(3):289-300. (In Russ.) https://doi.org/10.30895/1991-2919-2025-655