Перейти к:
Совершенствование микробиологических методик анализа качества нестерильных лекарственных средств, обладающих антимикробным действием
https://doi.org/10.30895/1991-2919-2024-14-3-362-369
Резюме
ВВЕДЕНИЕ. Первым этапом микробиологического анализа лекарственного средства (ЛС) является оценка его антимикробного действия, то есть влияния ЛС на рост аэробных бактерий, дрожжевых и плесневых грибов. Совершенствование методических инструментов для проведения микробиологического анализа с целью повышения качества получаемых данных остается актуальной задачей.
ЦЕЛЬ. Разработка методического подхода к определению микробиологической чистоты нестерильных лекарственных средств, обладающих антимикробным действием, повышение точности и надежности существующих методик микробиологического анализа.
МАТЕРИАЛЫ И МЕТОДЫ. Для исследования использовали нестерильные ЛС 12 наименований, 5 разбавителей (фосфатный буферный раствор, фосфатный буферный раствор с добавкой полисорбата-80 (1 или 5%), нейтрализующая жидкость, триптиказо-соевый бульон), питательные среды и тест-микроорганизмы, регламентированные Государственной фармакопеей Российской Федерации и Фармакопеей Евразийского экономического союза для проведения микробиологического анализа качества.
РЕЗУЛЬТАТЫ. Определены условия проведения микробиологического исследования нестерильных ЛС с выявленным антимикробным действием, разработанные методики апробированы на ЛС 10 наименований. Доказана применимость методик количественного определения микроскопических грибов в образцах с фунгистатическим действием. Коэффициенты прорастания Candida albicans и Aspergillus brasiliensis находились в допустимом диапазоне 76–128%. Предложено внесение изменений в методику качественного определения Escherichia coli: разведение образца 1:50 в количестве 50 мл (соответствующее 1 г ЛС), которое вносили в 450 мл соответствующей питательной среды. Сравнение разбавителей, содержащих в составе неспецифические инактиваторы антимикробного действия, показало, что предпочтительным является использование нейтрализующей жидкости.
ВЫВОДЫ. Предложен методический подход к определению микробиологической чистоты ЛС, основанный на том, что результаты анализа следует считать достоверными только с учетом антимикробного действия испытуемого образца. Доказана целесообразность увеличения количества образца до 10 мл из разведения, в котором антимикробное действие отсутствует (например, 1:100). Для посева рекомендовано использовать чашки Петри диаметром 150 мм, 50 мл агаризованной питательной среды, а также разбавители, содержащие в составе до 5% полисорбата-80. Показана применимость разведения, при котором антимикробное действие отсутствует; необходимость увеличения количества образца пропорционально вносимому в питательную среду до регламентированного фармакопеями количества — не меньше 1 г (мл), а также рекомендовано использовать разбавители, содержащие в составе до 5% полисорбата-80, для инактивации бактериостатического и фунгистатического действия.
Ключевые слова
Для цитирования:
Гунар О.В., Булгакова Г.М. Совершенствование микробиологических методик анализа качества нестерильных лекарственных средств, обладающих антимикробным действием. Регуляторные исследования и экспертиза лекарственных средств. 2024;14(3):362-369. https://doi.org/10.30895/1991-2919-2024-14-3-362-369
For citation:
Gunar O.V., Bulgakova G.M. Improvement of Microbiological Methods for Testing the Quality of Non-sterile Medicines with Antimicrobial Effects. Regulatory Research and Medicine Evaluation. 2024;14(3):362-369. (In Russ.) https://doi.org/10.30895/1991-2919-2024-14-3-362-369
ВВЕДЕНИЕ
Инциденты, связанные с контаминацией лекарственных средств (ЛС) микроорганизмами, были зафиксированы еще в 60-х годах ХХ века и, к сожалению, продолжаются до наших дней1, что требует от производителей фармацевтической продукции, экспертов и представителей контрольных органов особого внимания к микробиологическому качеству ЛС. В 2024 г. в Федеральный закон Российской Федерации «Об обращении лекарственных средств» были внесены изменения, согласно которым была обозначена необходимость определения микробиологических характеристик лекарственных средств, в том числе фармацевтических субстанций2.
Методики оценки микробиологических показателей качества ЛС (стерильность и микробиологическая чистота) утверждены в Государственной фармакопее Российской Федерации (ГФ РФ) и Фармакопее Евразийского экономического союза (ФЕАЭС)3, микробиологические методики для анализа конкретных лекарственных препаратов (ЛП) в случае необходимости описываются в нормативной документации и, как правило, обосновываются валидационными (верификационными) исследованиями, представленными в регистрационных досье на ЛП. В соответствии с положениями фармакопей4 первым этапом испытания ЛС, в том числе высокотехнологичных лекарственных препаратов, по показателям «Стерильность» или «Микробиологическая чистота» является оценка влияния непосредственно ЛП на рост минимального количества определенных микроорганизмов с целью доказательства применимости методики анализа. Выявленное влияние определяется как антимикробное действие ЛС, которое может быть одной из основных возможных причин получения ложноотрицательных результатов анализа качества ЛС [1] и отражает особенности используемых субстанций, вспомогательных веществ, а также технологический процесс производства [2].
Ранее вопросы, связанные с изучением антибактериального и противогрибкового действия ЛС и с различными способами его нейтрализации, уже обсуждались [3][4], однако в связи с развитием фармацевтической микробиологии необходимы пересмотр и модификация методик анализа с целью повышения точности и достоверности результатов анализа.
Цель работы — разработка методического подхода к определению микробиологической чистоты нестерильных лекарственных средств, обладающих антимикробным действием, повышение точности и надежности существующих методик микробиологического анализа.
Задачи исследования:
- определение антимикробного действия некоторых ЛС;
- определение подходов к совершенствованию испытания в отношении содержания аэробных микроорганизмов и дрожжевых и плесневых грибов и модификация условий методик определения микробиологического качества;
- модификация методики выделения Escherichia coliиз ЛС, обладающих антибактериальным действием в отношении указанного микроорганизма;
- оценка применимости различных разбавителей ЛС в качестве неспецифических инактиваторов для нейтрализации антимикробного действия.
МАТЕРИАЛЫ И МЕТОДЫ
Лекарственные средства. В работе использовали ЛС 12 международных непатентованных наименований: безопрокт, мазь для ректального и наружного применения; протаргол (серебра протеинат), порошок для приготовления раствора для местного применения; вегадерм, мазь для наружного применения 0,5+1,0+10,0 мг/г (бетаметазон+гентамицин+ клотримазол); уксусная кислота, субстанция-раствор; формагель, гель для наружного применения 3,7%; амлодипин, таблетки 10 мг; хлоропирамин, таблетки 25 мг; дротаверина гидрохлорид, субстанция-порошок; альфа-липоевая кислота, субстанция-порошок; периндоприл+амлодипин 10 мг+10 мг, таблетки; эстриол, крем вагинальный 1 мг/г; итраконазол, капсулы 100 мг.
Тест-штаммы микроорганизмов. Escherichia coli ATCC 8739; Bacillus subtilis ATCC 6633; Staphylococcus aureus АТСС 6538; Pseudomonas aeruginosa ATCC 9027; Candida albicans ATCC 10231; Aspergillus brasiliensis ATCC 16404.
В работе использовали микробиологические питательные среды, в том числе триптиказо-соевый агар (TSA); агар Сабуро (SDCA); триптиказо-соевый бульон (ТSB); маннитно-солевой агар; цетримидный агар; агар Эндо-ГРМ для выявления энтеробактерий; разбавители: раствор натрия хлорида 0,9%5, фосфатный буферный раствор с натрия хлоридом и пептоном (рН 7,0) (ФБР)6 с полисорбатом-80 (1 или 5%), нейтрализующая жидкость7.
Используемое оборудование. Инкубаторы BD-240 и КB-115 (Binder); ламинарный шкаф (Labconco); счетчик колоний Scan 100 (Interscience); микроскоп стереоскопический Olympus BX41; весы лабораторные электронные Сартогосм СЕ 623-С (ООО «Сартогосм»).
Методы исследования. Экспериментальное исследование проводили по методикам определения антимикробного действия и микробиологической чистоты, указанным в ОФС.1.2.4.0002.18 «Микробиологическая чистота» ГФ РФ XIV изд., ОФС 2.1.6.6 «Микробиологические испытания нестерильных лекарственных средств: общее количество аэробных микроорганизмов» Фармакопеи ЕАЭС.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Рассмотрим случай, когда установленное противогрибковое действие нестерильных ЛС нейтрализуется дополнительным разведением образца в 100 раз, а применять такое разведение для посева 1 мл в стандартные чашки Петри диаметром 90 мм нецелесообразно, так как нормативные требования в отношении количества дрожжевых и плесневых грибов составляют не более 10 КОЕ/г (мл).
Для получения достоверного значения содержания дрожжевых и плесневых грибов использовали стерильные чашки Петри увеличенного размера (150 мм в диаметре), в каждую из которых вносили по 10 мл образца из разведения 1:100, что по количеству анализируемого вещества соответствовало стандартному объему 1 мл из разведения 1:10. Дополнительное разведение 1:100 нейтрализовало выявленное противогрибковое действие рассматриваемых ЛС, а внесение в каждую чашку Петри по 10 мл образца позволило получить достоверный результат, соответствующий в пересчете 1 г ЛС. Согласно методике испытания для роста возможных грибов-контаминантов использовали агар Сабуро в количестве 50 мл на каждую чашку Петри при посеве, а затем выполняли инкубацию в стандартных условиях.
На основании полученных значений количества дрожжеподобных и плесневых грибов рассчитывали коэффициенты прорастания микроорганизмов (Кпр) по формуле (1) (табл. 1). Коэффициенты прорастания Candida albicans составляли 76–101%, Aspergillus brasiliensis — 82–128%, что является допустимым согласно ФЕАЭС8.
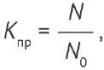 (1)
(1)
где N и N0 — средние арифметические числа колоний на чашках Петри с исследуемым и с контрольным образцом соответственно.
Таблица 1. Результаты оценки фунгистатического действия лекарственных препаратов
Table 1. Results of assessing the fungistatic activity of medicines
|
Наименование лекарственного средства Medicine name |
Разведение Dilution |
Количество выявленных микроорганизмов (КОЕ/г) Number of micro-organisms detected (CFU/g) |
|||||
|
Candida albicans |
Aspergillus brasiliensis |
||||||
|
I |
II |
III |
I |
II |
III |
||
|
Безопрокт, мазь Bezoproct, ointment |
1:10 |
– |
– |
99±4 Кпр 101% |
– |
– |
75±2 Кпр 110% |
|
1:100 |
+ |
+ |
+ |
+ |
|||
|
Протаргол (серебра протеинат), порошок Protargol (silver proteinate), powder |
1:10 |
– |
– |
89±6 Кпр 91% |
– |
– |
87±3 Кпр 128% |
|
1:100 |
+ |
+ |
+ |
+ |
|||
|
Вегадерм, мазь Vegaderm, ointment |
1:10 |
– |
– |
88±1 Кпр 90% |
– |
– |
63±2 Кпр 93% |
|
1:100 |
+ |
+ |
+ |
+ |
|||
|
Уксусная кислота, субстанция-раствор Acetic acid, active substance, solution |
1:10 |
– |
– |
76±4 Кпр 76% |
– |
– |
65±1 Кпр 96% |
|
1:100 |
+ |
+ |
+ |
+ |
|||
|
Формагель, гель Formagel, gel |
1:10 |
– |
– |
84±6 Кпр 86% |
– |
– |
56±6 Кпр 82% |
|
1:100 |
+ |
+ |
+ |
+ |
|||
|
Контроль роста тест-микроорганизма Test strain growth control |
не применимо not applicable |
+ |
+ |
98±2 |
+ |
+ |
68±1 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. «–» — 0%, рост отсутствовал; «+» — 100%, рост, аналогичный росту тест-микроорганизмов по количеству и морфологии колоний; Кпр — коэффициент прорастания микроорганизмов.
I — метод определения антимикробного действия в условиях определения микробиологической чистоты нестерильных лекарственных средств (ОФС.1.2.4.0002.18 Государственная фармакопея Российской Федерации, изд. XIV); II — метод репликаций; III — количественный метод, предложенный авторами статьи;
Note. –, no growth (0%); +, growth similar in the number and morphology of colonies to that of test strains (100%); Кпр, proliferation factor from growth promotion tests.
I: method for determining antimicrobial activity in microbiological quality testing of non-sterile medicines (OFS.1.2.4.0002.18, State Pharmacopoeia of the Russian Federation, ed. XIV); II: method for determining the antimicrobial activity of water-insoluble medicines (method of replications); III: quantitative method proposed by the authors.
Рассмотренный в настоящем исследовании подход может быть реализован в тех случаях, когда антибактериальное действие ЛС сохраняется в разведении 1:1000 при допустимом пределе содержания аэробных микроорганизмов 1000 КОЕ/г. При отсутствии роста после внесения 10 мл из разведения 1:10000 на чашку Петри диаметром 150 мм можно дать заключение следующего содержания: в 1 г испытуемого ЛС — менее 1000 КОЕ микроорганизмов, что соответствует требуемым нормативам.
В некоторых случаях при оценке показателя «Микробиологическая чистота», согласно нормативным требованиям9, необходимо установить отсутствие E. coli в образце ЛС. Этот микроорганизм, относящийся к семейству энтеробактерий, является санитарно-показательным, может служить критерием соблюдения правил надлежащей производственной практики при фармацевтическом производстве. E. coli необходимо выделять:
- из твердых (неводных) и жидких препаратов для приема внутрь (категория 3А);
- из ЛП природного происхождения, уровень микробной загрязненности которого невозможно снизить в процессе предварительной обработки (категория 3Б);
- из готовых смесей для лечебных кормов, применяемых в ветеринарии, с использованием наполнителей природного происхождения, для которых противомикробная обработка невозможна (категория 3В);
- из фармацевтических субстанций и вспомогательных веществ синтетического и природного происхождения для производства нестерильных ЛП (категории 3.2 и 2.2).
Оценка микробиологического качества ЛС, обладающих антимикробным действием в отношении E. coli, затруднена. Для решения этой задачи нами был предложен подход, состоящий в нейтрализации антимикробного действия препарата путем увеличения объема анализируемого образца ЛС до 50 мл в разведении 1:50, при котором нейтрализуется антимикробное действие. Увеличенный объем (50 мл) образца лекарственного препарата вносили в 450 мл питательной среды (триптиказо-соевого бульона). Результаты, полученные при апробации данной методики на примере пяти ЛС (амлодипин, таблетки; периндоприл+амлодипин, таблетки; хлоропирамин, таблетки; дротаверин, субстанция; липоевая кислота, субстанция), обобщены в таблице 2 и демонстрируют целесообразность увеличения объема разведения образца (например, до 50 или 100 мл) и объема питательной среды (до 450 или 900 мл) пропорционально количеству образца, которое должно составлять не менее 1 г (мл). Условия методик определения микробиологического качества лекарственных средств, обладающих и не обладающих антимикробным действием, приведены в таблице 3.
Таблица 2. Нейтрализация бактериостатического действия лекарственного препарата
в отношении Escherichia coli различными методами
Table 2. Neutralisation of the bacteriostatic activity of medicines
against Escherichia coli by various methods
|
Наименование лекарственного средства Medicine name |
Разведение Dilution |
Методики нейтрализации Neutralisation methods |
||
|
I |
II |
III |
||
|
Амлодипин, таблетки Хлоропирамин, таблетки Дротаверин, субстанция Липоевая кислота, субстанция Периндоприл+амлодипин, таблетки Amlodipine, tablets Chloropyramine, tablets Drotaverine, active substance Lipoic acid, active substance Perindopril+amlodipine, tablets |
1:10 |
– |
– |
50 мл из разведения 1:50 вносили в 450 мл соответствующей питательной среды 50 mL of a 1:50 dilution was transferred to 450 mL of an appropriate culture medium |
|
1:50 |
+ |
+ |
||
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. «–» — рост отсутствовал, «+» — рост, аналогичный росту тест-микроорганизма в жидкой питательной среде, I — метод определения антимикробного действия в условиях определения микробиологической чистоты нестерильных лекарственных средств (ОФС.1.2.4.0002.18 Государственная фармакопея Российской Федерации, изд. XIV); II — метод репликаций; III — качественный метод, предложенный авторами статьи.
Note. –, no growth; +, growth similar to that of the test strain in a liquid culture medium.
I: method for determining antimicrobial activity in microbiological quality testing of non-sterile medicines (OFS.1.2.4.0002.18, State Pharmacopoeia of the Russian Federation, ed. XIV); II: method for determining the antimicrobial activity of water-insoluble medicines (method of replications); III: quantitative method proposed by the authors.
Таблица 3. Условия микробиологических методик
количественного и качественного определения микроорганизмов
в лекарственных средствах
Table 3. Conditions for microbiological analytical procedures
for the quantitative and qualitative determination of micro-organisms in medicines
|
Условия методики Analytical conditions |
Антимикробное действие лекарственного средства Antimicrobial activity |
|
|
Присутствует Present |
Отсутствует Absent |
|
|
Количественное определение аэробных микроорганизмов, дрожжевых и плесневых грибов Quantitative determination of aerobic micro-organisms, yeasts, and moulds |
||
|
Минимальное разведение образца Minimum sample dilution |
1:10 |
1:50 |
|
Минимальный объем образца, вносимый в чашку Петри, мл Minimum volume of a sample added to a Petri dish, mL |
1 |
10 |
|
Диаметр используемых чашек Петри, мм Petri dish diameter, mm |
90 |
150 |
|
Количество питательной среды, вносимой в чашку Петри, мл Volume of a culture medium added to a Petri dish, mL |
10 |
50 |
|
Качественное определение отдельных видов бактерий (например, Escherichia coli) Qualitative determination of specified micro-organisms (e.g. Escherichia coli) |
||
|
Минимальное разведение образца Minimum sample dilution |
1:10 |
1:50 |
|
Минимальный объем образца, вносимый в жидкую питательную среду, мл Minimum volume of a sample added to a liquid culture medium, mL |
10 |
50 |
|
Объем питательной среды, мл Volume of a culture medium, mL |
90 |
450 |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Нами было проведено сравнение пяти различных разбавителей с целью оценки их применимости в качестве неспецифических инактиваторов для нейтрализации антимикробного действия. Так, для нейтрализации бактериостатического действия экстриола, крем вагинальный, и фунгистатического действия итраконазола, капсулы 100 мг, были апробированы два разбавителя без инактиваторов (ФБР и TSB) и три разбавителя, содержащие в составе неспецифические инактиваторы: полисорбат-80 (1 или 5%), яичный (или соевый) лецитин (0,3% в составе нейтрализующей жидкости), гистидина гидрохлорид (0,1% в составе нейтрализующей жидкости). Полученные результаты представлены в таблице 4 «Результаты нейтрализации антимикробного действия лекарственных препаратов эстриол, крем вагинальный, и итраконазол, капсулы 100 мг, с использованием различных разбавителей», опубликованной на сайте журнала10.
Разведения от 1:10 до 1:50 препарата эстриол, крем вагинальный, в ФБР, ФБР с 1% полисорбатом-80 и TSB не могут быть применены для выявления грамположительных (B. subtilis и S. aureus) и грамотрицательных (E. coli) бактерий. Кпр составляет 0–48%. При добавлении в разбавитель полисорба-80 в количестве 5% или применении нейтрализующей жидкости, в состав которой согласно нормативным актам11 входит 3% полисорбата-80, Кпр возрастает до 88%. Применение разбавителя, содержащего 1 или 5% полисорбата-80, для нейтрализации противогрибкового действия итраконазола, капсул, положительно сказывается на Кпр дрожжевых и плесневых грибов. Использование фосфатного буферного раствора и триптиказо-соевого бульона в качестве разбавителя не позволяет выявить A. brasiliensis.
ВЫВОДЫ
- Предложен методический подход к определению микробиологической чистоты ЛС, основанный на том, что результаты определения анализа следует считать достоверными только с учетом антимикробного действия испытуемого образца.
- На примере различных лекарственных форм (мазь, гель, порошок и др.), обладающих антимикробным действием в минимально возможном разведении (1:10), показана целесообразность увеличения количества образца до 10 мл из разведения, в котором антимикробное действие отсутствует (1:50). Для посева рекомендовано использовать чашки Петри диаметром 150 мм и 50 мл соответствующей агаризованной питательной среды.
- Показана применимость следующих условий оценки микробиологической чистоты:
- использование разведения, при котором антимикробное действие отсутствует;
- увеличение количества образца пропорционально вносимому в питательную среду до регламентированного фармакопеями количества — не меньше 1 г (мл).
- Рекомендовано использование разбавителей, содержащих в составе до 5% полисорбата-80, для инактивации бактериостатического и фунгистатического действия.
Дополнительная информация. Таблица 4 размещена на сайте журнала «Регуляторные исследования и экспертиза лекарственных средств».
https://doi.org/10.30895/1991-2919-2024-14-3-362-369-tabl
Вклад авторов. Авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Г.М. Булгакова — экспериментальное выполнение исследования, участие в обсуждении результатов и редактировании текста рукописи; О.В. Гунар — идея выполнения исследования, участие в обсуждении результатов, написание и редактирование текста рукописи.
Additional information. Table 4 is posted on the website of Regulatory Research and Medicine Evaluation.
https://doi.org/10.30895/1991-2919-2024-14-3-362-369-tabl
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Galina M. Bulgakova conducted experiments, participated in the discussion of the study results and editing of the manuscript. Olga V. Gunar conceived the idea of the study and participated in the discussion of the study results and drafting and editing of the manuscript.
1. Чисто неслучайно: проблема контаминации при производстве лекарств. GxP News, 05.02.2024. https://gxpnews.net/2024/02/chisto-ne-sluchajno-problema-kontaminaczii-pri-proizvodstve-lekarstv/
2. Федеральный закон Российской Федерации от 30.01.2024 № 1-ФЗ «О внесении изменений в Федеральный закон “Об обращении лекарственных средств” и статьи 1 и 4 Федерального закона “О внесении изменений в Федеральный закон “Об обращении лекарственных средств” и Федеральный закон “О внесении изменений в Федеральный закон “Об обращении лекарственных средств”».
3. ОФС.1.2.4.0002.18. Государственная фармакопея Российской Федерации. XIV изд. Т. 2. М.; 2018.
Фармакопея ЕАЭС 2.1.6.6. Микробиологические испытания нестерильных лекарственных средств: общее количество аэробных микроорганизмов. М.; 2020.
4. Там же.
5. ОФС.1.2.4.0002.18. Государственная фармакопея Российской Федерации. XIV изд. Т. 2. М.; 2018.
6. Там же.
7. Фармакопея ЕАЭС 2.1.6.6. Микробиологические испытания нестерильных лекарственных средств: общее количество аэробных микроорганизмов. М.; 2020.
8. Там же.
9. ОФС.1.2.4.0002.18. Государственная фармакопея Российской Федерации. XIV изд. Т. 2. М.; 2018.
Фармакопея ЕАЭС 2.1.6.6. Микробиологические испытания нестерильных лекарственных средств: общее количество аэробных микроорганизмов. М.; 2020
10. https://doi.org/10.30895/1991-2919-2024-14-3-362-369-tabl
11. Там же.
Список литературы
1. Буйлова ИА, Сахно НГ, Булгакова ГМ, Гунар ОВ. Исключение ложных результатов микробиологического анализа лекарственных средств. Ведомости Научного центра экспертизы средств медицинского применения. Регуляторные исследования и экспертиза лекарственных средств. 2018;8(3):187–92. https://doi.org/10.30895/1991-2919-2018-8-3-187-192
2. Каменская ЮВ. Антимикробное действие растительных экстрактов. Наука, образование и культура. 2019;(7):31–2. EDN: KZYLYI
3. Буйлова ИА, Гунар ОВ. Применение поверхностно-активных веществ (ПАВ) при контроле качества лекарственных средств по микробиологическим показателям. Химико-фармацевтический журнал. 2021;55(3):58–61. https://doi.org/10.30906/0023-1134-2021-55-3-58-61
4. Гунар ОВ, Сахно НГ. Микробиологическая безопасность лекарственных препаратов, содержащих этиловый спирт. Биозащита и биобезопасность. 2011;3(2):44–8. EDN: OQRBCJ
Об авторах
О. В. ГунарРоссия
Гунар Ольга Викторовна, д-р фарм. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
Г. М. Булгакова
Россия
Булгакова Галина Михайловна
Петровский б-р, д. 8, стр. 2, Москва, 127051
Дополнительные файлы

|
1. Таблица 4. Результаты нейтрализации антимикробного действия лекарственных препаратов эстриол, крем вагинальный, и итраконазол, капсулы 100 мг, с использованием различных разбавителей | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(530KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Гунар О.В., Булгакова Г.М. Совершенствование микробиологических методик анализа качества нестерильных лекарственных средств, обладающих антимикробным действием. Регуляторные исследования и экспертиза лекарственных средств. 2024;14(3):362-369. https://doi.org/10.30895/1991-2919-2024-14-3-362-369
For citation:
Gunar O.V., Bulgakova G.M. Improvement of Microbiological Methods for Testing the Quality of Non-sterile Medicines with Antimicrobial Effects. Regulatory Research and Medicine Evaluation. 2024;14(3):362-369. (In Russ.) https://doi.org/10.30895/1991-2919-2024-14-3-362-369



































