Перейти к:
Метод определения пирогенности с использованием моноцитов: перспективы и особенности применения (обзор)
https://doi.org/10.30895/1991-2919-2025-15-3-347-356
Резюме
ВВЕДЕНИЕ. Отсутствие пирогенных загрязнений относится к критическим показателям качества лекарственных средств, гарантирующим сохранение жизни и здоровья пациентов. С целью контроля подобных веществ в середине ХХ века в практику был внедрен биологический показатель «Пирогенность», в основе которого лежит оценка реакции кроликов на введение испытуемого образца. Следуя концепции 3R в 2009 г. в Европейскую фармакопею помимо испытания на кроликах включена монография альтернативного метода in vitro — тест активации моноцитов. В отечественную фармакопею данный тест включен в 2018 г. (ОФС.1.2.4.0016.18 «Тест активации моноцитов»). Однако на сегодняшний день метод не получил широкого применения среди производителей ни в России, ни за рубежом ввиду особенностей проведения теста, связанных с потребностью значительного количества человеческой крови для получения моноцитов, с ограниченным выбором наборов реактивов и др. Испытание «Пирогенность» по-прежнему остается востребованным в области определения пирогенных примесей любой природы (бактериальных эндотоксинов и неэндотоксиновых пирогенов). Для более полной гармонизации с европейскими требованиями, реализации концепции 3R, связанной с гуманным отношением к животным, внедрение теста активации моноцитов является одной из приоритетных задач развития системы контроля качества лекарственных средств.
ЦЕЛЬ. Оценка возможности применения теста активации моноцитов в качестве основного для определения неэндотоксиновых пирогенов.
ОБСУЖДЕНИЕ. В статье описаны фармакопейные методы определения пирогенных веществ, детально проанализирован метод определения пирогенов с использованием клеток крови человека — моноцитов. В настоящее время испытание на активацию моноцитов — единственный тест in vitro, позволяющий определять наличие пирогенов любой природы (бактериальные эндотоксины и пирогены неэндотоксиновой природы). Тест является достойным примером реализации стратегии замены испытаний на животных, позволяет определять примеси в случаях, когда контроль с помощью иных методик вызывает сложности или его невозможно выполнить. Главным недостатком, который затрудняет внедрение теста в рутинный контроль, является ограниченная доступность человеческой крови в качестве источника моноцитов. Обсуждены возможные источники моноцитов, которые могут быть применены при определении пирогенности, в том числе клетки крови животных. В соответствии с тенденцией к замене испытания in vivo — «Пирогенность» на альтернативный метод in vitro показана необходимость освоения применения метода при контроле качества биологических и иммунобиологических лекарственных средств.
ВЫВОДЫ. По итогам проведенного теоретического анализа возможности применения метода in vitro в качестве основного для определения в первую очередь неэндотоксиновых пирогенов установлено, что мировое сообщество серьезно настроено на отказ от использования животных. Тест активации моноцитов включен в большинство фармакопей мира, а также в отечественную фармакопею, и рекомендован для выполнения в качестве основного контроля содержания пирогенов в лекарственных средствах.
Ключевые слова
Для цитирования:
Чечетова Е.О., Неугодова Н.П., Шаповалова О.В. Метод определения пирогенности с использованием моноцитов: перспективы и особенности применения (обзор). Регуляторные исследования и экспертиза лекарственных средств. 2025;15(3):347-356. https://doi.org/10.30895/1991-2919-2025-15-3-347-356
For citation:
Chechetova E.O., Neugodova N.P., Shapovalova O.V. Method for Determining Pyrogenicity Using Monocytes: Prospects and Features of Application (Review). Regulatory Research and Medicine Evaluation. 2025;15(3):347-356. (In Russ.) https://doi.org/10.30895/1991-2919-2025-15-3-347-356
ВВЕДЕНИЕ
В соответствии с руководящими принципами этичного использования лабораторных животных (принципы 3R: Replacement, Reduction, Refinement)1 научное сообщество старается минимизировать их применение в качестве тест-систем для лабораторных исследований. Один из постулатов данной концепции — замена биологических испытаний альтернативными методиками in vitro и (или) in silico2. Ярким примером воплощения данной стратегии является внедрение метода определения пирогенных веществ in vitro («Тест активации моноцитов»), который был разработан на смену биологическому методу определения пирогенов на кроликах — «Пирогенность».
Пирогены — это класс химически гетерогенных веществ, вызывающих повышение температуры тела, которые представлены бактериальными эндотоксинами (БЭ) (продуктами жизнедеятельности бактерий, вирусов, грибов), а также пирогенами неэндотоксиновой природы (НЭП) (различными химическими соединениями, например фторопластами, нуклеатами и др.) [1][2]. Контроль их содержания в лекарственных средствах (с микробиологической чистотой категории 1.2.Б) и лекарственных препаратах (ЛП) для парентерального введения, а также для медицинских иммунобиологических препаратов (МИБП) является жизненно необходимой процедурой — при введении препаратов с примесями пирогенных веществ может произойти нарушение терморегуляции, сопровождающееся тяжелыми реакциями интоксикации вплоть до летального исхода3.
С целью обеспечения контроля содержания пирогенных примесей в 1942 г. в Фармакопею США (USP) был введен биологический показатель «Пирогенность»4, принцип которого основан на измерении ректальной температуры тела кроликов до и после внутривенного введения испытуемого образца. Со временем данный показатель был включен и в другие фармакопеи. В 2009 г. в соответствии с Директивой Европейского парламента и Совета Европейского союза 2010/63/EU5 и принципами 3R6, направленными на сокращение применения животных в научных целях, был предложен новый метод определения пирогенных веществ — «Тест активации моноцитов» (МАТ), в котором в качестве тест-системы используют клетки крови человека (моноциты).
Цель работы — оценка возможности применения теста активации моноцитов в качестве основного для определения неэндотоксиновых пирогенов. Задачами работы являются: обзор однонаправленных методов7 определения пирогенности; описание преимуществ и недостатков теста активации моноцитов при определении пирогенов любой природы; обзор специфики возможных источников моноцитов и применения их в испытании; рассмотрение тенденций внедрения МАТ взамен классического биологического испытания на кроликах.
ОБЩАЯ ХАРАКТЕРИСТИКА МЕТОДОВ ОПРЕДЕЛЕНИЯ ПИРОГЕННОСТИ
На сегодняшний день на территории Российской Федерации контроль пирогенных веществ может быть осуществлен с помощью различных методологических подходов: биологического метода («Пирогенность»), а также методов in vitro («Бактериальные эндотоксины» и «Тест активации моноцитов»).
Долгие годы контроль наличия пирогенных веществ любой природы проводили путем биологического испытания «Пирогенность». Основанием для разработки универсальных методов in vitro послужило стремление сделать испытание на пирогенность более гуманным, так как основной недостаток биологического метода — использование животных. Другими недостатками метода являются отсутствие возможности получения количественного ответа, а также контроля некоторых групп препаратов в силу их фармакологических свойств (например, анальгетиков, седативных препаратов, миорелаксантов, средств для наркоза и т.п.) [1]. Также фактором, ограничивающим применение метода «Пирогенность», является растворимость фармацевтических субстанций. Так, например, субстанции, растворимые только в органических растворителях, невозможно ввести кроликам внутривенно.
Снизить количество используемых лабораторных животных удалось с появлением in vitro испытания «Бактериальные эндотоксины», специфичного к БЭ, которые являются основными пирогенными примесями. Их содержание определяют с помощью лизата амебоцитов мечехвостов Limulus polyphemus или Tachypleus tridentatus (ЛАЛ-тест или ТАЛ-тест). Испытание основано на специфической реакции природного или генно-инженерного реактива с БЭ8. Тест обладает значительными преимуществами в определении БЭ по отношению к методу «Пирогенность» (скорость получения результатов, сниженные издержки, отсутствие влияния фармакологических свойств препарата, количественное определение эндотоксиновых примесей, возможность валидации метода) и в короткие сроки стал востребованным во всем мире.
«Тест активации моноцитов» in vitro — клеточная методика определения пирогенных веществ любой природы — является примером воплощения стратегии по исключению животных из лабораторных испытаний. Предполагалось, что внедрение этого испытания в фармацевтическую практику должно привести к значительному снижению числа животных, используемых в тесте, что соответствует «Европейской конвенции о защите позвоночных животных, используемых для экспериментальных и других научных целей»9. Однако процесс перехода от испытания на кроликах к клеточной методике занял продолжительное время10, тогда как ЛАЛ-тест в России с момента утверждения общей фармакопейной статьи (ОФС) в 2000 г.11 в течение пяти лет был внедрен более чем на половине производств, выпускающих инъекционные препараты, вследствие чего значительно возросло количество нормативных документов для инъекционных ЛП, которые, согласно требованиям, должны подвергаться испытанию с помощью ЛАЛ-теста взамен испытанию на животных [4][5].
Впервые статьи об использовании цельной крови для определения пирогенов были опубликованы в середине 1990-х гг. [6]. В 2009 г. в Европейскую фармакопею (Ph. Eur.) введена монография «Monocyte Activation Test»12, а в 2018 г. на ее основе была создана отечественная ОФС «Тест активации моноцитов»13. В основе данного метода лежит воспроизведение механизма развития лихорадки с помощью клеток крови человека — моноцитов или моноцитоподобных клеток. Тест на клеточном уровне воспроизводит испытание «Пирогенность». В испытании используют стандартные образцы эндотоксиновой и неэндотоксиновой природы. Для обнаружения БЭ применяют контрольный стандарт эндотоксина, растворы которого в разных концентрациях используют для построения калибровочной кривой. В качестве «неэндотоксинового контроля» используют растворы липотейхоевой кислоты, флагеллина, термоинактивированного Staphyloccocus aureus и др. (рис. 1). С помощью неэндотоксиновых стандартов для каждого конкретного испытуемого образца оценивается способность клеток давать иммунный ответ на взаимодействие с пирогенами, отличными от БЭ.

Фотографии выполнены авторами / The photographs were taken by the authors
Рис. 1. Цветная реакция в лунках, содержащих пирогены, после добавления стоп-реагента
Fig. 1. Color reaction in wells containing pyrogens after addition of stop reagent
МАТ возможен в трех вариантах постановки14: количественное испытание (А); полуколичественное испытание (В); сравнительное испытание с серией лекарственного средства, утвержденной в качестве контрольной15 (С) [1]. Методы А и В пригодны для контроля ЛC, не обладающих пирогенными свойствами. Метод С разработан с целью контроля содержания пирогенных примесей в ЛП или МИБП, обладающих пирогенными свойствами (например, вакцина для профилактики менингококковой инфекции). Его особенность заключается в сравнении реакции испытуемого образца с реакцией контрольной серии, а не со стандартами пирогенов16.
КЛЕТКИ КРОВИ КАК ПРЕДМЕТ ИССЛЕДОВАНИЯ ТЕСТА АКТИВАЦИИ МОНОЦИТОВ
При внедрении показателя МАТ в рутинный контроль представители фармацевтической промышленности могут столкнуться с трудностями, вызванными необходимостью работы с форменными элементами крови человека. Во-первых, логистическая проблема, связанная с большим количеством требуемой цельной крови или выделенных моноцитов, особыми условиями их получения и транспортировки. Во-вторых, высокие требования к качеству крови, например: квалификация, количество клеток в 1 мл, экспрессия, характеристики доноров, специфичность получаемых клеток. Такие требования связаны с отсутствием возможности стандартизации факторов, влияющих на индивидуальные генетические особенности и жизнедеятельность (сопутствующие заболевания, образ жизни, питание и др.) доноров [7].
Для проведения испытания моноциты можно получать самостоятельно в лаборатории или использовать готовые клетки из коммерческих наборов. Источниками тест-объекта могут быть как клеточная линия или мононуклеарные клетки периферической крови человека (МКПК), так и цельная кровь или пулы цельной крови, которые квалифицируются в соответствии с требованиями Государственной фармакопеи Российской Федерации (ГФ РФ)16. Особенности выполнения работ с клетками зависят от выбранного источника моноцитов:
Цельная кровь. Для получения МКПК используют нативную цельную кровь не менее чем от 4 здоровых доноров. Оптимальная концентрация готовой клеточной суспензии для испытания — 1,0×10⁷ клеток в 1 мл. При работе с данным источником клеток требуется соблюдение строгих правил работы с биологическими жидкостями, наличие компетентных сотрудников, а также специализированное оборудование17.
Клеточная линия Mono Mac 6 (ММ6) впервые была получена в 1988 г. из периферической крови пациента с острым лейкозом при помощи клонирования. К линии моноцитов она отнесена на основании морфологических, цитохимических и иммунологических критериев, которые подтвердили фенотипические и функциональные особенности зрелых моноцитов [8][9]. Так как ММ6 была получена путем клонирования, перед ее использованием необходимо исключить возможные мутации клеток, а также оценить их функциональную стабильность и экспрессию (способность улавливать пирогены)18.
Клеточная линия MM6 чувствительна как к грамположительным, так и к грамотрицательным бактериям, но нечувствительна к дрожжам и спорам грибов [10], в связи с чем моноциты этой линии несколько уступают по активности живым клеткам. Причиной этому является искусственное поддержание жизни клеток ММ6. Так при появлении новой клетки набор специализированных для иммунного ответа и выработки цитокинов толл-подобных рецепторов (TLR), находящихся на поверхности моноцитов, может быть неполон, в отличие от моноцитов, выделенных из крови здорового человека. Так, TLR2 распознает бактериальные патоген-ассоциированные молекулы паттернов — липотейхоевые кислоты, липоарабиноманнаны, пептидогликан и некоторые другие, TLR4 — липополисахариды грамотрицательных бактерий [11]. В случае их отсутствия клонированные клетки становятся нечувствительными к ряду пирогенов, поэтому ММ6 считается ограниченной в способности обнаруживать НЭП19.
Криоконсервированные моноциты (квалифицированные, подсчитанные и рассчитанные на одно испытание) являются наиболее удобным и практичным источником клеток и позволяет использовать нужное количество клеток, отвечающих морфологическим и функциональным критериям. Главной задачей при работе с ними является обеспечение жизнеспособности клеток после размораживания, так как моноцитарные клетки сохраняют свою жизнеспособность при температуре не выше –80 °С. Процедуру оттаивания следует проводить на водяной бане при температуре 37 °С в течение 2–3 мин. В случае длительного и постепенного размораживания существует вероятность гибели клеток в результате действия консерванта диметилсульфоксида, контакт с которым в жидкой фазе приводит к снижению жизнеспособности моноцитов [12]. При транспортировке и хранении следует строго соблюдать температурный режим. Следует отметить, что выполнение теста с использованием свежевыделенных МКПК дает более надежные результаты при обнаружении пирогенов в ЛП [12].
Вне зависимости от способа получения моноцитов клетки обязательно должны быть квалифицированы перед проведением испытания. Для этого необходимо определить чувствительность моноцитов к эндотоксинам посредством построения стандартной калибровочной кривой зависимости взаимодействия моноцитов с эндотоксинами разной концентрации20.
Необходимо учитывать, что при внедрении показателя в рутинный контроль потребление здоровой человеческой цельной крови возрастет в разы. Чтобы избежать перерасхода материала, жизненно необходимого людям, учеными предпринимаются попытки использовать в качестве источника моноцитов клетки крови животных. Так, немецкие ученые рассмотрели возможность использования клеток крупного рогатого скота. В пользу применения бычьей крови свидетельствует, например, то, что набор TLR лейкоцитов быка сравним с человеческими, а также сообщения о прямых попытках использовать кровь быка для обнаружения бактериальных эндотоксинов (липополисахаридов) [7]. Следует отметить, что условия содержания животных и контроль за содержанием конкретных патогенов можно стандартизировать, что позволит получать клетки более однородного качества.
Ученые из Южной Кореи разработали и внедрили в практику тест «Rabbit МАТ» с моноцитами крови кроликов. Авторы полагают, что моноциты кроликов более чувствительны, чем моноциты человека [13]. На сегодняшний день МАТ с клетками крови животных имеет экспериментальный единичный характер и не получил широкого распространения на практике.
ПРЕИМУЩЕСТВА И НЕДОСТАТКИ ТЕСТА АКТИВАЦИИ МОНОЦИТОВ
Основными преимуществами МАТ являются:
1) возможность замены показателя «Пирогенность» in vitro; возможность определения содержания как БЭ, так и НЭП без использования животных (что не позволяют иные, однонаправленные методы in vitro);
2) расширение области контроля ЛС на наличие пирогенных веществ любой природы. В биологическом испытании тест-доза, которая вводится на килограмм массы кролика, всегда выше терапевтической, что связано с более низкой чувствительностью кроликов к пирогенам по сравнению с человеком. Некоторые образцы ввиду своих фармакологических и (или) физических свойств не могут тестироваться на животных, так как при внутривенном введении это может привести к интоксикации живого организма или даже к летальному исходу, а МАТ позволяет контролировать подобные образцы [1];
3) возможность контроля испытуемых образцов, для которых сложно устранить влияние мешающих факторов в испытании «Бактериальные эндотоксины»21. Так, например, при контроле альбумина, содержащего большое количество бета-глюканов, взаимодействующих с лизатом амебоцитов, возможно получение ложноположительных результатов, в то время как использование МАТ позволит этого избежать [14];
4) наличие нескольких методов (А, В и С), которые позволяют применять испытание для групп фармацевтических средств МИБП, обладающих пирогенными свойствами. В таком случае испытание проводят с использованием стандарта сравнения — серии образца, в которой содержится регламентированное количество пирогенов (Метод С).
К основным недостаткам МАТ относят следующие (рис. 2):
1) больше времени (до 48 ч), чем в случае исследования биологическим методом на кроликах (3–5 ч);
2) многостадийность и длительность процесса повышает риск возможного возникновения ошибок (человеческий фактор);
3) специфическая квалификация персонала, допуск персонала к работе с кровью;
4) дополнительное оборудование для подсчета клеток, их замораживания и хранения;
5) большое количество донорской крови человека для получения моноцитов, необходимых для основного эксперимента, и для проведения предварительных испытаний по определению мешающих факторов (например, ингибирование выработки цитокинов, варьирование экспрессии клеток и др.).
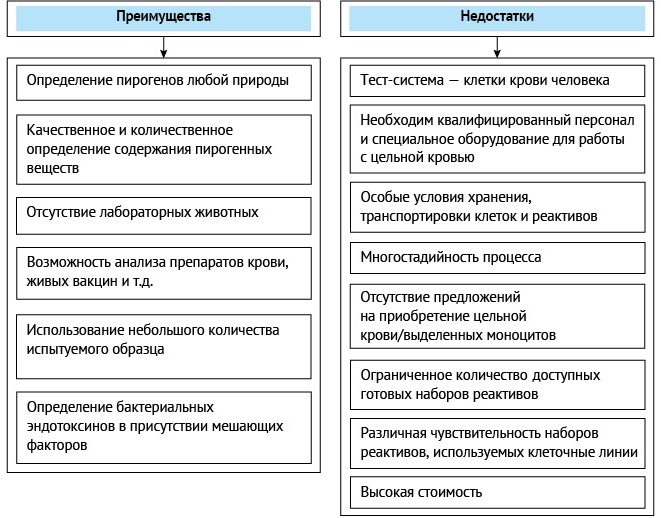
Рисунок подготовлен авторами / The figure is prepared by the authors
Рис. 2. Характеристика метода определения пирогенности с использованием моноцитов
Fig. 2. Characteristics of the method for determining pyrogenicity using monocytes
ВНЕДРЕНИЕ МЕТОДА В ПРАКТИКУ КОНТРОЛЯ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ
В настоящее время МАТ включен в большинство фармакопей мира (страны ЕАЭС, страны Европы, Индия, Корея, Российская Федерация), в некоторых странах (США и Китай) тест выполняют в соответствии с руководствами22, в которых описаны условия его применения [15].
Несмотря на введение метода in vitro в качестве фармакопейного для определения пирогенных примесей любой природы, производители не спешат переходить на клеточную методику23. Это подтверждается результатами опроса24, опубликованными в 2018 г. на ежегодной конференции Европейского партнерства по альтернативным подходам к тестированию на животных (EPAA)25, проведенного среди европейских компаний и испытательных институтов, которые все еще регулярно проводят испытания на кроликах. Было установлено, что при наличии фармакопейного метода in vivo стимулов для внедрения МАТ недостаточно26. Еще одной причиной незавершенного перехода на клеточную методику является отсутствие международной гармонизации требований к определению пирогенных примесей — правила применения МАТ в разных странах отличаются, что напрямую влияет на введение метода в нормативной документации [16].
Согласно ст. 13 «Выбор методов» Директивы ЕС 2010/63/EU27 единственным выходом из ситуации является полное исключение биологического метода из Европейской фармакопеи. Для ускорения целенаправленного процесса перехода на использование МАТ в качестве основного метода в декабре 2024 г. Европейское агентство по лекарственным средствам (European Medicines Agency, EMA) опубликовало проект документа нормативных требований к испытаниям ЛС и возможности внедрения принципов 3R28, в котором описана рабочая программа, включающая план по исключению показателя «Пирогенность» к январю 2026 г. Для регистрации новых ЛП, в том числе и МИБП, необходимо предоставлять данные об отсутствии пирогенных веществ, подтвержденные только с помощью МАТ29.
В июле 2025 г. в Ph. Eur. 11 изд. (приложение 11.8) планируется утверждение главы 5.1.13 Pyrogenicity30, которая включает в себя описания всех испытаний, направленных на обнаружение пирогенных примесей31. В июле 2024 г. была опубликована новая отдельная монография, касающаяся вакцин, содержащих пирогенные вещества32. В настоящее время МАТ регламентирован в Ph. Eur. только для одной действующей частной монографии 01/2018:0896 «Deferoxamine mesilate», в которой есть указание о причине выбора данного метода (ингибирующее действие на реактив) взамен показателя «Бактериальные эндотоксины». Такой же метод испытания рассматривается в проекте монографии 07/2025:2537 «3-O-Desacyl-4'-monophosphoryl lipid A».
В Фармакопее США в некоторые частные монографии до сих пор включен тест на кроликах, но в соответствии с руководством33 для производителей для определения содержания пирогенных примесей допускается использование МАТ при наличии валидационных материалов об альтернативности методов. Для медицинских изделий, для которых повышен риск содержания НЭП, рекомендуется использовать испытания in vivo, а именно, следовать монографии USP <151> Pyrogenicity test. Для снижения количества испытаний на животных в некоторых случаях, валидированных согласно USP <1225> Validation of сompendial procedures, достаточно использования теста на бактериальные эндотоксины USP <85> Bacterial endotoxin test.
В России метод МАТ практически не используется, несмотря на то что он введен в Государственную фармакопею Российской Федерации XIV изд.34, и не регламентирован ни в одной фармакопейной статье (ФС). Напротив, биологическое испытание «Пирогенность» описано в 63 ФС, 15 из которых для ЛС, остальные для МИБП.
В связи с гармонизацией с Европейской фармакопеей, а именно с изменением монографии «2.6.30 Monocyte-activation test»35 и введением монографии «2.6.40 Monocyte-activation test for vaccines containing inherently pyrogenic components»36, планируется пересмотр российской ОФС 1.2.4.0016.18 и введение отдельной статьи с описанием МАТ для вакцин, содержащих пирогенные вещества. Основные изменения коснутся методов постановки испытания: на выбор будут предложены два варианта постановки вместо трех: полуколичественный метод и сравнительное испытание с контрольной серией.
С целью решения вопроса о сокращении использования лабораторных животных в контроле пирогенных примесей авторами публикации был проведен теоретический анализ, в котором была оценена необходимость наличия биологического показателя в ФС для ЛС природного происхождения. В ходе анализа ряда нормативных документов было установлено, что для некоторых препаратов допустим контроль только бактериальных эндотоксинов, поскольку технологии производства и соблюдение правил GMP позволили минимизировать риск загрязнения неэндотоксиновыми пирогенами, что подтверждено многолетними результатами контроля. Такой подход позволит не только снизить количество используемых животных для метода in vivo, но и сократить перечень наименований препаратов, для которых необходим переход на МАТ, что, в свою очередь, напрямую влияет на снижение потребности в донорской крови, необходимой для его проведения. В настоящее время на территории РФ доступны готовые наборы реактивов для проведения теста in vitro, которые рассчитаны на постановку одного испытания. Это значительно облегчает выполнение теста, так как в работу берут необходимое количество подготовленных и квалифицированных моноцитов. Исследователям не нужно специально выделять клетки из крови, что заметно упрощает процесс испытания, способствует освоению теста и оценке возможного применения для контроля качества ЛС и МИБП на наличие пирогенных примесей.
Так как на регистрацию уже начали поступать образцы, в которых валидационные материалы представлены с использованием МАТ37, российским производителям и контрольным органам необходимо приступить к освоению данной методики.
ЗАКЛЮЧЕНИЕ
Внедрение метода in vitro как основного инструмента контроля пирогенных примесей любой природы связано с рядом существенных препятствий. В первую очередь должны быть урегулированы вопросы логистики и ценообразования, касающиеся источников клеток и необходимых реактивов. На данный момент эти проблемы определяют меньшую востребованность метода in vitro по сравнению с классическими однонаправленными методами определения пирогенных примесей. Прежде чем полностью отказываться от традиционного биологического испытания, необходимо провести тщательную и всестороннюю валидацию альтернативного метода.
Однозначно оценить перспективы применения клеточного метода на территории России в настоящее время сложно, так как отсутствуют практические данные. МАТ — единственный реальный путь отказа от животных при определении пирогенов неэндотоксиновой природы. Следовательно, производителям и контрольным службам необходимо приступить к осваиванию теста активации моноцитов. Наличие доступных наборов реактивов с готовыми выделенными моноцитами является хорошей поддержкой в освоении метода.
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Е.О. Чечетова — основная идея работы, сбор, анализ и систематизация литературных данных, набор текста, формулировка выводов; Н.П. Неугодова — критический пересмотр текста рукописи, консультация, утверждение окончательного варианта статьи для публикации; О.В. Шаповалова — сбор литературных данных, обсуждение и редактирование текста рукописи.
Благодарности. Коллектив авторов благодарит А.А. Тутнову за ценные консультации и возможность практической работы.
Authors’ contributions. All authors confirm that their authorship meets the ICMJE criteria. The most significant contributions were as is distributed as follows. Ekaterina O. Chechetova — the main idea of the work, collection, analysis and systematization of literary data, typesetting, formulation of conclusions. Natalia P. Neugodova — critical revision of the manuscript text and approval of the final version of the article for publication, consultation, approval of the final version of the article for publication. Olga V. Shapovalova — collection of literary data, discussion and editing of the manuscript.
Acknowledgements. The team of authors thanks Anna A. Tutnova for valuable consultations and the opportunity for practical work.
1. Russell W, Burch R. Principles of humane experimental techniques. London: Methuen & Co; 1959.
2. Альтернативы экспериментам на животных. Проект организации «Врачи против экспериментов на животных.
3. Лютинский СИ. Патологическая физиология сельскохозяйственных животных. М.: КолосС; 2002.
4. General chapter <151> Pyrogen test. USP43–NF38. Rockville; 2024.
5. Директива Европейского парламента и Совета Европейского союза от 22.09.2010 № 2010/63/EU по охране животных, используемых в научных целях.
6. Russell W, Burch R. Principles of humane experimental techniques. London: Methuen & Co; 1959.
7. Под однонаправленными подразумеваются не универсальные методы, характеризующиеся высокой селективностью по отношению к одному (нескольким) видам пирогенов [3].
8. ОФС.1.2.4.0006.15 Бактериальные эндотоксины. Государственная фармакопея Российской Федерации. XIV изд. М.; 2018.
ОФС2.1.6.12 Испытание на бактериальные эндотоксины с использованием рекомбинантного фактора. Фармакопея Евразийского экономического союза. Т. 1, ч. 3. М.; 2024.
General chapter 2.6.32 Test for bacterial endotoxins using recombinant factor C. European Pharmacopoeia. 11th ed. Strasbourg: EDQM; 2024.
9. Европейская конвенция о защите позвоночных животных, используемых для экспериментов или в иных научных целях. ETS No. 123, 18.03.1986.
10. Ph. Eur. bids adieu to rabbit pyrogen test in its monographs.
Charton E. European Pharmacopoeia approach to testing for pyrogenicity. American Pharmaceutical Review; 2022.
11. ОФС.42-0002-00 Бактериальные эндотоксины. Государственная фармакопея Российской Федерации. XII изд. М.; 2008.
12. General chapter 2.6.30 Monocyte activation test. European Pharmacopoeia. 11th ed. Strasbourg: EDQM; 2024.
13. ОФС.1.2.4.0016.18 Тест активации моноцитов. Государственная фармакопея Российской Федерации. XIV изд. М.; 2018.
14. ОФС.1.2.4.0016.18 Тест активации моноцитов. Государственная фармакопея Российской Федерации. XIV изд. М.; 2018.
15. Контрольную серию, заведомо не содержащую пирогенные вещества, в препарате в качестве примесей, создают на производстве.
16. ОФС.1.2.4.0016.18 Тест активации моноцитов. Государственная фармакопея Российской Федерации. XIV изд. М.; 2018.
17. Приказ Министерства труда и социальной защиты Российской Федерации от 18.12.2020 № 928н «Об утверждении Правил по охране труда в медицинских организациях».
18. ОФС.1.2.4.0016.18 Тест активации моноцитов. Государственная фармакопея Российской Федерации. XIV изд. М.; 2018.
19. General chapter 2.6.30 Monocyte activation test. European Pharmacopoeia. 10th ed. Strasbourg: EDQM; 2019.
ICCVAM-recommended test method protocol The monocytoid cell line Mono Mac 6 / Interleukin-6 in vitro pyrogen test, 2008.
20. ОФС.1.2.4.0016.18 Тест активации моноцитов. Государственная фармакопея Российской Федерации. XIV изд. М.; 2018.
21. ОФС.1.2.4.0016.15 Бактериальные эндотоксины. Государственная фармакопея Российской Федерации. XIV изд. М.; 2018.
22. General chapter 9301 Guidelines for the application of safety tests for injections. Pharmacopoeia of the People’s Republic of China. Beijing; 2020.
Guidance for industry: Pyrogen and endotoxins testing: Questions and answers. FDA; 2012.
23. Charton E. European Pharmacopoeia approach to testing for pyrogenicity. American Pharmaceutical Review; 2022.
Ph. Eur. bids adieu to rabbit pyrogen test in its monographs.
24. Charton E. European Pharmacopoeia approach to testing for pyrogenicity. American Pharmaceutical Review; 2022.
25. European Partnership for Alternative Approaches to Animal Testing (EPAA). EPAA Annual Conference 2018: Pooling resources to promote the use of alternative methods for advancing safety assessment.
26. https://www.edqm.eu/en/-/ph.-eur.-bids-adieu-to-rabbit-pyrogen-test-in-its-monographs?p_l_back_url=%2Fen%2Fsearch%3Fq%3Dpyrogen
27. Директива Европейского парламента и Совета Европейского союза от 22.09.2010 № 2010/63/EU по охране животных, используемых в научных целях.
28. Reflection paper on the current regulatory testing 4 requirements for medicinal products for human use and 5 opportunities for implementation of the 3Rs. EMA; 2024.
29. Strategy for removing or replacing the rabbit pyrogen test: New pyrogenicity strategy of the European Pharmacopoeia Commission, 2022.
30. Там же.
31. General chapter 2.6.14 Bacterial endotoxin; 2.6.30 Monocyte activation test; 2.6.32 Recombinant factor C. European Pharmacopoeia. 11th ed. Strasbourg: EDQM; 2024.
32. General chapter 2.6.40. Monocyte-activation test for vaccines containing inherently pyrogenic components. European Pharmacopoeia. 10th ed. Strasbourg: EDQM; 2019.
33. Guidance for industry: Pyrogen and endotoxins testing: Questions and answers. FDA; 2012.
34. ОФС.1.2.4.0016.18 Тест активации моноцитов. Государственная фармакопея Российской Федерации. XIV изд. М.; 2018.
35. General chapter 2.6.30 Monocyte-activation test. European Pharmacopoeia. 11th ed. Strasbourg: EDQM; 2024.
36. General chapter 2.6.40. Monocyte-activation test for vaccines containing inherently pyrogenic components. European Pharmacopoeia. 10th ed. Strasbourg: EDQM; 2019.
37. Материалы работ, выполняемых в рамках уставной деятельности ФГБУ «НЦЭСМП» Минздрава России.
Список литературы
1. Багирова ВЛ, Митькин ОД, Митькина ЛИ. Тест на активацию моноцитов как альтернатива тесту «пирогенность» на кроликах. Фармация. 2010;(7):40–1.
2. Moreillon P, Majcherczyk PA. Proinflammatory activity of cell-wall constituents from gram-positive bacteria. Scand J Infect Dis. 2003;35(9):632–41. https://doi.org/10.1080/00365540310016259
3. Неугодова НП, Рябцева МС, Сапожникова ГА. Основные требования к биологическим показателям при оценке качества лекарственных средств. Возможности валидации биологических методов контроля. Ведомости Научного центра экспертизы средств медицинского применения. 2016;(3):3–8.
4. Ситников АГ, Долгова ГВ, Неугодова НП. Анализ «Бактериальные эндотоксины» в отечественной нормативной документации. Бюллетень ЛАЛ-тест. 2008;(1):1–3.
5. Ситников АГ, Неугодова НП, Долгова ГВ, Йорданова-Пашевич А. ЛАЛ-тест в России – итоги пяти лет внедрения метода в практику фармацевтического производства. Бюллетень ЛАЛ-тест. 2002;(1):1–8.
6. Hartung T, Wendel A. Detection of Pyrogens using human whole blood. ALTEX. 1995;12(2):70–5. PMID: 11178418.
7. Wunderlich C, Schumacher S, Kietzmann M. Pyrogen detection methods: Comparison of bovine whole blood assay (bWBA) and monocyte activation test (MAT). BMC Pharmacol Toxicol. 2014;15:50. https://doi.org/10.1186/2050-6511-15-50
8. Ziegler‐Heitbroc H, Thiel E, Futterer A, Herzog V, Wirtz A, Riethmüller G. Establishment of a human cell line (Mono Mac 6) with characteristics of mature monocytes. Int J Cancer. 1988;41(3):456–61. https://doi.org/10.1002/ijc.2910410324
9. Akula S, Lara S, Olsson A-K, Hellman L. Quantitative analysis of the transcriptome of two commonly used human monocytic cell lines – THP-1 and Mono Mac 6 – Reveals their arrest during early monocyte/neutrophil differentiation. Int J Mol Sci. 2022;23(10):5818. https://doi.org/10.3390/ijms23105818
10. Moesby L, Hansen EW, Christensen JD. Ultrasonication of pyrogenic microorganisms improves the detection of pyrogens in the Mono Mac 6 assay. Eur J Pharm Sci. 2000;11(1):51–7. https://doi.org/10.1016/S0928-0987(00)00080-4
11. Тюкавкина СЮ, Лабушкина АВ, Оксенюк ОС. Роль toll-подобных рецепторов в иммунопатогенезе нефропатий. Журнал фундаментальной медицины и биологии. 2017;(1):17–26.
12. Koryakina A, Frey E, Bruegger P. Cryopreservation of human monocytes for pharmacopeial monocyte activation test. J Immunol Methods. 2014;405:181–91. https://doi.org/10.1016/j.jim.2014.01.005
13. Kim JH, Jung K, Kim J, Lee J, Kim H, Song H, et al. Development of a rabbit monocyte activation test as an alternative to the rabbit pyrogen test and its application in the analysis of plasma-derived products. Biologicals. 2021;71:20–30. https://doi.org/10.1016/j.biologicals.2021.04.003
14. Perdomo-Morales R, Pardo-Ruiz Z, Spreitzer I, Lagarto A, Montag T. Monocyte activation test (MAT) reliably detects pyrogens in parenteral formulations of human serum albumin. ALTEX. 2011;28(3):227–35. https://doi.org/10.14573/altex.2011.3.227
15. Xu X, Xu H, Shang Y, Zhu R, Hong X, Song Z, Yang Z. Development of the general chapters of the Chinese Pharmacopoeia 2020 edition: A review. J Pharm Anal. 2021;11(4):398–404. https://doi.org/10.1016/j.jpha.2021.05
16. Cirefice G, Schütte K, Spreitzer I, Charton E, Shaid S, Viviani L, et al. Rubbrecht. The future of pyrogenicity testing: Phasing out the rabbit pyrogen test. A meeting report, Biologicals. 2023;84:101702. https://doi.org/10.1016/j.biologicals.2023.101702
Об авторах
Е. О. ЧечетоваРоссия
Чечетова Екатерина Олеговна
Петровский б-р, д. 8, стр. 2, Москва, 127051
Н. П. Неугодова
Россия
Неугодова Наталия Петровна, канд. биол. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
О. В. Шаповалова
Россия
Шаповалова Ольга Владимировна, канд. фарм. наук
Петровский б-р, д. 8, стр. 2, Москва, 127051
Дополнительные файлы
Рецензия
Для цитирования:
Чечетова Е.О., Неугодова Н.П., Шаповалова О.В. Метод определения пирогенности с использованием моноцитов: перспективы и особенности применения (обзор). Регуляторные исследования и экспертиза лекарственных средств. 2025;15(3):347-356. https://doi.org/10.30895/1991-2919-2025-15-3-347-356
For citation:
Chechetova E.O., Neugodova N.P., Shapovalova O.V. Method for Determining Pyrogenicity Using Monocytes: Prospects and Features of Application (Review). Regulatory Research and Medicine Evaluation. 2025;15(3):347-356. (In Russ.) https://doi.org/10.30895/1991-2919-2025-15-3-347-356



































