Перейти к:
Стратегические индикаторы в разработке оригинальных препаратов в 2024 году: анализ пайплайнов международных фармацевтических лидеров
https://doi.org/10.30895/1991-2919-2025-752
Резюме
ВВЕДЕНИЕ. Ключевое влияние на планирование разработки оригинальных лекарственных препаратов оказывают крупнейшие зарубежные фармацевтические компании. Для определения направлений развития разработки оригинальных препаратов в России актуален анализ мировых трендов и слабых сигналов (тенденций) — ранних индикаторов значимых в будущем инноваций.
ЦЕЛЬ. Выявление трендов и тенденций, способных оказать влияние на фармацевтическую разработку в России, путем анализа спектра разрабатываемых оригинальных препаратов крупнейшими зарубежными компаниями.
МАТЕРИАЛЫ И МЕТОДЫ. Проведен анализ планов разработки препаратов на 2024 г. 20 крупнейших на мировом рынке зарубежных фармацевтических компаний, имеющих наиболее высокие бюджеты на исследования и разработки. Проанализированы оригинальные препараты, запланированные к изучению в клинических исследованиях I фазы за период январь — май 2024 г. Применена концепция описательного исследования, которая базируется на ретроспективном анализе вторичных данных. Измерениями проведенного анализа являлись номенклатура разрабатываемых оригинальных препаратов, направления разработки, целевые классы, виды и группы препаратов. На основании количественной и качественной оценки проводилось определение трендов и тенденций (слабых сигналов) в разработке оригинальных препаратов.
РЕЗУЛЬТАТЫ. За анализируемый период 17 из 20 крупнейших фармацевтических компаний включили в исследования I фазы 84 оригинальных препарата. Больше всего разрабатываемых молекул определено в направлениях: «онкология», «эндокринология и обмен веществ», «сердечно-сосудистая система», «иммунология». 40 препаратов включены в исследования I фазы в направлении «онкология». Наибольшее количество препаратов (42%) относится к молекулам с относительно высокой молекулярной массой. На основании выявленного количества препаратов у нескольких разработчиков сделано предположение о наличии трендов разработки для следующих классов: «Большая молекула» — биспецифическое антитело (10 препаратов, 5 разработчиков); моноспецифическое антитело (8 препаратов, 7 разработчиков); конъюгат «антитело — лекарственное средство» (8 препаратов, 3 разработчика); «Малая молекула» — ингибиторы ферментов (9 препаратов, 6 разработчиков); «Препарат клеточной терапии» — препараты на основе CAR-T технологии (6 препаратов, 2 разработчика).
ВЫВОДЫ. Актуальными трендами в развитии таргетной терапии является разработка биспецифических антител и конъюгатов «антитело–лекарство» нового поколения, параллельно с разработкой САR-T препаратов на основе аутологичных Т-клеток, преимущественно для терапии злокачественных новообразований. Исследование препаратов группы мультиспецифических антител формирует тенденцию разработки препаратов для таргетной терапии рака. Создание низкомолекулярных ингибиторов ферментов определяет тренд разработки препаратов в различных терапевтических областях. Разработка ингибиторов ферментов, воздействующих на мишени, основанные на принципе синтетической летальности (такие как WRN и PRMT5), является тенденцией в разработке малых молекул для прицельной терапии злокачественных опухолей.
Ключевые слова
Для цитирования:
Литвин Л.С., Куликова Е.А. Стратегические индикаторы в разработке оригинальных препаратов в 2024 году: анализ пайплайнов международных фармацевтических лидеров. Регуляторные исследования и экспертиза лекарственных средств. 2025;15(4):471-484. https://doi.org/10.30895/1991-2919-2025-752
For citation:
Litvin L.S., Kulikova E.A. Strategic Indicators in the Development of Original Medicinal Products in 2024: Analysis of Pipelines of International Pharmaceutical Leaders. Regulatory Research and Medicine Evaluation. 2025;15(4):471-484. https://doi.org/10.30895/1991-2919-2025-752
ВВЕДЕНИЕ
Значимое влияние на спектр разрабатываемых оригинальных лекарственных препаратов (ЛП) оказывают крупнейшие мировые фармацевтические компании. Эффективные стратегии, способствующие реализации исследований перспективных разработок ЛП, обеспечивают данным компаниям способность поддерживать конкурентное преимущество, создавать жизнеспособные бизнес-модели и влиять на изменение парадигмы привычной клинической практики, предлагая инновационные решения, что определяет долгосрочный успех на фармацевтическом рынке [1].
Анализ мировых трендов и тенденций (слабых сигналов) в разработке оригинальных ЛП является одним из ключевых инструментов для понимания возможного направления развития производства российских оригинальных препаратов. Он позволяет выделить целевые нозологии, новые терапевтические мишени и подходы к разработке препаратов, являющиеся наиболее обоснованными с точки зрения подтверждения потенциального клинического эффекта, востребованности у пациентов и коммерческой перспективности.
Цель работы — выявление трендов и тенденций, способных оказать влияние на фармацевтическую разработку в России, путем анализа спектра разрабатываемых оригинальных препаратов крупнейшими зарубежными компаниями. Задачи исследования: анализ планов разработки ЛП на 2024 г. 20 крупнейших зарубежных фармацевтических компаний; определение ЛП, запланированных к изучению в клинических исследованиях I фазы; анализ распределения ЛП по направлениям/областям медицины и показаниям; разработка подхода к классификации ЛП; определение мишеней воздействия лекарственных средств; определение трендов и тенденций (слабых сигналов) в разработке ЛП.
МАТЕРИАЛЫ И МЕТОДЫ
Проведен анализ планов разработки (пайплайнов) лекарственных препаратов на 2024 г. 20 крупнейших на мировом рынке фармацевтических компаний, имеющих наиболее высокие бюджеты на исследования и разработки ЛП в 2023 г.1 Пайплайны компаний (Merck&Co, Roche, Novartis, Johnson& Johnson, Astra Zeneca, Pfizer, Eli Lilly, Bristol Myers Squibb, GSK, AbbVie, Sanofi, Gilead Sciences, Beringer Ingelheim, Moderna, Takeda, Amgen, Novo Nordisk, Regeneron Pharmaceuticals, Bayer, Otsuka Pharmaceutical)2 представлены в открытом доступе на официальных сайтах компаний и доступны для оценки спектра разрабатываемых препаратов. Для анализа использованы данные, предоставленные компаниями по состоянию на май 2024 г., такое ограничение обусловлено индивидуальной по времени периодичностью обновления данной информации на сайтах компаний.
Определены ЛП, запланированные к изучению в клинических исследованиях (КИ) I фазы для всех компаний из перечня за период январь — май 2024 г. Фармацевтические компании распределены по объемам инвестиций в исследования и разработки и по количеству оригинальных препаратов, запланированных к первому применению у человека за анализируемый период. Препараты распределены по направлениям/областям медицины.
Оценка областей разработки и показаний для применения этих ЛП проведена по Международной статистической классификации болезней и проблем, связанных со здоровьем, 10 пересмотра (МКБ-10).
Препараты распределены по классам, видам и группам. Под классом в данной работе понимается характерная общность химического строения молекул. Названия классов ЛП даны в соответствии с формулировками, предложенными в пайплайнах, с переводом на русский язык. Систематизация препаратов по виду и группе внутри классов, основанная на общности в технологиях разработки ЛП, была предложена в координационном центре проекта «Медицинская наука для человека». Под видом ЛП понимаются биологические и (или) полученные путем химического синтеза лекарственные препараты. Под группой ЛП понимаются биологические и (или) химически синтезированные препараты, объединенные на основании общности специфической технологии разработки и потенциальному физико-химическому или химическому взаимодействию с мишенями.
Применена концепция описательного исследования, которая базируется на ретроспективном анализе вторичных данных. Измерениями анализа являются разрабатываемые оригинальные ЛП, направления и области разработки, целевые классы, виды и группы ЛП.
Для определения трендов в разработке оригинальных ЛП выделены классы, виды и группы ЛП, разрабатываемые в наибольшем количестве и наибольшим количеством компаний-разработчиков. Под трендами в рамках данной работы понимали выявленное сходство при выборе разрабатываемых препаратов несколькими компаниями (минимум двумя), определяющее общую траекторию развития фармацевтической разработки.
Классы с наибольшим количеством ЛП оценивались на предмет появляющихся тенденций (слабых сигналов). В фармацевтике тенденция (слабый сигнал) — это ранний, часто слабо выраженный признак потенциального изменения, который может повлиять на отрасль в будущем. Такие сигналы требуют мониторинга, так как могут привести к новым трендам. Таким образом, слабые сигналы — индикаторы значимых в будущем событий, применительно к фармацевтической индустрии — появление перспективных новых разработок. Сделано предположение, что тенденцией (слабым сигналом) в разработке могут быть ЛП, формирующие принципиально новую группу препаратов и соответствующие трем предложенным качественным критериям, позволяющим определить статус тенденции:
1) наличие опубликованной информации о потенциальной клинической значимости препаратов новой группы ЛП;
2) отсутствие на сегодняшний день в мире зарегистрированных ЛП, которые можно было бы отнести к данной группе;
3) наличие публикаций о выводе ряда ЛП данной группы на этап клинических исследований.
На основании наличия информации о нескольких разрабатываемых препаратах одного класса, имеющих одинаковую мишень воздействия, также делали предположение о наличии тенденций в разработке ЛП (рис. 1).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
За анализируемый период (январь — май 2024 г.) 17 из 20 компаний включили 84 новых оригинальных препарата в КИ I фазы (табл. 1). Лидеры по количеству новых ЛП в пайплайнах: Astra Zeneca (n=18), Pfizer (n=13), Bristol Myers Squibb (n=9). Анализ пайплайнов компаний Merck, Takeda и Otsuka Pharmaceutical не выявил новых молекул, запланированных к исследованиям в рамках I фазы.
Анализ направлений/областей и показаний для применения лекарственных препаратов. Препараты, которые были включены в КИ I фазы, можно распределить по 12 направлениям разработки (табл. 2). 40 (48%) разрабатываемых препаратов относятся к направлению «Онкология», что подчеркивает его приоритетность. Высокая активность в этой терапевтической области отмечена у AstraZeneca (n=11), Pfizer (n=8), Bristol Myers Squibb (n=6), Novartis (n=5). Также к приоритетам разработки относятся направления «Эндокринология и обмен веществ», «Иммунология», «Сердечно-сосудистая система».
Анализ показал, что из 84 ЛП 76 (90%) соотносятся с классами и группами по МКБ-10, для 8 (10%) ЛП определение затруднено из-за широких границ показаний (например, фиброз). Для направления «Иммунология» анализ по МКБ-10 был затруднен из-за широких показаний, обозначенных разработчиками (аутоиммунные заболевания, воспаление). В связи с этим вместо направления «Иммунология» рассмотрено следующее по числу препаратов направление: «Сердечно-сосудистая система». Систематизированная информация по количественному распределению разрабатываемых оригинальных препаратов в соответствии с показаниями по классам и группам МКБ-10 представлена в таблице 3 «Распределение показаний для применения разрабатываемых оригинальных препаратов, запланированных к первому применению у человека в 2024 г., по общему количеству препаратов, классам и группам МКБ-10» (опубликована на сайте журнала3).
Анализ классов, видов и групп препаратов. Среди 84 оригинальных ЛП, включенных в пайплайны для КИ I фазы, для 11 не удалось определить класс, поэтому в анализ вошли 73 ЛП. Распределение ЛП представлено в таблице 4 «Распределение разрабатываемых оригинальных препаратов, запланированных к первому применению у человека, по классам, видам и группам» (опубликована на сайте журнала4). Наиболее часто разрабатываемыми классами ЛП явились: «Большая молекула» (42%); «Малая молекула» (27%); «Препарат клеточной терапии» (12%). Для определения трендов оценивали количество ЛП со схожей структурой, а также количество компаний, начавших их разработку.
В классе «Большая молекула» выделены следующие группы ЛП, определяющие тренды: моноспецифическое антитело (моноклональное антитело, МкАТ); конъюгат «антитело — лекарственное средство» (конъюгат-связанные МКaT, КМА); биспецифическое антитело (БсАТ). Препараты групп КМА и БсАТ были выведены на мировой рынок относительно недавно, на сегодняшний день зарегистрировано сравнительно небольшое количество таких препаратов [5].
В классе «Большая молекула» следует обратить внимание на группу ЛП «Мультиспецифическое антитело», которая представлена одним разрабатываемым препаратом (табл. 4). Этот единственный ЛП, отнесенный к принципиально новой группе, тем не менее определяет тенденцию в разработке в классе «Большая молекула». Такой вывод обоснован сочетанием следующих критериев: наличие опубликованной информации о потенциальной клинической значимости ЛП, относящихся к группе «Мультиспецифическое антитело» [2], отсутствие на сегодняшний день зарегистрированных ЛП в мире, которые можно было бы отнести к данной группе [3], подтвержденный факт вывода на этап клинической разработки целого ряда мультиспецифических антител [4].
В классе «Малая молекула» доминирует одна группа ЛП, определяющая тренд разработки: ингибитор фермента (табл. 4). В данной группе на основании наличия у нескольких разработчиков нескольких препаратов, имеющих одинаковую мишень для воздействия, сделано предположение о наличии тенденций разработки ингибиторов PRMT5 и ингибиторов WRN.
В классе «Препарат клеточной терапии» преобладают ЛП одной группы, определяющие тренд разработки «Препарат CAR-T на основе аутологичных Т-лимфоцитов». В данном классе не были идентифицированы тенденции в разработке.
Представляется оправданным отметить выделенные выше группы препаратов в качестве текущих ключевых направлений разработки у ЗФК и рассмотреть их подробнее в неразрывной связи с представленными новыми ЛП-кандидатами проанализированных компаний.
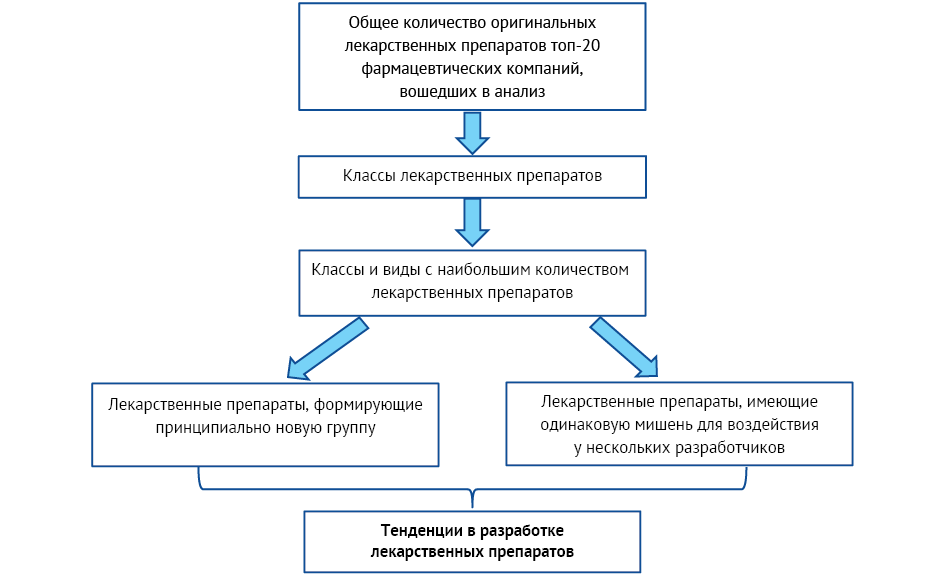
Рисунок подготовлен авторами / The figure is prepared by the authors
Рис. 1. Схема определения тенденций (слабых сигналов) в разработке оригинальных лекарственных препаратов
Fig. 1. Flowchart for identifying tеndencies in the development of original medicinal products
Таблица 1. Распределение фармацевтических компаний по объемам инвестиций в R&D и количеству оригинальных препаратов, запланированных к первому применению у человека в 2024 г.
Table 1. Distribution of Pharmaceutical Companies by R&D Investment Volume and Number of Original medicines Scheduled for First-in-Human Trials in 2024
Название компании | Место компании в рейтинге инвестиций в R&D в 2023 г. | Инвестиции в R&D в 2023 г. (млрд $) | Количество наименований препаратов |
Merck&Co | 1 | 30,5 | 0 |
Roche | 2 | 14,7 | 5 |
Novartis | 3 | 13,6 | 6 |
Johnson&Johnson | 4 | 11,9 | 3 |
Astra Zeneca | 5 | 10,9 | 18 |
Pfizer | 6 | 10,6 | 13 |
Eli Lilly | 7 | 9,3 | 7 |
Bristol Myers Squibb | 8 | 9,2 | 8 |
GSK | 9 | 7,7 | 6 |
AbbVie | 10 | 7,6 | 1 |
Sanofi | 11 | 7,2 | 5 |
Gilead Sciences | 12 | 5,7 | 2 |
Beringer Ingelheim | 13 | 5,6 | 3 |
Moderna | 14 | 4,84 | 1 |
Takeda | 15 | 4,80 | 0 |
Amgen | 16 | 4,78 | 2 |
Novo Nordisk | 17 | 4,70 | 4 |
Regeneron Pharmaceuticals | 18 | 4,4 | 1 |
Bayer | 19 | 3,5 | 1 |
Otsuka Pharmaceutical | 20 | 2,0 | 0 |
Таблица составлена авторами по данным, размещенным на официальных интернет-ресурсах фармацевтических компаний по состоянию на май 2024 г.
Примечание. R&D — Исследования и разработки.
Таблица 2. Распределение оригинальных препаратов, запланированных к первому применению у человека в 2024 г., по направлениям для разработки
Table 2. Distribution of original medicines scheduled for first-in-human trials in 2024 by therapeutic area
Направление разработки | Количество препаратов | |
Ед. | % | |
Онкология | 40 | 47 |
Эндокринология и обмен веществ | 9 | 11 |
Иммунология | 8 | 10 |
Сердечно-сосудистая система | 7 | 8 |
Ревматология | 4 | 4,8 |
Инфекционные болезни | 4 | 4,8 |
Клиническая неврология | 4 | 4,8 |
Дыхательная система | 2 | 2,4 |
Гастроэнтерология и гепатология | 2 | 2,4 |
Патология | 2 | 2,4 |
Колопроктология | 1 | 1,2 |
Аллергология | 1 | 1,2 |
Итого | 84 | 100 |
Таблица составлена авторами по данным, размещенным на официальных интернет-ресурсах фармацевтических компаний по состоянию на май 2024 г.
Класс «Большая молекула». Моноклональные антитела широко представлены на рынке с 1986 г. [6]. К настоящему времени Управление по контролю за качеством продуктов питания и лекарственных средств США (Food and Drug Administration, FDA) одобрило более 100 терапевтических моноклональных антител, которые совершили прорыв в иммунотерапии опухолей и значительно улучшили выживаемость пациентов с определенными типами опухолей и другими заболеваниями [7]. МКaT изменили парадигму терапии рака благодаря точному нацеливанию на поверхностные антигены опухоли, однако лечение с использованием одних МКaT часто оказывается недостаточным [8]. Возникла концепция конъюгат-связанных МКaT (КМА), предназначенная для преодоления разрыва между МКaT и цитотоксическими средствами, улучшая терапевтическое окно. Ключевая идея КМА — направленная доставка цитотоксического препарата в опухолевые клетки и минимизация его системной токсичности. Также КМА привлекают иммунные клетки для уничтожения клеток-мишеней [9].
КМА относятся к таргетным средствам, в структуре которых цитотоксическое вещество соединяется с МКаТ через химический линкер. Препараты КМА обеспечивают точечную доставку цитостатика в клетки-мишени с меньшей системной токсичностью [10]. Первый КМА, Mylotarg (гемтузумаб озогамицин), был одобрен в 2000 г. для лечения острого миелоидного лейкоза [11]. На данном этапе отмечается заметное расширение мишеней и показаний для применения КМА. Существующие стратегии разработки КМА следующих поколений позволяют предположить, что данная категория лекарственных средств имеет высокий потенциал для развития таргетной терапии онкологических заболеваний и, как ожидается, в будущем может стать заменой традиционной химиотерапии [12].
Акцент на разработку КМА делают три компании (табл. 4). Большинство разрабатываемых КМА нацелены на антигены солидных опухолей. Один из 8 КМА, разрабатываемых в КИ I фазы, является первым в своем классе5 (код BL-B01D1, Bristol Myers Squibb). Это биспецифический конъюгат «антитело — лекарственное средство», нацеленный на рецептор эпидермального фактора роста человека 3 типа (HER3) и на рецептор эпидермального фактора роста (EGFR). Рецепторы EGFR и HER3 высоко экспрессируются в эпителиальных опухолях. Препарат содержит новый ингибитор топоизомеразы I (Ed-04), высвобождаемый после антитело-опосредованной интернализации. Доклинические исследования BL-B01D1 показали широкий потенциал при различных солидных опухолях при удовлетворительном профиле безопасности [13].
Биспецифические антитела относят к новому поколению МКаТ, нацеленных на два антигена или эпитопа. Это позволяет вызывать множественные физиологические реакции или противоопухолевые эффекты и обеспечивать значительный лечебный эффект за счет синергии. Лекарственные препараты на основе биспецифических антител начали внедряться в клиническую практику существенно позже, чем КМА. Первый препарат блинатумомаб был зарегистрирован в США в 2014 г. и применяется для лечения рецидивирующего острого лимфобластного лейкоза. В России данный препарат был зарегистрирован в 2023 г.6 Биспецифические антитела уже показали в клинике свои преимущества перед моноспецифическими. Например, блинатумомаб имеет самую высокую эффективность среди всех противоопухолевых препаратов на основе антител, при этом дозировки составляют несколько сотен микрограммов на весь курс лечения, тогда как для терапии моноспецифическими антителами требуется 5–20 г антител на одного пациента в год [14].
Большинство разрабатываемых биспецифических антител направлено на лечение онкозаболеваний, часть — на терапию хронических воспалительных, аутоиммунных, нейродегенеративных, сосудистых и инфекционных болезней. С 2014 г. FDA одобрило 9 ЛП на основе биспецифических антител7. Лидером по числу одобренных препаратов является Roche (4 ЛП), за ней следует Johnson&Johnson (3 ЛП). Объем продаж БсАТ превысил 2,4 млрд $ в первом квартале 2024 г. Более 60% продаж пришлось на рынок США. В 2023 г. глобальные продажи БсАТ превысили 8 млрд $8, что подтверждает их коммерческую перспективность.
Анализ показал, что большинство разрабатываемых биспецифических антител нацелены на лечение солидных опухолей. В 2024 г. пять компаний запланировали КИ I фазы для биспецифических антител (табл. 4). Среди 10 разрабатываемых препаратов 3 можно отнести к потенциально первым в классе5, поскольку в настоящее время отсутствуют препараты с аналогичным механизмом действия.
Биспецифическое антитело JNJ-9968 (Johnson& Johnson) — для лечения гематологических злокачественных новообразований (ЗНО), избирательно воздействующее на клетки, несущие мутации в гене кальретикулина. Мутантная форма кальретикулина (CALRmut), экспрессируемая на поверхности опухолевых клеток, является новой терапевтической мишенью для лечения миелопролиферативных ЗНО. Препарат действует как мост между опухолевыми клетками с такой мутацией и Т-клетками, индуцируя активацию цитотоксического действия последних, что наблюдалось в исследованиях в отношении CD34+ кальретикулин-мутантных клеток [15].
Биспецифический активатор γδT-клеток PF-08046052 (Pfizer) для лечения прогрессирующих солидных опухолей нацелен на рецептор эпидермального фактора роста 1 типа (EGFR). Препарат воздействует преимущественно на EGFR-положительные опухолевые клетки и потенциально может расширить возможности терапии у пациентов с резистентностью к стандартной противоопухолевой терапии за счет активации пула γδT-клеток [16].
Биспецифическое антитело AZD1163 (Astra Zeneca) — ингибитор ферментов пептидил аргинин дезаминазы 2 и 4 (PAD2 и PAD4), разрабатывается для лечения ревматоидного артрита. Ингибирование PAD2 и PAD4 подавляет образование спектра цитруллинированных аутоантигенов, распознаваемых аутоантителами у пациентов c ревматоидным артритом. Результаты доклинических исследований демонстрируют высокую ингибирующую активность относительно PAD2 и PAD4, что указывает на многообещающее влияние препарата на одно из важных патогенетических звеньев при ревматоидном артрите, определяющем образование аутоантигенов [17].
Несмотря на клинический успех моноспецифических и биспецифических антител, все еще существуют ограничения терапевтического эффекта лечения злокачественных опухолей, такие как низкая скорость ответа, резистентность к лечению и другие, что свидетельствует о перспективности исследований мультиспецифических антител (МсА). На сегодняшний день согласованного определения, что такое мультиспецифические антитела, не существует. D. Keri и соавт. [18] считают, что это антитела, распознающие ≥2 эпитопов, а A. Amash и соавт. [19] относят к МсА антитела, нацеленные на ≥3 мишени. Для разграничения общих трендов и тенденций в разработке терапевтических антител в настоящем анализе в группу мультиспецифических антител включались МКаT, нацеленные на 3 и более мишени.
К настоящему времени существует множество МcA, находящихся на этапе клинических исследований [4]. Однако ни одно МcA еще не одобрено для клинического применения [3].
Клиническое значение МсA как потенциальных препаратов для иммунотерапии заключается в следующем [2]:
- способность одновременно связывать три и более различных антигена одновременно;
- усиленная активация иммунных клеток или блокада иммуносупрессии с помощью гибкой комбинации мишеней, обеспечивающей точное и эффективное уничтожение опухоли;
- меньшая молекулярная масса по сравнению с традиционно применяемыми высокомолекулярными агентами (например, формат scFv — одноцепочечный вариабельный фрагмент или короткоформатное антитело, способное распознавать целевой антиген, но не имеющее фрагментированной кристаллизующейся (Fc) области, представляет собой базовую функциональную единицу для разработки МсА), обеспечивающая высокую проницаемость.
Преимуществами МсА могут быть также снижение стоимости производства, а также количества клинических исследований по сравнению с CAR-T или комбинированной терапией антителами [2].
Примером мультиспецифического антитела может быть антитело-активатор NK-клеток и CD8+ Т-клеток компании AbbVie для лечения солидных опухолей, код ABBV-303. Препарат-кандидат нацелен одновременно на три мишени: рецептор фактора роста гепатоцитов (c-Met), активирующий рецептор NK-клеток (NKG2D) и на рецептор CD16a NK-клеток. Связывание ABBV-303 с NKG2D и CD16a приводит к перенаправлению как врожденных (NK-клетки), так и адаптивных (CD8+ Т-клетки) иммунных клеток на лизис опухолевых клеток, экспрессирующих c-Met. Предполагается совместное использование ABBV-303 с широким спектром других иммуноонкологических препаратов, а также с другими традиционными подходами в онкологии — химиотерапией и лучевой терапией [20].
Класс «Малая молекула». Из общей доли низкомолекулярных препаратов, относящихся к классу «Малая молекула» (табл. 4 «Распределение разрабатываемых оригинальных препаратов, запланированных к первому применению у человека в 2024 году, по классам, видам и группам», опубликована на сайте журнала9), ингибиторов ферментов разрабатывается больше всего (9 ЛП, 6 разработчиков). Ингибирование ферментов общепризнано в качестве стратегии терапии таких патологических состояний, как воспаление, диабет, микробные инфекции, ВИЧ, опухолевые заболевания.
Среди целевых ферментов внимание разработчиков сосредоточено на ферментных молекулах, задействованных в патогенезе ЗНО. В нескольких компаниях в разработке находятся препараты, ингибирующие одни и те же ферменты, в частности, аргинин-N-метилтрансферазу 5 и хеликазу синдрома Вернера. Обе мишени являются «синтетическими летальными» мишенями10 и в настоящее время рассматриваются в качестве перспективных целей для таргетной терапии.
Белок аргинин-N-метилтрансфераза 5 (PRMT5) относится к семейству протеин-аргинин-N-метилтрансфераз. На данный момент в клетках человека идентифицировано 9 PRMT. Активность PRMT5 имеет решающее значение для процессов кроветворения, регуляции клеточного апоптоза, прогрессирования клеточного цикла и воспаления, что демонстрирует его потенциал в качестве лекарственной мишени при различных заболеваниях, включая гематологические и солидные формы рака [21]. Определено, что уровень PRMT5 повышается в опухолях с делециями гена MTAP (MTAP del). Фермент PRMT5 был идентифицирован как «синтетическая летальная» мишень для данного генотипа рака. Известно, что данный ген кодирует фосфорилазу МТА, которая накапливается у пациентов с MTAP del. Потеря активности MTAP сенсибилизирует клетки к ингибированию PRMT5. Ингибирование PRMT5 может замедлить или остановить рост опухоли [22][23].
В настоящее время компания Astra Zeneca проводит КИ I фазы ингибитора PRMT5 (код AZD3470), предназначенного для лечения лимфомы Ходжкина и солидных опухолей. У компании Bristol Myers Squibb находится в разработке ингибитор PRMT5 (код MRTX1719) для лечения солидных опухолей. Ожидается, что разрабатываемые ЛП позволят преодолеть ограничения, связанные с ингибиторами PRMT5 первого поколения, демонстрирующими токсичность, обусловленную механизмом действия, а также отсутствием избирательного действия на генотип рака MTAP del [24].
Хеликаза синдрома Вернера (WRN) рассматривается разработчиками в качестве мишени относительно недавно, с 2019 г., когда в ряде публикаций, независимо друг от друга, была отмечена терапевтически многообещающая взаимосвязь между белком WRN и опухолями с фенотипом микросателлитной нестабильности (MSI) [25–27]. Было показано, что WRN играет важную роль в различных клеточных процессах, имеющих высокое значение для поддержания стабильности генома, включая репликацию ДНК, транскрипцию и репарацию. Дальнейший анализ показал, что истощение WRN вызывает остановку клеточного цикла, митотические дефекты и апоптоз, особенно в клетках MSI, что вызывало интерес к исследованиям ингибиторов WRN в качестве препаратов таргетной терапии для лечения онкологических заболеваний [28]. Фермент WRN является перспективной «синтетической летальной» мишенью для опухолей MSI [25].
В 2024 г. компании Roche и Novartis включили в план разработки проведение КИ I фазы селективных ковалентных ингибиторов WRN, код RG6457, код HR0761, соответственно, для терапии солидных опухолей с MSI. Ингибируя белок WRN, эти молекулы могут вызывать летальную геномную нестабильность в раковых клетках, которые уже скомпрометированы в своих возможностях восстановления ДНК.
В фокусе внимания разработчиков также находятся ингибиторы мишеней DGKα и CDK2 для лечения ЗНО. Альфа-изофермент диацилглицеролкиназа (DGKα) является первым обнаруженным представителем семейства диацилглицеролкиназ, и его связывают с прогрессированием различных типов опухолей. Фермент DGKα высоко экспрессируется при различных видах рака и способствует выживанию раковых клеток благодаря своей антиапоптотической и пролиферативной активности [29]. Было определено, что экспрессия DGKα в раковых клетках способствовала росту опухоли через сигнальный путь AKT, на основании чего можно предположить, что DGKα может быть потенциальной мишенью в опухолевых клетках для таргетной терапии. Выявлено, что DGKα опосредует дисфункцию Т-клеток во время анти-PD-1-терапии, усугубляя истощение восстановленных опухолеспецифических Т-клеток. Фармакологический антагонизм DGKα позволил отсрочить истощение Т-клеток и задержать развитие резистентности к блокаде PD-1. Ингибирование DGKα может повысить эффективность анти-PD-1 терапии [30]. В 2024 г. компания Gilead включила в КИ I фазы ингибитор DGKα, код GS-9911, для терапии пациентов с поздними стадиями рака. Ожидается, что использование препарата, в том числе в сочетании с другими противоопухолевыми ЛП, позволит увеличить выживаемость пациентов с резистентными к стандартной терапии различными ЗНО за счет подавления пролиферации чувствительных опухолевых клеток, активации апоптоза, а также за счет снятия блока анергии Т-клеток и активации их цитотоксической активности.
Циклинзависимая киназа 2 типа (СDK2) относится к ферментам, которые выполняют основные функции в регуляции деления и пролиферации клеток. Сверхэкспрессия CDK2 связана с аномальной регуляцией клеточного цикла и неблагоприятными исходами при разных видах рака. При клиническом применении ингибиторов первого поколения, нацеленных на CDK2, была зафиксирована плохая переносимость, вероятно, из-за нецелевых эффектов. Несмотря на значительные усилия в разработке, на сегодняшний день не существует одобренных ЛП, селективно воздействующих на CDK2 [31]. Ингибирование CDK2 имеет потенциал для устранения множественных механизмов резистентности к ингибиторам CDK4/6 при раке молочной железы.
Компанией Astra Zeneca в 2024 г. в КИ I фазы включен селективный ингибитор СDK2, код AZD8421, для терапии солидных опухолей. AZD8421 показал улучшенный терапевтический индекс и комбинированный потенциал воздействия по сравнению с другими модуляторами CDK2 в рамках доклинических исследований.
Одной из мишеней при терапии заболеваний нервной системы может быть нерецепторная тирозин-протеинкиназа 2 типа (TYK2). TYK2 представляет собой внутриклеточную киназу, которая является членом семейства янус-киназ (JAK). Фермент TYK2 опосредует передачу сигналов с помощью цитокинов, например, таких, как интерлейкин-23, которые участвуют в патогенезе иммуноопосредованных заболеваний. Общегеномные ассоциативные исследования в европейских популяциях выявили связь TYK2 с рядом аутоиммунных заболеваний, таких как ревматоидный артрит, системная красная волчанка, рассеянный склероз, воспалительные заболевания кишечника и рядом других патологий [32].
Компания Bristol Myers Squibb включила в разработку ингибитор TYK2, код BMS-986465. Действующее вещество препарата связывается с уникальным регуляторным доменом TYK2 с высокой селективностью, блокируя фермент TYK2 и проходящие через него клеточные сигналы. Нарушение передачи этих сигналов путем воздействия на TYK2 рассматривается как многообещающий способ подавления выраженного воспаления. При этом TYK2 не блокирует родственные белки JAK, ингибирование которых может вызвать серьезные побочные эффекты. Ожидается, что ЛП не будет обладать системной токсичностью, так как сигнальные пути TYK2, которые ингибирует препарат, ограничены избранными иммунными путями, в отличие от путей других членов семейства JAK [33].
Первый ингибитор TYK2 был также разработан Bristol Myers Squibb и получил одобрение FDA в 2022 г.11 на основании двух крупных исследований, в которых была подтверждена значительно более высокая эффективность препарата в сравнении с апремиластом12 у пациентов с псориазом [34]. Информация о конкретном показании компанией-разработчиком в 2024 г. не представлена. Имеются сведения о том, что исследуемая нозология относится к нейровоспалительным заболеваниям.
Ингибиторы мишени SIK (соль-индуцируемые киназы, SIK) имеют потенциал в лечении болезней системы пищеварения. SIK являются важными регуляторами метаболизма, деления клеток, онкогенеза, воспаления. Известно, что три изоформы SIK регулируют выработку провоспалительных цитокинов клетками врожденного иммунитета с различной степенью. Однако механизм, посредством которого это происходит, в настоящее время не до конца ясен. Компания Pfizer начала разработку ингибитора SIK для терапии язвенного колита, код PF-07899895. Можно предположить, что специфическое ингибирование вышеуказанной мишени будет приводить к подавлению гиперактивации сигнальных провоспалительных путей, снижению выработки провоспалительных цитокинов, участвующих в поддержании иммунного воспаления в слизистой оболочке толстой кишки. Ожидается, что данный ЛП позволит расширить возможности контроля иммунного воспаления при язвенном колите (потенциально у пациентов, резистентных к текущим возможностям медикаментозного лечения). ЛП будет способствовать достижению клинической и эндоскопической ремиссии, в том числе бесстероидной, улучшит качество жизни пациентов [35].
Обратная транскриптаза ВИЧ (RT) — хорошо известная мишень для разработки ЛП, входящих в группу высокоактивной антиретровирусной терапии. В 2024 г. компания Gilead начала клиническую разработку ненуклеозидного ингибитора обратной транскриптазы ВИЧ длительного действия, код GS-1614. Разрабатываемый препарат отличается от аналогов более пролонгированным действием. В перспективе разработчики планируют исследовать эффективность препарата при применении в составе комбинации и с кратностью применения 1 раз в 6 мес.13 Ожидается, что GS-1614 расширит терапевтические возможности лечения пациентов с резистентностью к антиретровирусным препаратам и позволит достичь более высокой комплаентности за счет длительного действия.
Препараты клеточной терапии. Препараты клеточной терапии относят к передовой терапии [36]. Существует два основных вида клеточной терапии: клеточная иммунотерапия и регенеративная медицина [37]. Проведенный нами анализ позволил заключить, что среди ЛП, включенных в КИ I фазы, превалируют препараты на основе CAR-T технологии14 (CAR-T на основе аутологичных Т-лимфоцитов: 6 ЛП, 2 разработчика). CAR-T терапия является формой адаптивной Т-клеточной терапии, которая недавно была введена в арсенал для лечения гематологических злокачественных новообразований. Она включает в себя ex vivo инженерию аутологичных Т-клеток пациента для снабжения их рецепторами, нацеленными на специфические антигены на раковых клетках, и последующее введение генетически модифицированных Т-клеток обратно пациентам для реализации направленной на опухолевые клетки цитотоксичности [38].
Акцент на исследование CAR-T препаратов делают Astra Zeneca и Bristol Myers Squibb. Обращает на себя внимание тот факт, что компания Astra Zeneca сфокусировала разработку CAR-T препаратов в направлении терапии солидных опухолей (3 из 4 разрабатываемых ЛП).
CAR-T препарат с кодом AZD0754 может быть отнесен к первому в классе5. Препарат предназначен для лечения рака предстательной железы и нацелен на новую мишень: шестой трансмембранный эпителиальный антиген предстательной железы 2 типа (STEAP2) при помощи химерных антигенных рецепторов к нему на модифицированных аутологичных Т-лимфоцитах. STEAP2 является антигеном опухолевых клеток, который демонстрирует высокую гомогенную экспрессию на клеточной поверхности на всех стадиях заболевания с ограниченной экспрессией в нормальных тканях. Недавно опубликованные данные подтвердили гипотезу, что STEAP2 играет функциональную роль в управлении агрессивными признаками рака простаты [39]. Для препарата также характерна совместная экспрессия доминантно-негативного TGF-βRII с целью снижения иммуносупрессивного действия трансформирующего фактора роста бета (TGF-β) на CAR-T клетки; данный подход ранее не использовался для их защиты [40].
У компании Bristol Myers Squibb, в свою очередь, в разработке два препарата CAR-T на основе аутологичных Т-лимфоцитов, предназначенных для терапии рассеянного склероза и рецидивирующей/рефрактерной множественной миеломы.
ВЫВОДЫ
Таким образом, из 20 крупнейших фармацевтических компаний, имеющих наиболее высокие бюджеты на исследования и разработки в 2023 г., 17 компаний начали изучение оригинальных ЛП в КИ I фазы. Компаниями-лидерами по количеству ЛП, включенных в планы разработки за период январь — май 2024 г., являются Astra Zeneca, Pfizer, Bristol Myers Squibb; в общей сложности в КИ I фазы было включено 84 ЛП. Основные классы ЛП по МКБ-10, включенные в разработку (67%), II Новообразования (С00–С97, Злокачественные новообразования); IV Болезни эндокринной системы, расстройства питания и нарушения обмена веществ (E00–E90); IX Болезни системы кровообращения (I00–I99). Ведущей областью разработок оригинальных ЛП является онкология.
Наибольшее количество ЛП, запланированных к первому применению у человека, относится к молекулам с относительно высокой молекулярной массой (класс «Большая молекула» — 42%). Реже разрабатывались препараты с относительно низкой молекулярной массой (класс «Малая молекула» — 27%) и препараты клеточной терапии (12%).
- На основании оценки количества разрабатываемых несколькими разработчиками препаратов, имеющих схожую структуру, сделано предположение о наличии трендов разработки для следующих классов: 1) «Большая молекула» — биспецифическое антитело (10 ЛП, 5 разработчиков); моноспецифическое антитело (8 ЛП, 7 разработчиков); конъюгат «Антитело — лекарственное средство» (8 ЛП, 3 разработчика); 2) «Малая молекула» — ингибиторы ферментов (9 ЛП, 6 разработчиков); 3) «Препараты клеточной терапии» — препараты на основе технологии CAR-T (6 ЛП, 2 разработчика). Следует отметить, что актуальным трендом в развитии таргетной терапии является разработка биспецифических антител и конъюгатов «антитело–лекарство» нового поколения, параллельно с разработкой САR-T препаратов на основе аутологичных Т-клеток, преимущественно для терапии злокачественных новообразований.
- Руководствуясь предложенными качественными критериями для определения тенденции, было сделано предположение о наличии слабого сигнала разработки для класса «Большая молекула» в виде ЛП, формирующих группу «мультиспецифическое антитело». Ожидается, что ЛП данной группы откроют новую эру таргетной терапии ЗНО.
- На основании количества исследуемых препаратов, имеющих одинаковую мишень для воздействия у нескольких разработчиков, сделано предположение о наличии тенденций разработки для группы «ингибиторы ферментов»: ингибитор PRMT5 (2 ЛП, 2 разработчика) и ингибитор WRN(2 ЛП, 2 разработчика). Мишени, основанные на принципе синтетической летальности (такие как WRN и PRMT5), в настоящее время рассматриваются в качестве перспективных целей для таргетной терапии ЗНО малыми молекулами.
Выявленные тренды и тенденции могут быть положены в основу планирования деятельности российской фармацевтической отрасли с целью успешной реализации стратегии фармацевтического суверенитета и перехода к персонализированной медицине.
1 По данным Drug Discovery and Development. Top 25 investors in pharma R&D 2023.
2 https://www.merck.com/research/product-pipeline/; https://www.roche.com/solutions/pipeline/; https://www.novartis.com/research-development/novartis-pipeline; https://www.investor.jnj.com/pipeline/development-pipeline/default.aspx; https://www.astrazeneca.com/our-therapy-areas/pipeline.html; https://www.pfizer.com/science/drug-product-pipeline; https://www.lilly.com/discovery/clinical-development-pipeline; https://www.bms.com/researchers-and-partners/in-the-pipeline.html; https://www.gsk.com/en-gb/innovation/pipeline/; https://www.abbvie.com/science/pipeline.html; https://www.sanofi.com/en/our-science/our-pipeline; https://www.gilead.com/science-and-medicine/pipeline; https://www.boehringer-ingelheim.com/human-pharma-clinical-pipeline; https://www.modernatx.com/research/product-pipeline; https://www.takeda.com/science/pipeline/; https://www.amgenpipeline.com/; https://www.novonordisk.com/science-and-technology/r-d-pipeline.html; https://www.regeneron.com/pipeline-medicines/investigational-pipeline; https://www.bayer.com/en/pharma/development-pipeline; https://www.otsuka.co.jp/en/research-and-development/pipeline/
3 https://doi.org/10.30895/1991-2919-2025-752-annex
4 Там же.
5 «Первые в классе» («First-in-class») — препараты, имеющие механизм действия, отличный от механизма действия препаратов, применяемых в существующей практике.
6 Блинцинто, лиофилизат для приготовления концентрата для приготовления раствора для инфузий (МНН: блинатумомаб; ДРУ: Амджен Европа Б.В., Нидерланды; РУ № ЛП-(002210)-(РГ-RU) от 19.04.2023).
7 FDA. Bispecific antibodies: An area of research and clinical applications.
8 По данным Global Bispecific Antibody Market, Drugs Sales, Patent, Price and Clinical Trials Insight 2029.
9 https://doi.org/10.30895/1991-2919-2025-752-annex
10 Синтетическая летальность — взаимодействие между двумя генетическими событиями, при котором совместное возникновение этих двух генетических событий приводит к гибели клетки, но каждое событие в отдельности не приводит к этому, — может быть использована для терапии рака. Процессы восстановления ДНК могут быть синтетическими летальными целями, поскольку многие виды онкологических заболеваний приводят к нарушению пути восстановления ДНК, следствием чего может стать зависимость от специфических белков восстановления.
11 SOTYKTU tablets, for oral use. Highlights of Prescribing Information. Initial U.S. Approval: 2022.
12 ОТЕСЛА, таблетки, покрытые пленочной оболочкой, 10, 20, 30 мг. ДРУ: Амджен Европа Б.В. (Нидерланды), РУ № ЛП-003829 от 08.09.2016.
13 CATIE. A potential long-acting treatment — GS-1614.
14 Т-клеточная терапия с использованием химерных антигенных рецепторов.
Список литературы
1. Schuhmacher A, Gassmann O, Hinder M, Hartl D. Comparative analysis of FDA approvals by top 20 pharma companies (2014-2023). Drug Discov Today. 2024;29(9):104128. https://doi.org/10.1016/j.drudis.2024.104128
2. Yao Y, Hu Y, Wang F. Trispecific antibodies for cancer immunotherapy. Immunology. 2023;169(4):389–99. https://doi.org/10.1111/imm.13636
3. Tapia-Galisteo A, Compte M, Álvarez-Vallina L, Sanz L. When three is not a crowd: Trispecific antibodies for enhanced cancer immunotherapy. Theranostics. 2023;13(3):1028–41. https://doi.org/10.7150/thno.81494
4. Mullard A. Trispecific antibodies take to the clinic. Nat Rev Drug Discov. 2020;19(10):657–8. https://doi.org/10.1038/d41573-020-00164-3
5. Shim H. Bispecific antibodies and antibody-drug conjugates for cancer therapy: technological considerations. Biomolecules. 2020;10(3):360. https://doi.org/10.3390/biom10030360
6. Lu RM, Hwang YC, Liu IJ, Lee CC, Tsai HZ, Li HJ, Wu HC. Development of therapeutic antibodies for the treatment of diseases. J Biomed Sci. 2020;27(1):1. https://doi.org/10.1186/s12929-019-0592-z
7. Lu J, Ding J, Liu Z, Chen T. Retrospective analysis of the preparation and application of immunotherapy in cancer treatment (Review). Int J Oncol. 2022;60(2):12. https://doi.org/10.3892/ijo.2022.5302
8. Pineda C, Illades-Aguiar B, Flores-Alfaro E, Leyva-Vázquez MA, Parra-Rojas I, Del Moral-Hernández O, et al. Mechanisms of action and limitations of monoclonal antibodies and single chain fragment variable (scFv) in the treatment of cancer. Biomedicines. 2023;11(6):1610. https://doi.org/10.3390/biomedicines11061610
9. Ruan DY, Wu HX, Meng Q, Xu RH. Development of antibody-drug conjugates in cancer: Overview and prospects. Cancer Commun (Lond). 2024;44(1):3–22. https://doi.org/10.1002/cac2.12517
10. Степанова ЕО, Моисеенко ФВ, Моисеенко ВМ. Конъюгированные моноклональные антитела. Практическая онкология. 2023;24(1):7–18. https://doi.org/10.31917/2401007
11. Василевич НИ, Честков АВ, Янг М, Сан Л. Химерные конъюганты на основе белков и пептидов в таргетной противораковой терапии. Лаборатория и производство. 2023;23(1):56–64. https://doi.org/10.32757/2619-0923.2023.1.23.56.64
12. Fu Z, Li S, Han S, Shi C, Zhang Y. Antibody drug conjugate: the «biological missile» for targeted cancer therapy. Signal Transduct Target Ther. 2022;7(1):93. https://doi.org/2010.1038/s41392-022-00947-7
13. Ma Y, Huang Y, Zhao Y, Zhao S, Xue J, Yang Y, et al. BL-B01D1, a first-in-class EGFR-HER3 bispecific antibody-drug conjugate, in patients with locally advanced or metastatic solid tumours: a first-in-human, open-label, multicentre, phase 1 study. Lancet Oncol. 2024;25(7):901–11. https://doi.org/10.1016/S1470-2045(24)00159-1
14. Солопова ОН, Мисюрин ВА. Биспецифические антитела в клинике и клинических исследованиях (обзор литературы). Клиническая онкогематология. 2019;12(2):125–44. https://doi.org/2010.21320/2500-2139-2019-12-2-125-144
15. Kuchnio A, Samakai E, HugE, BalmañaM, JanssenL, Amorim R, et al. Discovery of JNJ-88549968, a novel, first-in-class CALRmutxCD3 T-cell redirecting antibody for the treatment of myeloproliferative neoplasms. Blood. 2023;142(1):1777. https://doi.org/10.1182/blood-2023-173430
16. Saura-Esteller J, de Jong M, King L, Ensing E, Winograd B, de Gruijl T, et al. Gamma delta T-cell based cancer immunotherapy: Past — present — future. Front Immunol. 2022;13:915837. https://doi.org/10.3389/fimmu.2022.915837
17. Scaletta L, Kuriakose T, Nanda S, Collins M, Darrah E, McInnes I, et al. Blockade of soluble and cell surface PAD activity prevents the generation of citrullinated autoantigens recognized by RA patients’ serum [abstract]. Arthritis Rheumatol. 2024;76(9).
18. Keri D, Walker M, Singh I, Nishikawa K, Garces F. Next generation of multispecific antibody engineering. Antib Ther. 2023;7(1):37–52. https://doi.org/10.1093/abt/tbad027
19. Amash A, Volkers G, Farber P, Griffin D, Davison K, Goodman A, et al. Developability considerations for bispecific and multispecific antibodies. mAbs. 2024;6(1):2394229. https://doi.org/10.1080/19420862.2024.2394229
20. Stone J, Pear Fish K, Ashok D, McKay L. Abstract ND01: ABBV-303: A novel NK and CD8 T cell engager specific for c-Met-expressing tumors. Cancer Research. 2024;84(7_Supplement):ND01. https://doi.org/10.1136/jitc-2024-SITC2024.1282
21. Motolani A, Martin M, Sun M, Lu T. The structure and functions of PRMT5 in human diseases. Life (Basel). 2021;11(10):1074. https://doi.org/10.3390/life11101074
22. Kalev P, Hyer ML, Gross S, Konteatis Z, Chen CC, Fletcher M, et al. MAT2A inhibition blocks the growth of MTAP-deleted cancer cells by reducing PRMT5-dependent mRNA splicing and inducing DNA damage. Cancer Cell. 2021;39(2):209-24. e11. https://doi.org/10.1016/j.ccell.2020.12.010
23. Ikushima H, Watanabe K, Shinozaki-Ushiku A, Oda K, Kage H. Pan-cancer clinical and molecular landscape of MTAP deletion in nationwide and international comprehensive genomic data. ESMO Open. 2025;10(4):104535. https://doi.org/10.1016/j.esmoop.2025.104535
24. Engstrom L, Aranda R, Waters L, Moya K, Bowcut V, Vegar L, et al. MRTX1719 is an MTA-cooperative PRMT5 inhibitor that exhibits synthetic lethality in preclinical models and patients with MTAP-deleted cancer. Cancer Discov. 2023;13(11):2412–31. https://doi.org/10.1158/2159-8290.CD-23-0669
25. Chan E, Shibue T, McFarland J, Gaeta B, Ghandi M, Dumont N, et al. WRN helicase is a synthetic lethal target in microsatellite unstable cancers. Nature. 2019;568(7753):551–6. https://doi.org/10.1038/s41586-019-1102-x
26. Wainberg ZA. WRN helicase: Is there more to MSI-H than immunotherapy? Cancer Discov. 2024;14(8):1369–71. https://doi.org/10.1158/2159-8290.CD-24-0771
27. Mengoli V, Ceppi I, Sanchez A, Cannavo E, Halder S, Scaglione S, et al. WRN helicase and mismatch repair complexes independently and synergistically disrupt cruciform DNA structures. EMBO J. 2023;42(3):e111998. https://doi.org/10.15252/embj.2022111998
28. Morales-Juarez D., Jackson S. Clinical prospects of WRN inhibition as a treatment for MSI tumours. NPJ Precis Oncol. 2022;6(1):85. https://doi.org/10.1038/s41698-022-00319-y
29. Zhou D, Liu T, Rao X, Jie X, Chen Y, Wu Z, et al. Targeting diacylglycerol kinase α impairs lung tumorigenesis by inhibiting cyclin D3. Thorac Cancer. 2023;14(13):1179–91. https://doi.org/10.1111/1759-7714.14851
30. Fu L, Li S, Xiao W, Yu K, Li S, Yuan S, et al. DGKA mediates resistance to PD-1 blockade. Cancer Immunol Res. 2021;9(4):371–85. https://doi.org/10.1158/2326-6066.cir-20-0216
31. Sabnis R. Novel CDK2 inhibitors for treating cancer. ACS Med Chem Lett. 2020;11(12):2346–7. https://doi.org/10.1021/acsmedchemlett.0c00500
32. Jensen L, Attfield K, Feldmann M, Fugger L. Allosteric TYK2 inhibition: Redefining autoimmune disease therapy beyond JAK1-3 inhibitors. EBioMedicine. 2023;97:104840. https://doi.org/10.1016/j.ebiom.2023.104840
33. Nogueira M, Puig L, Torres T. JAK inhibitors for treatment of psoriasis: Focus on selective TYK2 inhibitors. Drugs. 2020; 80(4):341–52. https://doi.org/10.1007/s40265-020-01261-8
34. Armstrong A, Gooderham M, Warren R, Papp K, Strober B, Thaçi D, et al. Deucravacitinib versus placebo and apremilast in moderate to severe plaque psoriasis: Efficacy and safety results from the 52-week, randomized, double-blinded, placebo-controlled phase 3 POETYK PSO-1 trial. J Am Acad Dermatol. 2023;88(1):29–39. https://doi.org/10.1016/j.jaad.2022.07.002
35. Jagannath A, Taylor L, Ru Y, Wakaf Z, Akpobaro K, Vasudevan S, et al. The multiple roles of salt-inducible kinases in regulating physiology. Physiol Rev. 2023;103(3):2231–69. https://doi.org/10.1016/j.jaad.2022.07.002
36. Меркулова ОВ, Меркулов ВА, Меркулова ОВ. Регуляторные механизмы внедрения генной и клеточной терапии в медицинскую практику в странах Восточной Азии. Ведомости Научного центра экспертизы средств медицинского применения. Регуляторные исследования и экспертиза лекарственных средств. 2024;14(1):29–41. https://doi.org/10.30895/1991-2919-2024-14-1-29-41
37. Водякова МА, Покровский НС, Семенова ИС, Меркулов ВA, Мельникова ЕВ. Классификация продуктов клеточной терапии по степени манипулирования клеток и выполняемым функциям: анализ международных регуляторных подходов. Регуляторные исследования и экспертиза лекарственных средств. 2024;14(5):533–46. https://doi.org/10.30895/1991-2919-2024-14-1-29-41
38. Uscanga-Palomeque AC, Chávez-Escamilla AK, Alvizo-Báez CA, Saavedra-Alonso S, Terrazas-Armendáriz LD, Tamez-Guerra RS, et al. CAR-T cell therapy: From the shop to cancer therapy. Int J Mol Sci. 2023;24(21):15688. https://doi.org/10.3390/ijms242115688
39. Jones LA, Conway GE, Nguyen-Chi A, Burnell S, Jenkins GJ, Conlan RS, Doak SH. Investigating STEAP2 as a potential therapeutic target for the treatment of aggressive prostate cancer. Cell Mol Biol (Noisy-le-grand). 2023;69(4):179–87. https://doi.org/10.14715/cmb/2023.69.4.28
40. Zanvit P, van Dyk D, Fazenbaker C, McGlinchey K, Luo W, Pezold J, et al. Antitumor activity of AZD0754, a dnT-GFβRII-armored, STEAP2-targeted CAR-T cell therapy, in prostate cancer. J Clin Invest. 2023;133(22):e169655. https://doi.org/10.1172/JCI169655
Об авторах
Л. С. ЛитвинРоссия
Литвин Лолиана Стефановна - канд. мед. наук.
ул. Добролюбова, д. 11, Москва, 127254
Е. А. Куликова
Россия
Куликова Екатерина Александровна.
ул. Добролюбова, д. 11, Москва, 127254
Дополнительные файлы

|
1. Таблицы 3 и 4 | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(272KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Литвин Л.С., Куликова Е.А. Стратегические индикаторы в разработке оригинальных препаратов в 2024 году: анализ пайплайнов международных фармацевтических лидеров. Регуляторные исследования и экспертиза лекарственных средств. 2025;15(4):471-484. https://doi.org/10.30895/1991-2919-2025-752
For citation:
Litvin L.S., Kulikova E.A. Strategic Indicators in the Development of Original Medicinal Products in 2024: Analysis of Pipelines of International Pharmaceutical Leaders. Regulatory Research and Medicine Evaluation. 2025;15(4):471-484. https://doi.org/10.30895/1991-2919-2025-752



































