Перейти к:
Количественное определение основных компонентов в лекарственных препаратах полимиксина В методом ЯМР-спектроскопии
https://doi.org/10.30895/1991-2919-2025-15-2-206-212
Резюме
ВВЕДЕНИЕ. Природный многокомпонентный антибиотик полимиксин В в виде сульфата применяют для лечения инфекций, вызванных полирезистентными грамотрицательными микроорганизмами. Согласно фармакопейным требованиям в препаратах полимиксина В нормируют суммарное содержание компонентов В1, В2, В3 и В1-I, а также индивидуальное содержание В3 и В1-I. Токсичность отдельных компонентов полимиксина В различается, поэтому разработка индивидуальных норм позволит регулировать содержание компонентов, характеризующихся максимальной нефротоксичностью. Подходом к решению этой задачи является анализ компонентного состава различных образцов полимиксина В. Результаты такого анализа, полученные с использованием часто применяемого метода высокоэффективной жидкостной хроматографии (ВЭЖХ) не всегда корректны из-за отсутствия стандартных образцов отдельных компонентов полимиксина В.
ЦЕЛЬ. Оценка возможности количественного определения компонентов В1, В2, В3, B1-I в препаратах полимиксина В методом ЯМР-спектроскопии.
МАТЕРИАЛЫ И МЕТОДЫ. Объекты исследования — стандартный образец полимиксина В сульфата и лекарственные препараты полимиксина В различных производителей. Измерения проводили на ЯМР-спектрометре Agilent DD2 NMR System 600. Измерения референтным методом проводили по фармакопейной методике, используя ВЭЖХ-хроматограф Agilent 1200.
РЕЗУЛЬТАТЫ. В спектре 13С выявлены характеристические сигналы, присущие каждому из полимиксинов В1, В2, В3 и B1-I. Мольную долю каждого из полимиксинов В1, В2, В3, B1-I определяли методом внутренней нормализации интегральных интенсивностей их характеристических сигналов. Результаты измерения содержания нормируемых компонентов в образцах полимиксина В методами ЯМР и ВЭЖХ практически совпадают с учетом доверительных интервалов.
ВЫВОДЫ. Показана возможность использования метода 13С ЯМР-спектроскопии для идентификации основных компонентов полимиксина В и определения их количественного содержания в препаратах полимиксина В сульфата без использования стандартных образцов.
Ключевые слова
Для цитирования:
Кузьмина Н.Е., Моисеев С.В., Якупов И.Ю., Кулешова С.И. Количественное определение основных компонентов в лекарственных препаратах полимиксина В методом ЯМР-спектроскопии. Регуляторные исследования и экспертиза лекарственных средств. 2025;15(2):206-212. https://doi.org/10.30895/1991-2919-2025-15-2-206-212
For citation:
Kuz’mina N.E., Moiseev S.V., Yakupov I.Yu., Kuleshova S.I. Quantitative Determination of Major Active Components in Polymyxin B Medicinal Products by NMR Spectroscopy. Regulatory Research and Medicine Evaluation. 2025;15(2):206-212. (In Russ.) https://doi.org/10.30895/1991-2919-2025-15-2-206-212
ВВЕДЕНИЕ
Полимиксин В, входящий в группу природных полипептидных антибиотиков, продуцируемых штаммами Paenibacillus polymyxa, обладает широким спектром активности против многих грамотрицательных бактерий. В медицинской практике полимиксин В в виде сульфата используется с 60-х годов прошлого века, однако в 80-х годах данный антибиотик практически был выведен из медицинской практики из-за его высокой нефро- и нейротоксичности и в связи с появлением более безопасных и эффективных антибактериальных препаратов [1]. В последнее десятилетие врачи вновь вернулись к использованию полимиксина В из-за широкого распространения инфекций, вызванных полирезистентными грамотрицательными микроорганизмами (Pseudomonas aeruginosa, Escherichia coli, Klebsiella pneumoniae, Acinetobacter baumannii и др.), устойчивыми не только к цефалоспоринам, аминогликозидам и фторхинолонам, но и к карбапенемам. Данные микроорганизмы не обладают резистентностью к полимиксину В (возможно, из-за ограничения его применения): резистентность Pseudomonas aeruginosa составила 1,3%, Acinetobacter spp. — 2,1%, Citrobacter spp., Escherichia coli и Klebsiella spp. — менее 2% [2]. Помимо использования в качестве антибиотика его применяют при терапии сепсиса для сорбции эндотоксинов в крови [3].
Полимиксин В — смесь родственных соединений, из которых наиболее активными компонентами являются полимиксины В1, В2, В3 и В1-I. По химической структуре каждый из них представляет собой циклический гептапептид с трипептидным ациклическим заместителем, соединенным с ацильной алифатической цепью (рис. 1).
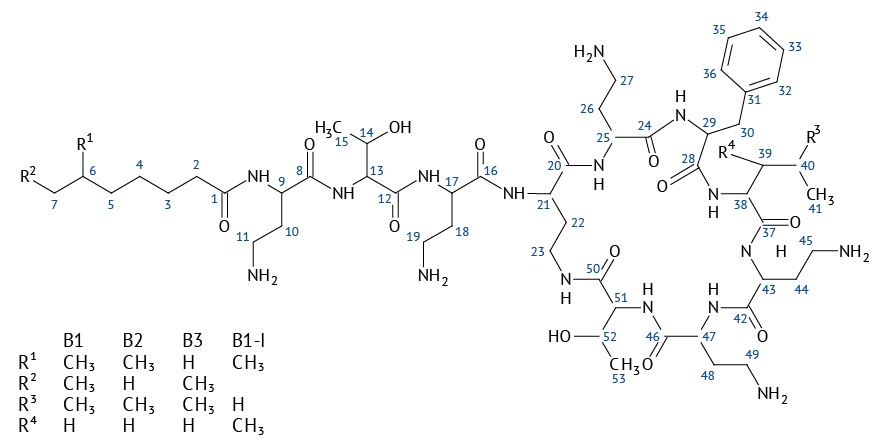
Рисунок подготовлен авторами / The figure is prepared by the authors
Рис. 1. Структурная формула полимиксинов В1, В2, В3 и В1-I
Fig. 1. Structural formula of polymyxins B1, B2, B3, and B1-I
Согласно фармакопейным требованиям суммарное содержание полимиксинов В1, В2, В3 и В1-I в используемых в клинической практике препаратах полимиксина В сульфата должно быть не менее 80%, при этом содержание В3 и В1-I не должно превышать 6 и 15% соответственно1. Индивидуальное содержание В1 и В2 не нормируется. Принято считать, что эти компоненты обладают одинаковой биоактивностью. Однако исследования последних лет показали, что соотношение компонентов В1 и В2 в полимиксине В существенно влияет на его фармакокинетику, фармакодинамику и токсикокинетику [4–6], на основании чего был сделан вывод о необходимости ужесточить стандартизацию основных компонентов полимиксиновых смесей, доступных в настоящее время для клинического применения, или разработать более безопасные однокомпонентные полимиксиновые липопептидные препараты с четкой фармакокинетикой [5][7].
Стандартизация полимиксина В сульфата по индивидуальному содержанию компонентов В1, В2, В3, B1-I невозможна без мониторинга компонентного состава различных образцов полимиксина В с последующим обобщением полученной информации. Как правило, определение компонентного состава полимиксина В сульфата проводят методом высокоэффективной жидкостной хроматографии (ВЭЖХ) с УФ2 или масс-детектором [1][8][9]. Из-за отсутствия стандартных образцов отдельных компонентов полимиксина В применяют метод внутренней нормализации. Следует отметить, что применение внутренней нормализации в методе ВЭЖХ не всегда корректно, так как интенсивность хроматографического сигнала зависит не только от концентрации компонента, но и от его сорбционных свойств. Актуально при оценке компонентного состава полимиксина В сульфата использовать метод, в котором свойства соединения не влияют на интенсивность его сигналов. Таким методом является метод ЯМР-спектроскопии3 [10][11]. Данный метод успешно применяется для определения состава природных многокомпонентных антибиотиков [12].
Цель работы — оценка индивидуального содержания нормируемых компонентов В1, В2, В3, B1-I в препаратах полимиксина В методом ЯМР-спектроскопии.
МАТЕРИАЛЫ И МЕТОДЫ
В качестве объектов исследования использовали стандартный образец полимиксина В сульфата для микробиологических исследований Европейской фармакопеи (EDQM СRS, кат. № Y0000355) (I), лекарственные препараты «Полимиксин В, лиофилизат для приготовления раствора для инъекций» (Jodas Expoim, (II)), «Полимиксин В, порошок для приготовления раствора для инъекций» (ПАО «КрасФарма») различных серий (III и IV).
Были использованы следующие реактивы: дейтерированные вода-D2 (Cambridge Isotope Laboratories, кат. № DLM-4-99.8-1000) и 3-(триметилсилил)-пропионат натрия-D4 (ТСП, Cambridge Isotope Laboratories, кат. № DLM-48-1), натрия сульфат (99,99% Merck, кат. № 1.06649-1000), ацетонитрил для ВЭЖХ (Thermo Fisher Scientific, кат. № A/0627/17), фосфорная кислота (85%, Sigma-Aldrich, кат. № 438081).
Измерения методом ЯМР. Около 20 мг полимиксина В сульфата (точная навеска не обязательна) растворяли в 0,5 мл дейтерированной воды с добавлением следовых количеств ТСП и переносили в ЯМР-ампулы. Регистрацию спектров проводили на ЯМР-спектрометре Agilent DD2 NMR System 600 (США) с 5-мм мультиядерным датчиком, оснащенным градиентной катушкой, используя программное обеспечение VNMRJ, версия 4.2. Параметры 1D экспериментов: температура — 27 °С, ширина спектра — 6009,6 Гц (¹Н) и 37878,8 Гц (¹³С), угол поворота намагниченности — 45°, время задержки между импульсными последовательностями — 5 с (¹Н), 3 с (¹³С), количество накоплений сигнала спада свободной индукции — 8 (¹Н) и 16000 (¹³С), число точек аналого-цифрового преобразования — 64 К, экспоненциальный коэффициент аподизации по Лоренсу — 0,3 Гц (¹Н) и 2 Гц (¹³С), дополнение нулями 64 К, автоматическая коррекция базовой линии спектра, ручная настройка фазы, калибровка шкалы химических сдвигов (δ) под сигнал триметилсилильной группы ТСП (δ=0,00 м.д.). Цифровое разрешение на ядре ¹Н 0,09 Гц. Регистрацию двумерных спектров ¹H-¹Н gCOSY, ¹H-¹Н TOCSY, ¹H-¹³C gHSQC, ¹H-¹³C gHMBC проводили с применением стандартных параметров. Мольные доли полимиксинов В1, В2, В3, B1-I в анализируемых образцах определены методом нормализации интегральных интенсивностей сигналов соответствующих структурных фрагментов их молекул. Нормализованные интегральные интенсивности измеряли в пяти повторностях.
Измерения методом ВЭЖХ проводили по фармакопейной методике4 (методики, приведенные в Фармакопее США и Европейской фармакопее, одинаковы), используя ВЭЖХ-хроматограф Agilent 1200 с диодно-матричным детектором на колонках ACE 3 C18-HL (150×4,6 мм, размер частиц 3,5 мкм). Для приготовления испытуемых образцов 50 мг полимиксина В растворяли в 100 мл деионизованной воды. Для исключения возможной разницы в поглощении разных компонентов полимиксина В сульфата анализ проводили как при длине волны детектирования 215 нм (указана в фармакопейной методике5), так и при 200, 205, 210, 220, 225 и 230 нм с усреднением результатов анализа для всех длин волн. Для каждого раствора полимиксина В получали не менее трех хроматограмм. Мольное соотношение содержания основных компонентов раствора полимиксина В рассчитывали как долю площади каждого пика в сумме площадей 4 пиков, выраженную в процентах.
Статистическую обработку результатов, полученных методами ЯМР и ВЭЖХ, осуществляли с помощью программы Microsoft Office Excel 2010 с установленным пакетом «Анализ данных».
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Количественное определение компонентного состава сложной смеси методом ЯМР невозможно без предварительной структурной идентификации одномерных спектров (¹Н, ¹³С) анализируемого образца и выбора для каждого компонента характеристических сигналов, которые не пересекаются с другими сигналами в спектре. Нормализованные интегральные интенсивности характеристических сигналов компонентов соответствуют мольной доле каждого компонента в анализируемом образце.
Структурное соотнесение сигналов спектров ¹Н и ¹³С образцов I–IV проводили на основе комплексного анализа результатов двумерных экспериментов (¹H-¹Н gCOSY, ¹H-¹Н TOCSY, ¹H-¹³C gHSQC, ¹H-¹³C gHMBC). В таблице 1 «Спектральные характеристики полимиксина В1» (опубликована на сайте журнала)6 представлено структурное соотнесение сигналов спектров ¹Н и ¹³С полимиксина В1, содержание которого в анализируемых образцах максимально.
Следует отметить, что в спектре ¹Н практически все сигналы анализируемых компонентов полностью или частично перекрываются, также наблюдается наложение сигналов различных структурных фрагментов, входящих в состав индивидуальных соединений, по этой причине в таблице 17 не приведены мультиплетность и значения констант спин-спинового взаимодействия сигналов протонов. Сигналы олигопептидного остова компонентов В2, В3 и B1-I практически совпадают с таковыми в В1 за исключением изолейцинового фрагмента в B1-I (табл. 2 «Спектральные характеристики изолейцинового фрагмента в полимиксине В1-I», опубликована на сайте журнала8).
Все химические сдвиги сигналов алифатической ациламидной цепи в В1 и В1-I совпадают, кроме сигналов ¹³С метиленового фрагмента С(3)Н2 (28,40 и 28,32 для В1 и В1-I соответственно). Для В2 и В3 наблюдаются небольшие различия в спектральных характеристиках 6-метилгептамидного (В2) и октамидного (В3) фрагментов (табл. 3 «Спектральные характеристики ациламидного фрагмента в полимиксинах В2 и В3», опубликована на сайте журнала9).
В спектре ¹³С выявлены характеристические сигналы, присущие каждому из полимиксинов В1, В2, В3 и B1-I, которые могут служить спектральными маркерами их присутствия в анализируемом образце (рис. 2):
В1, δ, м.д.: 28,40 (C(3)H2);
В2, δ, м.д.: 28,90 (C(3)H2), 40,66 (C(5)H2), 29,94 (C(6)H), 24,72 (C(7)H3 и R¹);
В3, δ, м.д.: 28,09 (C(3)H2), 26,84 (C(5)H2), 33,76 (C(6)H2), 16,22 (R¹);
В1-I, δ, м.д.: 28,32 (C(3)H2), 17,68 (R⁴), 13,37 (С(41)Н3).
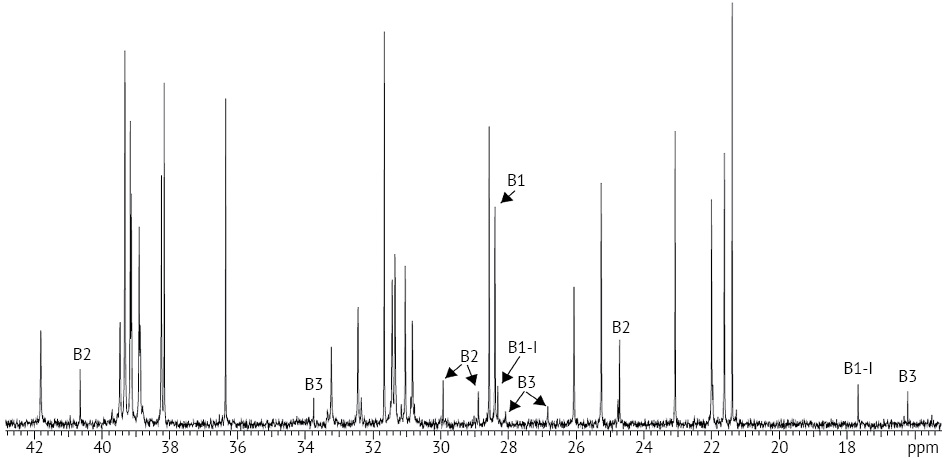
Рисунок подготовлен авторами по собственным данным / The figure is prepared by the authors using their own data
Рис. 2. Характеристические сигналы компонентов полимиксинов В1, В2, В3, В1-I в спектре ¹³С ЯМР
Fig. 2. Characteristic signals of polymyxins B1, B2, B3, and B1-I in the ¹³C NMR spectrum
Следует отметить, что оценку мольных долей нормируемых компонентов полимиксина В необходимо выполнять по характеристическим сигналам, принадлежащим к однотипным углеводородным фрагментам молекул компонентов, так как интенсивность сигналов ¹³C, полученных с развязкой от протонов, зависит не только от концентрации вещества, но и от числа водородных заместителей при углеродном атоме. В данной работе мы ограничились нормируемыми интегральными интенсивностями сигналов С(3): 28,40 (B1), 28,90 (В2), 28,09 (В3), 28,32 (B1-I).
Результаты определения содержания полимиксинов В1, B2, B3, B1-I в образцах методами ЯМР и ВЭЖХ представлены в таблице 4. Значения содержания нормируемых компонентов в образцах полимиксина В, определенные методами ЯМР и ВЭЖХ, практически совпадают с учетом доверительных интервалов.
Таблица 4. Результаты определения содержания полимиксинов В1, B2, B3, B1-I в образцах полимиксина В
Table 4. Results of polymyxin B1, B2, B3, and B1-I quantification in polymyxin B samples
Образец Sample | Метод Method | В1, мольн. % В1, mol% (RSD, %) | В2, мольн. % В2, mol% (RSD, %) | В3, мольн. % В3, mol% (RSD, %) | В1-I, мольн. % В1-I, mol% (RSD, %) |
I | ¹³C ЯМР ¹³C NMR | 70,04±0,52 (0,60) | 14,05±0,42 (2,38) | 3,83±0,17 (2,84) | 11,89±0,36 (2,46) |
ВЭЖХ HPLC | 70,05±0,30 (0,94) | 14,45±0,05 (0,80) | 3,53±0,15 (2,94) | 11,96±0,0,38 (6,98) | |
II | ¹³C ЯМР ¹³C NMR | 72,46±0,66 (0,73) | 10,99±0,33 (2,40) | 4,83±0,25 (4,22) | 11,75±0,55 (3,75) |
ВЭЖХ HPLC | 72,32±0,16 (0,50) | 10,91±0,03 (0,55) | 4,50±0,09 (4,40) | 12,26±0,17 (2,97) | |
III | ¹³C ЯМР ¹³C NMR | 70,46±0,31 (0,35) | 13,61±0,29 (1,71) | 4,36±0,36 (6,66) | 11,59±0,37 (2,49) |
ВЭЖХ HPLC | 70,10±0,18 (0,57) | 13,65±0,07 (1,15) | 4,63±0,07 (3,23) | 11,61±0,24 (4,58) | |
IV | ¹³C ЯМР ¹³C NMR | 70,65±0,41 (0,46) | 13,73±0,29 (1,72) | 4,50±0,13 (2,24) | 11,11±0,48 (3,46) |
ВЭЖХ HPLC | 70,12±0,22 (0,68) | 13,66±0,08 (1,33) | 4,63±0,07 (3,16) | 11,59±0,26 (4,83) |
Таблица составлена авторами по собственным данным / The table is prepared by the authors using their own data
Примечание. ЯМР — ядерный магнитный резонанс, ВЭЖХ — высокоэффективная жидкостная хроматография.
Note. NMR, nuclear magnetic resonance spectroscopy; HPLC, high-performance liquid chromatography.
ЗАКЛЮЧЕНИЕ
Результаты проведенных исследований показали возможность использования ¹³С ЯМР-спектроскопии для идентификации нормируемых компонентов полимиксина В и определения их количественного содержания в препаратах полимиксина В сульфата без использования стандартных образцов. Совпадение результатов определения мольных долей полимиксина В1, В2, В3 и В1-I методами ЯМР-спектроскопии и ВЭЖХ доказывает отсутствие различий в сорбционных свойствах компонентов полимиксина В и корректность применения метода внутренней нормализации при определении нестехиометрического состава полимиксина В методом ВЭЖХ.
Дополнительная информация. На сайте журнала «Регуляторные исследования и экспертиза лекарственных средств» размещены таблицы 1–3.
https://doi.org/10.30895/1991-2919-2025-744-table
Вклад авторов. Все авторы подтверждают соответствие своего авторства критериям ICMJE. Наибольший вклад распределен следующим образом: Н.Е. Кузьмина — идея, планирование исследования, анализ данных литературы, систематизация и обобщение экспериментальных данных, подготовка и оформление текста рукописи; С.В. Моисеев — пробоподготовка образцов, проведение экспериментальных исследований методом ЯМР, систематизация и обобщение экспериментальных данных, редактирование текста рукописи; И.Ю. Якупов — проведение экспериментальных исследований методом ВЭЖХ; С.И. Кулешова — ответственность за все аспекты работы, включая надлежащее изучение и решение вопросов, связанных с достоверностью данных и целостностью всех частей статьи.
Additional information. Tables 1–3 are published on the website of Regulatory Research and Medicine Evaluation.
https://doi.org/10.30895/1991-2919-2025-744-table
Authors’ contributions. All the authors confirm that they meet the ICMJE criteria for authorship. The most significant contributions were as follows. Nataliya E. Kuz’mina conceived the study idea, designed the study, analysed literature data, systemised and interpreted the experimental data obtained, and drafted and formatted the manuscript. Sergey V. Moiseev prepared samples, conducted the NMR experiments, systemised and interpreted the experimental data obtained, and edited the manuscript. Ilya Yu. Yakupov conducted the HPLC experiments. Svetlana I. Kuleshova agreed to be accountable for all aspects of the work and for ensuring that all questions related to data reliability and article integrity are appropriately investigated and resolved.
1. Monograph Polymyxin B Sulfate. United States Pharmacopeia. 44th ed. Rockville; 2023.
Monograph Polymyxin B Sulfate. European Pharmacopeia. 11th ed. Strasbourg: EDQM; 2022.
2. Там же.
3. ОФС.1.2.1.1.0007 Спектроскопия ядерного магнитного резонанса. Государственная фармакопея Российской Федерации. XV изд. М.; 2023.
4. Monograph Polymyxin B Sulfate. United States Pharmacopeia. 44th ed. Rockville; 2023.
Monograph Polymyxin B Sulfate. European Pharmacopeia. 11th ed. Strasbourg: EDQM; 2022.
5. Там же.
6. https://doi.org/10.30895/1991-2919-2025-744-table
7. Там же.
8. Там же.
9. Там же.
Список литературы
1. Wang P, Zhang Q, Qin Z, Xing H, Xu M, Pei H, et al. A simple and robust liquid chromatography with tandem mass spectrometry analytical method for therapeutic drug monitoring of plasma and cerebrospinal fluid polymyxin B1 and B2. Ther Drug Monit. 2020;42(5):716–23. https://doi.org/10.1097/FTD.0000000000000754
2. Kumar RS, Anitha E, Junaid M, Chetty S. A study on polymyxin b induced nephrotoxicity: A systematic review. Int J Pharm Sci Rev Res. 2022;72(2):73–8. https://doi.org/10.47583/ijpsrr.2022.v72i02.011
3. Shoji H, Opal SM. Therapeutic rationale for endotoxin removal with polymyxin B immobilized fiber column (PMX) for septic shock. Int J Mol Sci. 2021;22(4):2228. https://doi.org/10.3390/ijms22042228
4. Velkov T, Roberts KD, Nation RL, Thompson PE, Li J. Pharmacology of polymyxins: New insights into an ‘old’ class of antibiotics. Future Microbiol. 2013;8(6):711–24. https://doi.org/10.2217/fmb.13.39
5. Sivanesan S, Roberts K, Wang J, Chea SE, Thompson PE, Li J, et al. Pharmacokinetics of the individual major components of polymyxin B and colistin in rats. J Nat Prod. 2017;80(1): 225–9. https://doi.org/10.1021/acs.jnatprod.6b01176
6. Roberts KD, Azad MAK, Wang J, Horne AS, Thompson PE, Nation RL, et al. Antimicrobial activity and toxicity of the major lipopeptide components of polymyxin B and colistin: Last-line antibiotics against multidrug-resistant Gram-negative bacteria. ACS Infect. Dis. 2015;1(11):568−75. https://doi.org/10.1021/acsinfecdis.5b00085
7. Sun HZ, Wei SY, Xu QM, Shang W, Li Q, Cheng JS, et al. Enhancement of polymyxin B1 production by an artificial microbial consortium of Paenibacillus polymyxa and recombinant Corynebacterium glutamicum producing precursor amino acids. Synth Syst Biotechnol. 2024;9(1):176–85. https://doi.org/10.1016/j.synbio.2024.01.015
8. Hee KH, Leaw YKJ, Ong JL, Lee LS. Development and validation of liquid chromatography tandem mass spectrometry method quantitative determination of polymyxin B1, polymyxin B2, polymyxin B3 and isoleucine-polymyxin B1 in human plasma and its application in clinical studies. J Pharm Biomed Anal. 2017;140:91–7. https://doi.org/10.1016/j.jpba.2017.03.018
9. Meng M, Wang L, Liua S, Jaber OM, Gao L, Chevrette L, Reuschel S. Simultaneous quantitation of polymyxin B1, polymyxin B2 and polymyxin B1-1 in human plasma and treated human urine using solid phase extraction and liquid chromatography–tandem mass spectrometry. J Chromatogr B Analyt Technol Biomed Life Sci. 2016;1012–1013:23–36. https://doi.org/10.1016/j.jchromb.2016.01.013
10. Калабин ГА, Васильев ВГ, Ивлев ВА. Возможности низкопольных спектрометров ЯМР в скрининге содержания лекарственных субстанций. Разработка и регистрация лекарственных средств. 2021;10(1):16–22.
11. Моисеев СВ, Кузьмина НЕ, Лутцева АИ. Метод ЯМР в отечественной и зарубежных фармакопеях для оценки качества лекарственных средств. Ведомости Научного центра экспертизы средств медицинского применения. Регуляторные исследования и экспертиза лекарственных средств. 2022;12(1):8–23. https://doi.org/10.30895/1991-2919-2022-12-1-8-23
12. Моисеев СВ, Кузьмина НЕ, Северинова ЕЮ, Симонова ЕП, Косенко ВВ. Идентификация и количественное определение компонентного состава фармацевтической субстанции «Гентамицина сульфат» методами 1Н и 13С ЯМР-спектроскопии. Регуляторные исследования и экспертиза лекарственных средств. 2023;13(2–1):283–91. https://doi.org/10.30895/1991-2919-2023-13-2-1-283-291
Об авторах
Н. Е. КузьминаРоссия
Кузьмина Наталия Евгеньевна - д-р хим. наук.
Петровский б-р, д. 8, стр. 2, Москва, 127051
С. В. Моисеев
Россия
Моисеев Сергей Владимирович - канд. хим. наук, доцент.
Петровский б-р, д. 8, стр. 2, Москва, 127051
И. Ю. Якупов
Россия
Якупов Илья Юрьевич
Петровский б-р, д. 8, стр. 2, Москва, 127051
С. И. Кулешова
Россия
Кулешова Светлана Ивановна - канд. биол. наук.
Петровский б-р, д. 8, стр. 2, Москва, 127051
Дополнительные файлы

|
1. Таблицы 1–3 | |
| Тема | ||
| Тип | Исследовательские инструменты | |
Скачать
(485KB)
|
Метаданные ▾ | |
Рецензия
Для цитирования:
Кузьмина Н.Е., Моисеев С.В., Якупов И.Ю., Кулешова С.И. Количественное определение основных компонентов в лекарственных препаратах полимиксина В методом ЯМР-спектроскопии. Регуляторные исследования и экспертиза лекарственных средств. 2025;15(2):206-212. https://doi.org/10.30895/1991-2919-2025-15-2-206-212
For citation:
Kuz’mina N.E., Moiseev S.V., Yakupov I.Yu., Kuleshova S.I. Quantitative Determination of Major Active Components in Polymyxin B Medicinal Products by NMR Spectroscopy. Regulatory Research and Medicine Evaluation. 2025;15(2):206-212. (In Russ.) https://doi.org/10.30895/1991-2919-2025-15-2-206-212



































