Перейти к:
Анализ локализации производства биотехнологических лекарственных препаратов в России с учетом происхождения активных фармацевтических субстанций
https://doi.org/10.30895/1991-2919-2024-14-1-53-61
Резюме
АКТУАЛЬНОСТЬ. В России проводится последовательная государственная политика по импортозамещению и углублению локализации производства лекарственных препаратов. Целевыми индикаторами реализации стратегии развития фармацевтической промышленности до 2030 г. являются доли препаратов из перечня стратегически значимых лекарственных средств (СЗЛС), производство которых должно быть организовано в Российской Федерации по полному циклу. Биотехнологические препараты занимают лидирующие позиции по темпам роста потребления и входят в СЗЛС, поэтому изучение процесса локализации производства подобных лекарственных средств является приоритетной задачей.
ЦЕЛЬ. Оценка степени локализации производства биотехнологических лекарственных препаратов на российском рынке с учетом страны происхождения активной фармацевтической субстанции.
МАТЕРИАЛЫ И МЕТОДЫ. Исследование основывалось на данных Государственного реестра лекарственных средств, базы данных продаж лекарственных препаратов компании DSM Group. Для определения степени локализации производства использовалась специально разработанная программа для платформы Node.js®. РЕЗУЛЬТАТЫ. Проведенный анализ показал, что в 2022 г. по полному циклу на территории страны производилось 25,6% всего объема потребляемых биотехнологических препаратов в упаковках и 26,6% в рублях. Импортируемые препараты преобладали в структуре потребления — 33,9 и 31,3% соответственно. На долю препаратов с локализированной стадией вторичной упаковки пришлось 5,8% в упаковках и 25,9% в рублях. Существенную долю в упаковках занимает производство из импортных субстанций — 23,7%, в рублях — 6,2%. По перечню СЗЛС на территории России производятся субстанции для 79% биотехнологических препаратов по номенклатуре, что соответствует производству по полному циклу 32,3 и 10,8% в стоимостном и натуральном выражении.
ВЫВОДЫ. На рынке биотехнологических препаратов сохраняется высокая импортозависимость как от готовых лекарственных средств, так и от импортных субстанций. Несмотря на то что целевые показатели Стратегии «Фарма-2030» в сфере производства биотехнологических препаратов по номенклатуре перечня СЗЛС уже достигнуты, количественные показатели свидетельствуют о необходимости увеличивать объемы выпуска и глубину локализации производства в стране.
Ключевые слова
Для цитирования:
Халимова А.А., Орлов А.С., Таубэ А.А. Анализ локализации производства биотехнологических лекарственных препаратов в России с учетом происхождения активных фармацевтических субстанций. Ведомости Научного центра экспертизы средств медицинского применения. Регуляторные исследования и экспертиза лекарственных средств. 2024;14(1):53-61. https://doi.org/10.30895/1991-2919-2024-14-1-53-61
For citation:
Khalimova A.A., Orlov A.S., Taube A.A. Analysis of Biopharmaceutical Manufacturing Localisation in Russia Considering the Country of Origin of Active Pharmaceutical Ingredients. Bulletin of the Scientific Centre for Expert Evaluation of Medicinal Products. Regulatory Research and Medicine Evaluation. 2024;14(1):53-61. (In Russ.) https://doi.org/10.30895/1991-2919-2024-14-1-53-61
Введение
Основным драйвером роста мирового фармацевтического рынка в ближайшие пять лет станут биотехнологии, на которые будет приходиться 35% расходов1. Биотехнологии являются одновременно и направлением, в котором наиболее активно разрабатываются инновационные лекарственные средства, и, в то же время, позволят сэкономить свыше 290 млрд долларов США в совокупных расходах до 2027 г. за счет разработок новых биоаналогов. Онкология и иммунология являются ведущими терапевтическими областями как по объемам продаж препаратов2, так и по количеству их разработок. Около 40% клинических испытаний, запущенных в 2022 г. составляли исследования препаратов против онкологических заболеваний, среди которых CAR-T технологии, NK-клетки, моноклональные антитела3. В ближайшие годы будут расти мировые расходы на лечение аутоиммунных заболеваний в связи с появлением новых лекарственных препаратов и увеличением числа пациентов.
В последнее десятилетие российский фармацевтический рынок активно развивается, в том числе на фоне стратегии импортозамещения и поддержки промышленности. За прошедший период было выведено на рынок более 40 импортозамещающих и инновационных разработок, открыты более 30 новых производственных площадок, в том числе иностранных компаний [1, 2]. Направления инновационных разработок российских компаний совпадают с зарубежными — это противоопухолевые препараты и иммуномодуляторы, противомикробные препараты, а среди лидеров такие компании, как ООО «Биокад», ЦВТ «ХимРар», АО «Р-Фарм» и др. [3].
Государственная политика в фармацевтической отрасли направлена на углубление степени локализации производства жизненно необходимых и важнейших лекарственных препаратов (ЖНВЛП), а в отношении стратегически значимых лекарственных средств (СЗЛС) — на организацию производства по полному циклу на территории страны. Среди основных методов стимуляции этих процессов — преференции, заложенные в правило «третий лишний» в отношении государственных закупок лекарственных препаратов (ЛП), входящих в перечень ЖНВЛП. Они возникают у поставщиков ЛП при локализации их производства на территории России (РФ) или в странах Евразийского экономического союза (ЕАЭС)4. До 2017 г. было достаточно локализовать стадию упаковки и выпускающего контроля качества, но впоследствии правила были изменены5 и условием допуска стало производство всех стадий выпуска готовой лекарственной формы (ГЛФ) в РФ или ЕАЭС. Благодаря этим требованиям на рынке существенно возросла доля лекарственных препаратов отечественного производства [4, 5]. С ноября 2018 г. действуют дополнения к правилам «третий лишний». В случае лекарственных препаратов, все стадии производства которых, включая синтез активной фармацевтической субстанции (АФС), реализуются на территории ЕАЭС, действует ценовая преференция в размере 25%.
В принятой Стратегии развития фармацевтической промышленности до 2030 года6
(«Фарма-2030») среди основных мероприятий обеспечения доступа отечественной продукции на внутренний рынок значится установление приоритета в системе госзакупок для продукции, соответствующей перечню СЗЛС, производство которой осуществляется по полному производственному циклу, включая синтез фармацевтических субстанций. Согласно базовому прогнозу развития фармацевтической промышленности к 2030 г. по полному производственному циклу должно быть локализовано 80% всей номенклатуры СЗЛС. Центральное место в перечне СЗЛС занимают биотехнологические лекарственные препараты (БТЛП).
В Решении № 78 Совета Евразийской экономической комиссии (ЕЭК)7 приведено определение биологических лекарственных препаратов, среди которых указаны БТЛП, а в Решении № 89 Совета ЕЭК8 дано определение биотехнологических препаратов. К ним относятся препараты, произведенные при помощи биотехнологических процессов с использованием технологии рекомбинантной ДНК, контролируемой экспрессии генов, кодирующих выработку биологически активных белков, гибридомных технологий, моноклональных антител или других биотехнологических процессов, то есть действующим веществом обычно являются крупные белковые молекулы, обладающие сложной гетерогенной структурой. В работе Ю.В. Олефира и соавт. [6] отмечено отсутствие общепринятой классификации БТЛП, а также необходимость включения в их состав таких групп препаратов, как вакцины, аллергены, бактериофаги и др.
В проведенном исследовании был использован расширенный подход к определению БТЛП и в качестве основного критерия включения в перечень БТЛП выступала технология получения целевого продукта с помощью культивирования клеток различных организмов. В классификацию вошли как исторически сложившиеся группы, традиционно причисляемые к БТЛП, — антибиотики, гормоны стероидной структуры, так и высокотехнологичные генотерапевтические препараты. В рамках ранее предложенной авторами классификации [7] весь пул БТЛП был разделен на две основные части: препараты на основе относительно малых биотехнологических молекул (массой до 1000 Да) и препараты на основе больших молекул (массой свыше 1000 Да). С учетом химической структуры и терапевтического действия выделены 8 классификационных групп: гормоны, моноклональные антитела, (в том числе биспецифические моноклональные антитела, белки слияния (фьюжн-белки) и конъюгаты), ферменты, рекомбинантные препараты крови (в том числе препараты цитокинов и факторов свертывания крови), вакцины, анатоксины, аллергены и бактериофаги (ВААБ), генотерапевтические препараты, а также препараты на основе малых молекул: антибиотики и гормоны стероидной структуры.
Цель работы — оценка степени локализации производства биотехнологических лекарственных препаратов на российском фармацевтическом рынке с учетом страны происхождения активной фармацевтической субстанции.
Материалы и методы
Информационная база БТЛП была создана на основе данных Государственного реестра лекарственных средств9 (ГРЛС), инструкций о применении лекарственных препаратов, базы данных продаж лекарственных препаратов компании DSM Group, научных публикаций и патентов.
С помощью разработанной программы на базе библиотеки Puppeteer для платформы Node.js® на языке JavaScript были собраны сведения о стадиях изготовления ГЛФ и странах производства АФС для всех БТЛП, обращавшихся на российском рынке в 2022 г. Программа осуществляет парсинг данных действующих регистрационных удостоверений с сайта ГРЛС по заданным МНН и структурирует их в файле формата JSON для последующей выгрузки в MS Excel.
Анализ проводился согласно схеме, представленной на рисунке 1. Препараты были разделены на семь групп по типу локализации производства:
- ПЦ_рп: лекарственные препараты, субстанция и готовая лекарственная форма которого производятся на одном российском предприятии.
- ПЦ_РФ: лекарственные препараты, готовая лекарственная форма которых производится на российском предприятии из субстанций отечественного производства.
- Локализация ГЛФ с отечественными и импортными субстанциями: лекарственные препараты, готовая лекарственная форма которых производится на российском предприятии из субстанций и отечественного, и импортного производства. Это может быть как одно и то же вещество, так и разные субстанции в комбинированных препаратах. Так, например, при производстве порошка для приготовления раствора для внутривенного и внутримышечного введения Цефазолин (производитель АО «Биохимик», владелец регистрационного удостоверения ООО «Промомед РУС») используется субстанция от 6 поставщиков — собственного производства АО «Биохимик» и от 5 поставщиков из Китая.
- Локализация ГЛФ с импортными субстанциями: ГЛФ изготавливается на территории Российской Федерации, а субстанции полностью закупаются в других странах.
- Локализация/импорт ГЛФ: переходная стадия между импортом готовой лекарственной формы лекарственного препарата и его производством в Российской Федерации. В этом случае все стадии изготовления ГЛФ осуществляются параллельно и на территории Российской Федерации, и в ином государстве. Например, Ребиф® от ООО «Мерк», производящийся из швейцарской субстанции интерферона бета-1а на заводе ОАО «Фармстандарт-УфаВИТА» и на заводах Мерк Сероно С.п.А. в Италии и Швейцарии.
- Локализация упаковки: на территории Российской Федерации производятся только стадии упаковки/фасовки во вторичную/третичную упаковку и выпускающий контроль качества готовой лекарственной формы препарата. Например, Иларис® от Новартис Фарма АГ, завершающие стадии производства которого локализованы на заводе ООО «СКОПИНФАРМ».
- Импортируемый лекарственный препарат: все стадии производства ГЛФ и АФС производятся не в Российской Федерации.
Полученные данные были соотнесены с данными аудита продаж лекарственных препаратов от компании DSM Group за 2022 г., что позволило получить количественную оценку локализации производства биотехнологических лекарственных препаратов в Российской Федерации.
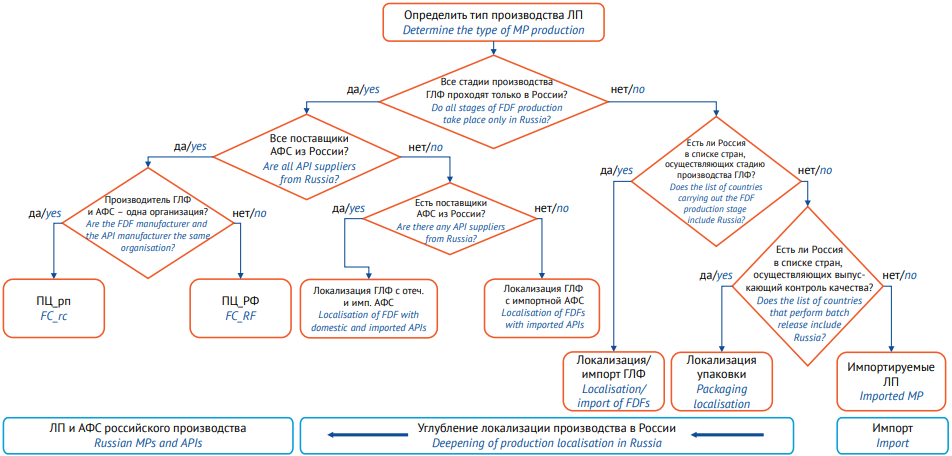
Рисунок подготовлен авторами / The figure is prepared by the authors
Рис. 1. Схема для определения типа производства лекарственного препарата
Fig. 1. Scheme for determining the type of pharmaceutical production
Примечание. ЛП — лекарственный препарат; ГЛФ — готовая лекарственная форма; ПЦ_рп — производство полного цикла на российском предприятии; ПЦ_РФ — производство полного цикла из отечественных субстанций; АФС — активная фармацевтическая субстанция.
Note. MP, medicinal product; FDF, finished dosage form; FC_rc, full-cycle production at a Russian manufacturer; FC_RF, full-cycle production from domestic APIs; API, active pharmaceutical ingredient.
Результаты и обсуждение
При анализе международных непатентованных наименований (МНН), обращавшихся на российском фармацевтическом рынке в 2022 г., было выделено 385 МНН БТЛП и более 1500 торговых наименований10. Наибольшее количество МНН в группе антибиотиков — 129 и моноклональных антител — 70 (рис. 2). Сегмент генотерапевтических препаратов находится в начальной фазе развития [8, 9] — в 2022 г. в него входили только 3 МНН и соответствующие им 3 оригинальных препарата (один отечественный полного цикла производства и два импортных).
По итогам 2022 г. объем российского фармацевтического рынка достиг 2529 млрд руб. и 6190 млн упаковок, доля биотехнологических препаратов составила 18,3% в рублях и 6,6% в упаковках. Сегмент БТЛП показывал более высокие темпы роста, чем российский фармацевтический рынок в целом, — 18,8 против 13,3% в рублях и 3,7 против 1,2% в упаковках. Самыми быстрорастущими сегментами рынка БТЛП стали моноклональные антитела, ВААБ и ферменты. На 80% в рублях и 37% в упаковках продажи БТЛП были представлены государственным сегментом.
Самым крупным сегментом рынка БТЛП в стоимостном выражении являлись моноклональные антитела, за ними с большим отрывом идут антибиотики и препараты ВААБ. В упаковках наибольшие продажи в сегменте антибиотиков и гормонов стероидной структуры (табл. 1).
Анализ степени локализации производства БТЛП показал, что в объеме продаж в стоимостном и в натуральном выражении преобладали импортируемые препараты, 31,3 и 33,9% соответственно (табл. 1). Велика доля препаратов с локализированной стадией вторичной упаковки — 25,9% в рублях и 5,8% в упаковках. Только 26,6% БТЛП производились в 2022 г. по полному циклу, что соответствовало 25,6% в упаковках. Существенную долю в упаковках занимало производство ГЛФ из импортных субстанций — 23,7% рынка, в рублях — 6,2%.
Наиболее важными для импортозамещения являются препараты, входящие в СЗЛС. В 2020 г. список был расширен до 215 наименований, причем вакцины в него были включены одной строкой «Вакцины в соответствии с национальным календарем профилактических прививок и календарем профилактических прививок по эпидемическим показаниям»11, что фактически увеличивает список еще на 33 МНН по данным календарей на 2023 г.
Из списка СЗЛС к биотехнологическим препаратам относятся 100 МНН с учетом вакцин, или 40,5% по номенклатуре. Из них на территории РФ не производятся субстанции для 21 МНН, то есть отечественными субстанциями по номенклатуре обеспечены 79% БТЛП (табл. 2).
В обновленной Стратегии развития фармацевтической промышленности на период до 2030 г. даны планируемые показатели производства лекарственных средств перечня СЗЛС по полному производственному циклу, включая синтез фармацевтической субстанции. Согласно этому документу к 2030 г. по номенклатуре на территории РФ должны производиться 80% СЗЛС в базовом сценарии и 76,74% в консервативном, следовательно, в сегменте БТЛП есть запас по выполнению плана вплоть до 2029 г. В результате количественного анализа продаж биотехнологических препаратов перечня СЗЛС с учетом степени локализации производства, проведенного авторами работы на основе данных продаж DSM Group за 2022 г., были получены более низкие показатели. По полному циклу производились в России БТЛП в количестве 32,3% в рублях и 10,8% в упаковках от всего объема потребляемых биотехнологических препаратов, входящих в перечень СЗЛС. При этом использовались при производстве полностью или частично импортные субстанции в 39,6% объема реализованных упаковок, что соответствует 7,1% в стоимостном выражении. Доля импортируемых препаратов в перечне СЗЛС составила 34,3% в упаковках и 9,8% в рублях, а стадия вторичной упаковки была локализована в 39,7% в рублях и 10,5% в упаковках. Еще 11,2% в стоимостном выражении и 4,8% в натуральном находились на стадии перехода между импортом и локализацией, то есть производились параллельно на территории иностранного государства и в России.
Несмотря на удовлетворительную обеспеченность отечественными субстанциями БТЛП по номенклатуре перечня СЗЛС, количественные показатели рынка свидетельствуют о высокой импортозависимости как от фармацевтических субстанций, так и от импортируемых препаратов.
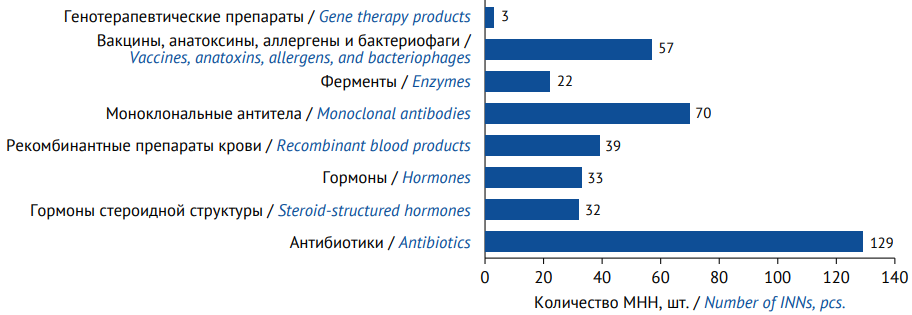
Рисунок подготовлен авторами по данным Государственного реестра лекарственных средств и DSM Group / The figure is prepared by the authors using the State Register of Medicines and sales data provided by the DSM Group marketing agency
Рис. 2. Количество зарегистрированных и представленных в структуре продаж международных непатентованных наименований (МНН) биотехнологических лекарственных препаратов по данным на конец 2022 года
Fig. 2. Number of approved biotechnological medicinal products (as International Nonproprietary Names (INNs)) represented in the sales structure as of the end of 2022
Таблица 1. Оценка локализации производства биотехнологических лекарственных препаратов по группам, в стоимостном исчислении (руб., %) / в упаковках (%)
Table 1. Evaluated localisation of biopharmaceutical manufacturing by value (RUB, %) / volume (packages, %)
|
Виды локализации Types of localisation |
Антибиотики Antibiotics |
Гормоны стероидной структуры Steroid- structured hormones |
Гормоны Hormones |
Рекомбинантные препараты крови Recombinant blood products |
Моноклональные антитела Monoclonal antibodies |
Ферменты Enzymes |
Вакцины, анатоксины, аллергены и бактериофаги Vaccines, anatoxins, allergens, and bacteriophages |
|
Импортируемый лекарственный препарат Imported medicinal products |
47,7 / 43,8 |
54,4 / 34,1 |
29,5 / 17,7 |
19,6 / 1,3 |
23,9 / 27,6 |
75,8 / 11,4 |
8,6 / 9,4 |
|
Локализация готовой лекарственной формы с импортной активной фармацевтической субстанцией Localisation of finished dosage forms (FDFs) with imported active pharmaceutical ingredients (APIs) |
26,3 / 25,8 |
28,3 / 46,1 |
4,3 / 12,2 |
1,1 / 0,2 |
0,2 / 0,5 |
0,5 / 2,3 |
0,0 / 0,0 |
|
Локализация готовой лекарственной формы с отечественной и импортной активной фармацевтической субстанцией Localisation of FDFs with domestic and imported APIs |
6,3 / 8,8 |
2,0 / 3,2 |
0,0 / 0,0 |
0,2 / 0,5 |
0,0 / 0,0 |
0,0 / 0,0 |
2,1 / 11,7 |
|
Локализация упаковки Localisation of packaging |
9,0 / 2,6 |
6,1 / 5,7 |
13,0 / 14,0 |
0,4 / 0,1 |
42,4 / 28,4 |
4,8 / 3,0 |
33,5 / 29,6 |
|
Локализация / импорт готовой лекарственной формы Localisation / import of FDFs |
1,7 / 1,0 |
8,3 / 7,8 |
33,8 / 32,7 |
0,1 / 0,0 |
7,9 / 15,5 |
6,0 / 4,5 |
10,0 / 9,7 |
|
Производство полного цикла на российском предприятии Full-cycle production |
0,8 / 0,5 |
0,8 / 2,1 |
11,0 / 17,6 |
27,8 / 2,4 |
11,6 / 6,1 |
5,1 / 1,4 |
36,0 / 35,2 |
|
Производство полного цикла из отечественных субстанций Full-cycle production from domestic APIs |
8,2 / 17,6 |
0,1 / 1,0 |
8,5 / 5,9 |
50,8 / 95,5 |
14,0 / 21,8 |
7,9 / 77,4 |
9,8 / 4,5 |
|
Всего, млрд руб. / млн упаковок Total, bln / mln packages |
68,9 / 241,2 |
26,3 / 73,1 |
41,2 / 17,3 |
39,7 / 40,7 |
212,0 / 4,6 |
22,3 / 1,2 |
46,2 / 30,5 |
Таблица составлена авторами по данным DSM Group / The table is prepared by the authors using data of the DSM Group marketing agency
Таблица 2. Стратегически значимые лекарственные средства, производство субстанций которых отсутствует в России
Table 2. Strategic medicines that include active pharmaceutical ingredients manufactured outside Russia
|
Группа биотехнологических лекарственных препаратов Group of biotechnological medicinal products |
Международные непатентованные наименования, активные фармацевтические субстанции которых не производятся в России INNs of active pharmaceutical ingredients manufactured outside Russia |
|
Гормоны Hormones |
Глюкагон; инсулин деглудек Glucagon; insulin degludec |
|
Рекомбинантные препараты крови Recombinant blood products |
Пэгинтерферон альфа-2a Peginterferon alfa-2a |
|
Моноклональные антитела Monoclonal antibodies |
Алирокумаб; афлиберцепт; даратумумаб; панитумумаб; пертузумаб; трастузумаб эмтанзин; цетуксимаб; этанерцепт Alirocumab; aflibercept; daratumumab; panitumumumab; pertuzumab; trastuzumab emtansine; cetuximab; etanercept |
|
Ферменты Enzymes |
Аспарагиназа; тенектеплаза Asparaginase; tenecteplase |
|
Вакцины, анатоксины, аллергены и бактериофаги Vaccines, anatoxins, allergens, and bacteriophages |
Вакцина для профилактики ветряной оспы; комбинированная вакцина для профилактики дифтерии, коклюша, полиомиелита, столбняка и инфекций, вызываемых Haemophilus influenzae типа b; вакцина для профилактики инфекций, вызываемых Haemophilus influenzae; вакцина для профилактики пневмококковых инфекций; вакцина для профилактики ротавирусной инфекции Varicella vaccine; diphtheria, tetanus, pertussis, poliovirus, Haemophilus influenzae type b combination vaccine; Haemophilus influenzae vaccine; pneumococcal vaccine; rotavirus vaccine |
|
Антибиотики Antibiotics |
Доксициклин; рифабутин; рифампицин Doxycycline; rifabutin; rifampicin |
Таблица составлена авторами по данным ГРЛС / The table is prepared by the authors using the State Register of Medicines
Заключение
Биотехнологические препараты занимают все более заметное положение на российском фармацевтическом рынке и показывают высокие значения среднего темпа роста, а также являются одним из ключевых направлений разработок российских компаний.
Самые высокие доли импорта и изготовления ГЛФ из импортных субстанций — в сегментах антибиотиков и гормонов стероидной структуры как в стоимостном, так и в натуральном выражении. Практически полностью обеспечивается производством по полному циклу сегмент рекомбинантных препаратов крови. Существенную часть локализации производства занимает стадия вторичной упаковки, доходя до 42,4% в группе моноклональных антител и 33,5% в группе вакцин, анатоксинов, аллергенов и бактериофагов в стоимостном выражении. Переходная стадия локализации/импорта представлена во всех сегментах рынка БТЛП, преимущественно на этой стадии находятся препараты из группы гормонов.
Список СЗЛС обеспечен отечественными субстанциями по номенклатуре на 79%, что
превышает целевые показатели стратегии «Фарма-2030» по плану до 2029 г. По полному циклу производится в России биотехнологических препаратов, находящихся в СЗЛС, около трети в рублях и десятая часть в упаковках.
Особенно значимыми направлениями для импортозамещения как воспроизведенными и (или)
биоаналоговыми, так и инновационными лекарственными препаратами являются разработка антибиотиков, гормональных препаратов, ферментов и моноклональных антител. Обеспокоенность по степени локализации вызывают также препараты из группы вакцин — несмотря на наличие отечественных вакцин, представлены они зачастую устаревшими монокомпонентными препаратами. Импортируемые вакцины являются поливалентными, содержат антигены большего количества инфекций или штаммов.
В целом по рынку биотехнологических препаратов можно констатировать сохраняющуюся высокую импортозависимость как от готовых лекарственных средств, так и от импортных субстанций, в том числе не находящихся под патентной защитой.
1 Global Use of Medicines 2023: Outlook to 2027. IQVIA. https://www.iqvia.com/insights/the-iqvia-institute/reports-and-publications/reports/the-global-use-of-medicines-2023
2 Там же.
3 Global Trends in R&D 2023: Activity, Productivity, and Enablers. IQVIA. https://www.iqvia.com/insights/the-iqvia-institute/reports-and-publications/reports/global-trends-in-r-and-d-2023
4 Постановление Правительства Российской Федерации от 30.11.2015 № 1289 «Об ограничениях и условиях допуска происходящих из иностранных государств лекарственных препаратов, включенных в перечень жизненно необходимых и важнейших лекарственных препаратов, для целей осуществления закупок для обеспечения государственных и муниципальных нужд».
5 Постановление Правительства Российской Федерации от 02.08.2016 № 744 «О внесении изменений в приложение к постановлению Правительства Российской Федерации от 17 июля 2015 года № 719».
6 Распоряжение Правительства Российской Федерации от 07.06.2023 № 1495-р «Стратегия развития фармацевтической промышленности до 2030 года».
7 Решение Совета Евразийской экономической комиссии от 03.11.2016 № 78 «О Правилах регистрации и экспертизы лекарственных средств для медицинского применения».
8 Решение Совета Евразийской экономической комиссии от 03.11.2016 № 89 «Об утверждении Правил проведения исследований биологических лекарственных средств Евразийского экономического союза».
9 https://grls.minzdrav.gov.ru/grls.aspx
10 https://grls.minzdrav.gov.ru/grls.aspx
11 Приказ Министерства здравоохранения Российской Федерации от 06.12.2021 № 1122н «Об утверждении национального календаря профилактических прививок, календаря профилактических прививок по эпидемическим показаниям и порядка проведения профилактических прививок».
Список литературы
1. Трофимова ЕО, Денисова МН. Российский фармацевтический рынок: положение отечественных компаний. Фармация. 2018;(1):3–7. https://doi.org/10.29296/25419218-2018-01-01
2. Каронский ЕВ, Амирханов АА. Институциональные ограничения импортозамещения в фармацевтической отрасли России. Финансовые рынки и банки. 2023;(8):65–71. EDN: HSPWPI
3. Чапленко АА, Власов ВВ, Гильдеева ГН. Инновационные лекарственные препараты на российском фармацевтическом рынке: ключевые игроки и основные направления разработок. Ремедиум. 2020;(10):4–9. https://doi.org/10.21518/1561-5936-2020-10-4-9
4. Трофимова ЕО, Денисова МН, Утемова АС. Структурные изменения и процессы импортозамещения в сегменте ВЗН в 2008–2018 годах. Ремедиум. 2019;(6):14–9. https://doi.org/10.21518/1561-5936-2019-6-14-19
5. Халимова АА. Обзор рынка антибиотиков и оценка перспектив его развития. Медико-фармацевтический журнал «Пульс». 2023;25(2):77–83. https://doi.org/10.26787/nydha-2686-6838-2023-25-2-77-83
6. Олефир ЮВ, Медуницын НВ, Авдеева ЖИ, Солдатов АА, Мовсесянц АА, Меркулов ВА и др. Современные биологические/биотехнологические лекарственные препараты. Актуальные вопросы разработки и перспективы использования. Биопрепараты. Профилактика, диагностика, лечение. 2016;16(2):67–77. EDN: WAIVUX
7. Халимова АА. Определение и классификация биотехнологических лекарственных препаратов в целях экономического анализа. В кн.: Вызовы глобализации и развитие цифрового общества в условиях новой реальности. Сборник материалов IX Международной научно-практической конференции. Пятигорск; 2023. С. 22–32. https://doi.org/10.34755/IROK.2023.96.20.093
8. Солдатов АА, Авдеева ЖИ, Горенков ДВ, Хантимирова ЛМ, Гусева СГ, Меркулов ВА. Проблемные аспекты разработки и регистрации генотерапевтических препаратов. БИОпрепараты. Профилактика, диагностика, лечение. 2022;22(1):6–22. https://doi.org/10.30895/2221-996X-2022-22-1-6-22
9. Дроков МЮ, Гапонова ТВ, Губенко ТЮ, Караваева ОС, Теляшов МА, Антимонов АС и др. Организационно-методические проблемы производства CAR-T в Российской Федерации. БИОпрепараты. Профилактика, диагностика, лечение. 2023;23(2):162–72. https://doi.org/10.30895/2221-996X-2023-23-2-162-172
Об авторах
А. А. ХалимоваРоссия
Халимова Алина Азатовна
Ул. Профессора Попова, д. 14, лит. А, Санкт-Петербург, 197022
А. С. Орлов
Россия
Орлов Александр Сергеевич, канд. фарм. наук, доцент
Ул. Профессора Попова, д. 14, лит. А, Санкт-Петербург, 197022
А. А. Таубэ
Россия
Таубэ Александра Альбертовна, канд. фарм. наук, доцент
Ул. Профессора Попова, д. 14, лит. А, Санкт-Петербург, 197022
Петровский б-р, д. 8, стр. 2, Москва, 127051
Дополнительные файлы
Рецензия
Для цитирования:
Халимова А.А., Орлов А.С., Таубэ А.А. Анализ локализации производства биотехнологических лекарственных препаратов в России с учетом происхождения активных фармацевтических субстанций. Ведомости Научного центра экспертизы средств медицинского применения. Регуляторные исследования и экспертиза лекарственных средств. 2024;14(1):53-61. https://doi.org/10.30895/1991-2919-2024-14-1-53-61
For citation:
Khalimova A.A., Orlov A.S., Taube A.A. Analysis of Biopharmaceutical Manufacturing Localisation in Russia Considering the Country of Origin of Active Pharmaceutical Ingredients. Bulletin of the Scientific Centre for Expert Evaluation of Medicinal Products. Regulatory Research and Medicine Evaluation. 2024;14(1):53-61. (In Russ.) https://doi.org/10.30895/1991-2919-2024-14-1-53-61



































