Перейти к:
Глобальный спектр разработки инновационных лекарственных препаратов: описательный обзор
https://doi.org/10.30895/1991-2919-2024-14-1-14-28
Резюме
АКТУАЛЬНОСТЬ. Быстрый рост ассортимента лекарственных средств глобального фармацевтического рынка предопределяет актуальность периодического обзора спектра инновационных лекарственных средств и продуктов, находящихся на различных стадиях разработки.
ЦЕЛЬ. Определение основных тенденций глобальных разработок инновационных лекарственных средств.
ОБСУЖДЕНИЕ. Представлены данные, характеризующие ценность и терапевтический эффект инновационных лекарственных препаратов, отражены современные подходы к регистрации и проблемы роста стоимости инновационных лекарственных препаратов. Описательный обзор проведен с использованием методов информационного поиска, контент-анализа и сканирования горизонтов. Дано описание глобального фармацевтического пайплайна как в целом, так и по отдельным направлениям по состоянию на II полугодие 2023 г. Выявлено, что в разработке находятся более 21 тыс. фармацевтических продуктов, из которых на поздних стадиях разработки (от клинических исследований III фазы до регистрации) находится около 23%, среди показаний к применению преобладает направление «Онкология и онкогематология». Отдельно рассмотрены инновации в области лекарственных препаратов для лечения болезни Альцгеймера, а также генной, клеточной и РНК-терапии.
ВЫВОДЫ. Значительный объем инновационных лекарственных препаратов, находящихся на различных этапах разработки, с высокой вероятностью может изменить существующие подходы к терапии, профилактике и диагностике заболеваний, что с учетом возрастающей стоимости инновационных лекарственных препаратов подчеркивает важность внедрения в отечественную систему здравоохранения прогнозирования, например с использованием метода сканирования горизонтов.
Ключевые слова
Для цитирования:
Меркулов В.А., Ягудина Р.И., Серпик В.Г. Глобальный спектр разработки инновационных лекарственных препаратов: описательный обзор. Ведомости Научного центра экспертизы средств медицинского применения. Регуляторные исследования и экспертиза лекарственных средств. 2024;14(1):14-28. https://doi.org/10.30895/1991-2919-2024-14-1-14-28
For citation:
Merkulov V.A., Yagudina R.I., Serpik V.G. Global Pipeline of Innovative Medicinal Products: A Narrative Review. Bulletin of the Scientific Centre for Expert Evaluation of Medicinal Products. Regulatory Research and Medicine Evaluation. 2024;14(1):14-28. (In Russ.) https://doi.org/10.30895/1991-2919-2024-14-1-14-28
Введение
Здравоохранение как область человеческой деятельности характеризуется нарастающим инновационным потенциалом, изменяющим не только ландшафт клинической практики, течение и исходы заболевания, но и образ жизни и среду обитания человека. Разработка и ввод инновационных технологий в практику здравоохранения получили «космическое» ускорение в конце XX столетия: вход в эру стратифицированной медицины, ознаменовавшуюся генотипированием злокачественных новообразований и регистрацией таргетных лекарственных препаратов; цифровизация здравоохранения, обеспечившая доступность работы с большими данными и использование данных реальной клинической практики вместе с возможностями искусственного интеллекта; создание медицинских изделий высокой точности; секвенирование генома человека, предопределившее развитие геномных и генетических технологий, фармакогеномики и в итоге внедрение в практику высокоточной и персонализированной медицины — это далеко не все технологические прорывы, которые произошли за эти десятилетия.
Под стать технологиям здравоохранения развиваются и пересматриваются организационные механизмы лекарственного обеспечения на всех его этапах: от разработки, доклинических (ДКИ) и клинических (КИ) исследований до регистрации и обеспечения доступности лекарственных препаратов. В этой связи становится очевидной важность ориентирования в быстро расширяющемся поле инноваций технологий здравоохранения.
В российском национальном законодательстве и законодательстве Евразийского экономического союза в настоящее время отсутствует определение термина «инновационный лекарственный препарат». Европейское агентство по лекарственным средствам (European Medicines Agency, EMA) определяет инновационный лекарственный препарат (ЛП) как ЛП, который содержит действующее вещество или комбинацию действующих веществ, которое(ая) ранее не было(а) зарегистрировано(а)1. Управление по контролю за качеством продуктов питания и лекарственных средств (Food and Drug Administration, FDA) под инновационным ЛП понимает новые возможности терапии и улучшения в здравоохранении для населения2.
Цель работы — определение основных тенденций глобальных разработок инновационных лекарственных средств. Задачи исследования — анализ факторов, определяющих инновационный потенциал, ценность и стоимость инноваций, описание основных инновационных лекарственных средств, находящихся на разных стадиях разработки, изучение глобального фармацевтического пайплайна3.
Материалы и методы
Описательный обзор проведен с использованием методов информационного поиска, контент-анализа и сканирования горизонтов. Поиск проводили посредством универсальных поисковых систем (Google, Yandex) в сети Интернет, на интернет-порталах профильных ассоциаций и компаний-производителей, а также в специализированных отечественных и международных базах данных: eLIBRARY.RU, Pubmed®, Cochrane.
Метод сканирования горизонтов, использованный для проведения анализа, является особенно востребованным с ростом числа, сложности и стоимости разрабатываемых инновационных ЛП. В полном своем применении этот инструмент прогнозирования подразумевает заблаговременный (за несколько лет до планируемой даты регистрации) регулярный сбор и анализ доступной информации об инновационных ЛП, главным образом, об эффективности, безопасности, планируемой численности пациентов, которым показан данный препарат, особенностях его применения и стоимости, с целью подготовки системы здравоохранения к оптимальному использованию инновационного ЛП к моменту его регистрации и прогнозирования долгосрочных последствий его применения [1]. Как правило, сканирование горизонтов проводится ассоциированными со структурами системы здравоохранения агентствами, промежуточные закрытые данные им представляют компании-производители; при этом возможна обратная связь. Результатом сканирования горизонтов является регулярно обновляемый отчет, в котором детально описываются и оцениваются представленные данные, формулируется социально-экономическое бремя рассматриваемой нозологии, разрабатываемая терапия сопоставляется с существующими методами лечения, определяются оптимальные точки приложения инновации.
Практическая значимость применения метода сканирования горизонтов в сфере прогнозирования глобального рынка и потребностей здравоохранения состоит в следующем. Система здравоохранения имеет возможность наилучшим образом внедрить в практику инновационный ЛП, располагая к моменту регистрации информацией о численности пациентов, объеме необходимого финансирования, ожидаемом эффекте терапии и понимании клинических специалистов, как этот препарат надлежащим образом применять. Компания-производитель может снизить риски при планировании коммерческой деятельности благодаря обратной связи от агентства и пониманию отношения регуляторных органов к продукту. Для пациентов этот инструмент, оптимизируя поздние этапы разработки ЛП, обеспечивает скорейший доступ к инновационному ЛП.
В нашем исследовании использован инструмент сканирования горизонтов для общего описания глобального пайплайна и нескольких отдельных направлений, а также ряда значимых инновационных ЛП, зарегистрированных в 2023 г., но без детализации объема и значения доказательной базы и последствий их внедрения.
Ценность и цена инноваций
Ценность инновационных ЛП может рассматриваться со многих точек зрения. Один из наиболее очевидных путей представления ценности инновационных ЛП — оценка их вклада в снижение смертности и увеличение продолжительности жизни. В этой связи невозможно не отметить одну из самых значимых и успешных фармацевтических инноваций в истории — создание препаратов на основе пенициллина, открывшего новую эру в медицине. Благодаря применению пенициллина и последовавших за ним антибактериальных ЛП в развитых странах качественно изменилась структура смертности: инфекционные заболевания, до того момента исторически занимавшие лидирующие позиции в качестве причины смертности, уступили место неинфекционным болезням и, в частности, сердечно-сосудистым заболеваниям4 [2].
J.D. Buxbaum и соавт. [3], оценившие вклад различных факторов в рост ожидаемой продолжительности жизни в США, показали, что с 1990 по 2015 г. продолжительность жизни увеличилась на 3,3 года, вклад инновационных ЛП в это достижение в целом составляет 35%, а в таких подгруппах, как ВИЧ-инфекция, онкология и кардиология, — 76, 60 и 52% соответственно. Исследование профессора Колумбийского университета F.R. Lichtenberg, который на протяжении десятилетий изучает демографические и социально-экономические эффекты инновационных ЛП, проведенное на основе данных по 26 развитым странам, показывает, что инновационные ЛП обеспечили 73% роста продолжительности жизни, наблюдаемого между 2006–2016 гг. [4]. В рамках другого анализа [5] было установлено, что в популяции пациентов с редкими заболеваниями в период 1999–2007 гг. преждевременная смертность в группе до 65 лет снижалась в среднем ежегодно на 3,3%, тогда как в случае отсутствия инновационных орфанных ЛП она могла бы увеличиться на 0,9%.
Статистически значимый вклад в снижение смертности от онкологических заболеваний инновационных ЛП был определен в работе J. MacEwan и соавт. [6]: за период 2000–2016 гг. смертность от онкологических заболеваний в США снизилась на 24%, а проведенный анализ показал, что благодаря использованию инновационных ЛП в 2016 г. удалось избежать около 5 тыс. смертей от колоректального рака, 34 тыс. смертей от рака легкого, более 11 тыс. смертей от рака молочной железы. Рассматривая вклад отдельных онкологических ЛП в увеличение выживаемости пациентов со злокачественными новообразованиями, можно выделить начало применения в 2000-х гг. ЛП класса ингибиторов тирозинкиназ (первым представителем которого был иматиниб): в сравнении с предшествующим периодом традиционной химиотерапии общая выживаемость пациентов с хроническим миелоидным лейкозом увеличилась с 6 до 22 лет, а пациентов с гастростромальными интерстициальными опухолями — с 1–1,5 до 5 лет5. Ярким примером достижений использования инновационных ЛП в онкологии является лечение немелкоклеточного рака легкого, при котором продолжительность терапии, а значит и жизни пациентов, в 2011 г. не превышала и года, а в 2021 г. достигла почти трех лет6.
В 2020 г. Нобелевская премия по физиологии и медицине была присуждена Х. Альтеру, М. Хотону и Ч. Райсу за исследование вируса гепатита С, результаты которого были положены в основу разработки ЛП прямого противовирусного действия [7]. Использование таких препаратов, внедренных в 2010-х, позволило к настоящему времени довести эффективность лечения, выражаемую в количестве пациентов, достигших устойчивого вирусного ответа (необнаружения вируса в крови через 24 недели после проведенной противовирусной терапии), практически до 100%, тогда как первые схемы лечения гепатита С на основе интерферона, применяемые с середины 1990-х, были эффективны не более чем у 6–30% пациентов (рис. 1) [8].
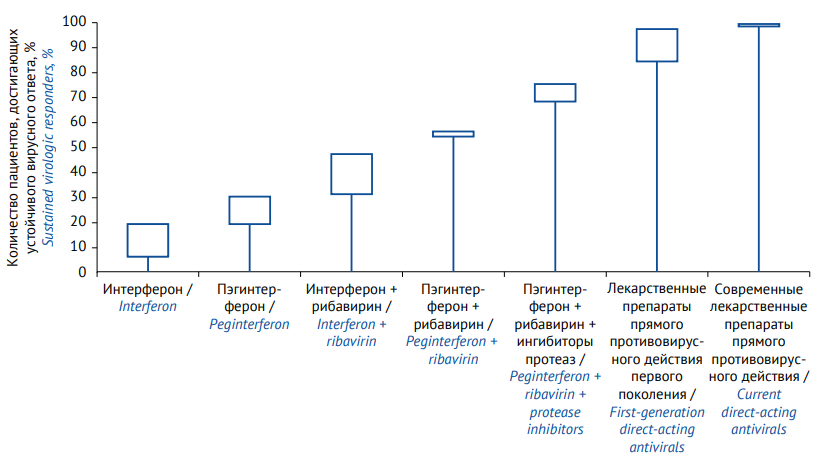
Рисунок подготовлен авторами / The figure is prepared by the authors
Рис. 1. Эволюция противовирусной фармакотерапии в лечении гепатита С (по данным [8]). Нижние и верхние границы прямоугольников отражают диапазон эффективности терапии
Fig. 1. Evolution of hepatitis C antiviral therapy (according to [8]). The upper and lower sides of the boxes show treatment efficacy ranges
Антиретровирусная терапия позволила к 2022 г. снизить смертность от ВИЧ-инфекции на 69% с 2004 г. (более чем 2 млн смертей в год)7.
Еще одним ярким примером эффективности применения инновационных ЛП являются редкие заболевания, и, в частности, спинальная мышечная атрофия (СМА) — жизнеугрожающее врожденное заболевание, характеризующееся поражением и гибелью двигательных нейронов, что проявляется нарастающей мышечной слабостью и при тяжелых формах приводит к гибели из-за дыхательной недостаточности в течение первых лет жизни. Первым орфанным ЛП, разработанным для лечения СМА и одобренным к применению в 2016 г.8, был генотерапевтический препарат нусинерсен, представляющий собой антисмысловой олигонуклеотид, воздействующий на ген выживаемости мотонейронов-2, и, таким образом, относящийся к генной терапии. Данные реальной клинической практики показывают, что нусинерсен статистически значимо увеличил выживаемость у пациентов [9, 10]. Вслед за нусинерсеном был зарегистрирован еще ряд орфанных ЛП, в том числе один из первых ЛП, корректирующих генные нарушения, — онасемногена абепарвовек9, который теоретически имеет возможность излечивать заболевания благодаря замещению дефектных генов их правильными последовательностями. Однако заявлять о реальной эффективности этого инновационного ЛП, равно как и любых других инноваций, можно будет только с течением времени, когда накопится достаточный опыт его применения.
Понимание ценности инновационных ЛП находит свое отражение и в особом подходе к их регистрации регуляторными органами: во многих странах для прорывных инноваций, открывающих новую возможность в лечении пациентов и решающих проблему их неудовлетворенной потребности в эффективной терапии, предусматриваются особые процедуры регистрации. Так, FDA разработало 4 опции для подобных случаев10:
- Приоритетный обзор (Priority review) предполагает ускоренный (до 6 мес., тогда как в случае стандартной процедуры 10 мес.) предварительный анализ предоставляемой агентству информации о ЛП.
- Ускоренная регистрация (Accelerated approval) заключается в возможности получения (временной) регистрации ЛП на основании промежуточных данных по эффективности или оценки эффективности на основе суррогатных точек. Получение ускоренной регистрации ЛП не снимает с производителя обязанности по предоставлению FDA полноценного досье на ЛП с учетом результатов регистрационных КИ. В случае если финальные данные по эффективности не отвечают предъявляемым требованиям, регистрация, полученная по данной процедуре, отзывается. Последнее не является чем-то исключительным: за время действия ускоренной регистрации у нескольких десятков ЛП, прошедших по данной процедуре, регистрация была отозвана11 [11]. Чаще всего отзывается регистрация ЛП по отдельным показаниям. Среднее время отзыва регистрации в случае установленной недостаточной эффективности ЛП, получившего разрешение на временное обращение на рынке по процедуре ускоренной регистрации, составляет около 4 лет12.
- Ускоренный путь (Fast track) и показание Прорывной терапии (Breakthrough therapy) введены для ЛП, которые имеют потенциал для решения проблемы неудовлетворенной медицинской потребности для пациентов, относятся к жизнеспасающим ЛП или обладают значительным преимуществом над существующей терапией в плане эффективности и безопасности лечения тяжелых заболеваний, открывая возможность ЛП пройти по вышеуказанным процедурам приоритетного обзора и ускоренной регистрации. При этом для получения показания прорывной терапии производитель должен предоставить FDA предварительные результаты по эффективности и безопасности, доказывающие превосходство подаваемого на регистрацию ЛП над существующими альтернативами, тогда как процедура ускоренного пути такого требования не содержит.
Все перечисленные опции являются рутинными процедурами и применяются к ЛП, соответствующим определенным критериям. Для экстренных случаев предлагается отдельная процедура (например, как в случае с коронавирусной инфекцией): разрешение для экстренного использования (Emergency use authorisation) ЛП без регистрации или не по зарегистрированному показанию.
В рамках обсуждения ценности инноваций нельзя не отметить тенденцию к ее более широкому и глубокому пониманию на пострегистрационном этапе, что становится особенно важно как для прорывных инновационных ЛП, характеризующихся неопределенностью в доказательной базе, так и для инноваций, направленных на лечение пациентов на тяжелых стадиях заболеваний в качестве поздних линий терапии, сама природа которых подразумевает снижающийся градиент добавленной эффективности [12]13. Примером такого мультикритериального подхода к определению ценности инновационных ЛП является учет фактора тяжести заболевания как фактора, предопределяющего инновационный потенциал ЛП при принятии решений о возмещении его стоимости системой здравоохранения [13]. В онкологии терапия спасения может добавлять лишь недели жизни, тогда как для ЛП первой линии терапии данный показатель исчисляется месяцами и даже годами. Вместе с тем для пациентов в тяжелом состоянии это может быть очень важно, что обосновывает необходимость расширения понятия ценности таких инноваций. Так, при принятии решений о возмещении системой здравоохранения для пациентов затрат на инновационные ЛП предлагается учитывать такие критерии, как: «ценность надежды» (вероятность того, что ЛП окажется эффективным для конкретного пациента) или «ценность доступной терапии», которая отражает факт возможности для пациента, получающего существующую инновационную терапию, дожить до разработки более эффективных ЛП [12]. При этом необходимо законодательное установление четких критериев «терапии спасения» или «терапии последнего шанса», которые в настоящее время в национальном законодательстве России и ЕАЭС отсутствуют.
В равной степени важен комплексный подход к определению ценности инновационных ЛП, предназначенных для лечения хронических заболеваний. В терапии хронических заболеваний критическое значение для достижения целей лечения приобретает приверженность пациентов приему назначенных ЛП. Так, установлено, что высокая приверженность пациентов лечению сопровождается снижением затрат системы здравоохранения, например, на 29% для гиперхолистеринемии, 27% для сахарного диабета, 9% для хронической сердечной недостаточности, 7% для артериальной гипертензии [13–18]. Сложно переоценить комплаентность назначенной терапии и при лечении ВИЧ-инфекции, когда нарушение распорядка приема ЛП может привести к необходимости смены терапии [19].
Инновационные ЛП характеризуются не только ценностью, но и разносторонним экономическим эффектом [20], который, с одной стороны, проявляется позитивно, так как разработка и выпуск новых ЛП отражают продуктивность и обеспечивают дальнейшее развитие фармацевтической отрасли экономики и экономики в целом. При этом инновации увеличивают продолжительность и качество жизни и, снижая бремя заболеваний, опосредованно повышают производительность труда. С другой стороны, растущая стоимость разработки самих инновационных ЛП и в итоге их цена становятся риском доступности инноваций для пациентов.
Ретроспективный обзор зарегистрированных предельных отпускных цен на инновационные ЛП разных лет наглядно демонстрирует тренд роста их стоимости, кардинально поменяв наше понимание дорогостоящей терапии. ЛП на основе моноклональных антител и ингибиторов тирозинкиназ, фактически открывшие эру стратифицированной медицины и таргетной терапии в онкологии — бевацизумаб, трастузумаб и иматиниб, характеризовались в начале 2010-х ценой упаковки в пределах 100 тыс. руб., а курсовой стоимостью в пределах 2 млн руб. [21–23]. Последовавший за этим интенсивный выход орфанных ЛП заставил по-новому посмотреть на возможную стоимость инновационных ЛП. Так, годовая стоимость экулизумаба достигала почти 26 млн руб. [24], а сегодня за счет средств фонда «Круг добра» для нужд пациентов со спинальной мышечной атрофией закупается ЛП генной терапии онасемногена абепарвовек, стоимость курса лечения которого достигает 95 млн руб. в расчете на одного пациента14. Самым же дорогим ЛП в мире по состоянию на июнь 2023 г. являлся орфанный препарат генной терапии, предназначенный для лечения гемофилии В, этранакоген дезапарвовек, стоимость лечения которым достигала 3,5 млн долларов США в расчете на одного пациента15.
Нельзя не подчеркнуть тот факт, что два последних ультрадорогих ЛП относятся к геннотерапевтическим препаратам, курс лечения которыми состоит из одной инъекции. С учетом малой численности пациентов с указанными редкими заболеваниями компании-производители устанавливают чрезмерно высокие цены на свои продукты, чтобы возместить затраченные при их разработке средства. Средняя стоимость разработки нового ЛП с учетом экономических потерь, затраченных на изучение препаратов-кандидатов, отклоненных в процессе создания, в 2022 г. оценивалась в 2,3 млрд долларов США16 (тогда как 20 лет назад эта сумма составляла не более 1 млрд долларов США [25]), а в крайних случаях — до 4,5 млрд долларов США [26], при этом срок разработки нового ЛП может превышать 10 лет. Вероятность успеха при разработке ЛП не превышает 5%: так, из 146 препаратов-кандидатов для лечения болезни Альцгеймера, разрабатываемых в период с 1998 по 2017 г., регистрацию получили только 4 ЛП17. Считается, что до половины всех затрат на создание нового ЛП приходится на проведение КИ и больше 1/5 — на процедуру регистрации, при этом вероятность достигнуть возврата инвестиций составляет около 30%18. Расходы на разработку лекарственных препаратов в мире в 2023 г. могут достигнуть 240 млрд долларов США19.
Однако все это не оправдывает тенденции к росту стоимости инновационных ЛП и не решает проблемы справедливости цен, устанавливаемых производителями на свои продукты, а заявления о необходимости их более строгого обоснования не утихают [27, 28]. Причиной таких дискуссий является стремительный рост цен на новые ЛП, за которым не поспевает увеличение финансирования систем здравоохранения в мире, в связи с чем возникает угроза снижения доступности инновационных ЛП для пациентов. Как следствие, это приводит, например, к появлению такого термина, как «финансовая токсичность ЛП» [29, 30], который подразумевает вынужденную необходимость для пациента и его семьи оплачивать дорогостоящее лечение (прежде всего в онкологии) за свой счет, что нередко приводит такие семьи к банкротству и разорению.
Факторы, определяющие инновационный потенциал
Немаловажным аспектом при обзоре инновационных ЛП является их неравномерное распределение между различными нозологическими областями [31]. Действительно, на протяжении последней четверти XX века и по настоящее время отчетливо выявляются группы заболеваний, для лечения которых фармацевтические компании активно разрабатывают и выводят на глобальный рынок новые ЛП. К таким нозологическим направлениям относятся, в первую очередь, онкология и онкогематология, редкие заболевания, ревматология, сахарный диабет, отдельные инфекционные заболевания (СПИД, гепатит С), ожидается выход целого ряда инновационных ЛП для лечения различных форм деменции и болезни Альцгеймера. С другой стороны, такие социально значимые направления, как лечение сердечно-сосудистых и инфекционных бактериальных заболеваний, испытывают выраженную нехватку фармацевтических инноваций [32–35].
Существующая диспропорция является следствием действующей модели разработки ЛП, когда компания стремится разрабатывать ЛП в первую очередь для самых «актуальных» нозологических областей, характеризующихся высокой вероятностью достижения коммерческого успеха. При этом фактор «актуальность» несмотря на то, что, как правило, ассоциирован с восприятием общества социально-экономической значимости, фактора тяжести и жизнеугрожающего статуса заболевания, может не всегда коррелировать с истинными вызовами здравоохранению. Подтверждением этому могут являться данные, представленные в следующем разделе настоящей публикации, которые свидетельствуют, что по объему продуктов в глобальном пайплайне показание «лечение коронавирусной инфекции» находится на шестом месте, а если к нему добавить разрабатываемые ЛП для профилактики COVID-19 и лечения его осложнений, то это интегральное показание займет первое место. Несмотря на то что мир пандемию коронавирусной инфекции уже прошел, ее эффект продолжается до сих пор.
Таким образом, инновационный потенциал
нозологического направления зависит как от от-
ношения общества к проблеме, которая представляется вызванной заболеванием (и, соответственно, готовности системы здравоохранения оплачивать инновацию), так и от сложности разработки инновации для конкретного заболевания (технологический аспект), коммерческой привлекательности нозологии (например, численности пациентов с данной нозологией, конкурентного окружения, стоимости проведения КИ) и стимулирующих мер от регуляторов. При этом последний из перечисленных факторов может сыграть решающую роль, что подтверждает пример редких заболеваний: изобилию орфанных ЛП, наблюдаемых в настоящее время, мы обязаны десятилетиям работы по формированию комплекса стимулирующих мер со стороны регуляторных органов США и ЕС, например таких, как увеличение сроков эксклюзивности (патентной защиты), ускоренные процедуры регистрации, дисконт для регистрационных сборов и т.п. [36, 37]. В настоящее время активно обсуждается необходимость введения стимулирующих мер для разработки антибактериальных ЛП [38].
Сканирование горизонтов
Общая характеристика глобального фармацевтического пайплайна
В формировании глобального фармацевтического пайплайна на начало 2023 г. участвовало свыше 5,2 тыс. фармацевтических и биотехнологических компаний. При этом в течение последних 13 лет сохраняется тренд на снижение доли вклада крупных фармацевтических компаний в мировой пайплайн за счет роста числа и эффективности работы стартапов и небольших компаний с собственным пайплайном из 1–2 продуктов20.
По состоянию на май 2023 г. в мире на различных стадиях разработки находилось более 21 тыс. потенциальных ЛП. Из них свыше 11 тыс. объектов проходили доклинический этап разработки, для свыше 6 тыс. препаратов-кандидатов проводятся КИ I и II фазы, более 1,2 тыс. продуктов были доведены до III фазы КИ, на предрегистрационной ступени находилось 250 и в процессе регистрации — 140 продуктов (рис. 2). Предварительные оценки показали, что в 2023 г. в мире было выведено на рынок более 1,2 тыс. ЛП. Ретроспективный анализ показал постоянный рост глобального фармацевтического пайплайна на протяжении последних 15 лет21.
Практически половина всего глобального пайплайна (около 8,5 тыс. продуктов) была сосредоточена в онкологии и онкогематологии, за ними следовали неврология (3,5 тыс. продуктов), по 3 тыс. потенциальных ЛП разрабатывалось для терапии заболеваний органов пищеварения и нарушений обмена веществ и инфекционных заболеваний, около 2 тыс. продуктов присутствовали в пайплайне терапии заболеваний скелетно-мышечного аппарата, проводились исследования примерно по 1 тыс. продуктов в таких областях, как иммунология, дерматология, заболевания органов чувств, органов дыхания, сердечно-сосудистые заболевания (рис. 3). По состоянию на 2022 г. в мире разрабатывались орфанные ЛП для лечения 700 редких заболеваний22, при этом почти 40% из них — это различные формы злокачественных новообразований. Процесс пополнения числа редких заболеваний посредством выделения отдельных форм и «моделей пациентов» с онкологическими заболеваниями напрямую связывают с действующей в ряде стран политикой по стимулированию фармацевтических производителей к разработке орфанных ЛП, которая оказалась настолько эффективной и привлекательной для компаний, что при возможности они стремятся подвести показания к применению разрабатываемых ими ЛП под орфанный статус [39].
Детализируя обзор распределения глобального пайплайна по нозологическим направлениям, представляется интересным выделить отдельные показания, по которым предполагается применение разрабатываемых ЛП. В соответствии с нозологическим распределением в показаниях преобладали различные формы онкологических заболеваний: лидировали по числу препаратов рак молочной железы, за ним следовал немелкоклеточный рак легкого, колоректальный рак, рак поджелудочной железы. Пятую позицию по числу разработок занимало лечение коронавирусной инфекции, за которой располагались рак яичников, рак мозга, болезнь Альцгеймера, рак предстательной железы. Из неонкологических показаний с широким пайплайном можно выделить также сахарный диабет II типа, ревматоидный артрит, болезнь Паркинсона, псориаз и бронхиальную астму.
Около 8,5 тыс. продуктов относились к биологическим ЛП, порядка 11 тыс. — к продуктам химического синтеза и около 350 — к продуктам животного или растительного происхождения. В разработке биологических ЛП более 25% приходилось на антитела, 22% — на клеточные технологии, 10% — на рекомбинантные белки, 9% — на генотерапевтические препараты на основе вирусных и невирусных векторов, в основе 6% лежат вирусные частицы, 5% — нуклеиновые кислоты (рис. 4).
Взгляд на глобальный фармацевтический пайплайн в разрезе путей введения ЛП показал, что более 60% разрабатываемых ЛП имели инъекционный путь введения, около 30% — пероральный, по 3% ингаляционный и формы для местного применения, 2% — офтальмологические лекарственные формы и по 1% — трансдермальный путь введения и импланты.
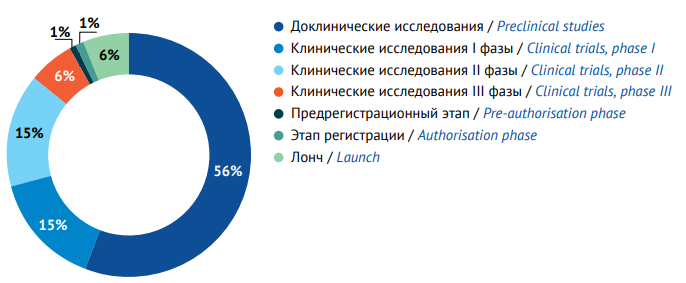
Рисунок подготовлен авторами по данным Pharma R&D Annual Review 2023 / This figure is prepared by the authors using the Pharma R&D Annual Review 2023
Рис. 2. Распределение глобального фармацевтического пайплайна по стадиям разработки
Fig. 2. Global pharmaceutical pipeline distribution by development phase
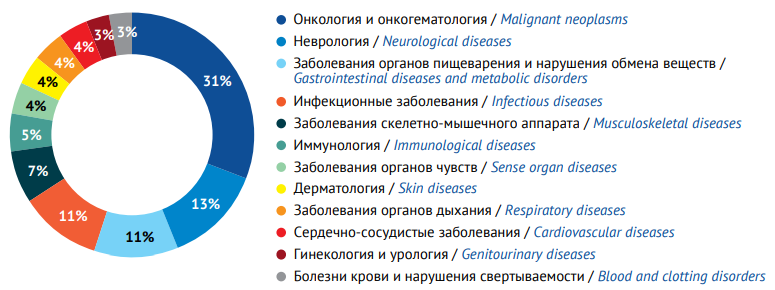
Рисунок подготовлен авторами по данным Pharma R&D Annual Review 2023 / This figure is prepared by the authors using the Pharma R&D Annual Review 2023
Рис. 3. Распределение глобального фармацевтического пайплайна по нозологическим областям
Fig. 3. Global pharmaceutical pipeline distribution by nosological group

Рисунок подготовлен авторами по данным Pharma R&D Annual Review 2023 / This figure is prepared by the authors using the Pharma R&D Annual Review 2023
Рис. 4. Распределение биологических лекарственных препаратов в глобальном фармацевтическом пайплайне по типам
Fig. 4. Global biopharmaceutical pipeline distribution by product type
Сканирование горизонтов по отдельным направлениям
Болезнь Альцгеймера. Рост продолжительности жизни населения за последние десятилетия, достигнутый не в последнюю очередь благодаря инновационным ЛП, и следующий за ним рост доли пожилого населения приводят к изменению картины глобального бремени болезни, актуализируя борьбу с такими проявлениями, как деменция, с целью продления активного долголетия [40]. Более всего деменция распространена при болезни Альцгеймера, охват заболеванием которой составляет около 50 млн чел во всем мире [41]. На текущий момент не существует эффективной терапии болезни Альцгеймера, что во многом обусловлено неустановленной природой самого заболевания, более того, существует лишь небольшое количество ЛП, используемых преимущественно для симптоматического лечения этого заболевания. Все перечисленные факты сформировали выраженную неудовлетворенную потребность в эффективной терапии в данной нозологии. В 2016 г. С.О. Бачуриным [42] проводилось сканирование горизонтов лечения болезни Альцгеймера, однако вышедшие за последние годы и ожидающие выхода инновации изменили ландшафт возможных доступных ЛП и вновь сделали востребованным обзор этого направления.
Глобальный фармацевтический пайплайн по показанию «болезнь Альцгеймера» на 2023 г. был представлен 141 продуктом, из которых 31 находились на I фазе КИ, 87 — на II фазе КИ, а 36 проходили КИ III фазы [43]. В связи с неустановленной природой заболевания и многообразием патофизиологических процессов, вносящих в него вклад, разработана классификация потенциальных мишеней для ЛП против болезни Альцгеймера CADRO (Common Alzheimer’s Disease Research Ontology), включающая следующие основные группы воздействия на: образование отложений бета-амилоида; тау-белки; эпигенетику заболевания (прежде всего регуляцию работы генов, вызывающих процессы образования бета-амилоида и тау-белков [43]); воспалительные процессы / аутоиммунные процессы; метаболизм / биоэнергетические процессы; нейрогенез; рецепторы к нейромедиаторам; оксидативный стресс; сосуды головного мозга; протеостаз/протеинопатии; синаптическую пластичность; циркадные ритмы и др.
Из 36 продуктов (включая существующие ЛП по новому показанию), проходивших КИ III фазы, 31% воздействуют на рецепторы к нейромедиаторам; мишенью для 19% разработок является образование бета-амилоида, 17% должны оказывать влияние на синаптическую пластичность, по 8% — на оксидативный стресс и метаболизм или энергетические процессы в нейронах, по 6% — на патогенез через тау-белок и воспаление, по 3% — на протеостаз и циркадные ритмы [41]. Зарегистрированные в последние годы инновационные ЛП, применяющиеся при лечении болезни Альцгеймера, представлены двумя ЛП: адуканумабом (в 2021 г. по процедуре ускоренной регистрации) и леканемабом (в 2023 г. по процедуре ускоренной регистрации)23. Оба ЛП предотвращают образование бета-амилоидных бляшек, являясь моноклональными антителами гуманизированного иммуноглобулина гамма-1 к бета-амилоиду. Также в ближайшее время ожидается пополнение данного класса ЛП еще одним препаратом — донанемабом24.
Таким образом, в недалекой перспективе ожидается существенное расширение арсенала ЛП для лечения болезни Альцгеймера.
Генная, клеточная и РНК-терапия. Генная, клеточная и РНК-терапия входят в инновационный потенциал персонализированной медицины. В 2023 г. в мире в разработке находилось около 3,9 тыс. продуктов по данному направлению, из которых наибольшую долю занимали кандидаты в ЛП генной терапии — 54% (включая генетически модифицированные клетки, такие как CAR-T (Chimeric Antigen Receptor) клетки), на РНК-продукты приходилось около 24%, а на препараты клеточной терапии (без генетической модификации) — 22%. Отметим, что в рамках настоящего обзора мы используем данные и классификацию американского общества генной и клеточной терапии (American Society of Gene & Cell Therapy, ASGCT)25.
В соответствии с терминологией ASGCT под генной терапией понимают интервенции, которые предполагают введение в клетки, являющиеся целью для терапии, in vivo или ex vivo генетической последовательности посредством специального вектора. Примером генной терапии in vivo может служить терапия с применением онасемногена абепарвовека, представляющего собой вектор аденоассоциированного вируса с функциональной копией гена SMN1, введение которого в организм ребенка заменяет собственный отсутствующий или дефектный ген.
Примером генной ex vivo терапии является CAR-T терапия, при которой у пациента осуществляется забор его собственных клеток-лимфоцитов. В условиях ex vivo отобранные клетки генетически модифицируют посредством введения ретровирусного/лентивирусного вектора, содержащего генетическую последовательность, обеспечивающую экспрессию на поверхности лимфоцита новых химерных рецепторов антигена. Эти рецепторы связываются с антигеном клеток-мишеней (например, опухоли) и одновременно содержат домен, активирующий Т-лимфоциты (запускающие иммунный ответ) в отношении указанных клеток-мишеней; после указанной процедуры генетически измененные лимфоциты вводятся обратно пациенту, обеспечивая терапевтический эффект — запуск собственной иммунной системы на борьбу с новообразованием.
Также генная терапия представлена литическими вирусами: генетически модифицированными вирусами, которые лизируют заданные патогенные клетки в организме (например, клетки опухоли), а для здоровых клеток безвредны.
По классификации ASGCT к клеточной терапии относится, например, лечение стволовыми клетками; терапия опухоль-инфильтрующими лимфоцитами, представляющая собой отбор, экспансию и введение обратно в организм пациента лимфоцитов, которые могут распознавать широкий перечень уникальных антигенов опухолевых клеток пациента; другие клеточные технологии.
В рамках РНК-терапии выделяют ЛП на основе м-РНК, РНК интерференции, терапию антисмысловыми олигонуклеотидами и ЛП на основе олигонуклеотидов, не относящиеся ни к одной из перечисленных ранее групп. РНК-интерференция позволяет отключать экспрессию определенных генов посредством специальных малых интерферирующих РНК (siRNA; small interfering RNA); антисмысловые олигонуклеотиды могут как активировать, так и подавлять экспрессию определенного гена; препарат на основе м-РНК в составе вектора26 или без него вводится в клетку, вызывая в ней синтез заданных соединений (белков) [44–46].
Из более чем 2 тыс. продуктов генной терапии в глобальном пайплайне по состоянию на конец II квартала 2023 г. на этапе ДКИ находились 1,5 тыс. продуктов, проходили КИ I, II и III фазы соответственно 240, 260 и 30 препаратов-кандидатов, на предрегистрационной стадии находилось 6 продуктов. Генетическая модификация в 70% разработок осуществлялась ex vivo и в 30% — in vivo. Терапия на основе технологии химерных антигенных рецепторов (CAR-T терапия) занимала лидирующую позицию по объему пайплайна в генной терапии — 46% всех продуктов в разработке, за ней следовала ТСR-T, при которой пациенту вводят генетически модифицированные Т-лимфоциты, экспрессирующие Т-клеточные рецепторы (TCR, T-cell receptor), специфичные к определенным опухолевым антигенам пациента (11%), терапия генетически модифицированными CAR натуральными киллерами CAR-NK (7%) и другие виды адоптивной иммунотерапии (макрофаги, экспрессирующие CAR — CAR-M, Т-клетки с химерным рецептором антигена, который перенаправляет эндогенный TCR на опухолевую мишень через внеклеточный антигенсвязывающий домен для индуцирования активации и онколиза (T-Cell Antigen Coupler, TAC-T)) и т.п. [47, 48].
Обращение исследователей к иммунным клеткам помимо лимфоцитов обусловливается тем, что генная терапия на основе лимфоцитов показала эффективность в лечении онкогематологических заболеваний, но не в терапии солидных опухолей, так как лимфоциты обладают слабой способностью в них проникать, тогда как генетически измененные натуральные киллеры и фагоциты потенциально могут быть в отношении солидных опухолей более эффективными [49, 50]. Такой фокус на онкологических и онкогематологических заболеваниях неслучаен, потому что подавляющее число продуктов генной терапии разрабатывается именно по этим направлениям, и лишь небольшой объем пайплайна генной терапии имеет показания к лечению склеродермии, ВИЧ-инфекции и аутоиммунных заболеваний (рис. 5).

Рисунок подготовлен авторами по данным Gene, Cell, +RNA Therapy Landscape Report / This figure is prepared by the authors using the Gene, Cell, +RNA Therapy Landscape Report
Рис. 5. Распределение разрабатываемых генотерапевтических препаратов по нозологическим направлениям
Fig. 5. Global gene therapy pipeline distribution by nosological group
В 2023 г. в мире было зарегистрировано два ЛП генной терапии, при которой введение вектора осуществляется in vivo: деландистрогена моксепарвовек для лечения болезни Дюшенна и беремагена геперпавек с показанием лечения дистрофического буллезного эпидермолиза, доведя, таким образом, общее количество зарегистрированных ЛП данного типа до 11 международных непатентованных наименований (МНН)27. В России зарегистрированы два ЛП генной терапии in vivo: воретигена непарвовек (показание: терапия наследственной дистрофии сетчатки, вызванной мутациями гена RPE65) и онасемногена абепарвовек (показание: терапия СМА)28. Оба ЛП не входят в перечень жизненно необходимых и важнейших лекарственных средств. В апреле 2023 г. в России был зарегистрирован первый ЛП CAR-T терапии — тисагенлеклейцел по показанию «лечение острого лимфобластного лейкоза и рефрактерной диффузной В-крупноклеточной лимфомы», общее же число ЛП этого типа в мире составляло 10 МНН29.
Из почти 600 клеточных продуктов, находившихся в разработке, более половины были предназначены для использования в онкологии, 36 — для лечения артрита, 32 — диабета I типа, 30 — болезни Паркинсона, 21 — сердечной недостаточности, 15 — болезни Альцгеймера.
По состоянию на второе полугодие 2023 г. в мире было зарегистрировано 3 новых ЛП РНК-терапии, из которых два — вакцины против коронавирусной инфекции, а один ЛП — тоферсен — для лечения бокового амиотрофического склероза. Всего в мире зарегистрировано 16 ЛП РНК-терапии и около 10 м-РНК вакцин (против коронавирусной инфекции). В России по состоянию на август 2023 г. зарегистрировано 3 ЛП, относящихся к РНК-терапии: нусинерсен (показание: лечение СМА), инклисиран (показание: лечение гетерозиготной наследственной гиперхолистеринемии) и синтетическая малая интерферирующая рибонуклеиновая кислота (миРНК) [двуцепочечная] (показание: лечение новой коронавирусной инфекции)30.
Заключение
В проведенном описательном обзоре, посвященном значению инновационных ЛП и состоянию современного глобального фармацевтического пайплайна, показаны положительные эффекты влияния инновационных ЛП на индикаторы продолжительности жизни и снижения смертности, а также возможность благодаря инновационным ЛП излечивать пациентов с заболеваниями, которые до выхода этих ЛП рассматривались как неизлечимые. Представляются открытыми вопросы определения справедливой стоимости инновационных ЛП, которая неуклонно растет, манифестируя угрозу доступа пациентов к инновационным ЛП. Внушительный объем пайплайна — более 21 тыс. продуктов в разработке — позволяет надеяться на продолжение и даже увеличение положительных эффектов от инновационных ЛП — как в рамках повышения эффективности для нозологий, для которых уже имеются свои схемы лечения, так и для заболеваний, для которых в настоящий момент отсутствует эффективная терапия, как, например, в случае болезни Альцгеймера. Использование генной терапии, клеточной терапии и РНК-терапии может привести к кардинальным изменениям в практике здравоохранения и нашем отношении к заболеваниям.
2 New drugs at FDA: CDER’s new molecular entities and new therapeutic biological products. https://www.fda.gov/drugs/development-approval-process-drugs/new-drugs-fda-cders-new-molecular-entities-and-new-therapeutic-biological-products
3 Пайплайн — совокупность разрабатываемых лекарственных средств.
4 Gottrfied J. History repeating? Avoiding a return to the pre-antibiotic age. https://dash.harvard.edu/handle/1/8889467
5 Jansen С, Amesz B. Vintura. Innovation for sustainable cancer care. Vintura; 2023.
6 Global Oncology Trends 2022: Outlook to 2026. IQVIA Institute for Human Data Science; 2022.
7 Global HIV & AIDS statistics — Fact sheet. UNAIDS. https://www.unaids.org/en/resources/fact-sheet
8 Spinraza (nusinersen) Centerwatch. https://www.centerwatch.com/directories/1067-fda-approved-drugs/listing/4207-spinraza-nusinersen
9 Zolgensma (onasemnogene abeparvovec-xioi). Centerwatch. https://www.centerwatch.com/directories/1067-fda-approved-drugs/listing/4522-zolgensma-onasemnogene-abeparvovec-xioi
10 Fast track, breakthrough therapy, accelerated approval, priority review. FDA. https://www.fda.gov/patients/learn-about-drug-and-device-approvals/fast-track-breakthrough-therapy-accelerated-approval-priority-review
Emergency use authorization. FDA. https://www.fda.gov/emergency-preparedness-and-response/mcm-legal-regulatory-and-policy-framework/emergency-use-authorization
11 Withdrawn | Cancer Accelerated Approvals. FDA. https://www.fda.gov/drugs/resources-information-approved-drugs/withdrawn-cancer-accelerated-approvals
12 Stark K. It takes the FDA 46 months to withdraw a failed drug with accelerated approval. https://ldi.upenn.edu/our-work/research-updates/it-takes-the-fda-46-months-to-withdraw-a-failed-drug-with-accelerated-approval/
13 Cong Z. Value of pharmaceutical innovation. The access effects, diffusion process and health effects of new drugs. 2009.
https://www.rand.org/pubs/rgs_dissertations/RGSD242.html
14 Прохорчук С. ФКУ Минздрава закупит Золгенсму для «Круга добра» по сниженной цене. Vademecum. 22.12.2023. https://vade-mec.ru/news/2022/12/29/fku-minzdrava-zakupit-zolgensmu-dlya-kruga-dobra-po-snizhennoy-tsene-/?ysclid=llbhfhrsj2426061778
15 Corona A. Most expensive prescription drugs in 2023. Pharma manufacturing. https://www.pharmamanufacturing.com/development/drug-approvals/article/33006956/most-expensive-drugs
17 Researching Alzheimer’s medicines: Setbacks and stepping stones. PHRMA; 2018
18 The pharmaceutical industry and global health. Facts and figures 2021. IFPMA. 2022.
19 Leading 15 pharmaceutical companies worldwide by size of R&D pipeline as of 2023. Statista. https://www.statista.com/statistics/791306/top-pharma-companies-by-randd-pipeline-size/
20 Pharma R&D Annual Review 2023. Citeline Clinical. https://pages.pharmaintelligence.informa.com/LDG_R-D_Review_2023
Jung EH, Engelberg A, Kesselheim AS. Do large pharma companies provide drug development innovation? Our analysis says no. Stat. https://www.statnews.com/2019/12/10/large-pharma-companies-provide-little-new-drug-development-innovation/
21 Pharma R&D Annual Review 2023. Citeline Clinical. https://pages.pharmaintelligence.informa.com/LDG_R-D_Review_2023
22 В данном случае условия отнесения заболевания к редкому — распространенность не более чем 1 на 2000 чел. населения в Европе или 1 на 1600 чел. в США.
23 Aduhelm (aducanumab-avwa). Centerwatch. https://www.centerwatch.com/directories/1067-fda-approved-drugs/listing/4716-aduhelm-aducanumab-avwa
Leqembi (lecanemab-irmb) injection. Centerwatch. https://www.centerwatch.com/directories/1067-fda-approved-drugs/listing/4831-leqembi-lecanemab-irmb-injection
Оба лекарственных препарата по состоянию на 18.08.2023 не зарегистрированы в Российской Федерации.
24 Lilly's donanemab significantly slowed cognitive and functional decline in phase 3 study of early Alzheimer's disease. Eli-Lilly. https://investor.lilly.com/news-releases/news-release-details/lillys-donanemab-significantly-slowed-cognitive-and-functional
25 Gene, Cell, +RNA Therapy Landscape Report. Q2 2023. ASGCT & Citeline; 2023.
26 В рамках используемой классификации ASGCT такие продукты относятся к генной терапии.
27 Gene, Cell, +RNA Therapy Landscape Report. Q2 2023. ASGCT & Citeline; 2023.
28 Воретиген непарвовек. https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=13c77542-9ac7-4153-a972-c9bf453aa7c1
Онасемноген абепарвовек. https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=b88ec4cb-856d-4515-9789-f97b1e731218
29 Тисагенлеклейцел. https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=86c5301d-673e-490b-950e-c99493dd64a3
30 Нусинерсен. https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=49e34734-3084-4cb1-bee3-95fbe56dea61 Инклисиран. https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=f6288960-8c95-4b90-904d-69bb8322b4a5
Список литературы
1. Vignali V, Hines PA, Cruz AG, Ziętek B, Herold R. Health horizons: future trends and technologies from the European Medicines Agency’s horizon scanning collaborations. Front Med (Lausanne). 2022;9:1064003. https://doi.org/10.3389/fmed.2022.1064003
2. Adedeji WA. The treasure called antibiotics. Ann Ib Postgrad Med. 2016;14(2):56–7. PMID: 28337088
3. Buxbaum JD, Chernew ME, Fendrick AM, Cutler DM. Contributions of public health, pharmaceuticals, and other medical care to US life expectancy changes, 1990–2015. Health Aff (Millwood). 2020;39(9):1546–56. https://doi.org/10.1377/hlthaff.2020.00284
4. Lichtenberg FR. The effect of pharmaceutical innovation on longevity: evidence from the U.S. and 26 high-income countries. Econ Hum Biol. 2022;46:101124. https://doi.org/10.1016/j.ehb.2022.101124
5. Lichtenberg FR. The impact of new (orphan) drug approvals on premature mortality from rare diseases in the United States and France, 1999–2007. Eur J Health Econ. 2013;14(1):41–56. https://doi.org/10.1007/s10198-011-0349-4
6. MacEwan JP, Dennen S, Kee R, Ali F, Shafrin J, Batt K. Changes in mortality associated with cancer drug approvals in the United States from 2000 to 2016. J Med Econ. 2020;23(12):1558–69. https://doi.org/10.1080/13696998.2020.1834403
7. Manns MP, Maasoumy B. Breakthroughs in hepatitis C research: from discovery to cure. Nat Rev Gastroenterol Hepatol. 2022;19(8):533–50. https://doi.org/10.1038/s41575-022-00608-8
8. Campollo O, Amaya G, McCormick PA. Milestones in the discovery of hepatitis C. World J Gastroenterol. 2022;28(37):5395–402. https://doi.org/10.3748/wjg.v28.i37.5395
9. Krupa D, Czech M, Chudzyńska E, Koń B, Kostera-Pruszczyk A. Real world evidence on the effectiveness of nusinersen within the national program to treat spinal muscular atrophy in Poland. Healthcare. 2023;11(10):1515. https://doi.org/10.3390/healthcare11101515
10. Berglund A, Berkö S, Lampa E, Sejersen T. Survival in patients diagnosed with SMA at less than 24 months of age in a population-based setting before, during and after introduction of nusinersen therapy. Experience from Sweden. Eur J Paediatr Neurol. 2022;40:57–60. https://doi.org/10.1016/j.ejpn.2022.07.005
11. Beakes-Read G, Neisser M, Frey P, Guarducci M. Analysis of FDA’s accelerated approval program performance December 1992 — December 2021. Ther Innov Regul Sci. 2022;56(5):698–703. https://doi.org/10.1007/s43441-022-00430-z
12. Lakdawalla DN, Doshi JA, Garrison LP Jr, Phelps CE, Basu A, Danzon PM. Defining elements of value in health care — A health economics approach: An ISPOR Special Task Force Report. Value Health. 2018;21(2):131–9. https://doi.org/10.1016/j.jval.2017.12.007
13. Franken M, Stolk E, Scharringhausen T, de Boer A, Koopmanschap M. A comparative study of the role of disease severity in drug reimbursement decision making in four European countries. Health Policy. 2015;119(2):195–202. https://doi.org/10.1016/j.healthpol.2014.10.007
14. Khunti K, Seidu S, Kunutsor S, Davies M. Association between adherence to pharmacotherapy and outcomes in type 2 diabetes: a meta-analysis. Diabetes Care. 2017;40(11):1588–96. https://doi.org/10.2337/dc16-1925
15. van Boven JF, Chavannes NH, van der Molen T, Rutten-van Mölken MP, Postma MJ, Vegter S. Clinical and economic impact of non-adherence in COPD: a systematic review. Respir Med. 2014;108(1):103–13. https://doi.org/10.1016/j.rmed.2013.08.044
16. Abegaz TM, Shehab A, Gebreyohannes EA, Bhagavathula AS, Elnour AA. Nonadherence to antihypertensive drugs: a systematic review and meta-analysis. Medicine (Baltimore). 2017;96(4):e5641. https://doi.org/10.1097/md.0000000000005641
17. Ruppar TM, Cooper PS, Mehr DR, Delgado JM, Dunbar-Jacob JM. Medication adherence interventions improve heart failure mortality and readmission rates: systematic review and meta-analysis of controlled trials. J Am Heart Assoc. 2016;5(6):e002606. https://doi.org/10.1161/jaha.115.002606
18. Du L, Cheng Z, Zhang Y, Li Y, Mei D. The impact of medication adherence on clinical outcomes of coronary artery disease: a meta-analysis. Eur J Prev Cardiol. 2017;24(9):962–70. https://doi.org/10.1177/2047487317695628
19. Lai H, Li R, Li Z, Zhang B, Li C, Song C, et al. Modelling the impact of treatment adherence on the transmission of HIV drug resistance. J Antimicrob Chemother. 2023;78(8):1934–43. https://doi.org/10.1093/jac/dkad186
20. Zozaya N, Alcalá B, Galindo J. The offset effect of pharmaceutical innovation: a review study. Glob Reg Health Technol Assess. 2019;2019(5):228424031987510. https://doi.org/10.1177/2284240319875108
21. Тихомирова АВ, Ягудина РИ. Фармакоэкономический анализ прямых медицинских затрат при лечении метастатического колоректального рака режимами XELOX или FOLFOX4 в сочетании с бевацизумабом или без него в качестве терапии первой линии. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2010;3(2):22–7. EDN: MUDQUX
22. Ягудина РИ, Куликов АЮ, Комаров ИА. Анализ «затраты–эффективность» лечения пациентов, которым за последние 6 месяцев был поставлен диагноз хронический миелолейкоз в хронической фазе, лекарственными средствами группы ингибиторов тирозинкиназы–нилотиниба в сравнении с иматинибом. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2013;6(2):42–7. EDN: RNKORX
23. Куликов АЮ, Нгуен T. Фармакоэкономический анализ одногодичной адъювантной терапии трастузумабом при НЕR2-положительном раке молочной железы ранней стадии. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2010;3(4):28–34. EDN: NXZQIJ
24. Серпик ВГ. Фармакоэкономическая оценка терапии редких заболеваний на примере лечения первичного миелофиброза препаратом руксолитиниб. Фармакоэкономика: теория и практика. 2015;3(2):20–3. https://doi.org/10.30809/phe.2.2015.10
25. DiMasi JA, Grabowski HG, Hansen RW. Innovation in the pharmaceutical industry: new estimates of R&D costs. J Health Econ. 2016;47:20–33. https://doi.org/10.1016/j.jhealeco.2016.01.012
26. Schlander M, Hernandez-Villafuerte K, Cheng CY, Mestre-Fernandiz J, Baumann M. How much does it cost to research and develop a new drug? A systematic review and assessment. Pharmacoeconomics. 2021;39(11):1243–69. https://doi.org/10.1007/s40273-021-01065-y
27. Moon S, Mariat S, Kamae I, Pedersen HB. Defining the concept of fair pricing for medicines. BMJ. 2020;368:l4726 https://doi.org/10.1136/bmj.l4726
28. Angelis A, Polyakov R, Wouters OJ, Torreele E, McKee M. High drug prices are not justified by industry’s spending on research and development. BMJ. 2023;380:e071710. https://doi.org/10.1136/bmj-2022-071710
29. Chan K, Sepassi A, Saunders IM, Goodman A, Watanabe JH. Effects of financial toxicity on prescription drug use and mental well-being in cancer patients. Explor Res Clin Soc Pharm. 2022;6:100136. https://doi.org/10.1016/j.rcsop.2022.100136
30. Hussaini SMQ, Gupta A, Dusetzina SB. Financial toxicity of cancer treatment. JAMA Oncol. 2022;8(5):788. https://doi.org/10.1001/jamaoncol.2021.7987
31. Jung YL, Hwang J, Yoo HS. Disease burden metrics and the innovations of leading pharmaceutical companies: a global and regional comparative study. Global Health. 2020;16:80. https://doi.org/10.1186/s12992-020-00610-2
32. The Lancet Respiratory Medicine. Where are the innovations in tuberculosis drug discovery? Lancet Respir Med. 2017;5(11):835. https://doi.org/10.1016/S2213-2600(17)30376-4
33. Abdelsayed M, Kort EJ, Jovinge S, Mercola M. Repurposing drugs to treat cardiovascular disease in the era of precision medicine. Nat Rev Cardiol. 2022;19(11):751–64. https://doi.org/10.1038/s41569-022-00717-6
34. Van Norman GA. Overcoming the declining trends in innovation and investment in cardiovascular therapeutics: beyond EROOM’s law. JACC Basic Transl Sci. 2017;2(5):613–25. https://doi.org/10.1016/j.jacbts.2017.09.002
35. Klug DM, Idiris FIM, Blaskovich MAT, von Delft F, Dowson CG, Kirchhelle C, et al. There is no market for new antibiotics: this allows an open approach to research and development. Wellcome Open Res. 2021;6:146. https://doi.org/10.12688/wellcomeopenres.16847.1
36. Miller KL, Fermaglich LJ, Maynard J. Using four decades of FDA orphan drug designations to describe trends in rare disease drug development: substantial growth seen in development of drugs for rare oncologic, neurologic, and pediatric-onset diseases. Orphanet J Rare Dis. 2021;16(1):265. https://doi.org/10.1186/s13023-021-01901-6
37. Wellman-Labadie O, Zhou Y. The US Orphan Drug Act: rare disease research stimulator or commercial opportunity? Health Policy. 2010;95(2–3):216–28. https://doi.org/10.1016/j.healthpol.2009.12.001
38. Årdal C, Lacotte Y, Ploy MC. Financing pull mechanisms for antibiotic-related innovation: opportunities for Europe. Clin Infect Dis. 2020;71(8):1994–9. https://doi.org/10.1093/cid/ciaa153
39. Проценко МВ, Серпик ВГ. Обзор международной классификации редких заболеваний. Фармакоэкономика: теория и практика. 2021;9(2):18–20. https://doi.org/10.30809/phe.2.2021.3
40. Ding C, Wu Y, Chen X, Chen Y, Wu Z, Lin Z, et al. Global, regional, and national burden and attributable risk factors of neurological disorders: the Global Burden of Disease study 1990–2019. Front Public Health. 2022;10:952161. https://doi.org/10.3389/fpubh.2022.952161
41. Cummings J, Zhou Y, Lee G, Zhong K, Fonseca J, Cheng F. Alzheimer’s disease drug development pipeline: 2023. Alzheimers Dement (NY). 2023;9(2):e12385. Erratum: Alzheimers Dement (NY). 2023;9(2):e12407. https://doi.org/10.1002/trc2.12385
42. Бачурин СО. Препараты для лечения болезни Альцгеймера по данным клинических испытаний и основные тенденции в подходах к поиску новых лекарственных средств. Журнал неврологии и психиатрии им. С.С. Корсакова. 2016;116(8):77–87. https://doi.org/10.17116/jnevro20161168177-87
43. Rabaneda-Bueno R, Mena-Montes B, Torres-Castro S, Torres-Carrillo N, Torres-Carrillo NM. Advances in genetics and epigenetic alterations in Alzheimer’s disease: a notion for therapeutic treatment. Genes (Basel). 2021;12(12):1959. https://doi.org/10.3390/genes12121959
44. Sasso JM, Ambrose BJB, Tenchov R, Datta RS, Basel MT, DeLong RK, Zhou QA. The progress and promise of RNA medicine — an arsenal of targeted treatments. J Med Chem. 2022;65(10):6975–7015. https://doi.org/10.1021/acs.jmedchem.2c00024
45. Yu AM, Choi YH, Tu MJ. RNA drugs and RNA targets for small molecules: principles, progress, and challenges. Pharmacol Rev. 2020;72(4):862–98. https://doi.org/10.1124/pr.120.019554
46. Boada C, Sukhovershin R, Pettigrew R, Cooke JP. RNA therapeutics for cardiovascular disease. Curr Opin Cardiol. 2021;36(3):256–63. https://doi.org/10.1097/hco.0000000000000850
47. Biernacki MA, Brault M, Bleakley M. T-cell receptor-based immunotherapy for hematologic malignancies. Cancer J. 2019;25(3):179–90. https://doi.org/10.1097/ppo.0000000000000378
48. Helsen CW, Hammill JA, Lau VWC, Mwawasi KA, Afsahi A, Bezverbnaya K, et al. The chimeric TAC receptor co-opts the T cell receptor yielding robust anti-tumor activity without toxicity. Nat Commun. 2018;9(1):3049. https://doi.org/10.1038/s41467-018-05395-y
49. Chen Y, Yu Z, Tan X, Jiang H, Xu Z, Fang Y, et al. CAR-macrophage: a new immunotherapy candidate against solid tumors. Biomed Pharmacother. 2021;139:111605. https://doi.org/10.1016/j.biopha.2021.111605
50. Wrona E, Borowiec M, Potemski P. CAR-NK cells in the treatment of solid tumors. Int J Mol Sci. 2021;22(11):5899. https://doi.org/10.3390/ijms22115899
Об авторах
В. А. МеркуловРоссия
Меркулов Вадим Анатольевич, д-р мед. наук, профессор
Петровский б-р, д. 8, стр. 2, Москва, 127051
Р. И. Ягудина
Россия
Ягудина Роза Исмаиловна, д-р фарм. наук, профессор
Петровский б-р, д. 8, стр. 2, Москва, 127051
В. Г. Серпик
Россия
Серпик Вячеслав Геннадьевич, канд. фарм. наук, доцент
Трубецкая ул., д. 8, стр. 2, Москва, 119991
Дополнительные файлы
Рецензия
Для цитирования:
Меркулов В.А., Ягудина Р.И., Серпик В.Г. Глобальный спектр разработки инновационных лекарственных препаратов: описательный обзор. Ведомости Научного центра экспертизы средств медицинского применения. Регуляторные исследования и экспертиза лекарственных средств. 2024;14(1):14-28. https://doi.org/10.30895/1991-2919-2024-14-1-14-28
For citation:
Merkulov V.A., Yagudina R.I., Serpik V.G. Global Pipeline of Innovative Medicinal Products: A Narrative Review. Bulletin of the Scientific Centre for Expert Evaluation of Medicinal Products. Regulatory Research and Medicine Evaluation. 2024;14(1):14-28. (In Russ.) https://doi.org/10.30895/1991-2919-2024-14-1-14-28


































